传染性法氏囊病毒抗原偶联磁性微粒及其制备方法和应用与流程
本发明涉及生物检测领域。具体地,涉及一种传染性法氏囊病毒抗原偶联磁性微粒及其制备方法和应用。
背景技术:
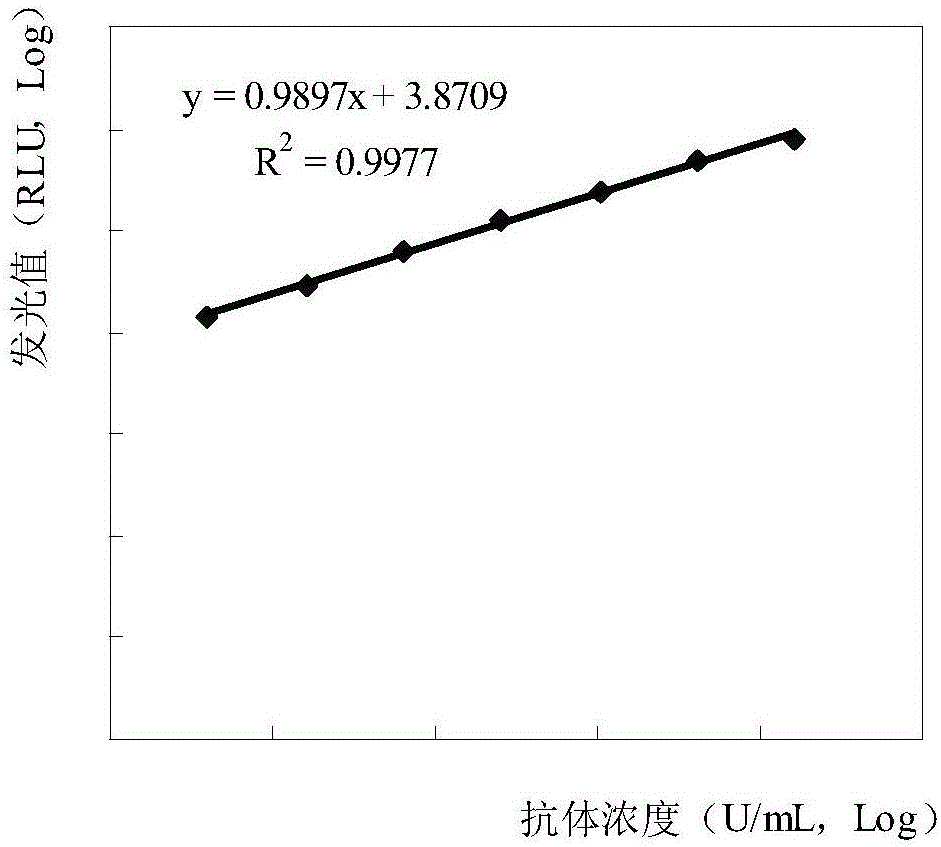
:鸡传染性法氏囊病(Infectiousbursaldisease;IBD)又称鸡传染性腔上囊病,是由传染性法氏囊病毒(Infectiousbursaldiseasevirus;IBDV)引起的一种急性、接触传染性疾病。传染性法氏囊病毒属于双RNA病毒科,包括两个血清型。以法氏囊发炎、坏死、萎缩和法氏囊内淋巴细胞严重受损为特征。从而引起鸡的免疫机能障碍,干扰各种疫苗的免疫效果。发病率高,几乎达100%,死亡率低,一般为5%~15%,是目前养禽业最重要的疾病之一。雏鸡易发病,2~3天内可波及60%~70%的鸡,发病后3~4天死亡达到高峰,7~8天后死亡停止。病初精神沉郁,采食量减少,饮水增多,有些自啄肛门,排白色水样稀粪,重者脱水,卧地不起,极度虚弱、最后死亡。耐过雏鸡贫血消瘦,生长缓慢。剖检可见:法氏囊发生特征性病变,法氏囊呈黄色胶胨样水肿、质硬、粘膜上覆盖有奶油色纤维素性渗出物。有时法氏囊粘膜严重发炎,出血,坏死,萎缩。另外,病死鸡表现脱水,腿和胸部肌肉常有出血,颜色暗红。肾肿胀,肾小管和输尿管充满白色尿酸盐。脾脏及腺胃和肌胃交界处粘膜出血。传染性法氏囊抗原VP2蛋白是主要的中和性抗原蛋白,其抗体是疫苗免疫后抗体水平的监测和病毒感染后抗体水平检测的主要标的,抗体水平高低与其免疫或感染状况直接相关,通过抗体水平的监测来制定合理、有效的免疫程序是提高群体免疫水平的保证。现有的检测机构有兽医站、疫苗公司、养殖场等存在着大量的样本,也对大通量的传染性法氏囊抗体检测试剂盒和仪器有着需求。目前建立并应用的传染性法氏囊抗体检测方法有琼扩试验、ELISA、病毒中和试验、胶体金试纸条等方法,其中琼扩试验目前是传染性法氏囊抗体检测最常用的方法,通过倍比稀释抗体血清和抗原观察是否发生沉淀判断抗体滴度;ELISA试验较为灵敏,但难以定量;病毒中和试验是通过传染性法氏囊病毒和抗体在细胞上中进行抗原抗体反应来判定抗体滴度,能较全面反映中和抗体的高低,全过程为病毒滴定、抗体中和、结果判定等过程需5-7天时间,全过程只能人工来操作、判定,重复性差;胶体金方法能快速得出结果,但是只能定性,难以定量,限制了应用范围。现有的琼扩试验、ELISA、病毒中和试验、胶体金等的方法难以满足。因此,本领域迫切需要开发一种高灵敏度、高准确性、花费时间较短的检测方法。技术实现要素:本发明第一方面,提供了一种传染性法氏囊病毒抗原偶联的磁性微粒的制备方法,包括步骤:(a)提供磁性微粒溶液、和传染性法氏囊病毒抗原或其片段;(b)将(a)中的磁性微粒溶液和传染性法氏囊病毒抗原或其片段进行混合得到磁性微粒溶液和传染性法氏囊病毒抗原或其片段相偶联的混合液,其中,磁性微粒溶液和传染性法氏囊病毒抗原或其片段的混合比例为5-15mg:0.5-10nmol,较佳地,5-10mg:1-8nmol,更佳地,8-10mg:1.2-5mg,例如,1.1-2.27nmol。在另一优选例中,所述步骤(b)中还包括步骤(b’):向所述的混合液中加入交联剂和/或催化剂,从而获得经交联和/或经催化的混合液。所述步骤(b)中还包括步骤(b”):向所述的混合中加入标记物,从而获得经标记的混合液。在另一优选例中,所述的传染性法氏囊病毒抗原或其片段包括VP2蛋白或其片段。在另一优选例中,所述标记物包括发光标记物,例如,光激发发光标记物、电激发发光标记物。在另一优选例中,所述的发光标记物包括吖啶酯、碱性磷酸酶、和/或过氧化物酶。在另一优选例中,还包括步骤(c):向(b)所获得的混合液中加入封闭剂。在另一优选例中,所述的磁性微粒与所述的传染性法氏囊病毒抗原或其片段的结合方式包括直接偶联和间接偶联。在另一优选例中,所述的间接偶联包括通过以下方式介导的偶联:链霉亲和素-生物素介导的偶联、抗FITC抗体-FITC偶联。在另一优选例中,所述的直接偶联包括通过磁性微粒羧基与蛋白氨基缩合形成酰胺、磁性微粒氨基与蛋白氨基通过戊二醛交联形成五碳桥、或甲苯磺酰基磁性微粒与蛋白氨基共价偶联相连接。在另一优选例中,所述的磁性微粒核心为氧化铁。在另一优选例中,所述的磁性微粒还含有活性基团。在另一优选例中,所述的活性基团包括羟基、羧基、磺酰基或氨基活性基团。在另一优选例中,所述的磁性微粒的粒径为0.1-5μm,优选地为1-3μm。在另一优选例中,所述的磁性微粒溶液中,磁性微粒粒径CV<3%。在另一优选例中,所述传染性法氏囊病毒抗原或其片段包括:传染性法氏囊病毒全长、天然传染性法氏囊病毒片段、重组表达的传染性法氏囊病毒全长、重组表达的传染性法氏囊病毒片段,传染性法氏囊病毒多肽、或传染性法氏囊病毒化学合成物。在另一优选例中,所述传染性法氏囊病毒VP2蛋白的全长序列如SEQIDNO.:1所示。在另一优选例中,所述传染性法氏囊病毒VP2蛋白片段的序列如SEQIDNO.:2所示。在另一优选例中,所述传染性法氏囊病毒VP2蛋白多肽片段的序列如SEQIDNO.:3所示。在另一优选例中,所述方法包括步骤:(a)提供磁性微粒溶液、和传染性法氏囊病毒抗原或其片段;(b)将(a)中的磁性微粒溶液和传染性法氏囊病毒抗原或其片段进行混合得到混合液,其中,磁性微粒溶液和传染性法氏囊病毒抗原或其片段的混合比例为10mg:0.6-9.5nmol;(b’)向(b)中加入交联剂或催化剂,从而得到经交联或催化的混合液;(b”)向(b’)经交联或催化的混合液中加入封闭剂。本发明第二方面,提供了一种传染性法氏囊病毒抗原偶联的磁性微粒,其中,磁性微粒溶液和传染性法氏囊病毒抗原或其片段的比例为5-15mg:0.5-10nmol,较佳地,5-10mg:1-8nmol,更佳地,8-10mg:1.2-5nmol,例如,10mg:1.1-2.27nmol。在另一优选例中,所述传染性法氏囊病毒抗原偶联的磁性微粒由本发明第一方面所述的方法制成。本发明第三方面,提供了本发明第二方面所述传染性法氏囊病毒抗原偶联的磁性微粒的用途,用于制备检测传染性法氏囊抗体的检测试剂和/或试剂盒。本发明第四方面,提供了一种试剂盒,所述的试剂盒含有容器和说明书,所述的容器内含有本发明第二方面所述的传染性法氏囊病毒抗原偶联的磁性微粒。在另一优选例中,所述的容器内还含有独立包装的质控品或校准品、或清洗液。在另一优选例中,所述校准品包括传染性法氏囊病毒抗体阴性或阳性血清稀释液。在另一优选例中,所述清洗液包括含有Tween20的Tris缓冲液或含有Tween20的PBS缓冲液。在另一优选例中,所述Tween20的Tris缓冲液浓度为0.05mol/L,pH为8.0。在另一优选例中,所述Tween20的PBS缓冲液浓度为0.05mol/L,pH为7.0。在另一优选例中,所述的说明书记载了含有本发明第二方面所述的传染性法氏囊病毒抗原偶联的磁性微粒的使用方法,包括步骤:(i)提供待测样品、和所述传染性法氏囊病毒抗原偶联的磁性微粒;(ii)将所述待测样品与所述传染性法氏囊病毒抗原偶联的磁性微粒混合并进行反应;(iii)将(ii)中反应后的混合液进行洗涤并加入发光底物;(iv)对(iii)中加入发光底物后的混合液进行发光值检测,从而定量或定性检测待测样品中的传染性法氏囊病毒抗体。在另一优选例中,所述的待测样品包括血液样品、体液样品和组织样品。本发明第五方面,提供了一种检测传染性法氏囊病毒抗体的检测方法,包括步骤:(i)提供待测样品、和所述传染性法氏囊病毒抗原偶联的磁性微粒;(ii)将所述待测样品与所述传染性法氏囊病毒抗原偶联的磁性微粒混合并进行反应;(iii)将(ii)中反应后的混合液进行洗涤并加入发光底物;(iv)对(iii)中加入发光底物后的混合液进行发光值检测,从而定量或定性检测待测样品中的传染性法氏囊病毒抗体。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1是本发明制备实施例1中的校准曲线;图2是本发明制备实施例2中的校准曲线;图3是本发明制备实施例3中的校准曲线;图4是本发明制备实施例4中的校准曲线;图5是本发明实验实施例1中羧基磁珠最适的蛋白用量曲线;图6是本发明实验实施例1中甲苯磺酰基磁珠最适的蛋白用量曲线。具体实施方式本发明人经过广泛而深入的研究,首次意外地发现,采用特定比例的传染性法氏囊病毒抗原或其片段和磁性微粒进行混合,可以获得包被饱和均质、空间构象稳定的包被磁性微粒,所包被的磁性微粒上作为传染性法氏囊病毒抗体的检测试剂,能够高灵敏、高准确率地检出样本中传染性法氏囊病毒抗体,且在最大程度上节省了试剂制备成本。在此基础上,完成了本发明。传染性法氏囊病毒抗原或其片段可用于本发明的传染性法氏囊病毒抗原蛋白或其片段没有特殊限制,可以包括所述天然或重组的传染性法氏囊病毒抗原蛋白的全长或其片段。优选地,可包括传染性法氏囊病毒VP2蛋白全长序列如SEQIDNO.:1所示,其含有469个氨基酸,分子量57kD;传染性法氏囊病毒VP2蛋白片段序列如SEQIDNO.:2所示,其含有134氨基酸,分子量17kD;传染性法氏囊病毒VP2蛋白多肽序列如SEQIDNO.:3所示,其含有50氨基酸,分子量5.5kD。本领域的技术人员能用标准的蛋白质纯化技术纯化所述多肽。基本上纯的多肽在非还原聚丙烯酰胺凝胶上能产生单一的主带。所述多肽的纯度还可以用氨基酸序列进行进一步分析。本发明的所述蛋白或其片段可以是重组的、天然的、合成的蛋白或其片段。本发明所述蛋白或其片段可以是天然纯化的产物,或是化学合成的产物,或使用重组技术从原核或真核宿主(例如,细菌、酵母、植物)中产生。磁性微粒如本文所用,术语“磁性微粒”、“磁性颗粒”、“磁珠”可互换使用,指的是内部有磁性核心,外部包覆聚合物的微粒。包覆层含有活性基团,可与蛋白、多肽等偶联,并不影响蛋白、多肽的免疫活性;磁核使微粒在外部磁场作用下可定向移动聚集,离开磁场之后可在溶液中均匀分散,从而兼顾了抗原抗体的液相反应和抗原抗体复合物与未反应物质的分离。可用于本发明的磁性微粒没有特殊限制,可以是任何具有磁性核心、表面附有聚合物的磁性颗粒。可用于本发明磁性微粒的核心为氧化铁(Fe3O4);可用于本发明磁性颗粒表面的聚合物包括聚苯乙烯、丙烯酸树脂、聚甲基丙烯酸甲酯等。本发明磁性微粒的大小优选为0.1-5μm,优选为1-3μm。可用于本发明的磁性微粒通常以微粒群溶液的形式存在,通常,所述微粒群溶液中,微粒大小形状高度均一,粒径CV<3%。可用于本发明的磁性微粒还可以含有多个活性基团,从而通过化学交联的方式将蛋白、多肽结合于磁性微粒表面。优选地,所述的活性基团包括羟基、羧基、磺酰基或氨基活性基团。含有活性基团的磁性微粒可以通过本领域常规技术制备获得或直接市售可得。例如购于日本JSR公司,货号:MagnosphereTMMS300/Caboxyl的含有羧基的磁性微粒;或购于日本JSR公司,货号:MagnosphereTMMS300/Tosyl含有甲苯磺酰基的磁性微粒。传染性法氏囊病毒抗原或其片段偶联的磁性微粒及其制备方法本发明提供了一种传染性法氏囊病毒抗原或其片段偶联的磁性微粒及其制备方法,所述方法包括步骤:(a)提供磁性微粒溶液、和传染性法氏囊病毒抗原或其片段;(b)将(a)中的磁性微粒溶液和传染性法氏囊病毒抗原或其片段进行混合得到磁性微粒溶液和传染性法氏囊病毒抗原或其片段相偶联的混合液,其中,磁性微粒溶液和传染性法氏囊病毒抗原或其片段的混合比例为5-15mg:0.5-10nmol,较佳地,5-10mg:1-8nmol,更佳地,8-10mg:1.2-5mg,例如,1.1-2.27nmol;(c):向(b)所获得的混合液中加入封闭剂。通常,所述步骤(b)中还包括步骤(b’):向所述的混合液中加入交联剂和/或催化剂,从而获得经交联和/或经催化的混合液。所述步骤(b)中还包括步骤(b”):向所述的混合中加入标记物,从而获得经标记的混合液。所述方法包括步骤:(a)提供磁性微粒溶液、和传染性法氏囊病毒抗原或其片段;(b)将(a)中的磁性微粒溶液和传染性法氏囊病毒抗原或其片段进行混合得到混合液,其中,磁性微粒溶液和传染性法氏囊病毒抗原或其片段的混合比例为5-15mg:0.5-10nmol,较佳地,5-10mg:1-8nmol,更佳地,8-10mg:1.2-5mg,例如,1.1-2.27nmol;(b’)向(b)中加入交联剂或催化剂,从而得到经交联或催化的混合液;(b”)向(b’)经交联或催化的混合液中加入封闭剂。可用于本发明的交联剂和催化剂没有特别限制,可以是本领域中常用于磁珠表面包裹的交联剂或催化剂。优选地,所述的交联剂和催化剂包括1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)、戊二醛、硫酸铵。可用于本发明的标记物没有特殊限制,可以是生物检测领域中用于显色、显影的常用标记物。优选地,所述标记物包括发光标记物,例如光激发发光标记物、电激发发光标记物。例如,所述发光标记物包括吖啶酯、碱性磷酸酶、和/或过氧化物酶。其可通过本领域的常规技术进行制备或配置。优选的是,所述发光标记物为吖啶酯时,发光底物由第一发光底物和第二发光底物组成,第一发光底物为含有0.1mol/L硝酸、0.1%过氧化氢的溶液,第二发光底物为含有2%Tween-20、0.25mol/LNaOH的溶液;所述发光标记物为碱性磷酸酶时,发光底物为以金刚烷为基础的底物液;所述发光标记物为过氧化物酶时,发光底物由第一发光底物和第二发光底物组成,第一发光底物为含有0.5g/L鲁米诺、0.1g/L对碘酚的溶液,第二发光底物为0.625g/L过氧化脲溶液。可用于本发明传染性法氏囊病毒抗原或其片段偶联的磁性微粒中磁性微粒溶液和传染性法氏囊病毒抗原或其片段的混合比例为10mg:0.6-9.5nmol,优选为10mg:2.0-8.0nmol。在该范围以下时,发光值随蛋白用量增加迅速上升,说明蛋白未完全结合于磁珠;在该范围内时,发光值增幅变缓,说明磁珠结合蛋白接近饱和;而超过该范围时,发光值随蛋白用量增加反而有所降低,说明蛋白开始出现较多的自身交联,从而导致了偶联磁珠产生构型的改变。本发明中传染性法氏囊病毒抗原或其片段与磁性微粒之间可通过直接或间接偶联。例如,所述的直接偶联包括通过磁性微粒羧基与蛋白氨基缩合形成酰胺、磁性微粒氨基与蛋白氨基通过戊二醛交联形成五碳桥、甲苯磺酰基磁性微粒与蛋白氨基共价偶联相连接。所述的间接偶联包括通过以下方式介导的偶联:链霉亲和素-生物素介导的偶联、抗FITC抗体-FITC偶联。优选的方式为:链霉亲和素包被在磁性微粒上,生物素偶联在传染性法氏囊病毒上,通过链霉亲和素-生物素作用结合传染性法氏囊病毒和磁性微粒;抗FITC抗体包被在磁性微粒上,FITC交联在传染性法氏囊病毒上,通过抗FITC抗体-FITC相互作用结合传染性法氏囊病毒和磁性微粒。本发明传染性法氏囊病毒抗原或其片段偶联的磁性微粒可用于制备检测传染性法氏囊病毒抗体的检测试剂和/或试剂盒。检测试剂或试剂盒本发明提供了一种检测传染性法氏囊病毒抗体的检测试剂或试剂盒,所述的试剂盒含有容器和说明书,所述的容器内含有本发明传染性法氏囊病毒抗原偶联的磁性微粒。优选地,所述的容器内还含有独立包装的质控品或校准品、或清洗液;其中,所述校准品包括传染性法氏囊病毒抗体阴性或阳性血清稀释液。优选地,所述的说明书记载了含有本发明第二方面所述的传染性法氏囊病毒抗原偶联的磁性微粒的使用方法,包括步骤:(i)提供待测样品、和所述传染性法氏囊病毒抗原偶联的磁性微粒;(ii)将所述待测样品与所述传染性法氏囊病毒抗原偶联的磁性微粒混合并进行反应;(iii)将(ii)中反应后的混合液进行洗涤并加入发光底物;(iv)对(iii)中加入发光底物后的混合液进行发光值检测,从而定量或定性检测待测样品中的传染性法氏囊病毒抗体。可用于本发明的清洗液没有特别限制,可以为本领域常用的磁珠清洗液,优选包括含有Tween20的Tris缓冲液或含有Tween20的PBS缓冲液。在另一优选例中,所述Tween20的Tris缓冲液浓度为0.05mol/L,pH为8.0。在另一优选例中,所述Tween20的PBS缓冲液浓度为0.05mol/L,pH为7.0。应用本发明传染性法氏囊病毒抗原偶联的磁性微粒及含有其的检测试剂、检测试剂盒可有效地用于高效、高灵敏度地检测待测样本中的传染性法氏囊病毒抗体,且所述检测可以是定性或定量检测。本发明有益效果本发明采用特定粒径的磁性微粒作为包被载体,采用特定的传染性法氏囊病毒与磁性微粒之比进行混合并反应,获得了包被均质、结构稳定的传染性法氏囊病毒抗原或其片段偶联磁性微粒,也节省了包被蛋白原料,其包被的蛋白充分、检测范围较宽,灵敏度较高、反应时间非常短(仅需5-10分钟),并具有高通量、自动化、可重复的优异特点。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如Sambrook等人,分子克隆:实验室手册(NewYork:ColdSpringVP2rborLaboratoryPress,1989)中所述的条件,或按照制造厂商所建议的条件。通用方法1.传染性法氏囊抗体的检测方法,包括如下步骤:S1、取若干反应管,依次加入20μL待测血清或校准品、100μL稀释液和25μL包被传染性法氏囊抗原蛋白的磁性悬浮液;S2、37℃下反应10分钟;S3、磁铁吸附,吸去上清液,每个反应管加入300-500μL清洗液,重复清洗3次,弃去清洗液;S4、向S3中加入100μL碱性磷酸酶标记的传染性法氏囊抗体溶液;S5、37℃下反应10分钟;S6、重复步骤S3中的清洗步骤;S7、S6中加入100μL发光底物;S8、37℃下反应5分钟;S9、用化学发光仪检测发光值。2.绘制校准曲线,根据校准曲线计算待测血清中抗体的浓度。以浓度值取对数为X轴,以发光值取Logit为Y轴,进行线性拟合,绘制校准曲线。Sn:校准品(除校准品零值外)或样本发光值;S0:校准品零值的发光值。制备实施例1本实施例制备了一种传染性法氏囊抗体检测的试剂盒,包括包被传染性法氏囊抗原蛋白的磁性悬浮液,碱性磷酸酶标记的传染性法氏囊抗体溶液,稀释液,校准品,质控品,清洗液,发光底物和反应管。包被传染性法氏囊抗原蛋白的磁性悬浮液的制备:(1)取1mL含磁性微粒(购于日本JSR公司,货号:MagnosphereTMMS300/Caboxyl)的溶液,浓度为10mg/mL,用0.1mol/LpH为5.0的2-吗啉乙磺酸(MES)缓冲液清洗2遍,最后悬浮于1mL0.1mol/LpH为5.0的MES缓冲液中;(2)加入纯化的传染性法氏囊抗原蛋白(购自于青岛易邦生物工程有限公司)50-500μg;(3)称取1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC),用0.1mol/LpH为5.0的MES缓冲液溶解,使EDC的浓度为10mg/mL;(4)取(3)中的EDC溶液100μL加入(2)中,37℃下振荡反应2小时;(5)磁铁吸附,去上清液,用0.01mol/LpH为7.4的PBS溶液(含0.1%的Tween-20)清洗3遍,最后悬浮在0.01mol/LpH为7.4的PBS溶液(含1%的BSA)中,并加入0.1%的ProClinTM300(购于Sigma公司,货号:48914-U)。所述的磁性微粒为含有羧基基团的磁性微粒。碱性磷酸酶标记的传染性法氏囊抗体溶液的制备:(1)取1mg碱性磷酸酶,用0.05mol/LpH为9.5的碳酸盐缓冲液(CB缓冲液)稀释至10mg/mL;(2)称取高碘酸钠(NaIO4)并用0.05mol/LpH为9.5的CB缓冲液溶解,使NaIO4的浓度为12.5mg/mL;(3)取(2)中NaIO4溶液100μL,加入(1)中,振荡混匀,于2-8℃下避光反应1小时;(4)取10μL乙二醇,加入1mL0.05mol/LpH为9.5的CB缓冲液,获得乙二醇溶液;(5)取(4)中乙二醇溶液100μL加入(3)中,于2-8℃避光反应1小时;(6)取传染性法氏囊单克隆抗体0.5-1mg加入(5)中,混匀后用0.05mol/LpH为9.5的CB缓冲液于2-8℃下避光透析20-24小时;(7)称取硼氢化钠(NaBH4)溶于纯水中,配制2mg/mL的NaBH4溶液;(8)取(7)中NaBH4溶液10μL,加入(6)中,于2-8℃避光反应2小时;(9)过分子筛纯化分离未结合的碱性磷酸酶和传染性法氏囊单克隆抗体;(10)将(9)中纯化后的抗体溶液用含有1%BSA的pH为7.00.05M的3-吗啉丙磺酸(MOPS)缓冲液稀释备用。稀释浓度由预实验效果来确定,合适的稀释浓度为0.1-0.5μg/mL。校准品是经标定的含有已知浓度的传染性法氏囊抗体的缓冲液。校准品的制备:(1)将经传染性法氏囊病毒疫苗强化免疫后获得的传染性法氏囊抗体强阳性血清于60℃热灭活1小时;(2)将(1)中灭活后的强阳性血清经0.2μm的微滤膜过滤,加入0.1%的ProClinTM300;(3)将(2)中的血清进行标定,按一定浓度稀释,得到0,3.13,6.25,12.5,25,50,100,200U/mL系列校准品。质控品是经标定的传染性法氏囊抗体阳性鸡血清。分为低值质控品和高值质控品,其中低值质控品的质控范围为20-30U/mL,高值质控品的质控范围为100-150U/mL。质控品用于控制试验的有效性,定期检测质控品,若超出质控范围,则须使用校准品重新定标。质控品的制备:(1)选择10份以上传染性法氏囊抗体阳性血清,60℃热灭活1小时,混合后经0.2μm的微滤膜过滤,加入0.1%的ProClinTM300。(2)调整混合阳性血清至合适的浓度。稀释液是含有1%BSA,pH为7.4,浓度为0.01mol/L的PBS缓冲液;清洗液是含0.1%Tween-20的0.05mol/LpH为8.0的Tris缓冲液;发光底物是以金刚烷及其衍生物为基础的溶液,此例中的发光底物为Lumi-Phos530,购于Lumigen公司,货号:P-5000。表1为不同浓度的校准品所对应的发光值,图1为绘制的校准曲线表1制备实施例2本实施例制备了一种传染性法氏囊抗体检测的试剂盒,包括包被传染性法氏囊抗原蛋白的磁性悬浮液,吖啶酯标记的山羊抗鸡IgG抗体(购自北京索莱宝科技有限公司)溶液,稀释液,校准品,质控品,清洗液,第一发光底物和第二发光底物,反应管。包被传染性法氏囊抗原蛋白的磁性悬浮液的制备:(1)取1mL含磁性微粒的溶液,浓度为10mg/mL,用0.1mol/LpH为9.5的硼酸缓冲液清洗2遍,最后悬浮于1mL0.1mol/LpH为9.5的硼酸缓冲液中;(2)加入纯化的传染性法氏囊抗原蛋白50-500μg,涡旋混匀;(3)加入0.1mol/LpH为9.5的硼酸缓冲液(含有3mol/L硫酸铵)0.5-1mL,37℃下振荡反应20-24小时;(4)加入0.5mL10%的BSA水溶液,涡旋混匀,37℃振荡反应6-12小时;(5)磁铁吸附,去上清液,用0.01mol/LpH为7.4的PBS溶液(含0.1%的Tween-20)清洗3遍,最后悬浮在0.01mol/LpH7.4的PBS溶液(含1%BSA)中,并加入0.1%的ProClinTM300。所述的磁性微粒为含有甲苯磺酰基基团的磁性微粒。吖啶酯标记山羊抗鸡IgG抗体溶液的制备:(1)取1mg山羊抗鸡IgG抗体,用0.05mol/LpH为9.5的CB缓冲液在2-8℃下透析过夜;(2)取含有0.2mg吖啶酯的吖啶酯溶液加入到(1)中,常温避光反应2小时;(3)加入100μL0.1g/mL赖氨酸溶液,常温避光反应2小时;(4)用0.05mol/LpH为9.5的CB缓冲液在2-8℃下避光透析20-24小时;(5)将(4)中的抗体溶液用含有1%BSA的pH为7.00.05mol/L的MOPS缓冲液稀释备用。校准品的制备方法与制备实施例一相同。质控品的制备方法与制备实施例一相同。稀释液是含有1%BSA,pH为7.4,浓度为0.01mol/L的PBS缓冲液;清洗液是含0.1%Tween-20的0.01mol/LpH为7.0的PBS缓冲液;第一发光底物为含有0.1mol/L硝酸、0.1%过氧化氢的溶液,第二发光底物为含有2%Tween-20、0.25mol/LNaOH的溶液。表2为不同校准品浓度所对应的发光值,图2为绘制的校准曲线。表2制备实施例3本实施例制备了一种传染性法氏囊抗体检测的试剂盒,包括包被传染性法氏囊抗原蛋白的磁性悬浮液,辣根过氧化物酶标记的传染性法氏囊抗原溶液,稀释液,校准品,质控品,清洗液,第一发光底物和第二发光底物,反应管。包被传染性法氏囊抗原蛋白的磁性悬浮液的制备:(1)取1mL含磁性微粒的溶液,浓度为10mg/mL,用0.01mol/LpH为7.4的磷酸盐(PBS)缓冲液清洗2遍,最后悬浮于1mL0.01mol/LpH为7.4的PBS缓冲液中;(2)加入0.1mL25%(v/v)的戊二醛溶液,37℃振荡反应2小时;(3)用1mL0.01mol/LpH为7.4的PBS缓冲液清洗3遍;(4)加入纯化的传染性法氏囊抗原重组抗原50-500μg,37℃振荡反应20-24小时;(5)加入0.5mL10%牛血清白蛋白(BSA)水溶液,涡旋混匀,37℃振荡反应2小时;(6)用0.01mol/LpH为7.4的PBS溶液(含0.1%的Tween-20)清洗3遍,最后悬浮在0.01mol/LpH7.4的PBS溶液(含1%BSA)中,并加入0.1%的ProClinTM300。所述的磁性微粒为含有氨基基团的磁性微粒。辣根过氧化物酶标记传染性法氏囊抗原的制备:(1)取1mg辣根过氧化物酶,用0.05mol/LpH为9.5的CB缓冲液稀释至10mg/mL;(2)称取NaIO4并用0.05mol/LpH为9.5的CB缓冲液溶解,使NaIO4的浓度为12.5mg/mL;(3)取(2)中NaIO4溶液100μL,加入(1)中,振荡混匀,于2-8℃下避光反应1小时;(4)取10μL乙二醇,加入1mL0.05mol/LpH为9.5的CB缓冲液,获得乙二醇溶液;(5)取(4)中乙二醇溶液1mL加入(3)中,于2-8℃避光反应1小时;(6)取传染性法氏囊抗原0.5-1mg加入(5)中,混匀后用0.05mol/LpH为9.5的CB缓冲液于2-8℃下避光透析20-24小时;(7)称取NaBH4溶于纯水中,配制2mg/mL的NaBH4溶液;(8)取(7)中NaBH4溶液10μL,加入(6)中,于2-8℃避光反应2小时;(9)过分子筛纯化;(10)将(9)中纯化后的抗原溶液用含有1%BSA的pH7.00.05mol/L的MOPS缓冲液稀释备用。校准品的制备方法与制备实施例一相同。质控品的制备方法与制备实施例一相同。稀释液是含有1%BSA,pH为7.4,浓度为0.01mol/L的PBS缓冲液;清洗液是含0.1%Tween-20的0.01mol/LpH7.0的PBS缓冲液;第一发光底物为0.5g/L鲁米诺、0.1g/L对碘酚的溶液,第二发光底物为0.625g/L过氧化脲溶液。表3为校准品不同浓度对应的发光值,图3为绘制的校准曲线。表3制备实施例4本实施例制备了一种传染性法氏囊抗体检测的试剂盒,包括包被链霉亲和素的磁性悬浮液,碱性磷酸酶标记的传染性法氏囊病毒抗原,生物素化抗原,校准品,质控品,清洗液,发光底物和反应管。包被链霉亲和素的磁性悬浮液的制备:(1)取1mL含磁性微粒的溶液,浓度为10mg/mL,用0.1mol/LpH为5.0的1-吗啉乙磺酸(MES)缓冲液清洗2遍,最后悬浮于1mL0.1mol/LpH为5.0的MES缓冲液中;(2)加入链霉亲和素50-500μg;(3)称取EDC,用0.1mol/LpH为5.0的MES缓冲液溶解,使EDC的浓度为10mg/mL;(4)取(3)中的EDC溶液100μL加入(2)中,37℃下振荡反应2小时;(5)磁铁吸附,去上清液,用0.01mol/LpH为7.4的PBS溶液(含0.1%的Tween-20)清洗3遍,最后悬浮在0.01mol/LpH为7.4的PBS溶液(含1%BSA)中,并加入0.1%的ProClinTM300。所述的磁性微粒为含有羧基基团的磁性微粒。碱性磷酸酶标记的传染性法氏囊病毒抗原溶液的制备:(1)取1mg碱性磷酸酶,用0.05mol/LpH为9.5的CB缓冲液稀释至10mg/mL;(2)称取NaIO4并用0.05mol/LpH为9.5的CB缓冲液溶解,使NaIO4的浓度为12.5mg/mL;(3)取(2)中NaIO4溶液100μL,加入(1)中,振荡混匀,于2-8℃下避光反应1小时;(4)取10μL乙二醇,加入1mL0.05mol/LpH为9.5的CB缓冲液,获得乙二醇溶液;(5)取(4)中乙二醇溶液1mL加入(3)中,于2-8℃避光反应1小时;(6)取传染性法氏囊病毒抗原0.5-1mg加入(5)中,混匀后用0.05mol/LpH为9.5的CB缓冲液于2-8℃下避光透析20-24小时;(7)称取NaBH4溶于纯水中,配制2mg/mL的NaBH4溶液;(8)取(7)中NaBH4溶液10μL,加入(6)中,于2-8℃避光反应2小时;(9)过分子筛纯化;(10)将(9)中纯化后的抗体溶液用含有1%BSA的pH为7.00.05mol/L的MOPS缓冲液稀释备用。生物素抗原的制备:(1)取1mg传染性法氏囊病毒抗原,用0.01mol/LpH为7.4的PBS缓冲液在2-8℃下透析过夜;(2)将预活化的生物素溶于纯水中,制备50mmol/L的生物素溶液;(3)取(2)中生物素溶液20μL加入(1)中,常温反应1小时;(4)将(3)中加入100μL0.1g/mL赖氨酸溶液,常温反应1小时;(5)将(4)中溶液用0.01mol/LpH为7.4的PBS缓冲液在2-8℃下透析20-24小时。(6)将(5)中溶液用含有1%BSA的pH为7.00.05mol/L的MOPS缓冲液稀释备用。校准品的制备方法与制备实施例一相同。质控品的制备方法与制备实施例一相同。清洗液是含0.1%Tween-20的0.05MpH8.0的Tris缓冲液;发光底物是以金刚烷及其衍生物为基础的溶液。此例中的发光底物为Lumi-Phos530,购于Lumigen公司,货号:P-5000。表4为校准品不同浓度对应的发光值,图4为绘制的校准曲线。表4实验实施例1传染性法氏囊病毒抗原或其片段对磁性微粒的比例研究本实施例采用了3种传染性法氏囊病毒抗原或其片段(SEQIDNO.:1-3)、2种磁性微粒((购于日本JSR公司,货号:MagnosphereTMMS300/Caboxyl)和含有甲苯磺酰基的磁性微粒(购于日本JSR公司,货号:MagnosphereTMMS300/Tosyl))包被,制备过程如下:本实验实施例先采用了制备实施例1中所制备的传染性法氏囊病毒VP2蛋白偶联磁性微粒,其中传染性法氏囊病毒VP2蛋白全长的加入量为15.7、31.3、62.5、125、250、500μg,对应物质的量为0.28、0.55、1.1、2.19、4.39、8.77nmol;传染性法氏囊病毒VP2蛋白片段的加入量为4.7、9.4、18.8、37.5、75、150μg,对应物质的量为0.28、0.55、1.11、2.21、4.41、8.82nmol;传染性法氏囊病毒VP2蛋白多肽的加入量为1.6、3.2、6.3、12.5、25、50μg,对应物质的量为0.29、0.58、1.15、2.27、4.55、9.09nmol。本实验实施例还采用了制备实施例2中所制备的传染性法氏囊病毒VP2蛋白偶联磁性微粒,其中传染性法氏囊病毒VP2蛋白全长的加入量为15.7、31.3、62.5、125、250、500μg,对应物质的量为0.28、0.55、1.1、2.19、4.39、8.77nmol;传染性法氏囊病毒VP2蛋白片段的加入量为4.7、9.4、18.8、37.5、75、150μg,对应物质的量为0.28、0.55、1.11、2.21、4.41、8.82nmol;传染性法氏囊病毒VP2蛋白多肽的加入量为1.6、3.2、6.3、12.5、25、50μg,对应物质的量为0.29、0.58、1.15、2.27、4.55、9.09nmol。配以碱性磷酸酶标记的传染性法氏囊病毒溶液、清洗液、发光底物和反应管进行试验。1.1羧基磁珠的最适蛋白用量用本实施例传染性法氏囊抗体阳性血清,结果如表5所示,图5为包被蛋白用量与其发光值对应的曲线。结果表明,随蛋白用量增加,发光值上升速度逐渐变缓,说明磁珠结合蛋白接近饱和;而蛋白用量继续增加,发光值反而有所降低,说明蛋白过量,出现了较多的蛋白自身交联。因此,对于羧基磁珠,传染性法氏囊VP2蛋白全长、片段、多肽的最适用量为1.1-9.09nmol/10mg磁珠,在0.5-10nmol/10mg的范围内也可以满足实验需求。三种蛋白虽然氨基酸数量、分子量差别很大,但按物质的量计算,最佳包被蛋白用量相差不大,都在0.5-10nmol/10mg磁珠范围内。其中,1.1-2.27nmol/10mg磁珠效果最好。表5羧基磁珠的最适蛋白用量1.2甲苯磺酰基磁珠的最适蛋白用量用本实施例检测传染性法氏囊抗体阳性血清,结果如表6所示,图6为包被蛋白用量与其发光值对应的曲线。随蛋白用量增加,发光值上升速度逐渐变缓,说明磁珠结合蛋白接近饱和。因此,对于甲苯磺酰基磁珠,传染性法氏囊VP2蛋白全长、片段、多肽的最适用量为1.1nmol/10mg磁珠以上。三种蛋白虽然氨基酸数量、分子量差别很大,但按物质的量计算,最佳包被蛋白用量相差不大,考虑成本因素,蛋白用量不宜过多,结合羧基磁珠的结果,确定三种蛋白的最佳用量范围为1.1-9.09nmol/10mg磁珠。表6甲苯磺酰基磁珠的最适蛋白用量实验实施例2灵敏度实验分别采用制备实施例1、2、3、4中的试剂盒分别进行灵敏度测试,国外知名厂家生产的传染性法氏囊抗体检测试剂盒(酶联免疫吸附试验,以下简称为ELISA试剂盒)同时检测不同稀释倍数的传染性法氏囊抗体血清,其中,本实施例的试剂盒对每份血样均做10个重复检测,计算变异系数(CV%=10个测试结果的标准偏差/算术平均值)。以CV%<20%的最大稀释倍数作为灵敏度结果。结果分别见表7、8、9、10,可见本试剂灵敏度均优于ELISA试剂盒,其中表7可见本发明试剂盒灵敏度<2.38U/mL;表8可见本发明试剂盒灵敏度<0.57U/mL;表9可见本发明试剂盒灵敏度<0.60U/mL;表10可见本发明试剂盒灵敏度<1.41U/mL。表7表8表9表10实验实施例3重复性实验取3例传染性法氏囊抗体阳性血清,分别采用制备实施例1、2、3、4中的试剂盒分别进行重复性测试,每天分2批检测,每批3份血清各做2个测试,两批试验至少间隔2小时,连续检测5天。每份血清各得到20个检测数据,计算其浓度的变异系数,结果如表11、12、13、14。结果证明,3份血清检测结果重复性良好。表11表12表13表14实验实施例4符合率实验分别采用制备实施例1、2、3、4中的试剂盒与ELISA试剂盒同时检测多份鸡血清,检测结果如表15-18。结果显示,四次实验中,本试剂与ELISA试剂盒阳性符合率分别为93.8%、92.0%、94.3%、92.6%,阴性符合率分别为94.5%、92.4%、93.2%、92.0%,总体符合率分别为94.2%、92.3%、93.7%、92.3%。表15表16表17表18实验实施例5传染性法氏囊病毒疫苗的免疫监测浓度<8.0U/mL判定为阴性,浓度≥8.0U/mL判定为阳性;Elisa试剂盒S/P≤0.20判定为阴性,S/P>0.20判定为阳性。在用传染性法氏囊病毒疫苗免疫后,随机抽取3只,分别于免疫后0、7、10、14、21、35天抽取血样检测传染性法氏囊抗体,采用制备实施例1、2、3、4中试剂盒进行检测,检测结果如表19-22。结果显示,在免疫后10天至35天,传染性法氏囊病毒抗体由阴转阳,且浓度逐渐上升;两种试剂检测结果一致。表19表20表21表22实验实施例6特异性实验分别采用制备实施例1、2、3、4中的试剂盒检测多种相关病毒抗体强阳性血清,包括H9亚型禽流感病毒抗体(AIV-H9-Ab)、新城疫病毒抗体(NDV-Ab)、传染性支气管炎抗体(IBV-Ab)、禽白血病病毒J亚型抗体(ALV-J-Ab)、鸡网状内皮组织增生病毒抗体(REV-Ab)。检测结果检测结果均低于8.0U/mL,均为阴性,未发现交叉反应,见表23、24、25、26。表23相关病毒抗体AIV-H9-AbNDV-AbIBV-AbALV-J-AbREV-Ab浓度(U/mL)2.522.233.432.112.36表24相关病毒抗体AIV-H9-AbNDV-AbIBV-AbALV-J-AbREV-Ab浓度(U/mL)1.482.061.731.991.61表25相关病毒抗体AIV-H9-AbNDV-AbIBV-AbALV-J-AbREV-Ab浓度(U/mL)1.251.331.861.231.75表26相关病毒抗体AIV-H9-AbNDV-AbIBV-AbALV-J-AbREV-Ab浓度(U/mL)3.013.12.463.133.06在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。序列表<110>上海鸣捷生物科技有限公司<120>传染性法氏囊病毒抗原偶联磁性微粒及其制备方法和应用<130>P2016-1201<160>3<170>PatentInversion3.5<210>1<211>469<212>PRT<213>传染性法氏囊病毒(Infectiousbursaldiseasevirus;IBDV)<220><221>misc_feature<223>VP2全长<400>1GlnThrGlnGlnIleValProPheIleArgSerLeuLeuMetProThr151015ThrGlyProAlaSerIleProAspAspThrLeuGluLysHisThrLeu202530ArgSerGluThrSerThrTyrAsnLeuThrValGlyAspThrGlySer354045GlyLeuIleAlaPhePheProGlyPheProGlySerIleValGlyAla505560HisTyrThrLeuGlnSerAsnGlyAsnTyrLysPheAspGlnMetLeu65707580LeuThrAlaGlnAsnLeuProAlaSerTyrAsnTyrCysArgLeuVal859095SerArgSerLeuThrValArgSerSerThrLeuProGlyGlyValTyr100105110AlaLeuAsnGlyThrValAsnAlaValThrPheGlnGlySerLeuSer115120125GluLeuThrAspValSerTyrAsnGlyLeuMetSerAlaThrAlaAsn130135140IleAsnAspLysIleGlyAsnValLeuIleGlyGluGlyValThrVal145150155160LeuSerLeuProThrSerTyrAspLeuGlyTyrValArgLeuGlyAsp165170175ProIleProAlaIleGlyLeuAspProLysMetValAlaThrCysAsp180185190SerSerAspArgProArgValTyrThrIleThrAlaAlaAspAspTyr195200205GlnPheSerSerGlnTyrGlnSerGlyGlyValThrIleThrLeuPhe210215220SerAlaAsnIleAspAlaIleThrSerLeuSerValGlyGlyGluLeu225230235240ValPheGlnThrSerValGlnSerLeuValLeuGlyAlaThrIleTyr245250255LeuIleGlyPheAspGlyThrThrValThrThrArgThrValAlaAla260265270AsnThrGlyLeuThrAlaGlyThrAspAsnProIleProPheAsnLeu275280285ValPheProThrAsnGluIleThrGlnProIleThrSerIleLysLeu290295300GluIleValThrSerLysSerGlyGlyGlnAlaGlyAspGlnMetSer305310315320TrpSerAlaSerGlyArgLeuAlaValThrIleHisGlyGlyAsnTyr325330335ProGlyAlaLeuArgProValThrLeuValAlaTyrGluArgValAla340345350LysGlySerValValThrValAlaGlyValSerAsnPheGluLeuIle355360365ProAsnProGluLeuAlaLysAsnLeuValThrGluTyrGlyArgPhe370375380AspProGlyAlaMetAsnTyrThrLysLeuIleLeuSerGluArgAsp385390395400ArgLeuGlyIleLysThrValTrpProThrArgGluTyrThrAspPhe405410415ArgGluTyrPheMetGluValAlaAspLeuAsnSerProLeuLysIle420425430AlaGlyAlaPheGlyPheLysAspIleIleArgAlaIleArgArgIle435440445AlaValProValValSerThrLeuPheProProAlaAlaProLeuAla450455460HisAlaIleGlyGlu465<210>2<211>134<212>PRT<213>传染性法氏囊病毒(Infectiousbursaldiseasevirus;IBDV)<220><221>misc_feature<223>VP2片段<400>2IleGlyLeuAspProLysMetValAlaThrCysAspSerSerAspArg151015ProArgValTyrThrIleThrAlaAlaAspAspTyrGlnPheSerSer202530GlnTyrGlnSerGlyGlyValThrIleThrLeuPheSerAlaAsnIle354045AspAlaIleThrSerLeuSerValGlyGlyGluLeuValPheGlnThr505560SerValGlnSerLeuValLeuGlyAlaThrIleTyrLeuIleGlyPhe65707580AspGlyThrThrValThrThrArgThrValAlaAlaAsnThrGlyLeu859095ThrAlaGlyThrAspAsnProIleProPheAsnLeuValPheProThr100105110AsnGluIleThrGlnProIleThrSerIleLysLeuGluIleValThr115120125SerLysSerGlyGlyGln130<210>3<211>50<212>PRT<213>传染性法氏囊病毒(Infectiousbursaldiseasevirus;IBDV)<220><221>misc_feature<223>VP2片段<400>3ValPheGlnThrSerValGlnSerLeuValLeuGlyAlaThrIleTyr151015LeuIleGlyPheAspGlyThrThrValThrThrArgThrValAlaAla202530AsnThrGlyLeuThrAlaGlyThrAspAsnProIleProPheAsnLeu354045ValPhe50当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1