生物材料的红外成像的制作方法
本发明涉及使用红外吸收技术对生物材料,如组织进行表征的方法和设备。
背景技术:
在医学分析领域中,常常期望确定来自患者的组织样品的结构和组成。这可以帮助鉴定组织异常并且可以提供组织样品的指示,其中进一步的临床研究可能是可取的。
用于鉴定生物材料,如组织的化学性质的一种公认的方法是傅里叶变换(fouriertransform)红外光谱成像。如us2012/0052063中所述,使用中红外区中的吸收光谱作为可以鉴定分子种类和它们的局部环境的化学指纹图谱并且潜在地对癌症病理学具有吸引力。us'063中所述的技术将组织样品的红外光谱图像分割成上皮像素和基质像素,然后通过参考相对于参考癌性样品和良性样品的概率分布函数对上皮像素和它们的邻域的空间分析来将上皮像素分割成癌性类别或良性类别。这因此与使用染色剂或染料以使某些细胞结构在显微镜检查下突出显示的现有组织学方法相比为组织检查提供了一定程度的自动化。
将有利的是,提供可从红外吸收测量值中导出的数值组织学指数(例如量度),所述红外吸收测量值可以重复地提供一个或多个组织特征的量度,该量度可用于临床诊断和/或临床预后。
技术实现要素:
本发明涉及提供这样的数值组织学指数和用于从正在分析的样品产生这样的指数的设备。
根据一个方面,本发明提供了一种映射组织样品中的组织特征的方法,所述方法包括:
在所选择的波长从所述样品采集红外吸收数据;
从所述红外吸收数据确定可归因于酰胺部分的所吸收的能量或功率的量的第一量度和可归因于磷酸酯部分的所吸收的能量或功率的量的第二量度;以及
确定所述第一量度与所述第二量度的比率以确定组织学指数。
所述所选择的波长可以位于6.0微米±0.5微米、6.47微米±0.50微米、8.13微米±0.44微米、9.3微米±0.7微米范围内。所述组织学指数可以包括通过用所述第一量度除以所述第二量度所获得的数值。所述组织学指数pa可以根据以下表达式导出:pa=[|m(λ3)-m(λ4)|]/[|m(λ1)-m(λ2)|],其中:m(λn)是在λn吸收的能量或功率的量度;λ1是对应于可归因于酰胺部分的峰值吸收值的波长;λ2是对应于可归因于酰胺部分的基线吸收值的波长;λ3是对应于可归因于磷酸酯部分的峰值吸收值的波长;λ4是对应于可归因于磷酸酯部分的基线吸收值的波长。所述组织学指数pa可以根据以下表达式导出:pa=[xm(λ3)-m(λ4)]/[xm(λ1)-m(λ2)],其中:m(λn)是在λn吸收的能量或功率的量度;λ1是对应于可归因于酰胺部分的峰值吸收值的波长;λ2是对应于可归因于酰胺部分的基线吸收值的波长;λ3是对应于可归因于磷酸酯部分的峰值吸收值的波长;λ4是对应于可归因于磷酸酯部分的基线吸收值的波长;并且x是数值因子≥1,它被设定为足以确保对于所有测量值来说峰值吸收值λ3和λ1的量度m始终大于相应基线吸收值λ4和λ2的量度m的值。所述值x可以根据所述测量系统的信噪比来设定。x的值可以位于1.2至1.5范围内。可以应用以下值:λ1=6.0微米±0.1微米;λ2=6.5微米±0.1微米;λ3=8.13微米±0.1微米或9.26微米±0.1微米;λ4=8.57微米±0.1微米或10.0微米±0.1微米。所述第一量度可以包括酰胺吸收峰下面积并且所述第二量度可以包括磷酸酯吸收峰下面积。所述第一量度可以从在λ1=6.0微米和在λ2=6.5微米的吸收的量度导出,并且所述第二量度可以从在λ3=8.13微米或9.26微米和在λ4=8.57微米或10.0微米的吸收的量度导出。所述第一量度和所述第二量度中的每一个可以从以下各项获得:样品数据s;环境数据es;背景数据b;以及背景环境数据eb,所述方法还包括使用es、b、eb补偿所述样品数据s。所述第一量度和所述第二量度m中的每一个可以根据以下表达式从一个或多个测量值m获得:m=[s-es]/b-eb]。所述方法可以包括获得二维阵列中多个像素中的每一个的所述第一量度和所述第二量度中的每一个的值。
所述方法可以包括执行坏像素替换程序,所述程序包括:
导出所述阵列中所测量的吸收值的直方图;
鉴定具有最低测量吸收值的像素;
将所述所鉴定的像素中的每一个的吸收值用替代值替换,所述替代值包括所述所鉴定的像素的一个或多个相邻像素的平均值。
所述方法可以包括针对每一个所选择的波长执行所述坏像素替换程序。
所述方法可以包括对所述组织学指数在至少两个维度上的空间变化进行绘图。所述方法可以包括基于每一个像素的组织学指数将每一个像素分类为指示第一组织类型、第二组织类型或第三组织类型。所述方法可以包括将每一个像素分类为指示非癌组织候选类型或癌组织候选类型。所述方法可以应用于乳腺组织。所述方法可以包括使用所述组织学指数来导出癌症分级。所述癌症分级可以用于乳腺癌。
根据另一个方面,本发明提供了用于映射组织样品中的组织特征的设备,所述设备包括:
检测器,所述检测器被配置成在所选择的波长从组织样品获得红外吸收数据;
处理模块,所述处理模块被配置成处理所述红外吸收数据;
所述设备被配置成执行上文所限定的方法中的任一种。
附图说明
现在将以举例方式并且参考附图来描述本发明的实施方案,其中:
图1示出了用于从样品采集红外吸收数据的设备的示意图;
图2示出了从样品获得的红外吸收光谱的示意性实例;
图3是图示了适用于产生组织样品的组织学指数映射的数据处理技术的步骤的流程图;
图4是更详细地图示了图3的数据处理技术的步骤,从而限定了坏像素替换例程的流程图;
图5是图示了可用于图3的数据处理技术的进一步后续步骤的流程图;
图6是图示了显示样品的图像和在图3的程序中产生的组织学指数中的步骤的流程图;
图7示出了苏木精伊红(h&e)染色的组织样品的显微镜图像与使用图1的设备和图3的组织学指数处理方法所产生的样品的数字图像相比的比较;
图8示出了苏木精伊红(h&e)染色的乳腺组织样品的显微镜图像与使用图1的设备和图3的组织学指数处理方法所产生的样品的数字图像相比的进一步比较;
图9示出了图示了常规癌症分级法与使用图1的设备所产生的组织学指数之间的相关性的图表。
具体实施方式
大部分的生物分子在位于3μm至约16μm的中红外光谱范围内的波长下具有振动模式。振动模式的位置、宽度以及强度随分子的组成和结构而变。可以通过傅里叶变换红外光谱法来确定主要生物分子,如蛋白质、脂质以及核酸的振动模式的鉴定。定向于生物样品,例如组织样品的红外辐射被不同地吸收或透射,这取决于所存在的生物材料,即样品中存在的化合物和官能团、以及样品中材料的浓度和分布。样品的红外光谱表现出特征性的光谱特征,如在特征频率处特征形状和尺寸的吸收带。这些特征性光谱特征用作“指纹图谱”,通过它来唯一地鉴定特定官能团的存在;此外,某个官能团的存在指示某个生物分子。
图1示出了用于从样品采集红外吸收数据的合适的设备1。红外源2提供了红外辐射3的输出,该红外辐射3可以通过快门4(在打开时)和滤光器5以到达安装在样品台6上的样品10。样品10根据样品的局部结构和/或组成以及辐射的频率/波长吸收红外辐射或透射红外辐射。通过样品10的透射的红外辐射7由聚焦元件8聚焦到合适的检测器阵列9上。
红外源2可以是任何合适的类型,并且优选地是能够高效地产生具有约5微米至9微米范围内的波长的红外输出3的红外源。快门4可以包括能够中断红外输出3以防止它到达样品10的任何合适的布置。滤光器5可以是用于仅使得红外输出3的所选波段能够到达样品10的任何合适的装置。滤光器5可以是滤光轮,该滤光轮包括多个单独的滤光元件,它们可以移动到束线中或可以是可调谐的滤光器。更一般来说,滤光器5可以是用于使得能够选择红外辐射的波长或窄范围的波长以到达样品10的可控滤光器。以这种方式,可以在不同的时间在特定波长处或在特定波段中对样品进行单独的红外吸收测量。
没有被样品7吸收的红外辐射7可以使用任何合适的聚焦元件8聚焦到检测器阵列9上,所述聚焦元件8可以是一个透镜或多个透镜。检测器阵列9可以是任何合适的装置,如测辐射热照相机或对红外辐射敏感的任何检测器。
在替代性布置中,宽带红外源2、快门4以及滤光轮5可能用能够产生不同波长的红外输出光束3的可转换和/或可调谐的红外源代替,如光学参量发生器或光学参量振荡器、或一个或多个量子级联激光器。
优选的是,红外源和检测器布置被配置成在单次曝光中同时照射整个样品或其实质部分以及捕捉样品的大空间区域的透射红外能。或者,设备1可以每次仅对样品的小部分进行采样并且使用位置可控样品台6以依次测量样品的不同部分中的吸收,例如在多次曝光中。
来自检测器阵列9的输出11通过合适的处理装置12以执行下文所述的分析功能。所述处理器可以与合适的显示装置14联接以用于下文所述的功能。显示装置14还可以用作用户输入装置。
可以通过比较在样品处在红外光束内的位置处的情况下所获得的检测器测量值与在将样品从红外光束中取出的情况下所获得的检测器测量值来获得红外吸收测量值。
在四个波长λ1、λ2、λ3、λ4中的每一个处的吸收测量值可以根据所使用的红外吸收分析设备,通过任何合适的方式获得。在图1的实例中,每一个吸收测量值mλn优选地是使用四个测量值获得的:
(i)在样品被装载在样品台上的机器中并且快门打开/移除的情况下所获得的样品图像s;
(ii)在样品被装载在所述机器中并且快门进入/关闭的情况下所获得的环境信号es;
(ii)在从设备中取出样品并且快门打开/移除的情况下所获得的背景图像b;以及
(iv)在取出样品并且快门进入/关闭的情况下所获得的背景环境eb测量值。
优选地各自对应于吸收功率或能量的吸收测量值mλn是根据下式导出的:mλn=(s-es)/(b-eb)。优选的是,多次(例如n次)获得每一个吸收测量值mλn并且计算mλn的平均值。可以根据对于设备设定的采集时间来选择n的值。
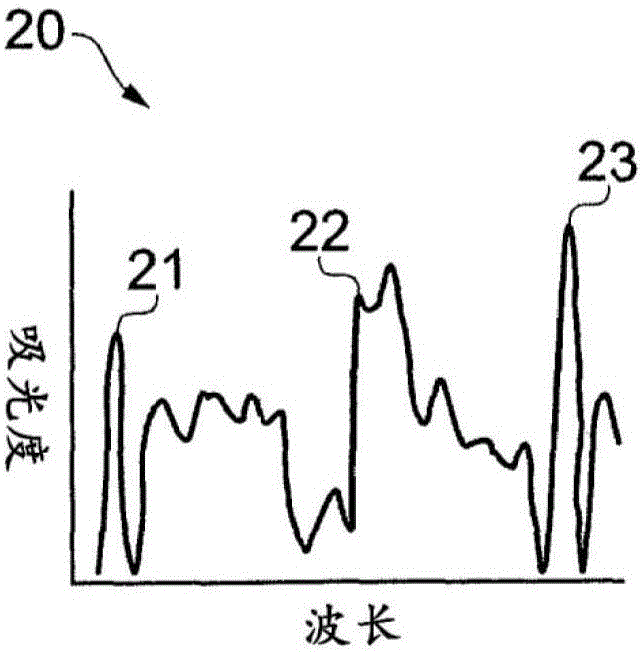
图2示意性地示出了从样品获得的示例性红外吸收光谱20。红外吸收光谱20可以使用本领域已知的技术作为由检测器阵列9接收的红外透射光谱的函数导出。峰21、22、23各自对应于与特定官能团有关的光谱特征。这些基团通常可以包括诸如下表中所列的那些的官能团。
本申请的发明人已经确定,确定可归因于酰胺官能团/酰胺部分的所吸收的功率或能量的量的第一量度ma和可归因于磷酸酯官能团/磷酸酯部分的所吸收的功率或能量的量的第二量度mp并且计算所述第一量度和所述第二量度的比率提供了定量量度,所述定量量度可以用作有用的组织学指数,所述组织学指数是可靠的预后标志物,至少对于浸润性乳腺癌来说。
更一般来说,定义该组织学指数的比率mp/ma被认为是样品中存在的与进一步临床评估高度相关的一种或多种组织结构的有用指标。所述比率因此在用于处于某些类型的癌症风险中的个体的筛查程序的第一阶段的自动化中可能是非常有用的,并且可以可靠地指示临床预后。所述组织类型可以是乳腺组织或其它类型的组织并且癌症的类型可以包括乳腺癌或其它类型的癌症。
在一个优选的方面,所述第一量度ma是在5.5微米至6.5微米波长范围内所获得的可归因于酰胺官能团的红外吸收(优选地是吸收功率)的量度并且所述第二量度mp是在7.6微米至8.6微米或8.6微米至10.0微米范围内所获得的可归因于磷酸酯官能团的红外吸收的量度。测量值ma和mp因此可以分别包括、对应于、或近似于酰胺吸收峰下面积和磷酸酯吸收峰下面积。所述第一量度ma可以包括在6.0微米波长处发现的吸收峰下计算面积并且所述第二量度mp可以包括在8.13微米波长处发现的吸收峰下计算面积或在9.3微米波长处发现的吸收峰下计算面积。所述第一量度ma可以包括在6.0微米±0.5微米波长或6.47微米±0.5微米范围内所获得的可归因于酰胺官能团的红外吸收的量度并且所述第二量度mp可以包括在8.13微米±0.44微米或9.3微米±0.7微米范围内所获得的可归因于磷酸酯官能团的红外吸收的量度。上文给出的范围优选地表示峰的半高全宽。磷酸酯官能团/磷酸二酯浓度的红外吸收优选地在8.13微米处测量,这是因为尽管在9.3微米处的峰在一些情况下相对于基线给出了更好的对比度,但是在该波长处的信噪比可能由于一些红外源的低发射率而受到限制。然而,信噪比的提高可以改变该偏好。
所述第一量度ma可以包括在酰胺官能团的吸收峰处所获得的吸收测量值与在酰胺官能团的吸收峰的基线处所获得的吸收测量值之间的差异。所述第二量度mp可以包括在磷酸酯官能团的吸收峰处所获得的吸收测量值与在磷酸酯官能团的吸收峰的基线处所获得的吸收测量值之间的差异。
在酰胺官能团的吸收峰处所获得的吸收测量值与在酰胺官能团的吸收峰的基线处所获得的吸收测量值之间的差异可以通过以下各项来确定:a)在λ1=6.0微米处测量吸收峰;以及b)在λ2=6.47微米处测量吸收基线。
在磷酸酯官能团的吸收峰处所获得的吸收测量值与在磷酸酯官能团的吸收峰的基线处所获得的吸收测量值之间的差异可以通过以下各项来确定:a)在λ3=8.13微米处测量吸收峰;以及b)在λ4=8.57微米处测量吸收基线。在磷酸酯官能团的吸收峰处所获得的吸收测量值与在磷酸酯官能团的吸收峰的基线处所获得的吸收测量值之间的差异可以通过以下各项来确定:a)在λ3=9.3微米处测量吸收峰;以及b)在λ4=10.0微米处测量吸收基线。
差异测量值可以通过使用将如下文所述的缩放因子来确定。
优选地对样品台6上样品10的视野中的多个像素进行测量,并且优选地通过检测器阵列9同时捕捉所有的像素测量值。像素数据处理例程参考图3描述于下文中。
图3示出了适用于产生样品10的图像中每一个像素的组织学指数的数据处理技术的流程图。数据处理可以在图1的处理器12内执行。
首先,在λ1、λ2、λ3、λ4中的每一个处测量每一个像素的吸收(步骤30)以产生每一个波长λ1、λ2、λ3、λ4的图像图。将此重复一定次数,即n次(步骤31)以产生每一个波长的n个图像图。n可以根据包括采集时间的系统参数而变化以优化性能。计算每一个图中每一个像素的平均值(其可以是平均数)(步骤32)以产生图像图或数据集mλn,它包括在每一个波长处每一个像素的吸收的平均值。
然后执行坏像素替换算法以消除、校正或以其它方式减少明显是异常值的任何像素值。示例性坏像素替换例程如步骤33至步骤36中所示。这可以是有用的,这是因为在随后的比率计算过程中,可能存在除以具有零值的像素的可能性,这会造成图像数据中的异常。构建每一个图像图mλ中出现的像素值的直方图(步骤33)。鉴定和标记具有对应于最低出现频率的值的像素(步骤34)。然后将标记的像素用标记的像素的第一直接相邻像素的平均值(优选地是中值)替换。这是针对每一个标记的像素执行的(步骤35)。
将步骤33至步骤35的程序重复多次(步骤36)以确保坏像素群已经被替换。何时停止重复程序(步骤36)的决定可以通过简单的计数,即重复固定的次数(例如20次)来确定,或可以通过另外的方法,如分析步骤33中产生的直方图的分布来确定。
我们现在具有代表四个图像的四个数据集mλ1、mλ2、mλ3、mλ4,它们各自包括对应于图像的像素的吸收值的阵列(步骤37)。mλ1映射了在以酰胺吸收峰为中心的波长处在样品上由于酰胺部分所产生的吸收曲线。mλ2映射了在与酰胺吸收峰紧邻的波长处样品上的吸收曲线并且因此表示酰胺吸收峰的基线。mλ3映射了在以磷酸酯吸收峰为中心的波长处在样品上由于磷酸酯部分所产生的吸收曲线。mλ4映射了在与磷酸酯吸收峰紧邻的波长处样品上的吸收曲线并且因此表示磷酸酯吸收峰的基线。
然后根据以下表达式从四个数据集mλ1、mλ2、mλ3、mλ4产生对应于组织学指数pa的数据集(步骤38):
pa=[xmλ3-mλ4]/[xmλ1-mλ2]
更一般来说,mλn是在λn处吸收的能量或功率的量度;λ1是对应于可归因于酰胺部分的峰值吸收值的波长;λ2是对应于可归因于酰胺部分的基线吸收值的波长;λ3是对应于可归因于磷酸酯部分的峰值吸收值的波长;λ4是对应于可归因于磷酸酯部分的基线吸收值的波长;并且x是数值因子≥1,它被设定为足以确保对于所有测量值来说峰值吸收值λ3和λ1的量度m始终大于相应基线吸收值λ4和λ2的量度m的值。x的值因此可以根据测量系统的信噪比来设定。x的值优选地可以位于1.2至1.5范围内。
在上文所给出的实例中,pa和mλn各自是包括对应于样品的空间图的像素值的二维阵列的数据集。
步骤38可以被指定为包括类似于关于步骤33至步骤36所述的坏像素替换例程的进一步的坏像素替换例程。这示于图4中,图4详述了可以被采取以执行步骤38的步骤。
参考图4,对于每一个像素评价对应于按比例缩放的磷酸酯峰高的分子表达式[xmλ3-mλ4](步骤40)。这提供了对应于按比例缩放的磷酸酯峰高ppk的像素图的数据集。构建像素图中出现的像素值的直方图(步骤41)。鉴定和标记具有对应于最低出现频率的值的像素(步骤42)。然后将标记的像素用标记的像素的第一直接相邻像素的平均值(优选地是中值)替换。这是针对每一个标记的像素执行的(步骤43)。
可以将步骤41至步骤43的程序重复多次(步骤44)以确保坏像素群已经被替换。何时停止重复程序(步骤44)的决定可以通过简单的计数,即重复固定的次数(例如20次)来确定,或可以通过另外的方法,如分析步骤41中产生的直方图的分布来确定。
对于每一个像素评价对应于按比例缩放的酰胺峰高的分母表达式[xmλ1-mλ2](步骤45)。这提供了对应于按比例缩放的酰胺峰高apk的像素图的数据集。构建像素图中出现的像素值的直方图(步骤46)。鉴定和标记具有对应于最低出现频率的值的像素(步骤47)。然后将标记的像素用标记的像素的第一直接相邻像素的平均值(优选地是中值)替换。这是针对每一个标记的像素执行的(步骤48)。
可以将步骤46至步骤48的程序重复多次(步骤49)以确保坏像素群已经被替换。何时停止重复程序(步骤36)的决定可以通过简单的计数,即重复固定的次数(例如20次)来确定,或可以通过另外的方法,如分析步骤46中产生的直方图的分布来确定。
一旦已经使用坏像素替换例程41-43和46-48产生了分子数据集ppk和分母数据集apk,就在步骤49之后,计算组织学指数pa,从而结束图3的步骤38。
可以对数据集pa执行进一步的坏像素替换例程50。如在图5中所看到,构建像素图pa中出现的像素值的直方图(步骤51)。鉴定和标记具有对应于最低出现频率的值的像素(步骤52)。然后将标记的像素用标记的像素的第一直接相邻像素的平均值(优选地是中值)替换。这是针对每一个标记的像素执行的(步骤53)。
可以将步骤51至步骤53的程序重复多次(步骤54)以确保坏像素群已经被替换。何时停止重复程序(步骤54)的决定可以通过简单的计数,即重复固定的次数(例如20次)来确定,或可以通过另外的方法,如分析步骤51中产生的直方图的分布来确定。
可以考虑用于坏像素替换的其它算法。上述缩放因子x的使用用于确保除以负值不会发生或不太可能发生。由于磷酸酯峰值和酰胺峰值这两者均是以相同的因子按比例缩放的,因此发现数据仍具代表性。可以考虑用于防止产生负值的其它技术,例如通过取分子和/或分母的模值,即pa=[|m(λ3)-m(λ4)|]/[|m(λ1)-m(λ2)|]。坏像素替换算法和峰值缩放算法可以根据在任何特定测量设备中发现的信噪比来确定。
然而,优选的是,为了使组织学指数pa在用于从样品采集红外吸收数据的许多不同类型的设备中是普遍有用的,可以在许多不同的设备上执行一致的算法。
数据集pa表示二维图像的每一个像素的组织学指数的值。在该图像内,存在一定范围的像素值。可以使用成像设备(例如显示器14)显示或输出组织样品的一些或所有像素的组织学指数的图像,例如经由颜色叠加到目视图像上或作为组织学指数的值的颜色编码的二维图。这样的输出的实例示于图7中,该图7示出了高级别发育不良食管上皮组织样品。
在图7b中,示出了未染色的组织样品的组织学指数pa的二维图,0至4.2的pa值以假色示出。在图7a中,示出了根据常规的苏木精伊红(h&e)染色技术所染色的相同的样品。在图7a的图像70中,区域71(在虚线72、73以外)具有正常组织的染色外观。区域74(在虚线72内)在图7b的图像中具有0.64±0.01(平均数±第一σ标准误差)的估计平均组织学指数pa(被示为“数字染色”或数字指数“di”)并且对应于低级别发育不良。区域75(在虚线73内)在图7b的图像中具有0.75±0.01的估计平均组织学指数并且对应于高级别发育不良。区域76、77指示了区域74、75中用于计算平均pa值的区域。
图8示出了h&e染色的乳腺肿瘤组织(图8a)和相应的组织学指数(pa)图(图8b)的进一步比较图像。组织学指数图(图8b)提供了整个组织切片中化学组成的准确和定量的图并且显示出与使用更主观的染色技术的常规组织学分级的强相关性。图9示出了图示了使用染色法的常规乳腺癌分级(水平轴)与上文所述的组织学指数pa(垂直轴)之间的相关性的图表。
更一般来说,本申请的发明人已经发现,在确定pa时维持x的所选值的一致性时,阵列中值落入一定范围内的像素映射某些类型的组织。
因此,举例来说
d<pa<e可以映射上皮乳腺组织
e<pa<h可以映射组织学1级、2级或3级的癌性乳腺组织
h<pa<i可以映射纤维乳腺组织
参考图6,可以使用成像设备显示不同的区域,例如上皮组织、癌组织以及纤维组织(步骤60)。使用适当的输入装置,如鼠标或触摸屏,用户然后可以选择图像内所关注的区域(步骤61),该区域含有潜在或疑似癌组织,即包括其中e<pa<h的像素。这可以通过在可疑区域周围画线来界定。
一旦所关注的区域已经被界定,就从所关注的区域的轨迹中去除所关注的区域内在所述阵列中对应于非癌组织的所有点/像素(例如d>pa>e和h>pa>i)(步骤62)并且所述轨迹中的其余像素对应于疑似癌组织。
然后从数据集计算所述轨迹中对应于疑似癌组织的像素的平均(average)(例如平均(mean))像素值c(步骤63)。
本申请的发明人已经确定了统计显著性结果,所述结果表明位于e与h之间的组织学指数值可以与不同的组织学级别相关,例如
e<c<f-对应于组织学1级
f<c<g-对应于组织学2级
g<c<h-对应于组织学3级
并且这三个组织学级别在为临床医生提供诊断价值方面可能是有用的。可以为图像中的一个或多个所关注的区域分配一个或多个组织学级别(步骤63)。
e、f、g以及h的值取决于x的所选值、设备1中所用的波长滤光器的特定特性(可能因制造商而异)以及被选用于d和i的值。方法的一致性是所期望的。c的量度然后可以在不同的样品间是绝对的。
所关注的区域的c的值因此可能对于向临床医生提供诊断价值是有用的。c(或组织学指数pa的起始值)还可以经由卡普兰-迈耶曲线(kaplanmaierplot)提供有关预期患者寿命的指示以提供预后价值。在卡普兰-迈耶曲线中,可以确定各自属于不同患者的一组c值的中值。
可以构建c值的另外的范围,所述范围可以预测活检样品的er状态、her2状态以及pgr状态。这将消除对高成本的化学染色方案的需要。
上文参考图3至图6所述的功能可以在合适的处理器设备中执行,如图1中的处理器12,它可以与图1的红外吸收设备联接或形成图1的红外吸收设备的一部分。处理器12可以是红外吸收设备1的整体部分或可以是适当编程的通用计算装置。
所述设备可以包括电子病理诊断工具以将癌症活检进行分级并且对患者在他们的癌症复发可能性方面进行评分。所述设备可以用作苏木精伊红(h&e)染色的补充。组织学指数pa可以用作评估肿瘤的恶性程度级别的度量生物标志物。上文所述的磷酸酯部分与酰胺部分的红外吸收值的比率指示活检的化学组成并且指示所述分子的对应浓度,从而给出恶性程度的量度。所述浓度的校准组合可以用于产生如上文所述的假色计算机图像,所述图像再现了组织形态并且提供了整个组织切片中的化学组成的准确和定量的图。所述设备能够在扫描组织样品的数分钟内产生这样的图像和分析。所述设备可以用于分析浸润性乳腺肿瘤和原位乳腺肿瘤这两者。
在导出组织学指数pa中选择磷酸酯部分和酰胺部分,这是因为它们可以复制由病理学家使用的n:c(核:细胞质)比率,其中磷酸酯代表核并且酰胺代表细胞质。
可以使用用于红外吸收测量的样品的任何合适的制备物。可以使用来自目标部位(例如左侧乳腺或右侧乳腺)的广泛局部切除(wle)或细针穿刺(fna)提取的活检。样品通常含有浸润性导管癌、小叶癌、或管状癌、或替代地高级别、低级别或中级别dcis(原位导管癌)。可以将组织块处理到ffpe(福尔马林固定石蜡包埋)阶段。优选的是,如果需要比较样品以用于染色以及用于红外分析的单独样品,那么将来自每一个患者的同一组织块的两个相邻切片显微切片到5微米厚度,同时确保这两个切片均含有实际的肿瘤。可以将一个切片固定到标准显微镜载片(带盖片)上并且以常规的方式使用苏木精和伊红染色处理并且用dpx将盖片封片。优选地将相邻的切片固定到因它的光学特性而被选择的定制特殊基材上以确保红外吸收测量的最佳性能。将该切片在二甲苯中洗涤以去除石蜡,然后经过一系列乙醇浴以洗去二甲苯。不将盖片封片并且不使用化学染色剂。在整个过程中,应当维持化学纯度,避免在载片中的任何一个上有任何指纹。不在未染色的切片上使用dpx,并且所有设备都没有灰尘和污垢。所述染色的切片可以用于比较或进一步分析。在使用红外吸收技术作为校准的筛查工具的情况下,可能不需要提供单独的切片进行染色。
切片厚度可以根据偏好而变化。其它示例性厚度可以包括2微米-3微米、以及6微米-7微米,所有这些厚度均已经被证实在本文所述的红外技术的情况下是成功的。
其它实施方案有意落入所附权利要求书的范围内。
- 还没有人留言评论。精彩留言会获得点赞!