一种聚集态磷光铜纳米簇的制备方法及其应用与流程
本发明涉及一种聚集态磷光铜纳米簇的制备方法及其应用,属于纳米技术领域。
背景技术:
近年来,基于出色的尺寸效应和光学特性,铜纳米簇被广泛应用于催化剂,生物成像以及生化分析等领域。qing等人在生物传感器和生物电子学(biosensorsandbioelectronics)上报道了一种原位反应生成荧光铜纳米簇的工作。首先在溶液中加入抗坏血酸钠和寡核苷酸分别作为反应的还原剂和保护剂,接着硫酸铜cuso4加入导致荧光铜纳米簇的形成。此方法需要加入具有选择性的碱基链,合成成本相对较高且合成的铜簇稳定性不是很好,这可能是由于作为保护剂的dna容易水解的原因。wang等人在纳米尺度(nanoscale)上发表了一篇有关蓝色荧光的铜纳米簇的制备与应用的文章。首先配置了乙烯吡咯烷酮(pvp)溶液,将抗坏血酸(aa)和硫酸铜(cuso4)混合加入pvp溶液中,搅拌室温放置6天进行反应,通过加入谷胱甘肽进行表面修饰处理,生成了稳定的荧光铜纳米簇。这样的方法反应时间长,需要复杂的表面修饰加工,不能简单快速的制备铜纳米簇。zheng等人在传感器和制动器b:化学(sensorsandactuatorsb:chemical)报道了一种一步合成绿色反应的铜纳米簇的制备方法。在水溶液中加入抗坏血酸(aa)和硝酸铜,充分搅拌后,室温遮光放置3小时,制备成荧光铜纳米簇。此方法对遮光条件要求严格,有待改进。
综上所述,采用绿色快速的一步合成法制备稳定的铜纳米簇,对相关领域的铜纳米簇研究应用具有重大意义。
技术实现要素:
本发明解决的技术问题是:提出一种集还原剂和保护剂于一体快速获得具有磷光特性的聚集态铜纳米簇的制备方法及其应用。
为了解决上述技术问题,本发明提出的技术方案是:一种聚集态磷光铜纳米簇的制备方法,包括如下步骤:室温下,取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf:水体积比为4:1~8,配置0.025~0.2m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为1~8mm,再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为300~2000μm,将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成铜纳米簇。
为了解决上述技术问题,本发明提出的另一技术方案是:所述的聚集态磷光铜纳米簇的应用,在形成的铜纳米簇中加入的生物样品溶液,铜纳米簇和生物样品间发生荧光共振能量转移现象,增强铜纳米簇的磷光特性,在铜离子检测和生物成像效果得到增强,所述生物样品溶液为牛血清蛋白bsa、牛血清fbs、细胞培养基或人体尿液。
有益效果:
本发明为一种聚集态磷光铜纳米簇的制备和应用,室温下,通过调整溶剂的混合比例和铜离子浓度,快速制备稳定的具有磷光特性的铜纳米簇。
附图说明
下面结合附图对本发明的作进一步说明。
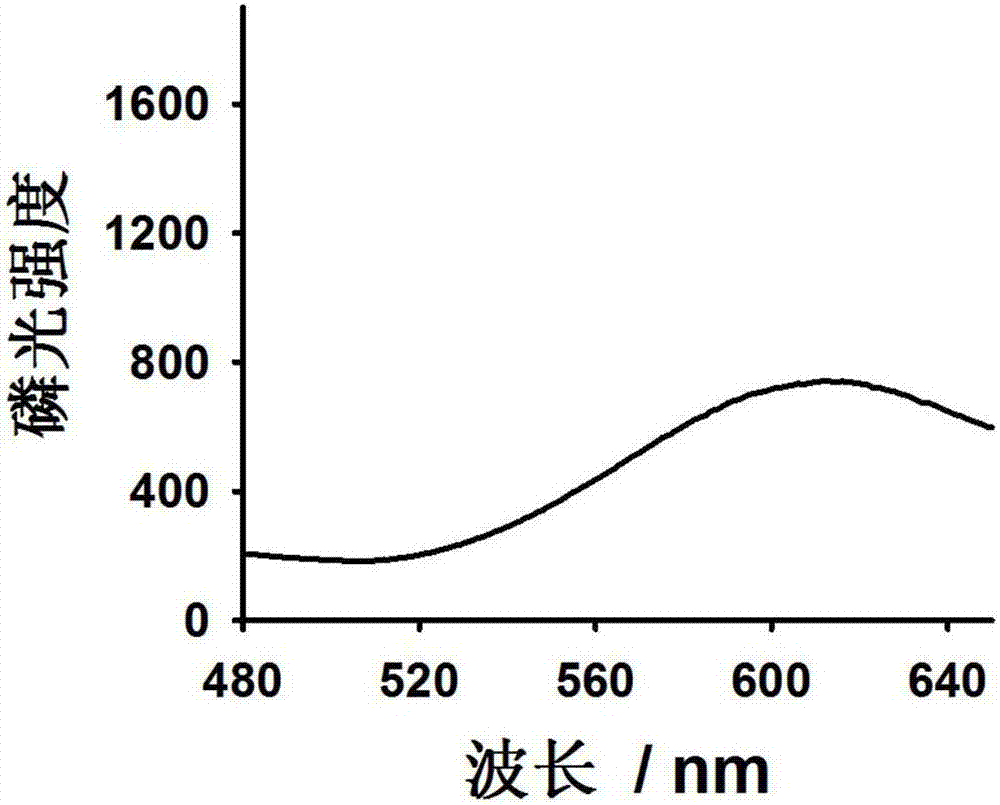
图1为实施例1中制得的铜纳米簇的磷光强度发射光谱图;
图2为实施例2中制得的铜纳米簇的磷光强度发射光谱图;
图3为实施例3中制得的铜纳米簇的磷光强度发射光谱图;
图4为实施例4中制得的铜纳米簇的磷光强度发射光谱图;
图5为实施例5中制得的铜纳米簇的磷光强度发射光谱图;
图6为实施例6中制得的铜纳米簇的磷光强度发射光谱图;
图7为实施例7中制得的铜纳米簇的磷光强度发射光谱图;
图8为实施例8中制得的铜纳米簇的磷光强度发射光谱图;
图9为实施例9中制得的铜纳米簇的磷光强度发射光谱图;
图10为实施例10中制得的铜纳米簇的磷光强度发射光谱图;
图11为实施例11中制得的铜纳米簇的磷光强度发射光谱图;
图12为实施例12中制得的铜纳米簇的磷光强度发射光谱图;
图13为实施例13中形成铜纳米簇前后的玻璃瓶放在日光和紫外灯下照射所拍摄实物照片;
图14为实施例13中制得的铜纳米簇的紫外吸收强度光谱图;
图15为实施例13中制得的铜纳米簇的光致发光寿命光谱图;
图16为实施例13中制得的铜纳米簇的光致发光寿命拟合曲线谱图;
图17为实施例14中加入牛血清蛋白前的铜纳米簇的磷光强度发射光谱图;
图18为实施例14中牛血清蛋白的荧光强度发射光谱图;
图19为实施例14中加入牛血清蛋白之后的铜纳米簇的磷光强度发射光谱图;
图20为实施例15中加入牛血清前的铜纳米簇的磷光强度发射光谱图;
图21为实施例15中牛血清的荧光强度发射光谱图;
图22为实施例15中加入牛血清之后的铜纳米簇的磷光强度发射光谱图;
图23为实施例16中加入细胞培养基前的铜纳米簇的磷光强度发射光谱图;
图24为实施例16中细胞培养基的荧光强度发射光谱图;
图25为实施例16中加入细胞培养基之后的铜纳米簇的磷光强度发射光谱图;
图26为实施例17中加入人体尿液前的铜纳米簇的磷光强度发射光谱图;
图27为实施例17中人体尿液的荧光强度发射光谱图;
图28为实施例17中加入人体尿液之后的铜纳米簇的磷光强度发射光谱图;
具体实施方式
以下结合附图对本发明的实施例作详细说明:本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和过程,但本发明的保护范围不限于下述实施例。
实施例1:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为2:1。配置0.025m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为1mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为1000μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。制备的铜纳米簇通过荧光分光光度计测量绘制荧光曲线,如图1。
实施例2:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为2:1。配置0.05m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为2mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为1000μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。制备的铜纳米簇通过荧光分光光度计测量绘制荧光曲线,如图2。
实施例3:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为2:1。配置0.1m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为4mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为1000μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。制备的铜纳米簇通过荧光分光光度计测量绘制荧光曲线,如图3。
实施例4:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为2:1。配置0.2m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为8mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为1000μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。制备的铜纳米簇通过荧光分光光度计测量绘制荧光曲线,如图4。
实施例5:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为1:2。配置0.2m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为8mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为1000μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。制备的铜纳米簇通过荧光分光光度计测量绘制荧光曲线,如图5。
实施例6:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为1:1。配置0.2m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为8mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为1000μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。制备的铜纳米簇通过荧光分光光度计测量绘制荧光曲线,如图6。
实施例7:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为2:1。配置0.2m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为8mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为1000μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。制备的铜纳米簇通过荧光分光光度计测量绘制荧光曲线,如图7。
实施例8:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为4:1。配置0.2m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为8mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为1000μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。制备的铜纳米簇通过荧光分光光度计测量绘制荧光曲线,如图8。
实施例9:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为2:1。配置0.2m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为8mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为300μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。制备的铜纳米簇通过荧光分光光度计测量绘制荧光曲线,如图9。
实施例10:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为2:1。配置0.2m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为8mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为500μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。制备的铜纳米簇通过荧光分光光度计测量绘制荧光曲线,如图10。
实施例11:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为2:1。配置0.2m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为8mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为800μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。制备的铜纳米簇通过荧光分光光度计测量绘制荧光曲线,如图11。
实施例12:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为2:1。配置0.2m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为8mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为1000μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。制备的铜纳米簇通过荧光分光光度计测量绘制荧光曲线,如图12。
实施例13:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为2:1。配置0.2m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为8mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为1000μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。混合溶剂和形成的铜纳米簇被放置在日光和紫外灯下照射,拍摄实物照片。将铜纳米簇经过紫外分光光度计测得数据绘制吸收图谱,并通过寿命检测绘出铜纳米簇的磷光寿命和拟合曲线。两段拟合寿命中18.8%为4.06微秒,81.20%为13.15微秒。如图13,14,15,16。
实施例14:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为2:1。配置0.2m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为8mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为500μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。在上述铜纳米簇中加入200μl牛血清蛋白bsa溶液,再次轻轻摇晃至溶液均匀混合。将含有牛血清蛋白溶液的铜纳米簇通过荧光分光光度计测量荧光曲线并记录绘图,与牛血清蛋白溶液荧光强度谱图以及未含有牛血清蛋白溶液的铜纳米簇磷光强度谱图进行比较。加入牛血清蛋白后,铜纳米簇的磷光强度大大增强,牛血清蛋白自身荧光强度减弱。如图17,18,19。
实施例15:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为2:1。配置0.2m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为8mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为600μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。在上述铜纳米簇中加入200μl牛血清fbs溶液,再次轻轻摇晃至溶液均匀混合。将含有牛血清溶液的铜纳米簇通过荧光分光光度计测量荧光曲线并记录绘图,与牛血清溶液样品荧光强度谱图以及未含有牛血清溶液的铜纳米簇磷光强度谱图进行比较。加入牛血清后,铜纳米簇的磷光强度大大增强,牛血清自身荧光强度减弱。如图20,21,22。
实施例16:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为2:1。配置0.2m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为8mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为800μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。在上述铜纳米簇中加入200μl细胞培养基溶液,再次轻轻摇晃至溶液均匀混合。将含有细胞培养基溶液的铜纳米簇通过荧光分光光度计测量荧光曲线并记录绘图,与细胞培养基溶液样品荧光强度谱图以及未含有细胞培养基溶液的铜纳米簇磷光强度谱图进行比较。加入细胞培养基后,铜纳米簇的磷光强度大大增强,细胞培养基自身荧光强度减弱。如图23,24,25。
实施例17:取dmf和去离子水配置5ml混合溶液于20ml玻璃瓶中,dmf/h2o体积比例为2:1。配置0.2m谷胱甘肽溶液,取200μl谷胱甘肽溶液加至上述混合溶液中,轻轻摇晃至均匀,混合溶液中gsh浓度为8mm。再配置1m硫酸铜溶液,取5μl硫酸铜溶液加入玻璃瓶,使混合溶液中铜离子浓度为2000μm。将玻璃瓶放入20℃振荡箱,慢速搅拌震荡1分钟,形成磷光铜纳米簇。在上述铜纳米簇中加入200μl人体尿液,再次轻轻摇晃至溶液均匀混合。将含有人体尿液的铜纳米簇通过荧光分光光度计测量荧光曲线并记录绘图,与人体尿液样品荧光强度谱图以及未含有人体尿液的铜纳米簇磷光强度谱图进行比较。加入人体尿液后,铜纳米簇的磷光强度大大增强,人体尿液自身荧光强度减弱。如图26,27,28。
本发明的不局限于上述实施例所述的具体技术方案,凡采用等同替换形成的技术方案均为本发明要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!