一种用于检测血吸虫的纳米抗体组合物、免疫传感器及其制备方法和应用与流程
本发明涉及生物医学或生物技术检测
技术领域:
,特别是涉及一种用于检测血吸虫的纳米抗体组合物、免疫传感器及其制备方法和应用。
背景技术:
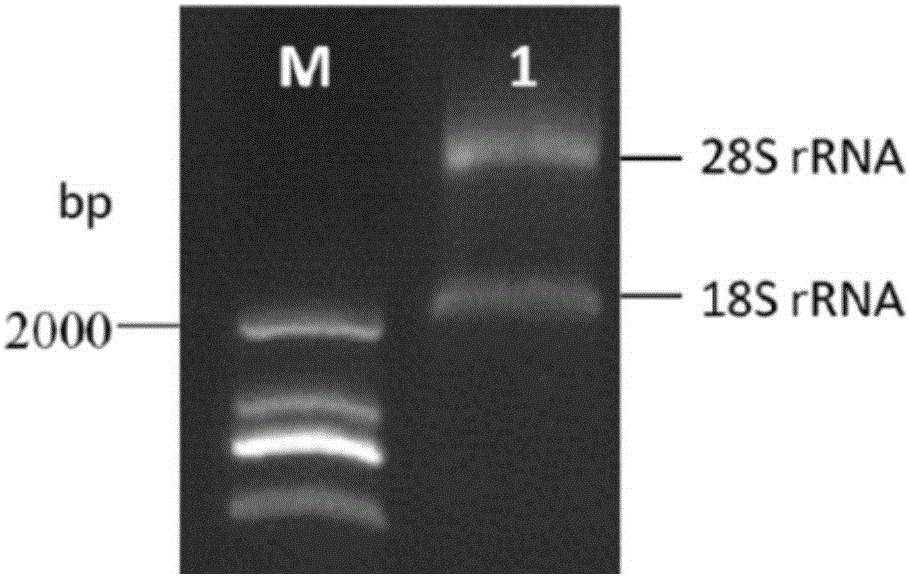
:血吸虫病是一种严重危害人体健康的人畜共患寄生虫病,血吸虫病防治工作仍然是一个重要的任务。血吸虫循环抗原(Circulatingantigen,CAg)可作为现症感染与疗效考核的的重要指标,常规免疫学方法较难检测出体液中含量较低的CAg,尤其对于低感染度或血吸虫病轻度流行区的人群。因此,建立一种灵敏、特异的CAg检测技术,对于血吸虫病的防治具有重要意义。生物传感器借助固化的生物识别分子和换能器将生化信号转化为电信号达到直接检测的目的,相较于传统方法其准确度和灵敏度高,测定过程简单,便于推广普及。随着纳米材料的加入,传感器在在检测诊断方面的灵敏度和特异性有了进一步的提升,并已成功检测到细菌、病毒、寄生虫、蛋白质。近年来,抗体技术已被广泛地应用于疾病的诊治领域,新型基因工程抗体不断出现,抗体小型化是抗体基因工程的主要研究方向之一。最新的单域抗体(Singledomainantibody,SdAb)是指保留了较好的抗原结合能力和专一性的VH小分子抗体片段,结构简单,容易进行体外规模化合成表达。SdAb体积较小,具有较强的组织穿透能力,利于它们进入致密的组织以及穿透血脑屏障。这使它容易接近靶目标表面的沟、缝或被隐藏的抗原表位,识别许多传统抗体无法识别的抗原。然而,SdAb暴露了表面疏水基团,非特异性吸附增加,易凝结和黏附,须经结构改造后才能使用。骆驼体内存在一种天然轻链缺失的功能性重链抗体(Heavychainantibodies,HCAb),克隆该重链抗体的可变区得到最小的抗原结合片段,即纳米抗体(Nanobody,Nb)。纳米抗体的最大优势在于它的体积小。其分子量只有15kDa,不足传统抗体(160KDa)的十分之一,也远小于单域抗体(55KDa)。Nb较普通抗体还具有高度水溶性和构象稳定性,较强的抗原亲合力和优良的组织穿透能力,容易体外表达和人源化改造修饰等优点,Nb的以上特性使其在诊断检测领域展现出广阔的应用前景。石墨烯是一种新型的碳纳米材料,具有较大的比表面积和高效的电子传导能力,其独特的二维层状结构又赋予石墨烯大量的电活性分布位点,可以负载大量的生物大分子物质对自身进行修饰且不改变自身活性具有良好的生物相容性,同时石墨烯具有直接感知和放大界面物质变化的能力,这些特性都有利于生物物质的识别和信号的转化。因此,石墨烯也成为生物传感器的理想材料。本研究建立了一种基于新型纳米材料石墨烯与Nb的微纳免疫传感器,并初步应用于日本血吸虫病患者血清中CAg的检测。技术实现要素:本发明针对现有技术的不足,提供了一种用于检测血吸虫的纳米抗体组合物,利用该组合物制备的免疫传感器用于检测血吸虫具有灵敏度高、特异性好。一种用于检测血吸虫的纳米抗体组合物,包括两种纳米抗体,其氨基酸序列分别如SEQIDNO.1和SEQIDNO.2所示。所述的纳米抗体组合物,编码所述两种纳米抗体的核苷酸序列分别如SEQIDNO.3和SEQIDNO.4所示。所述两种纳米抗体的比例为:按摩尔比计1∶0.5~2。本发明又提供了所述的纳米抗体组合物在制备血吸虫检测试剂盒中的应用。本发明还提供了一种用于检测血吸虫的免疫传感器,包含所述的纳米抗体组合物。本发明还提供了所述的免疫传感器在非疾病诊断为目的的血吸虫检测中的应用。本发明还提供了所述免疫传感器的制备方法,包括以下步骤:(1)以还原后的氧化石墨烯薄膜作为工作电极,在电极反应区域沉积一层金纳米颗粒获得金纳米颗粒修饰的氧化石墨烯电极;(2)将所述纳米抗体组合物通过金氨健结合到金纳米颗粒修饰的氧化石墨烯电极上获得所述免疫传感器。所述的制备方法,金纳米颗粒通过电化学沉积法沉积到工作电极反应区域,电镀液使用1%的HAuCl4溶液,电镀电压为-0.66V,反应时间100s。所述的制备方法,纳米抗体组合物结合后,使用BSA进行封闭。纳米抗体结合后,仍会存在没有结合抗体的裸露的金纳米颗粒,需要使用其他蛋白进行封闭。当然,除了使用BSA,也可以使用其他蛋白进行封闭,比如奶粉也是常用的封闭液。本发明用于检测血吸虫的纳米抗体组合物为由日本血吸虫的可溶性虫卵抗原免疫骆驼所得,纳米抗体亲水性好、分子量小,使用本发明纳米抗体组合物制备的免疫传感器用于检测血吸虫时,灵敏度高,灵敏度可以达到0.01ng/mL,远远高于常规的ELISA方法;特异性好,在不同物种的虫体之间不易发生误测。附图说明图1为免疫后骆驼血样提取的总RNA的胶检测结果图,其中M为DNAMarkerDL2000泳道1为总RNA。图2为巢式PCR产物胶检测结果图,其中,M为DNAMarkerDL2000。图3为初始文库的菌落PCR鉴定结果图,其中,M为DNAMarkerDL2000,泳道1-18为随机挑取的18个单菌落PCR产物,PC为阳性对照。图4为间接噬菌体ELISA鉴定结果图,其中1-48为随机挑取的噬菌体克隆,PC为阳性对照,NC为阴性对照。图5为纯化所得Nb重组表达的检测结果图,其中,图A为SDS-PAGE检测结果图,图B为WesternBlot结果的DAB显色图。图6为石墨烯薄膜的原子力显微镜表征图。图7为石墨烯薄膜的扫描电子显微镜表征图,其中图A为横截面结构,图B为表面形貌图8为镀金后的石墨烯薄膜电极表面的扫描电子显微镜表征图。图9为氧化石墨烯薄膜和石墨烯薄膜的拉曼光谱图。图10为实施例6中阻抗测试图,其中,a:石墨烯裸电极;b:金纳米颗粒修饰后的电极;c:纳米抗体固定后的电极;d:BSA封闭后的电极;e:SEA结合后的电极。图11为实施例2制备的免疫传感器特异性检测结果图,其中,图A为纳米抗体修饰电极检测不同寄生虫抗原的阻抗图;图B为纳米抗体修饰电极检测不同寄生虫抗原的阻抗变化值柱状图,*代表显著性差异;图C为抗血清修饰电极检测不同寄生虫抗原的阻抗图;图D为抗血清修饰电极检测不同寄生虫抗原的的阻抗变化值柱状图。图12为实施例2制备的免疫传感器灵敏度检测时不同SEA浓度下的检测曲线图,其中,曲线a~h浓度分别为10-8mg/mL、10-7mg/mL、10-6mg/mL、10-5mg/mL、10-4mg/mL、10-3mg/mL、10-2mg/mL、10-1mg/mL。图13为实施例2制备的免疫传感器灵敏度检测时电子转移电阻与SEA浓度的线性曲线图。具体实施方式主要试剂:0.1%氯金酸溶液、石墨(光谱纯)购自中国制药化学试剂有限公司;HI溶液、95%乙醇购自生工生物上海有限公司;氧化石墨烯溶液由氧化石墨(Hummers法制备)通过JY92-II超声波细胞粉碎机(购自宁波新芝生物科技股份有限公司)降解制备;0.45μm硝酸纤维素膜购自Bio-Rad公司;Ag/Agcl参比电极、对电极、电化学反应池购自上海辰华仪器有限公司;1%BSA;PBS溶液(pH=7.4,含0.01%吐温20);含有0.1MKCl的5.0mMK3Fe(CN)6/K4Fe(CN)6(1∶1)混合溶液;双蒸水;其他化学试剂均为分析纯。主要仪器:真空泵(GM-0.33A,天津津腾);1000mL真空抽滤瓶(sartorius,德国);电化学工作站(CHI660E,上海辰华);1260型阻抗分析仪(SolartronAnalytical,法恩伯勒,英国);1287型输力强电化学工作站(SolartronAnalytical,法恩伯勒,英国);Ultra-55型场发射扫描电子显微镜(Zeiss,德国);显微拉曼光谱仪(JobinYvonLabRamHRUV,法国)。样本来源:正常人血清与日本血吸虫粪检阳性的患者血清由浙江省血吸虫病防治中心提供。实施例1(1)骆驼免疫每次以600μg日本血吸虫可溶性虫卵抗原(solubleeggantigen,SEA)免疫骆驼,首次免疫为完全弗氏佐剂,加强免疫用不完全弗氏佐剂,共加强免疫3次,末次免疫2周后检测血清抗体的效价水平。各次免疫时间间隔为3周。(2)抗体效价检测效价检测:10μg/mL的SEA包板,4%脱脂奶粉封闭,抗血清稀释比为1∶51200时,测得OD490nm为0.188(P/N≧2),符合建库要求。(3)建库将符合建库标准的骆驼血样收集在50mL离心管中,加入等体积PBS后分装并提取RNA,由图1可知,泳道1中有两条非常清晰的条带,分别为28SrRNA和18SrRNA,表明提取的总RNA质量良好,没有发生显著的降解,可用于接下来纳米抗体文库的构建。以总RNA为模板,采用反转录PCR经两步反应合成cDNA。而后以此cDNA为模板,进行巢式PCR(NestPCR),扩增得到了约500bp的重链可变区基因VHH(图2)。采用限制性内切酶对NestPCR的扩增产物和噬菌粒载体pHEN4进行双酶切,将纯化后的酶切产物按优化后的VHH插入子片段与载体分子摩尔比3∶1进行连接、电转化,经平板计数测得所构建的文库菌落数达2.8×108个。从文库菌落计数的平板上随机挑取18个单菌落,进行菌落PCR鉴定VHH基因的插入率。菌落PCR结果如图3所示,阳性对照有明显条带,结果可信,实验组中15个单菌落扩增出了500-750bp的条带,阳性率83.3%,由此可知,初始文库实际的库容为2.3×108cfu。(4)抗体筛选以日本血吸虫SEA抗原作为靶标,结合Gly-HCl洗脱和标品竞争洗脱两种噬菌体洗脱方式,对纳米抗体噬菌体展示免疫文库进行三轮亲和淘选。由表1可知,在前两轮Gly-HCl洗脱淘选中,阳性噬菌体得到了有效的富集。而在第三轮竞争洗脱淘选中,噬菌体产出量较第一轮升高了两个数量级,表明特异性噬菌体得到了有效的富集,为随后的筛选特异性噬菌体提供了保障。表1淘选轮数SEA浓度(μg/mL)起始数量(cfu)淘选数量(cfu)富集度15002.80×10111.06×1062.64×1052503.11×10115.04×1076.17×1033202.84×10116.14×1084.63×102从第三轮淘选的洗脱物滴度测定平板上随机挑取48个噬菌体单克隆,采用间接噬菌体ELISA(phageELISA)对48个噬菌体克隆进行阳性筛选,结果如图4所示,48个噬菌体克隆均与检测抗原有很强的结合,初步表明48个噬菌体克隆阳性率达100%。提取27个特异性噬菌体克隆的DNA并送生物测序公司进行测序。对测序结果进行分析,纳米抗体在大肠杆菌等表达菌体内具有易可溶性表达、产量高等特点,本研究将阳性噬菌体克隆的DNA序列翻译为氨基酸,根据同源性差异以及噬菌体阳性强度两个指标,选取VHH2(核苷酸序列如SEQIDNO.3所示)和VHH48(核苷酸序列如SEQIDNO.4所示)基因亚克隆至原核表达载体pALTER(购自Addgene),载体上带有用于纯化的His标签,命名为pALTER-VHH2与pALTER-VHH48。(5)纳米抗体重组表达重组载体分别转化至大肠杆菌细胞E.coliBL21(DE3)pLysS,经0.3mM的IPTG,30℃诱导12h后,离心收集菌体并分离可溶性纳米抗体,经镍柱纯化后,获得大小约为17kDa的2种纳米抗体,将纯化后的表达产物进行SDS-PAGE与免疫印迹分析,免疫印迹结果使用DAB进行显色,结果如图5所示,得到约为15kD大小的纳米抗体。实施例2免疫传感器制备过程如下:氧化石墨烯薄膜(GO薄膜,GOP)是利用硝酸纤维素膜(直径47mm,孔径0.45μm)和GO溶液通过真空抽滤法抽滤而成,自然干燥后利用纯酒精从硝酸纤维素膜上剥离,GOP的厚度可通过控制一定浓度的GO溶液的体积而定。在室温条件下,利用HI溶液将获取的GOP还原6h,还原完成后,利用95%乙醇浸泡漂洗数次至不再有HI残留,自然晾干,成功制备还原后的氧化石墨烯薄膜(rGOP)。将rGOP剪裁出长宽尺寸规格为20mm×5mm的电极(可根据要求确定合适的大小),将所获电极固定到塑料底板上并确定电极的反应面积为5mm×5mm,使用绝缘胶带标记固定,获得氧化石墨烯电极(rGOPE)。随后将电极反应区域置于1%的HAuCl4溶液中利用电化学沉积法将金纳米颗粒沉积到电极反应区域表面从而获得金纳米颗粒修饰的氧化石墨烯电极(rGOPE/AuNPs),使用双蒸水冲洗并用氮气干燥,电镀时电压选为-0.66V,反应时间100s。之后将纳米抗体VHH2和VHH48等比例混合(摩尔比1∶1)的溶液6μL(抗体的浓度均为1mg/mL,效价均为1∶51200)滴定到电极反应区域,4℃条件下孵育过夜,过夜后使用1mMPBS溶液冲洗并使用氮气干燥。然后滴加1%BSA室温孵育30min,之后使用1mMPBS溶液冲洗并使用氮气干燥,以用来封闭金纳米颗粒表面没有结合抗体的位点,减少非特异性干扰。最后在电极表面滴加待测样本,室温孵育30min后并再次使用PBS溶液清洗并干燥。对孵育好的免疫电极进行电化学阻抗值的检测,通过阻抗值与样本浓度的线性关系,实现对待测样本定量检测目的。实施例3和4免疫传感器制备,纳米抗体VHH2和VHH48混合的比例如表2所示,纳米抗体浓度和效价以及其余步骤均同实施例2。表2VHH2∶VHH48(摩尔比)实施例31∶0.5实施例41∶2实施例5使用原子力显微镜、扫描电镜、拉曼光谱仪等仪器对实施例2中的石墨烯薄膜的内外部结构、氢碘酸还原前后的石墨烯薄膜以及镀金后的电极表面等进行了表征。原子力显微镜表征结果如图6所示,石墨烯片层厚度大约为1nm,说明氧化石墨完全剥离成单层石墨烯。图7A显示:所制备的石墨烯薄膜是由石墨烯单片层组装堆积而成,它内部的片层结构间的电子传递对石墨烯本身的导电性能关系密切。从图7B可以看出,有许多无规则的褶皱结构分布于石墨烯薄膜表面这种特殊结构有利于Nb高密度地固相结合在表面。石墨烯的弯曲特性是薄膜表面不规则褶皱形成的重要原因。镀金后的石墨烯薄膜电极表面可以看到大小不一的金颗粒沉积(图8),通过金原子和蛋白质氨基之间形成的金氨键实现日本血吸虫纳米抗体与石墨烯薄膜的固相结合。氢碘酸能够去除石墨烯薄膜内部的含氧基团使其导电性增加,随着石墨烯薄膜厚度增加,还原会变得不充分,进而影响其导电性能。对氢碘酸(HI)还原前、后的石墨烯薄膜进行拉曼分析得知(图9),氧化石墨烯薄膜的ID/IG的比值是1.34,HI还原后的氧化石墨烯ID/IG比值变为1.86,说明氢碘酸已经对氧化石墨烯进行了充分还原。实施例6使用电化学阻抗来表示实施例2中免疫传感器制备过程中电极表面阻抗的变化情况。一个完整的阻抗曲线由两部分构成,即一段半圆部分和一段直线部,它们分别代表着反应过程中电极表面电子的转移与扩散过程。其中,半圆的直径大小代表着电极表面的电子转移电阻的大小。实验测量选用传统的三电极测试系统,制备好的免疫传感器作为工作电极,辅助电极和参考电极分别连接铂丝电极和Ag/AgCl参比电极,反应缓冲液为含有5mMK3Fe(CN)6/K4Fe(CN)6(1∶1)和0.1mMKCl的混合溶液。测试仪器为1260型阻抗分析仪(SolartronAnalytical,法恩伯勒,英国)及1287型输力强电化学工作站(SolartronAnalytical,法恩伯勒,英国),测试分析软件为Zview和Zplot,测量频率范围和交流扰动电压分别设置为1Hz~100kHz和5mV。结果如图10所示,其中,曲线a~e分别为石墨烯裸电极(a),石墨烯/金纳米颗粒修饰的电极(b),抗体固定后电极(c),封闭非特异性位点后电极(d),与抗原结合后电极(e)的电极的阻抗测试曲线图谱。从图中可以看出,裸电极的阻抗图谱电子转移电阻比较大(曲线a),表明裸电极的电阻比较大,电子传递的速率比较慢;当把金颗粒电沉积到石墨烯电极之后(曲线b),半圆直径显著减小,表明修饰在电极上的Au颗粒具有良好的电子传递效应,使得电极的电子的传递阻抗显著减小;继续在电极上修饰抗体(曲线c)、通过牛血清蛋白来封闭非特异性位点(曲线d)、与特异性抗原结合进行检测后(曲线e),电极的阻抗图谱结果显示,免疫电极的阻抗随着对电极的逐步修饰而逐步增大,这是因为当把抗体、牛血清蛋白和抗原这类生物大分子物质修饰在电极表面后,电极表面的电子传递速率会逐步随之降低,电极传递电子的能力受到抑制之后,电子转移电阻就会增大。通过对免疫电极逐步的修饰反应,其各步反应中的组分物质成功逐层组装于电极表面,使电极的阻抗发生明显变化,这一结果表明免疫传感器的成功制备实施例7对实施例2中制备的免疫传感器的特异性进行检测。选取日本血吸虫(S.japonicum)抗原和其它六种虫体:弓形虫(T.gondii)、曼氏血吸虫(S.mansoni)、人棘颚口线虫(G.spinigerum)、简单异尖线虫(A.simplex)、华支睾吸虫(C.sinensis)、卫氏并殖吸虫(P.westermani)的抗原作为检测对象,待测抗原的浓度均为0.1mg/mL。具体的检测过程,与实施例6中方法相同。结果如图11所示,由图11A和图11B可以看出,孵育日本血吸虫纳米抗体的免疫传感器结合抗原后,结合日本血吸虫SEA的免疫电极阻抗增幅高达646.88Ω,远高于空白对照值和非特异性抗原的变化值。同时以普通的日本血吸虫抗血清(制备方法:在注射前从耳缘静脉取血约3ml用于制备阴性对照血清。将2ml用弗氏完全佐剂乳化的抗原溶液,约含500μg日本血吸虫可溶性虫卵抗原,通过皮下结合肌肉多点注射的方法注入发育良好的纯种新西兰大白兔体内。基础免疫后14天进行加强免疫。注射间隔周期为14天,加强注射所用的抗原溶液用弗氏不完全佐剂进行乳化,加强免疫3次,从兔耳中央静脉采血并分离血清,采用间接ELISA方法测定抗血清效价高达1∶16000。)代替本发明纳米抗体,以与实施例2相同的方法制备普通的血吸虫抗血清修饰的免疫传感器作为对照。检测结果如图11C和图11D所示,虽然阻抗增值的检测结果高于空白对照值,但是对血吸虫SEA和其它六种非靶性抗原的测量结果没有显著差别,阻抗谱的变化没有明显的区分度,且华支睾吸虫和卫氏并殖吸虫这两者的测量增幅高于日本血吸虫。由以上结果表明:本发明纳米抗体在与特异性抗原的结合能力上要远远高于普通的血清抗体,基于纳米抗体和石墨烯复合材料的免疫传感器具有良好的特异性。实施例8对实施例2中制备的免疫传感器的灵敏度进行检测。使用该传感器对不同浓度日本血吸虫SEA(10-8~10-1mg/mL)进行检测。具体的检测过程,与实施例6中方法相同。结果如图12和图13所示,在最低的血吸虫抗原浓度10-8mg/mL(曲线a)测试中,纳米抗体的检测增幅达到了87.092Ω;在最高浓度的10-1mg/mL(曲线h)检测结果中,纳米抗体修饰的免疫传感器的测试增值则为139.93Ω,表明随着测试抗原浓度的依次增加,免疫传感器的阻抗值也依次增加,在不同抗原稀释度中阻抗值与空白对照具有明显的区分度(图12)。并且在该检测浓度范围内,免疫传感器具有较好的线性关系,相关系数为0.9868(图13)。2002年,毛亚飞等(毛亚飞,张悟澄&潘劲草.磁珠-ELISA检测日本血吸虫循环虫卵抗原的研究.中国寄生虫学与寄生虫病杂志20,372-373(2002).)报道MB-ELISA检测法对血吸虫SEA的最低检测浓度为2.9ng/mL,常规的夹心法ELISA对SEA的最低检测浓度是5.8ng/mL。而本发明免疫传感器检测出的最低浓度为0.01ng/mL。以上结果表明,该传感器具有较好的灵敏性。实施例9使用实施例2中制备的免疫传感器对粪检阳性及阴性人血清样品进行日本血吸虫循环抗原的检测。具体的检测过程,与实施例6中方法相同。结果如表3所示,本发明免疫传感器的检测结果和粪检结果一致。另外,在同一条件下,对样本进行了三次重复检测,具有较好的重现性。表3样本粪检结果免疫传感器结果1阳性阳性2阳性阳性3阳性阳性4阴性阴性5阴性阴性SEQUENCELISTING<110>浙江省医学科学院<120>一种用于检测血吸虫的纳米抗体组合物、免疫传感器及其制备方法和应用<130><160>4<170>PatentInversion3.3<210>1<211>124<212>PRT<213>双峰驼(Camelusbactrianus)<400>1HisValGlnLeuValGluSerGlyGlyGlySerValGlnAlaGlyGly151015SerLeuArgLeuSerCysAlaAlaSerGlyLeuThrAlaIleAsnLys202530ArgMetAlaTrpPheArgGlnAlaProGlyLysGluArgGluGlyVal354045AlaGlyThrTyrArgLeuThrGlyAspThrAlaTyrAlaHisSerVal505560LysGlyArgPheThrLeuSerGlnAspThrAlaLysThrThrLeuTyr65707580LeuGlnMetAsnSerLeuLysProGluAspThrAlaMetTyrTyrCys859095AlaAlaValTrpThrGlyGlyValTrpTyrAspAlaArgPheTyrLys100105110SerTrpGlyGlnGlyThrGlnValThrValSerSer115120<210>2<211>124<212>PRT<213>双峰驼(Camelusbactrianus)<400>2GlnValGlnLeuValGluSerGlyGlyGlySerValGlnAlaGlyGly151015SerLeuArgLeuSerCysAlaAlaSerGlyLeuThrAlaArgAsnLys202530ArgMetAlaTrpPheArgGlnAlaProGlyLysGluArgGluAlaVal354045AlaGlyIleTyrArgLeuThrGlyAspThrAlaTyrAlaAsnSerVal505560LysGlyArgPheThrLeuSerGlnAspThrAlaLysThrThrLeuTyr65707580LeuGlnMetAsnSerLeuLysProGluAspThrAlaSerTyrTyrCys859095AlaAlaValTrpThrGlyGlyValTrpTyrAspAlaArgMetTyrLys100105110SerTrpGlyGlnGlyThrLeuValThrValSerSer115120<210>3<211>372<212>DNA<213>双峰驼(Camelusbactrianus)<400>3catgtgcagctggtggagtctgggggaggctcggtgcaggctggagggtctctgagactc60tcctgtgcagcctctggacttaccgccattaacaagcgcatggcctggttccgccaggct120ccagggaaggagcgcgagggagtcgcaggtacttatcggcttactggtgacacagcctat180gcccactccgtgaagggccgattcaccctctcccaagataccgccaagactacgctatat240ctgcagatgaacagcctgaaacctgaggacactgccatgtactactgtgcggcagtctgg300actggcggtgtctggtatgatgcgcgtttctataagtcctggggccaggggacccaggtc360accgtctcctca372<210>4<211>372<212>DNA<213>双峰驼(Camelusbactrianus)<400>4caggtgcagctggtggagtctgggggaggctcggtgcaggctggagggtctctgagactc60tcctgtgcagcctctggacttaccgcccgtaacaagcgcatggcctggttccgccaggct120ccagggaaggagcgcgaggcagtcgcaggtatttatcggcttactggtgacacagcctat180gccaactccgtgaagggccgattcaccctctcccaagacaccgccaagactacgctatat240ctgcagatgaacagcctgaagcctgaggacactgcctcgtactactgtgcggcagtctgg300actggcggtgtttggtatgatgcgcgtatgtataagtcctggggccaggggaccctggtc360accgtctcctca372当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1