一种双亲性单层分子膜的荧光检测方法与流程
本发明属于荧光检测技术领域,具体涉及一种单层分子膜的荧光检测方法,特别是双亲性单层分子膜的荧光检测方法。
背景技术:
单分子层脂膜作为生物体膜的模型被广泛利用。生物膜的组分繁多,为便于研究,往往采用单一或几种脂质组成的各种人工脂膜结构,单分子层膜就是其中一种。同时,也可将蛋白质嵌入后组成重建膜,利用人工膜可对膜的各种物理化学特性进行深入研究。单分子脂膜的研究在生物医学研究和生物传感器的研制领域具有广泛的潜在应用前景。
目前,对于单分子层脂膜的检测,尤其是具有一定相分离结构的单层膜时,需要用100x的物镜,也就是用油镜来对其进行观测,由于云母片较薄,油镜上面的油接近样品表面时,会呈现出变形,并不能表现出平整的结构,不能聚焦在一个平面上,不能得到理想的图像,仅仅能看到很小的局部。通常采取的方式是采用超薄云母片利用紫外胶黏贴在盖玻片上,这样用来观察样品膜结构。但是制备的单层膜做完荧光观测后,由于油滴的残留致使其在进行原子力显微镜等仪器进一步观测时就造成了一定的影响,使样品表面受损,导致观测结构不准确,而且盖玻片也受损,不能重复使用。
技术实现要素:
针对现有技术的不足,本发明提供了一种简单易行、无毒无污染、观测结果清晰且对膜层无损的双亲性单层分子膜的荧光检测方法。
本发明所采用的技术方案是:
该种双亲性单层分子膜的荧光检测方法,其是由以下步骤组成:
(1)用常规制膜方法制备单一组分或者混合组分的双亲性单层分子膜;
(2)在1~55mn/m的膜压下使用垂直提膜法以15~25mm/min的速度将单分子层转移到新解离的超薄云母基片上,成膜温度控制在21±0.5℃;
(3)在洗干净的盖玻片上滴水,将步骤(2)制备好的混合单层膜,吸附在盖玻片上,按照常规荧光检测操作对单层分子膜进行检测。
进一步限定,上述双亲性单层分子膜是具有荧光标记的固醇类分子或者磷脂类分子或者鞘磷脂类分子或者糖脂类分子或者其任意组合。
进一步限定,上述固醇类分子具体是胆固醇、谷固醇、麦角固醇、胆甾醇、豆固醇或者菜油固醇中的任意一种或任意组合;磷脂类分子是磷脂酰胆碱、磷脂酰乙醇胺、二磷脂酰甘油、磷脂酰丝氨酸或磷脂酰甘油中的任意一种或者其任意组合;鞘磷脂类分子是神经酰胺、鞘磷脂或神经氨酸中任意一种或者其任意组合;糖脂类分子是神经节苷脂、单(二)半乳糖基甘油二酯、脑苷脂、硫脑苷脂、葡萄糖苷神经酰胺、乳糖苷神经酰胺中任意一种或者其任意组合。
进一步限定,上述步骤(1)制备双亲性单层分子膜的方法由以下步骤实现:
将原料溶解在氯仿与甲醇混合的有机溶剂中形成浓度为0.01mmol/l的脂溶液;用微量进样器将脂溶液滴加到纯水表面,令其自动铺展;待铺展的液体表面有机溶剂完全挥发后,以1~20mm/min的速度压膜,得到双亲性单层分子膜。
进一步限定,上述氯仿与甲醇混合有机溶剂中氯仿与甲醇的体积比为3:1~10:1。
进一步限定,上述双亲性单层分子膜的厚度为2~5nm。
进一步限定,上述步骤(2)的垂直提膜法以20mm/min的速度将单分子层转移到新解离的超薄云母基片上。
进一步限定,上述新解离的超薄云母基片的厚度是0.01mm。
进一步限定,上述盖玻片的厚度为0.15~0.17mm。
进一步限定,上述步骤(3)所述的荧光检测操作中所用荧光的激发波长为405~660nm。
本发明的双亲性单层分子膜的荧光检测方法是将转移至超薄云母片上的单层膜吸附在表面含水的盖玻片上,巧妙利用了水的表面张力和其透明性,来无损检测超薄云母片上的分子膜,避免对膜层造成损,保证膜层完整无损,利于进一步如原子力显微镜观测等操作,保证检测结果准确,此外,本发明用荧光显微镜检测完毕后可通过镊子将云母片很容易的从盖玻片上分离,清洗后盖玻片仍可以重复使用,节约检测成本,而且本发明的检测方法检测,结果清晰,成本较低,无毒无污染,适于大范围推广应用。
附图说明
图1为bsm/popc/chol(2:2:1)混合单层膜的荧光显微镜观测结果。
图2为bsm/popc/chol(2:2:1)混合单层膜的原子力显微镜观测结果。
图3为bsm/popc(1:1)混合单层膜的荧光显微镜观测结果。
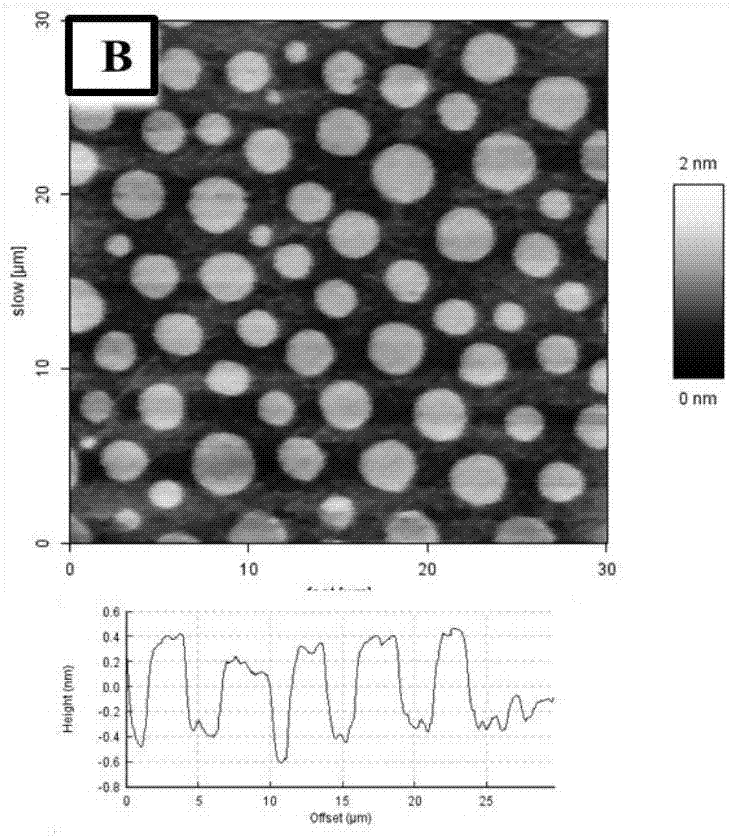
图4为bsm/popc(1:1)混合单层膜的原子力显微镜观测结果。
具体实施方式
下面结合实验和实施例对本发明作进一步的描述。
实施例1
s1:用常规制膜方法制备双亲性单层分子膜;
本实施例利用lb技术制备大脑鞘磷脂/1棕榈酸-2油酸-磷脂酰胆碱/胆固醇(下述简称:bsm/popc/chol)混合单层膜。
将bsm/popc/chol(2:2:1,mol:mol:mol)溶解在氯仿与甲醇(10:1,v:v)中形成浓度为0.01mmol/l的混合脂溶液,在ksv-minitrough仪器中(芬兰ksv公司,槽子:323mm×75mm)进行制备,用微量进样器将50ul的混合脂溶液滴加到纯水表面,让其自动铺展,30min后,等液体表面有机溶剂完全挥发后,以10mm/min的速度压膜,得到厚度为3nm的bsm/popc/chol混合单层分子膜。
s2:在固定的膜压(1mn/m~55mn/m)下使用垂直提膜法以15~25mm/min的速度将单分子层转移到新解离的厚度为0.01mm的超薄云母基片上,成膜温度控制在21±0.5℃;
s3:在洗干净的厚度为0.15~0.17mm的盖玻片上滴一滴水,将步骤(2)制备好的混合单层膜吸附在盖玻片上,用荧光显微镜按照常规荧光检测操作对单层分子膜进行检测。
荧光显微镜(奥林巴斯:ix71)物镜为100x油镜,实验中系统放大倍率为1000倍,采用绿光激发tr-dhpe,激发波长为560~600nm,使用高分辨ccd拍照,观测结果如图1所示;在荧光观测之后进一步用原子力显微镜(岛津公司:wet-spm-9500-j3)扫描采用动态模式,所采用的是标准扫描头,探针材料为si3n4,悬臂的弹性常数为0.06n/m,调节压电陶瓷管电压使针尖对样品以最小作用力进行扫描,图片像素点收集为512×512,扫描速度为1hz,结果如图2所示。
结合图1和图2可知,本实施例在固定的表面压力下bsm/popc/chol(2:2:1)单层膜分子间的相互作用和单层膜的结构表明,在固定的表面压力下,单层膜呈现出明显的相分离现象,当胆固醇加入到bsm/popc混合脂质单层膜中影响了bsm/popc分子间的相互作用,使bsm微区具有了一定的流动性,微区结构从能量较高的“花形”逐渐转化为能量较低的“圆形”。
实施例2
s1:用常规制膜方法制备双亲性单层分子膜;
将大脑鞘磷脂和1棕榈酸-2油酸-磷脂酰胆碱(下述简称:bsm/popc)按照摩尔比为1:1的比例混合后溶解在氯仿与甲醇(3:1,v:v)中形成浓度为0.5mmol/l的混合脂溶液,在ksv-minitrough仪器中(芬兰ksv公司,槽子:323mm×75mm)进行制备,用微量进样器将20ul的混合脂溶液滴加到纯水表面,让其自动铺展,15min后,等液体表面有机溶剂完全挥发后,以10mm/min的速度压膜,得到厚度为3nm的bsm/popc混合单层分子膜。
s2:在固定的膜压(1mn/m~55mn/m)下使用垂直提膜法以15~25mm/min的速度将单分子层转移到新解离的超薄云母基片上,成膜温度控制在21±0.5℃;
s3:在洗干净的盖玻片上滴一滴水,将步骤(2)制备好的混合单层膜吸附在盖玻片上,按照常规荧光检测操作对单层分子膜进行检测。
荧光显微镜(奥林巴斯:ix71)物镜为100x油镜,实验中系统放大倍率为1000倍,采用绿光激发tr-dhpe,激发波长为560~600nm,使用高分辨ccd拍照,观测结果如图3所示;在荧光观测之后进一步用原子力显微镜(岛津公司:wet-spm-9500-j3)扫描采用动态模式,所采用的是标准扫描头,探针材料为si3n4,悬臂的弹性常数为0.06n/m,调节压电陶瓷管电压使针尖对样品以最小作用力进行扫描,图片像素点收集为512×512,扫描速度为1hz,结果如图4所示。
结合图3和图4可知,在固定的表面压力下bsm/popc(1:1)单层膜分子间的相互作用和单层膜的结构表明,在固定的表面压力下,单层膜呈现出明显的相分离现象,液态的popc(图3亮区域)与形成明显“花形”微区结构的凝胶相bsm(图4暗区域)共存状态,微区结构呈现能量较高的“花形”。
实施例3
s1:用常规制膜方法制备双亲性单层分子膜;
将固醇类分子溶解在氯仿与甲醇(10:1,v:v)中形成浓度为0.01mmol/l的脂溶液,在ksv-minitrough仪器中(芬兰ksv公司,槽子:323mm×75mm)进行制备,用微量进样器将50ul的脂溶液滴加到纯水表面,让其自动铺展,30min后,等液体表面有机溶剂完全挥发后,以20mm/min的速度压膜,得到固醇类单层分子膜。
s2:在固定的膜压(1mn/m~55mn/m)下使用垂直提膜法以15~25mm/min的速度将单分子层转移到新解离的厚度为0.01mm的超薄云母基片上,成膜温度控制在21±0.5℃;
s3:在洗干净的厚度为0.15~0.17mm的盖玻片上滴一滴水,将步骤(2)制备好的混合单层膜吸附在盖玻片上,用荧光显微镜按照常规荧光检测操作对单层分子膜进行检测,荧光的激发波长可依据固醇类分子的荧光标记特性在405~660nm范围内调整。
本实施例的固醇类分子是具有荧光标记的胆固醇、谷固醇、麦角固醇、胆甾醇、豆固醇或者菜油固醇中的任意一种或其任意组合,均可适用。
实施例4
s1:用常规制膜方法制备双亲性单层分子膜;
将固醇类分子与鞘磷脂类分子按照摩尔比为1:2的比例混合后溶解在氯仿与甲醇(10:1,v:v)中形成浓度为0.01mmol/l的脂溶液,在ksv-minitrough仪器中(芬兰ksv公司,槽子:323mm×75mm)进行制备,用微量进样器将50ul的脂溶液滴加到纯水表面,让其自动铺展,30min后,等液体表面有机溶剂完全挥发后,以20mm/min的速度压膜,得到固醇类单层分子膜。
s2:在固定的膜压(1mn/m~55mn/m)下使用垂直提膜法以15~25mm/min的速度将单分子层转移到新解离的厚度为0.01mm的超薄云母基片上,成膜温度控制在21±0.5℃;
s3:在洗干净的厚度为0.15~0.17mm的盖玻片上滴一滴水,将步骤(2)制备好的混合单层膜吸附在盖玻片上,用荧光显微镜按照常规荧光检测操作对单层分子膜进行检测,荧光的激发波长可依据固醇类分子的荧光标记特性在405~660nm范围内调整。
本实施例的固醇类分子是具有荧光标记的胆固醇、谷固醇、麦角固醇、胆甾醇、豆固醇或者菜油固醇中的任意一种或其任意组合,鞘磷脂类分子是神经酰胺、鞘磷脂或神经氨酸中任意一种或者其任意组合,均可适用。
此外需要进一步说明的是固醇类分子与鞘磷脂类分子可按照任意需要的比例混合。
实施例5
s1:用常规制膜方法制备双亲性单层分子膜;
将磷脂类分子与鞘磷脂类分子按照摩尔比为2:1的比例混合后溶解在氯仿与甲醇(10:1,v:v)中形成浓度为0.01mmol/l的脂溶液,在ksv-minitrough仪器中(芬兰ksv公司,槽子:323mm×75mm)进行制备,用微量进样器将50ul的脂溶液滴加到纯水表面,让其自动铺展,30min后,等液体表面有机溶剂完全挥发后,以20mm/min的速度压膜,得到固醇类单层分子膜。
s2:在固定的膜压(1mn/m~55mn/m)下使用垂直提膜法以15~25mm/min的速度将单分子层转移到新解离的厚度为0.01mm的超薄云母基片上,成膜温度控制在21±0.5℃;
s3:在洗干净的厚度为0.15~0.17mm的盖玻片上加一滴水,将步骤(2)制备好的混合单层膜吸附在盖玻片上,用荧光显微镜按照常规荧光检测操作对单层分子膜进行检测,荧光的激发波长可依据固醇类分子的荧光标记特性在405~660nm范围内调整。
本实施例的磷脂类分子是磷脂酰胆碱、磷脂酰乙醇胺、二磷脂酰甘油、磷脂酰丝氨酸或磷脂酰甘油中的任意一种或者其任意组合,鞘磷脂类分子是神经酰胺、鞘磷脂或神经氨酸中任意一种或者其任意组合,均可适用。
此外需要进一步说明的是磷脂类分子与鞘磷脂类分子可按照任意需要的比例混合。
实施例6
s1:用常规制膜方法制备双亲性单层分子膜;
将磷脂类分子与鞘磷脂类分子、固醇类分子、糖脂类分子按照摩尔比为1:1:1:0.5的比例混合后溶解在氯仿与甲醇(10:1,v:v)中形成浓度为0.01mmol/l的脂溶液,在ksv-minitrough仪器中(芬兰ksv公司,槽子:323mm×75mm)进行制备,用微量进样器将50ul的脂溶液滴加到纯水表面,让其自动铺展,30min后,等液体表面有机溶剂完全挥发后,以20mm/min的速度压膜,得到固醇类单层分子膜。
s2:在固定的膜压(1mn/m~55mn/m)下使用垂直提膜法以15~25mm/min的速度将单分子层转移到新解离的厚度为0.01mm的超薄云母基片上,成膜温度控制在21±0.5℃;
s3:在洗干净的厚度为0.15~0.17mm的盖玻片上滴一滴水,将步骤(2)制备好的混合单层膜吸附在盖玻片上,用荧光显微镜按照常规荧光检测操作对单层分子膜进行检测,荧光的激发波长可依据固醇类分子的荧光标记特性在405~660nm范围内调整。
本实施例的磷脂类分子是磷脂酰胆碱、磷脂酰乙醇胺、二磷脂酰甘油、磷脂酰丝氨酸或磷脂酰甘油中的任意一种或者其任意组合,鞘磷脂类分子是神经酰胺、鞘磷脂或神经氨酸中任意一种或者其任意组合,固醇类分子具体是胆固醇、谷固醇、麦角固醇、胆甾醇、豆固醇或者菜油固醇中的任意一种或任意组合;糖脂类分子是神经节苷脂、单(二)半乳糖基甘油二酯、脑苷脂、硫脑苷脂、葡萄糖苷神经酰胺、乳糖苷神经酰胺中任意一种或者其任意组合均可适用。
此外需要进一步说明的是磷脂类分子与鞘磷脂类分子、固醇类分子、糖脂类分子可按照任意需要的比例混合,所制得双亲性单层分子膜均可在本发明的检测方法中呈现较好的状态,检测所得图像清晰。
- 还没有人留言评论。精彩留言会获得点赞!