基于两性离子聚甲基丙烯基半胱氨酸修饰的表面等离子共振仪芯片的制备方法与流程
本发明涉及表面等离子共振谱仪抗污染芯片制备领域,特别是涉及一种基于两性离子聚甲基丙烯基半胱氨酸修饰的表面等离子共振仪芯片的制备方法。
背景技术:
表面等离子共振(surfaceplasmonresonance,简称spr)仪是20世纪80年代出现的一种生物传感器技术,当入射光从高折射率介质入射到低折射率介质时,会发生全反射,此时若在介质交界面处镀一层金属薄膜(金或银),入射光产生的渐逝波会引起金属表面自由电子发生集体振荡,进而形成等离子体,当渐逝波与表面等离子体振荡的频率和波数相等时,即产生共振现象(spr),导致能量从渐逝波转移到表面等离子波中,使反射光的强度大大减弱,呈现衰减全反射现象,当反射光的强度为零时的入射角称为共振角。共振角与金属薄膜界面介质折射率有关,而折射率又随结合在金属薄膜表面的分子质量而变化,故可通过分析共振角来获得分子间相互作用的信息,由于其具有检测快速且无需标记等特点,已被广泛应用于蛋白质组学、药物研发、临床诊断、食品安全和环境监测等领域,并且显示出广阔的应用前景。
spr芯片是表面等离子共振仪最为核心的组件,提供产生spr信号的必须物理条件,主要包括耦合器件、金属膜和表面基质。然而,应用表面等离子共振仪进行分析测试时,传感芯片的表面污染是一个普遍存在的问题,来自样品中的生物分子或微生物的非特异性吸附将降低定量检测的准确性,产生假阳性结果。因此,开发有效抵抗非特异性吸附的表面是提高表面等离子共振传感器灵敏度和精确度的首要问题。
技术实现要素:
针对现有技术中存在的不足,本发明提供一种基于两性离子聚甲基丙烯基半胱氨酸修饰的表面等离子共振仪芯片的制备方法。
本发明是通过以下技术方案实现的:
一种基于两性离子聚甲基丙烯基半胱氨酸的表面等离子共振仪芯片的制备方法,包括以下步骤:
a)裸金芯片制备
采用电子束蒸发镀膜技术在基底上涂覆一层2-3nm厚的铬层,在该铬层上涂覆一层45-50nm厚的金膜,得到裸金芯片;
b)裸金芯片预处理
将步骤a)获得的裸金芯片浸入食人鱼洗液中,常温下浸泡1-3h,取出用去离子水清洗3次后用氮气吹干;
c)两性离子甲基丙烯基半胱氨酸单体的合成
将24.98mmol半胱氨酸用20ml去离子水溶解后,向其中加入27.47mmol2-丙烯酸-2-羟基-1,3-丙二酯以及29.4μmol二甲苯基磷,于20-30℃下搅拌反应2-4h,反应后的溶液用乙酸乙酯萃取一次,二氯甲烷萃取两次,冻干后得到白色粉末状的两性离子甲基丙烯基半胱氨酸单体;
d)裸金芯片表面多巴胺聚合
用ph=8.5的三羟甲基氨基甲烷缓冲液配制1-3mg/ml多巴胺溶液,将b)步骤得到的裸金芯片浸入其中,于40-60℃下孵育1-2h,取出用去离子水清洗3次后用氮气吹干;
e)聚多巴胺芯片表面溴代异丁酰溴引发剂修饰
将d)步骤得到的芯片的基底浸入20ml含有1.0ml三乙胺的二氯甲烷中,在冰浴且搅拌条件下逐滴加入10ml含有0.9ml溴代异丁酰溴的二氯甲烷,室温下搅拌反应12-24h,取出用乙醇和去离子水依次清洗3次后用氮气吹干;
f)裸金芯片表面聚甲基丙烯基半胱氨酸合成
将e)步骤得到的芯片放入预先三次循环脱气并充氮气的施伦克瓶中;将c)步骤得到的5mmol单体溶解于4ml去离子水中,用氮气脱气10-30min,向其中加入0.5mmol联吡啶、0.167mmol溴化亚铜和0.083mmol溴化铜,用氮气脱气10-30min后用超声处理5-10min,将得到的溶液移入施伦克瓶,使得溶液将瓶中的芯片浸没,于氮气条件下反应2-4h后取出芯片,用乙醇和去离子水依次清洗3次后用氮气吹干。
而且,上述的基底为玻璃片基底或光纤基底。
而且,上述的金膜还可为银膜或银/金符合膜。
而且,上述的食人鱼洗液为98wt.%浓硫酸与30wt.%双氧水的混合溶液,浓硫酸与双氧水的体积比为7:3。
本发明的优点及有益效果是:
1)本发明制备的基于两性离子聚甲基丙烯基半胱氨酸修饰的表面等离子共振仪芯片具有很好的抗污染性能;
2)本发明制备的基于两性离子聚甲基丙烯基半胱氨酸修饰的表面等离子共振仪芯片具有生物功能化作用,如可通过固载羊免疫球蛋白抗体进而检测其抗原;
3)本发明制备的基于两性离子聚甲基丙烯基半胱氨酸修饰的表面等离子共振仪芯片具有高的稳定性,在干燥状态下储存1个月或在ph为7.4的磷酸盐缓冲液中储存7天后,抗污染性能无变化;
4)本发明基于两性离子聚甲基丙烯基半胱氨酸修饰的表面等离子共振仪芯片的制备方法具有一定的普适性,不受基底材料性质的限制。
附图说明
图1为本发明基于两性离子聚甲基丙烯基半胱氨酸修饰的表面等离子共振仪芯片的结构示意图;
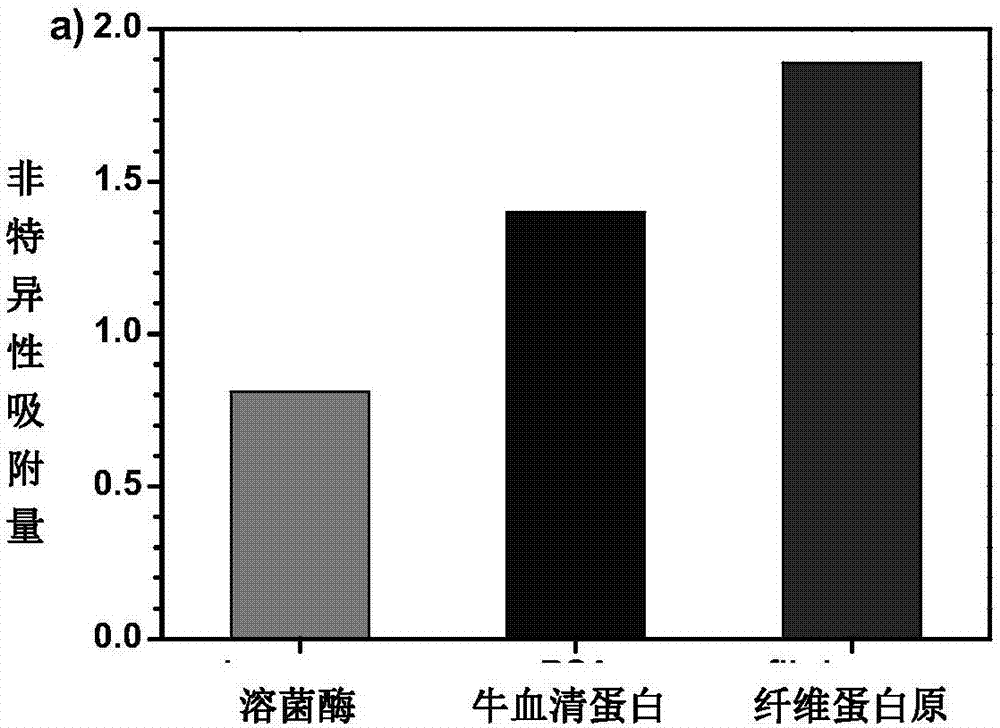
图2a为本发明基于两性离子聚甲基丙烯基半胱氨酸修饰的表面等离子共振仪芯片对单一蛋白体系(1mg/ml的溶菌酶(lysozyme)、牛血清蛋白(bsa)、纤维蛋白原(fibrinogen))中蛋白的非特异性吸附量;
图2b为本发明基于两性离子聚甲基丙烯基半胱氨酸修饰的表面等离子共振仪芯片对复杂体系(100%人血清(bloodserum)、豆浆(soybeanmilk)、牛奶(cowmilk))中蛋白的非特异性吸附量;
其中:
1、玻璃片基底;2、铬层;3、金膜层;4、聚多巴胺耦合引发剂层;5、两性离子聚甲基丙烯基半胱氨酸层。
具体实施方式
本发明通过以下实施例进一步详述。需要说明的是:下述实施例是说明性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。
实施例1
采用电子束蒸发镀膜技术在bk7玻璃基底上涂覆一层2nm厚的铬层,在该铬层上涂覆一层48nm厚的金膜,得到裸金芯片;将上述裸金芯片浸入98%浓硫酸与30%双氧水的混合溶液中,98%浓硫酸与30%双氧水的体积比为7:3,于常温下浸泡2h。然后取出用去离子水清洗3次后用氮气吹干备用。
将24.98mmol半胱氨酸用20ml去离子水溶解后,向其中加入27.47mmol2-丙烯酸-2-羟基-1,3-丙二酯以及29.4μmol二甲苯基磷,于20℃下搅拌反应4h,反应后的溶液用乙酸乙酯萃取一次,二氯甲烷萃取两次,冻干后得到白色粉末状的两性离子甲基丙烯基半胱氨酸单体;
用ph=8.5的三羟甲基氨基甲烷缓冲液配制2mg/ml多巴胺溶液,将上述吹干备用的裸金芯片浸入其中,于40℃下孵育2h,取出用去离子水清洗3次后用氮气吹干;将修饰有聚多巴胺的基底浸入包含有1.0ml三乙胺的20ml二氯甲烷中,在冰浴且搅拌条件下逐滴加入10ml包含有0.9ml溴代异丁酰溴的二氯甲烷,然后在室温下搅拌条件反应24h,取出用乙醇和去离子水依次清洗3次后用氮气吹干,将得到的芯片放入预先三次循环脱气充氮气的施伦克瓶中,取上述冻干后得到的白色粉末状两性离子甲基丙烯基半胱氨酸单体5mmol溶解于4ml去离子水中,用氮气脱气15min,向其中加入0.5mmol联吡啶、0.167mmol溴化亚铜和0.083mmol溴化铜,再用氮气脱气10min,后用超声处理5min,将得到的将溶液移入施伦克瓶中并将芯片浸没,于氮气条件下反应2h后取出芯片,依次用乙醇和去离子水各清洗3次,用氮气吹干备用。
将上述获得的两性离子甲基丙烯基半胱氨酸修饰的表面等离子共振芯片用柏油贴合到表面等离子共振系统的棱镜上,以ph为7.4的磷酸缓冲液为流动相,选择流速为10μl/min。待基线平稳后,往定量环中分别注入100μl1mg/ml的蛋白溶液:牛血清白蛋白、溶菌酶、纤维蛋白原、100%血清、豆浆上清液和牛奶上清液,经流动相推动上述各蛋白溶液到达芯片表面,由表面等离子共振系统测定共振角实时变化曲线,20min后读取表面等离子共振角变化值,并计算非特异性吸附量,分别为1.40ng/cm2、0.81ng/cm2、1.89ng/cm2、12.81ng/cm2、6.08ng/cm2、7.15ng/cm2,其蛋白吸附量远低于裸金表面各蛋白的非特异性吸附量。
实施例2
采用电子束蒸发镀膜技术在bk7玻璃基底上涂覆一层3nm厚的铬层,在该铬层上涂覆一层47nm厚的金膜,得到裸金芯片;将上述裸金芯片浸入98%浓硫酸与30%双氧水的混合溶液中,98%浓硫酸与30%双氧水的体积比为7:3,于常温下浸泡1h。然后取出用去离子水清洗3次后用氮气吹干备用。
将24.98mmol半胱氨酸用20ml去离子水溶解后,向其中加入27.47mmol2-丙烯酸-2-羟基-1,3-丙二酯以及29.4μmol二甲苯基磷,于30℃下搅拌反应2h,反应后的溶液用乙酸乙酯萃取一次,二氯甲烷萃取两次,冻干后得到白色粉末状的两性离子甲基丙烯基半胱氨酸单体;
用ph=8.5的三羟甲基氨基甲烷缓冲液配制3mg/ml多巴胺溶液,将上述吹干备用的裸金芯片浸入其中,于60℃下孵育1h,取出用去离子水清洗3次后用氮气吹干;将修饰有聚多巴胺的基底浸入包含有1.0ml三乙胺的20ml二氯甲烷中,在冰浴且搅拌条件下逐滴加入10ml包含有0.9ml溴代异丁酰溴的二氯甲烷,然后在室温下搅拌条件反应18h,取出用乙醇和去离子水依次清洗3次后用氮气吹干,将得到的芯片放入预先三次循环脱气充氮气的施伦克瓶中,取上述冻干后得到的白色粉末状两性离子甲基丙烯基半胱氨酸单体5mmol溶解于4ml去离子水中,用氮气脱气20min,向其中加入0.5mmol联吡啶、0.167mmol溴化亚铜和0.083mmol溴化铜,再用氮气脱气20min,后用超声处理10min,将得到的溶液移入施伦克瓶中并将芯片浸没,于氮气条件下反应3h后取出芯片,依次用乙醇和去离子水各清洗3次,用氮气吹干备用。
将上述获得的两性离子甲基丙烯基半胱氨酸修饰的表面等离子共振芯片用柏油贴合到表面等离子共振系统的棱镜上,以ph为7.4的磷酸缓冲液为流动相,选择流速为10μl/min。待基线平稳后,往定量环中分别注入100μl1mg/ml的蛋白溶液:牛血清白蛋白、溶菌酶、纤维蛋白原、100%血清、豆浆上清液和牛奶上清液,经流动相推动上述各蛋白溶液到达芯片表面,由表面等离子共振系统测定共振角实时变化曲线,20min后读取表面等离子共振角变化值,并计算非特异性吸附量,分别为1.95ng/cm2、1.02ng/cm2、2.20ng/cm2、14.25ng/cm2、6.95ng/cm2、9.05ng/cm2,其蛋白吸附量远低于裸金表面各蛋白的非特异性吸附量。
实施例3
采用电子束蒸发镀膜技术在bk7玻璃基底上涂覆一层2nm厚的铬层,在该铬层上涂覆一层48nm厚的金膜,得到裸金芯片;将上述裸金芯片浸入98%浓硫酸与30%双氧水(体积比7:3)的混合溶液中,98%浓硫酸与30%双氧水的体积比为7:3,于常温下浸泡2h。然后取出用去离子水清洗3次后用氮气吹干备用。
将24.98mmol半胱氨酸用20ml去离子水溶解后,向其中加入27.47mmol2-丙烯酸-2-羟基-1,3-丙二酯以及29.4μmol二甲苯基磷,于20℃下搅拌反应4h,反应后的溶液用乙酸乙酯萃取一次,二氯甲烷萃取两次,冻干后得到白色粉末状的两性离子甲基丙烯基半胱氨酸单体;
用ph=8.5的三羟甲基氨基甲烷缓冲液配制2mg/ml多巴胺溶液,将上述吹干备用的裸金芯片浸入其中,于40℃下孵育2h,取出用去离子水清洗3次后用氮气吹干;将修饰有聚多巴胺的基底浸入包含有1.0ml三乙胺的20ml二氯甲烷中,在冰浴且搅拌条件下逐滴加入10ml包含有0.9ml溴代异丁酰溴的二氯甲烷,然后在室温下搅拌条件反应24h,取出用乙醇和去离子水依次清洗3次后用氮气吹干,将得到的芯片放入预先三次循环脱气充氮气的施伦克瓶中,取上述冻干后得到的白色粉末状两性离子甲基丙烯基半胱氨酸单体5mmol溶解于4ml去离子水中,用氮气脱气15min,向其中加入0.5mmol联吡啶、0.167mmol溴化亚铜和0.083mmol溴化铜,再用氮气脱气10min,后用超声处理5min,将得到的将溶液移入施伦克瓶中并将芯片浸没,于氮气条件下反应2h后取出芯片,依次用乙醇和去离子水各清洗3次,用氮气吹干备用。
将上述获得的两性离子甲基丙烯基半胱氨酸修饰的表面等离子共振芯片用柏油贴合到表面等离子共振系统的棱镜上,以ph为7.4的磷酸缓冲液为流动相,选择流速为10μl/min。待基线平稳后,往定量环中内注入100μl1-乙基-3-(3-二甲基氨基丙基)碳酰二亚胺(edc,浓度为0.4m)和n-羟基硫代琥珀酰亚胺(nhs,浓度为0.1m)的混合溶液,经流动相推动上述混合溶液到达芯片表面。15min后注入100μl羊免疫球蛋白(anti-igg,1mg/ml)溶液,经流动相推动羊免疫球蛋白溶液到达芯片表面,再经乙醇胺封闭,30min后获得固载羊免疫球蛋白的表面等离子共振传感芯片。
将上述获得的固载羊免疫球蛋白的表面等离子共振传感芯片用柏油贴合到表面等离子共振系统的棱镜上。以ph为7.4的磷酸缓冲液为流动相,选择流速为10μl/min。待基线平稳后,往定量环中分别注入100μl蛋白溶液:溶菌酶(1mg/ml)、豆浆(10mg/ml)、牛奶(30mg/ml)和100%血清,经流动相推动上述各蛋白溶液到达芯片表面,由表面等离子共振系统测定共振角实时变化曲线,20min后读取表面等离子共振角变化值,并计算非特异性吸附量,分别为1.21ng/cm2、6.88ng/cm2、8.35ng/cm2、14.51ng/cm2。
实施例4
采用电子束蒸发镀膜技术在bk7玻璃基底上涂覆一层2nm厚的铬层,在该铬层上涂覆一层48nm厚的金膜,得到裸金芯片;将上述裸金芯片浸入98%浓硫酸与30%双氧水(体积比7:3)的混合溶液中,98%浓硫酸与30%双氧水的体积比为7:3,于常温下浸泡2h。然后取出用去离子水清洗3次后用氮气吹干备用。
将24.98mmol半胱氨酸用20ml去离子水溶解后,向其中加入27.47mmol2-丙烯酸-2-羟基-1,3-丙二酯以及29.4μmol二甲苯基磷,于20℃下搅拌反应4h,反应后的溶液用乙酸乙酯萃取一次,二氯甲烷萃取两次,冻干后得到白色粉末状的两性离子甲基丙烯基半胱氨酸单体;
用ph=8.5的三羟甲基氨基甲烷缓冲液配制2mg/ml多巴胺溶液,将上述吹干备用的裸金芯片浸入其中,于40℃下孵育2h,取出用去离子水清洗3次后用氮气吹干;将修饰有聚多巴胺的基底浸入包含有1.0ml三乙胺的20ml二氯甲烷中,在冰浴且搅拌条件下逐滴加入10ml包含有0.9ml溴代异丁酰溴的二氯甲烷,然后在室温下搅拌条件反应24h,取出用乙醇和去离子水依次清洗3次后用氮气吹干,将得到的芯片放入预先三次循环脱气充氮气的施伦克瓶中,取上述冻干后得到的白色粉末状两性离子甲基丙烯基半胱氨酸单体5mmol溶解于4ml去离子水中,用氮气脱气15min,向其中加入0.5mmol联吡啶、0.167mmol溴化亚铜和0.083mmol溴化铜,再用氮气脱气10min,后用超声处理5min,将得到的溶液移入施伦克瓶中并将芯片浸没,于氮气条件下反应2h后取出芯片,依次用乙醇和去离子水各清洗3次,用氮气吹干备用。
将上述获得的两性离子甲基丙烯基半胱氨酸修饰的表面等离子共振芯片用柏油贴合到表面等离子共振系统的棱镜上。以ph为7.4的磷酸缓冲液为流动相,选择流速为10μl/min。待基线平稳后,往定量环中内注入100μl1-乙基-3-(3-二甲基氨基丙基)碳酰二亚胺(edc,浓度为0.4m)和n-羟基硫代琥珀酰亚胺(nhs,浓度为0.1m)的混合溶液,经流动相推动上述混合溶液到达芯片表面。15min后注入100μl羊免疫球蛋白(anti-igg,1mg/ml)溶液,经流动相推动羊免疫球蛋白溶液到达芯片表面,再经乙醇胺封闭,30min后即获得固载羊免疫球蛋白的表面等离子共振传感芯片,分别注入100μl不同浓度的蛋白溶液:溶菌酶(1mg/ml)、豆浆(10mg/ml)、羊免疫球蛋白(15nm)、羊免疫球蛋白(75nm)、羊免疫球蛋白(150nm)、羊免疫球蛋白(300nm)、羊免疫球蛋白(450nm)、羊免疫球蛋白(700nm)、羊免疫球蛋白(15nm)和溶菌酶(1mg/ml)的混合液以及羊免疫球蛋白(15nm)和豆浆(10mg/ml)的混合液,通过spr响应信号以获得羊免疫球蛋白(igg)检测的标准曲线。
本发明制备的基于两性离子聚甲基丙烯基半胱氨酸修饰的表面等离子共振仪芯片具有很好的抗污染性能;具有生物功能化作用,可通过固载羊免疫球蛋白抗体进而检测其抗原;具有高的稳定性,在干燥状态下储存1个月或在ph为7.4的磷酸盐缓冲液中储存7天后,抗污染性能无变化;并且制备方法具有一定的普适性,不受基底材料性质的限制。
以上对本发明做了示例性的描述,应该说明的是,在不脱离本发明的核心的情况下,任何简单的变形、修改或者其他本领域技术人员能够不花费创造性劳动的等同替换均落入本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 制备N‑异丙基(甲基)丙烯酰胺的方法与制造工艺
- 一种单片氧化石墨烯/聚乙二醇单甲醚甲基丙烯酰胺水相复合材料及其制备方法与制造工艺
- 羧甲基魔芋葡甘聚糖‑纳米聚多巴胺微球的制备方法与制造工艺
- 隔震式N,N‑二甲基‑1,3‑丙二胺加氢反应釜的制造方法与工艺
- 四甲基哌啶胺的生产装置的制造方法
- 一种防滑移的核壳型三防整理剂及其制备方法
- 一种含有胺鲜酯和1?甲基环丙烯的农药组合物的制作方法
- 一种基于聚(n-异丙基丙烯酰胺)热致构象可逆转变的抗菌剂活性调用开关的制作方法
- 以羧甲基马铃薯淀粉与丙烯酰胺为原料合成吸附Fe<sup>3+</sup>树脂的方法
- 以羧甲基马铃薯淀粉与丙烯酰胺为原料合成吸附Cr<sup>3+</sup>树脂的方法
- 以羧甲基马铃薯淀粉与丙烯酰胺为原料合成吸附Pb<sup>2+</sup>树脂的方法
- 以羧甲基马铃薯淀粉与丙烯酰胺为原料合成吸附Cu<sup>2+</sup>树脂的方法
- 以羧甲基马铃薯淀粉与丙烯酰胺为原料合成吸附Ag<sup>+</sup>树脂的方法
- 丙烯酰胺系聚合物、纸力增强剂和纸的制作方法
- 使用含丙烯酰胺的过滤器分离蛋白的制作方法
- 以羧甲基马铃薯淀粉与丙烯酰胺为原料合成吸附Co<sup>2+</sup>树脂的方法
- 以羧甲基马铃薯淀粉与丙烯酰胺为原料合成吸附Ni<sup>2+</sup>树脂的方法
- 一种保水型腐植酸控释肥料及其制备方法
- 一种使富含淀粉的热加工食品增色并降低丙烯酰胺含量的方法
- 一种制备2-丙烯酰胺基-2-甲基丙磺酸用反应器的制造方法