一种基于金纳米棒刻蚀构建比色传感器定量检测有机磷农药的方法与流程
本发明属于生物传感技术领域,涉及基于金纳米棒和比色阵列的有机磷农药检测方法,具体涉及一种基于金纳米棒刻蚀构建比色传感器定量检测有机磷农药的方法。
背景技术:
近年来,我国有机磷农药滥用引起的食品安全及环境问题越来越引起人们的重视。有机磷农药因其品种多、杀虫效率高、易分解、对植物药害小等优点,广泛应用于农作物病虫防治。然而大多数有机磷农药品种属于高毒性。它们经过呼吸、皮肤以及肠胃吸收等途径进入人体后,对体内胆碱酯酶的活性产生抑制作用,因其可与胆碱酯酶迅速结合,形成磷酰化胆碱酯酶,使胆碱酯酶失去催化水解乙酰胆碱的能力,致使大量的乙酰胆碱在体内蓄积,导致神经处于过度兴奋状态而出现中毒症状。长期大量使用会造成许多潜在危害,如污染环境、药害及人畜中毒等。因此快速、灵敏地检测有机磷农药残留对保护生态环境和人类健康有着重要的意义。
传统的有机磷农药检测的主要方法有质谱法、气相色谱法、高效液相法等,这些方法虽然分析精度高,定量准确,灵敏度好。但其样品的前处理复杂、所需仪器设备昂贵,检测周期相对较长,需要技术熟练的操作人员。所以具有一定的局限性,只适合在实验室进行,不适合现场快速检测。其中比色传感器由于具有肉眼可见、快速、便携等优点,成为目前的研究热点之一。相比于单一颜色的深浅,视觉对多种颜色的变化更加灵敏。比色传感器中颜色种类的增多,可以显著提高视觉判断的准确性,同时也更具有挑战性。因此开发一种简单、快速、准确、即可定量又能可视化检测有机磷农药的新方法对于有机磷农药残留的检测具有重要的意义。
近年来,纳米技术作为一种新兴的检测方法,正在受到人们的更多关注。其中,金纳米棒在紫外-可见-近红外(uv-vis-nir)波段具有独特的可调节表面等离子体共振(spr)光学特性,其良好的稳定性、低生物毒性、易于修饰使其在比色检测方面的研究在不断展开与深入。相比较于显色底物的单一颜色变化,金纳米棒随着其长径比的改变呈现多种颜色的变化,如棕黄色、灰色、青色、绿色、蓝色、紫色、红色、黄色等。利用此光学特性,结合生物分子的高灵敏度和特异性,使得金纳米棒在比色法传感器上具有广泛而重要的应用前景。但如何快速有效的将金纳米棒的光学特性应用于有机磷农药的检测则是一项重大技术突破。
技术实现要素:
本发明提供一种基于金纳米棒刻蚀构建比色传感器定量检测有机磷农药的方法,其能简单、快速、准确、即可定量又能可视化检测有机磷农药。
为实现上述技术目的,本发明采取的具体的技术方案为,一种基于金纳米棒刻蚀构建比色传感器定量检测有机磷农药的方法,采用双酶体系催化氯化乙酰胆碱产生过氧化氢,过氧化氢在催化条件作用下刻蚀金纳米棒,观察反应后的颜色;其中,双酶体系为同时含乙酰胆碱酯酶与胆碱氧化酶的体系。
作为本发明改进的技术方案,所述过氧化氢在催化条件作用下刻蚀金纳米棒为过氧化氢在含有fe2+的酸性溶液中刻蚀金纳米棒。
作为本发明改进的技术方案,fe2+的来源于硫酸亚铁,酸性溶液中氢离子来源于盐酸。
作为本发明改进的技术方案,所述双酶体系催化氯化乙酰胆碱产生过氧化氢的过程为:氯化乙酰胆碱在乙酰胆碱酯酶催化下生成中间产物胆碱,胆碱经胆碱氧化酶催化生成过氧化氢。
作为本发明改进的技术方案,所述金纳米棒是通过一锅法合成的。
作为本发明改进的技术方案,一锅法合成金纳米棒包括如下步骤:
步骤一、制备金纳米棒生长溶液,将氯金酸、硝酸银和对苯二酚依次加入到ctab中,晃动,并静置5min;其中,氯金酸、硝酸银、对苯二酚的加入量分别为:氯金酸、硝酸银和对苯二酚,其物质的量比为:3.42:1:1.18;
步骤二、加入硼氢化钠,静止12h;硼氢酸钠的物质量与硝酸银物质量的比为1:(6-7)1mmol/l、646μl;
步骤三、将步骤三所得溶液在15000×g下离心20min,离心两次后复溶在40ml超纯水中,棕色瓶中常温保存。
作为本发明改进的技术方案,氯金酸的浓度为10mmol/l,硝酸银的浓度为20mmol/l,对苯二酚的浓度为5.26mmol/l,硼氢化钠的浓度为1mmol/l。
作为本发明改进的技术方案,一锅法合成金纳米棒是在30℃下进行。
作为本发明改进的技术方案,具体包括步骤如下:取0~1μg/ml不同浓度同一种有机磷农药,将不同浓度的有机磷农药分别加入至乙酰胆碱酯酶,在37℃的温度下抑制15min;向乙酰胆碱酯酶中加入氯化乙酰胆碱与胆碱氧化酶,得到反应液,用缓冲溶液调节ph值,直至反应液中ph为7.0~7.4,将反应液37℃下温育30min后依次加入金纳米棒、盐酸、以及硫酸亚铁,在室温下温育0.5~1h,对反应现象进行记录,其中,氯化乙酰胆碱、乙酰胆碱酯酶、胆碱氧化酶、金纳米棒、盐酸以及硫酸亚铁加入的体积比为5:(0.5-10):(1-10):100:150:50;乙酰胆碱酯酶的浓度为100u/ml;氯化乙酰胆碱的浓度为100mmol/l;胆碱氧化酶的浓度为50u/ml;盐酸的浓度为2mol/l;硫酸亚铁的浓度为20mmol/l。
作为本发明改进的技术方案,所用缓冲溶液的ph为7.2~7.4,浓度为10mmol/l的pbs缓冲溶液;pbs缓冲溶液包含nacl和kcl;并且pbs缓冲溶液中nacl的初始浓度为136.89mmol/l,kcl的初始浓度为2.67mmol/l。
有益效果
(1)本发明利用有机磷农药对乙酰胆碱酯酶的抑制作用,阻碍金纳米棒的刻蚀,具体为:双酶体系(同时含乙酰胆碱酯酶与胆碱氧化酶的体系)催化底物氯化乙酰胆碱,产生过氧化氢,过氧化氢在酸性条件及fe2+催化下,刻蚀金纳米棒;有机磷农药会抑制乙酰胆碱酯酶活性,导致过氧化氢产量降低,金纳米棒刻蚀受阻;因而是否存在有机磷农药以及含有不同浓度的有机磷农药会导致刻蚀金纳米棒的反应溶液有不同的颜色变化,当含有有机磷农药时,随着有机磷农药浓度的上升,刻蚀金纳米棒的反应溶液颜色由棕黄色变为灰色、青色、绿色、蓝色、紫色、红色、黄色的变化过程减缓,种类变化丰富,因此可用比色法检测有机磷农药,并且实验结果用肉眼便可直接观测而无需任何大型仪器。
(2)本发明有效利用了纳米材料的特性,不需要借助精密仪器检测,简化了检测方法,极大地降低了有机磷农药检测成本,本发明具有成本低、快速、简便、敏感的优点。
综上,本发明中依据金纳米棒刻蚀后长径比的改变,光学性质发生明显变化,从而建立比色法检测有机磷农药,它具有原理简单、操作方便、实验周期短。
附图说明
图1本发明基于金纳米棒刻蚀构建比色传感器定量检测有机磷农药的方法的流程图;
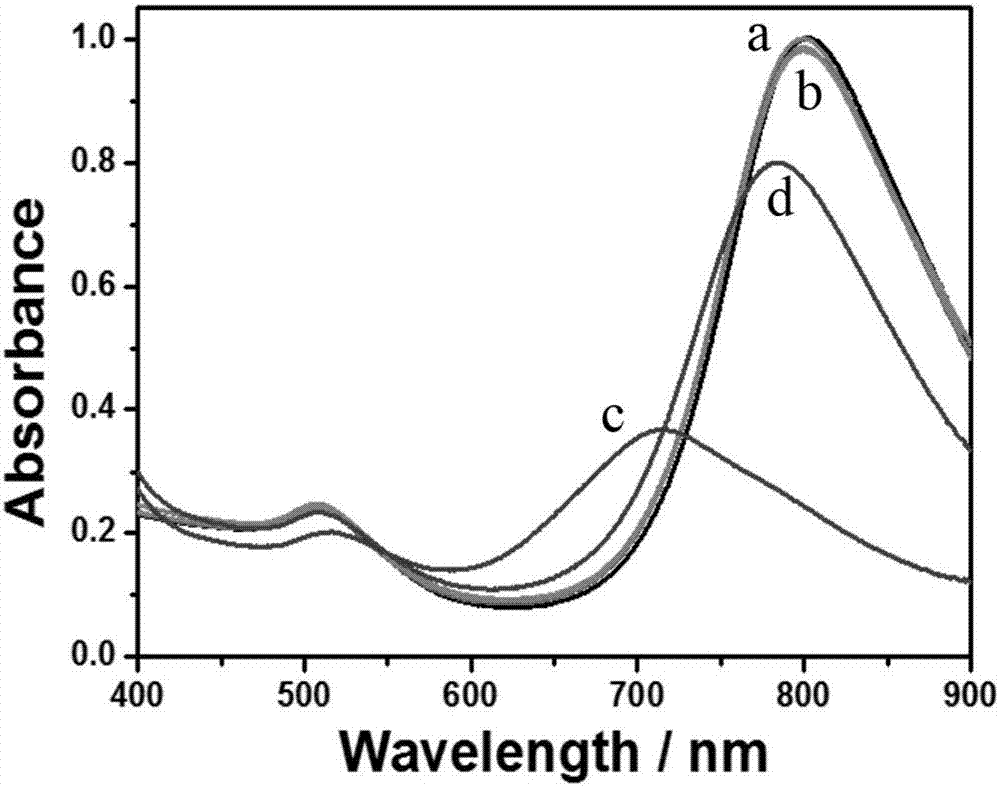
图2有机磷农药检测实验验证图;图中a线:金纳米棒的紫外吸收光谱;b线:不含乙酰胆碱酯酶时,金纳米棒在催化条件下的紫外吸收光谱;c线:双酶体系中,金纳米棒在催化条件下被刻蚀的紫外吸收光谱;d线:有机磷农药抑制乙酰胆碱酯酶时,金纳米棒刻蚀受阻的紫外吸收光谱;
图3a显示金纳米棒的电镜图,标尺为20纳米;
图4b显示双酶体系中,金纳米棒在催化条件下被刻蚀的电镜图,标尺为20纳米;
图5c显示了有机磷农药抑制乙酰胆碱酯酶时,金纳米棒刻蚀受阻的紫外吸收光谱;
图6在不同量的敌敌畏作用下得到的紫外光谱图(敌敌畏的浓度:(a)0μg/ml、(b)1μg/ml、(c)0.1μg/ml、(d)0.01μg/ml、(e)0.0075μg/ml、(f)0.0025μg/ml、(h)1×10-3μg/ml、(g)5×10-4μg/ml、(i)1×10-4μg/ml、(j)1×10-5μg/ml);
图7金纳米棒lspr峰波长变化量与敌敌畏浓度的拟合曲线(敌敌畏的浓度:1×10-5μg/ml、1×10-4μg/ml、5×10-4μg/ml、1×10-3μg/ml、0.0025μg/ml、0.0075μg/ml、0.01μg/ml、0.1μg/ml、1μg/ml。
具体实施方式
下面通过具体的实施例和附图对本发明进一步说明,应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干变型和改进,这些也应视为属于本发明的保护范围。
本实验中用到的试剂和仪器:
乙酰胆碱酯酶(ache),胆碱氧化酶(chox),氯化乙酰胆碱(ach),盐酸(hcl),硫酸亚铁(feso4),氯金酸(haucl4·3h2o),过氧化氢(h2o2),硝酸银(agno3),十六烷基三甲基溴化铵(ctab),对苯二酚(c6h4(oh)2),硼氢化钠(nabh4),敌敌畏,紫外分光光度计(shimadzuuv–2450,kyoto,japan),透射电镜(jem–2010,hitachi,japan),混合涡旋仪(ikagerman),离心机(eppendorfgerman)。
如图1所示,图1中pesticide是指有机磷农药,betaine是指甜菜碱(但在后续检测中均未用到甜菜碱),choline是指胆碱,ach是指氯化乙酰胆碱,一种基于金纳米棒刻蚀构建比色传感器定量检测有机磷农药的方法,包括如下步骤:
步骤一、一锅法合成金纳米棒;
步骤二、向待检测物中加入氯化乙酰胆碱,引发双酶体系催化氯化乙酰胆碱产生过氧化氢,过氧化氢在酸性及fe2+条件下催化刻蚀金纳米棒,如果待检测物里含有有机磷,有机磷将抑制乙酰胆碱酯酶活性,过氧化氢产量降低,金纳米棒刻蚀受阻,观察反应后溶液的颜色;其中,双酶体系为同时含乙酰胆碱酯酶与胆碱氧化酶的体系;步骤三、利用紫外–可见光谱仪对待测液的紫外吸收进行检测。
其原理为:通过有机磷农药对乙酰胆碱酯酶的抑制作用,阻碍双酶体系(同时含乙酰胆碱酯酶与胆碱氧化酶的体系)反应,产物过氧化氢的量减少,从而阻碍了金纳米棒的刻蚀,棒长变短减缓,金纳米棒在不同刻蚀度下溶液具有不同的颜色,观测溶液颜色变化就能判断是否含有有机磷农药。
图2显示了本申请中有机磷农药检测实验验证图;图中a线:金纳米棒的紫外吸收光谱;b线:不含乙酰胆碱酯酶时,金纳米棒在催化条件下的紫外吸收光谱;c线:双酶体系中,金纳米棒在催化条件下被刻蚀的紫外吸收光谱;d线:有机磷农药抑制乙酰胆碱酯酶时,金纳米棒刻蚀受阻的紫外吸收光谱;从图2中可以看出,乙酰胆碱酯酶存在时,金纳米棒的紫外吸收发生蓝移;乙酰胆碱酯酶被有机磷抑制后,金纳米棒的紫外吸收发生蓝移减少。
本实施例中有机磷农药统一选用的是敌敌畏,但本申请的方案在具体应用时不限于敌敌畏,还可用于甲拌磷、内吸磷、对硫磷、保棉丰、氧化乐果、甲基对硫磷、二甲硫吸磷、亚胺磷、敌百虫、乐果、氯硫磷、乙基稻丰散等等各类有机磷农药。
实施例1
基于金纳米棒刻蚀构建比色传感器定量检测有机磷农药的方法,检测步骤是:
一锅法合成金纳米棒的步骤:首先,将实验过程中使用的烧杯等玻璃仪器用王水(盐酸:硝酸=3:1)浸泡24小时。然后,制备金纳米棒生长溶液,将1520μl氯金酸(10mmol/l)、222μl硝酸银(20mmol/l)和1ml对苯二酚(5.26mmol/l)依次加入到34.612mlctab中,轻轻晃动,静置5分钟,最后加入646μl硼氢化钠(1mmol/l),静止12h,所有实验操作均在30℃下进行。然后将所得溶液在15000×g下离心20分钟,离心两次后复溶在40ml超纯水中,棕色瓶中常温保存。
乙酰胆碱酯酶检测步骤:取一ep管,加入5μl100mmol/l氯化乙酰胆碱底物,用l0mmol/lpbs缓冲溶液调节ph值为7.0,加入100u/ml乙酰胆碱酯酶0.5μl,50u/ml胆碱氧化酶2μl,37℃下温育30min,然后加入100μl,0.38mmol/l金纳米棒,2m盐酸150μl,以及20mmol/l硫酸亚铁50μl,室温下温育0.5小时,对其溶液进行记录和紫外–可见光谱检测;反应后溶液颜色为棕黄色。
有机磷农药检测步骤:取0~1μg/ml不同浓度敌敌畏,分别加入100u/ml乙酰胆碱酯酶0.5μl,37℃下抑制15min,然后加入100mmol/l氯化乙酰胆碱底物5μl,50u/ml胆碱氧化酶2μl,用l0mmol/lpbs缓冲溶液调节ph值为7.0,37℃下温育30min,最后加入100μl金纳米棒,2m盐酸150μl,以及20mmol/l硫酸亚铁50μl,室温下温育0.5小时,对反应现象进行记录和对反应后的溶液紫外–可见光谱检测。分析得到紫外吸收图谱,绘出敌敌畏检测线性图。
pbs缓冲溶液为ph为7.2,浓度为10mmol/l;包含nacl和kcl;具体为缓冲溶液中nacl的初始浓度为136.89mmol/l,kcl的初始浓度为2.67mmol/l。注:反应总体积为500μl。
本实施例中敌敌畏浓度值选为0μg/ml、1×10-5μg/ml、1×10-4μg/ml、5×10-4μg/ml、1×10-3μg/ml、0.0025μg/ml、0.0075μg/ml、0.01μg/ml、0.1μg/ml、1μg/ml,随着有机磷农药浓度的上升,刻蚀金纳米棒的反应溶液颜色由棕黄色变为灰色、青色、绿色、蓝色、紫色、红色、黄色的变化过程减缓。
实施例2
基于金纳米棒刻蚀构建比色传感器定量检测有机磷农药的方法,检测步骤是:
一锅法合成金纳米棒的步骤:首先,将实验过程中使用的烧杯等玻璃仪器用王水(盐酸:硝酸=3:1)浸泡24小时。然后,制备金纳米棒生长溶液,将1520μl氯金酸(10mmol/l)、222μl硝酸银(20mmol/l)和1ml对苯二酚(5.26mmol/l)依次加入到34.612mlctab中,轻轻晃动,静置5分钟,最后加入646μl硼氢化钠(1mmol/l),静止12h,所有实验操作均在30℃下进行。然后将所得溶液在15000×g下离心20分钟,离心两次后复溶在超纯水中,棕色瓶中常温保存。
乙酰胆碱酯酶检测步骤:取一ep管,加入5μl100mmol/l氯化乙酰胆碱底物,用l0mmol/lpbs缓冲溶液调节ph值为7.2,加入100u/ml乙酰胆碱酯酶5μl,50u/m胆碱氧化酶1μl,37℃下温育30min,然后加入100μl金纳米棒,2m盐酸150μl,以及20mmol/l硫酸亚铁50μl,室温下温育0.8小时,对其溶液进行记录和紫外–可见光谱检测。反应后溶液颜色为棕黄色。
有机磷农药检测步骤:取0~1μg/ml不同浓度敌敌畏,加入100u/ml乙酰胆碱酯酶5μl,37℃下抑制15min,然后加入5μl100mmol/l氯化乙酰胆碱底物,50u/m胆碱氧化酶1μl,用l0mmol/lpbs缓冲溶液调节ph值为7.2,37℃下温育30min,最后加入100μl金纳米棒,2m盐酸150μl,以及20mmol/l硫酸亚铁50μl,室温下温育0.8小时,对反应现象进行记录和对反应后的溶液紫外–可见光谱检测。分析得到紫外吸收图谱,绘出敌敌畏检测线性图。注:反应总体积为500μl。
pbs缓冲溶液为ph为7.3,浓度为10mmol/l;包含nacl和kcl;具体为缓冲溶液中nacl的初始浓度为136.89mmol/l,kcl的初始浓度为2.67mmol/l。注:反应总体积为500μl。
本实施例中敌敌畏浓度值选为0μg/ml、1×10-5μg/ml、1×10-4μg/ml、5×10-4μg/ml、1×10-3μg/ml、0.0025μg/ml、0.0075μg/ml、0.01μg/ml、0.1μg/ml、1μg/ml,随着敌敌畏有机磷农药浓度的上升,刻蚀金纳米棒的反应溶液颜色由棕黄色变为灰色、青色、绿色、蓝色、紫色、红色、黄色的变化过程减缓。
实施例3
基于金纳米棒刻蚀构建比色传感器定量检测有机磷农药的方法,检测步骤是:
一锅法合成金纳米棒的步骤:首先,将实验过程中使用的烧杯等玻璃仪器用王水(盐酸:硝酸=3:1)浸泡24小时。然后,制备金纳米棒生长溶液,将1520μl氯金酸(10mmol/l)、222μl硝酸银(20mmol/l)和1ml对苯二酚(5.26mmol/l)依次加入到34.612mlctab中,轻轻晃动,静置5分钟,最后加入646μl硼氢化钠(1mmol/l),静止12h,所有实验操作均在30℃下进行。然后将所得溶液在15000×g下离心20分钟,离心两次后复溶在超纯水中,棕色瓶中常温保存。
乙酰胆碱酯酶检测步骤:取一ep管,加入5μl100mmol/l氯化乙酰胆碱底物,用l0mmol/lpbs缓冲溶液调节ph值为7.4,加入100u/ml乙酰胆碱酯酶10μl,50u/m胆碱氧化酶10μl,37℃下温育30min,然后加入100μl金纳米棒,2m盐酸150μl,以及20mmol/l硫酸亚铁50μl,室温下温育1小时,对其溶液进行记录和紫外–可见光谱检测。反应后溶液颜色为棕黄色。
有机磷农药检测步骤:取0~1×10-5μg/ml不同浓度敌敌畏,加入100u/ml乙酰胆碱酯酶10μl,37℃下抑制15min,然后加入5μl100mmol/l氯化乙酰胆碱底物,50u/m胆碱氧化酶10μl,用l0mmol/lpbs缓冲溶液调节ph值为7.4,37℃下温育30min,最后加入100μl金纳米棒,2m盐酸150μl,以及20mmol/l硫酸亚铁50μl,室温下温育1小时,对反应现象进行记录和对反应后的溶液紫外–可见光谱检测。分析得到紫外吸收图谱,绘出敌敌畏检测线性图。注:反应总体积为500μl。
pbs缓冲溶液为ph为7.4,浓度为10mmol/l;包含nacl和kcl;具体为缓冲溶液中nacl的初始浓度为136.89mmol/l,kcl的初始浓度为2.67mmol/l。注:反应总体积为500μl。
本实施例中敌敌畏浓度值选为0μg/ml、1×10-5μg/ml、1×10-4μg/ml、5×10-4μg/ml、1×10-3μg/ml、0.0025μg/ml、0.0075μg/ml、0.01μg/ml、0.1μg/ml、1μg/ml,随着敌敌畏有机磷农药浓度的上升,刻蚀金纳米棒的反应溶液颜色由棕黄色变为灰色、青色、绿色、蓝色、紫色、红色、黄色的变化过程减缓。
实施例1-3实验结果检测为:
实施例1-3中紫外–可见光谱检测实验结果见图6-7,对敌敌畏在0-1μg/ml范围内进行检测,其中在1×10-5μg/ml到0.01μg/ml呈良好的线性关系,检测限是0.8×10-5μg/ml。图6-7显示了定量检测敌敌畏浓度的紫外光谱变化图。图6在不同量的敌敌畏作用下得到的紫外光谱图(敌敌畏的浓度:(a)0μg/ml、(b)1μg/ml、(c)0.1μg/ml、(d)0.01μg/ml、(e)0.0075μg/ml、(f)0.0025μg/ml、(h)1×10-3μg/ml、(g)5×10-4μg/ml、(i)1×10-4μg/ml、(j)1×10-5μg/ml);图7金纳米棒lspr峰波长变化量与敌敌畏浓度的拟合曲线。
图3-5显示了实施例1-3中金纳米棒在不同条件下的透射电镜图,标尺为20纳米;a显示了金纳米棒的电镜图,标尺为20纳米;b显示了双酶体系中,金纳米棒在催化条件下被刻蚀的电镜图;c显示了有机磷农药抑制乙酰胆碱酯酶时,金纳米棒刻蚀受阻的紫外吸收光谱;从图中可以看出乙酰胆碱酯酶存在时,金纳米棒棒长变短,接近球状;乙酰胆碱酯酶被有机磷抑制后,金纳米棒棒长变短减少。本申请中透射电镜检测是采用如下步骤进行的,取反应后的溶液滴加到碳膜支持的铜网上,室温下放置1~3min后,用滤纸吸去铜网上剩余溶液,然后将铜网浸于1%~2%的磷钨酸钠溶液中1~3min后,取出,室温下自然晾干,透射电镜检测。
上述仅为本发明优选的实施例,并不限制于本发明。对于所属领域的技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化或变动。这里无需也无法对所有的实施例来举例说明。而由此方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!