基于八面体Cu2O‑Au的电化学适配体传感器及其制备方法与流程
本发明涉及生物技术领域,特别是涉及一种基于八面体cu2o-au的电化学适配体传感器及其制备方法。
背景技术:
凝血酶是na+活化的突变丝氨酸蛋白酶,作为凝血级联中的中枢蛋白酶。在血管损伤中,凝血酶通过一系列酶裂解从前体活性酶凝血酶原快速产生,并且在凝血过程中其浓度可以从pm变化到mm。凝血酶在生理和病理性凝血中起关键作用,同时涉及各种疾病,如中枢神经系统损伤,血栓栓塞性疾病,阿尔茨海默病和癌症。因此,一个高灵敏度和特异性的凝血酶检测方法对于研究和临床诊断都非常有意义。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种基于八面体cu2o-au的电化学适配体传感器及其制备方法,用于解决现有技术中对凝血酶的检测限不够低、响应时间长、成本较高、灵敏度差等问题。
为实现上述目的及其他相关目的,本发明提供一种基于八面体cu2o-au的电化学适配体传感器的制备方法,包括如下步骤:
(1)制备cu2o-au纳米复合材料:将cu2o与haucl4水溶液混合,反应得到cu2o-au纳米复合材料,备用;
(2)标记cu2o-au纳米复合材料:将cu2o-au纳米复合材料、nh2-tba混合,反应结束后,加入bsa水溶液,反应制得标记的cu2o-au纳米复合材料;
(3)制备电化学适配体传感器:将标记的cu2o-au纳米复合材料滴加到修饰的电极上,孵育得到所述基于八面体cu2o-au的电化学适配体传感器。
优选地,步骤(1)中,cu2o的制备方法如下:将含有cu2+的溶液与碱溶液混合,反应得到cu(oh)2,向其中加入还原剂,反应得到cu2o。
优选地,步骤(1)中,所述还原剂选自水合肼。
优选地,步骤(1)中,先将cu2o制成水溶液,再向cu2o水溶液中加入pvp、haucl4水溶液,反应得到cu2o-au纳米复合材料。
优选地,步骤(1)中,混合液中haucl4·4h2o的浓度≥1.25mm。
优选地,步骤(1)中,混合液中haucl4·4h2o的浓度为1.25-7.50mm。
优选地,步骤(1)中,混合液中haucl4·4h2o的浓度为3.75-7.50mm。
优选地,步骤(1)中,混合液中haucl4·4h2o的浓度为5.00-7.50mm。
优选地,步骤(2)中,混合液中cu2o-au的浓度为0.5-3.5mg/ml。
优选地,步骤(2)中,混合液中cu2o-au的浓度为1.5-3.5mg/ml。
优选地,步骤(2)中,混合液中cu2o-au的浓度为2.0mg/ml。
优选地,步骤(2)中,混合液中tba的浓度≥0.5μm。
优选地,步骤(2)中,混合液中tba的浓度为0.5-3.0μm。
优选地,步骤(2)中,混合液中tba的浓度为1.5-3.0μm。
优选地,步骤(2)中,混合液中tba的浓度为2.0-3.0μm。
优选地,步骤(2)中,将cu2o-au复合物、nh2-tba混合反应后,再加入氯化血红素反应,反应结束后,再加入bsa水溶液进行反应。
优选地,步骤(2)中,将cu2o-au复合物、nh2-tba、甲苯胺蓝混合反应后,再加入氯化血红素反应,反应结束后,再加入bsa水溶液进行反应。
优选地,步骤(2)中,反应温度为4℃。
优选地,步骤(2)中,cu2o-au复合物、nh2-tba、甲苯胺蓝混合后,反应时间为12h。
优选地,步骤(2)中,加入氯化血红素后,反应时间为2h。
优选地,步骤(3)中,所述电极为改性玻璃碳电极。
优选地,步骤(3)中,将电极浸泡在haucl4水溶液中,电沉积至金纳米颗粒被固定在电极表面上,再将nh2-tba溶液滴加到aunps改性的电极表面上,孵育,再向电极表面滴加bsa溶液,孵育,再向电极表面滴加tb标准溶液,孵育得到修饰的电极。
优选地,步骤(3)中,电沉积时间≥10s。
优选地,步骤(3)中,电沉积时间为10-60s。
优选地,步骤(3)中,电沉积时间为30s。
优选地,步骤(3)中,向电极表面滴加tb标准溶液后,孵育时间≥10min。
优选地,步骤(3)中,向电极表面滴加tb标准溶液后,孵育时间为10-60min。
优选地,步骤(3)中,向电极表面滴加tb标准溶液后,孵育时间为30-60min。
优选地,步骤(3)中,向电极表面滴加tb标准溶液后,孵育时间为40-60min。
本发明第二方面提供上述方法制得的电化学适配体传感器。
本发明第三方面提供上述电化学适配体传感器在凝血酶检测中的用途。
如上所述,本发明的基于八面体cu2o-au的电化学适配体传感器及其制备方法,具有以下有益效果:本发明所提出的电化学适配体传感器具有良好的灵敏度(检测限低至23fm),高特异性,可接受的重复性,同时也可用于人血清样品中的检测。此外,cu2o-au纳米复合材料还具有优异的光催化活性,cu2o-au纳米复合材料在电致发光传感器领域具有广泛的应用前景。
附图说明
图1显示为本发明实施例中cu2o纳米晶体的fe-sem图像(a)、cu2o-au纳米复合材料的fe-sem图像(b)、cu2o-au纳米复合材料的eds(c)、cu2o-au纳米复合材料的xps光谱(d)、cu2o-au纳米复合材料中的cu2p3(e)、cu2o-au纳米复合材料中的au4f(f)、cu2o-au纳米复合材料中的o1s(g)的光谱图。
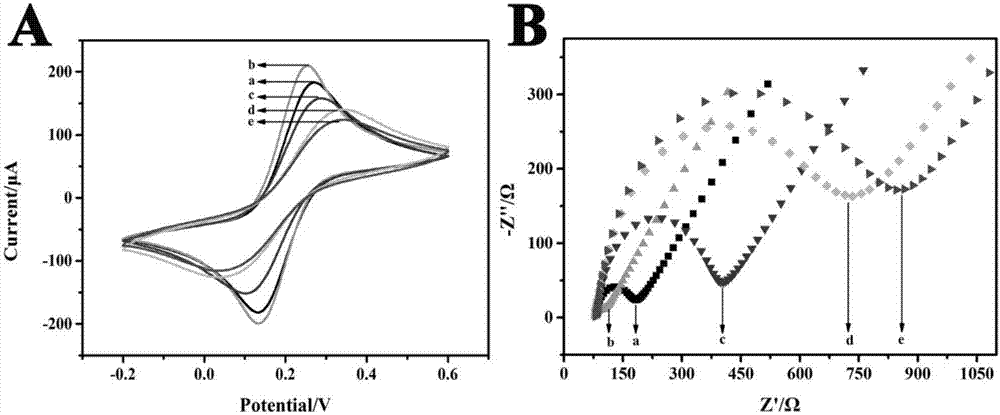
图2显示为本发明实施例中含有0.1mkcl的5mm[fe(cn)6]3-/4-溶液中不同电极的cv(a)和eis(b)响应图。
图3显示为本发明实施例中aunps(a)、nh2-tba/aunps(b)、bsa/nh2-tba/aunps(c)、tb/bsa/nh2-tba/aunps/gce(d)的afm三维图像。
图4显示为本发明实施例中在不含有h2o2(a)和含有15mmh2o2(b))的0.1mpbs中的不同材料修饰电极的cv图:(a)八面体cu2o纳米晶体;(b)cu2o-au纳米复合材料。
图5显示为本发明实施例中用不同信号标记孵育的适配体传感器的i-t曲线:(a)aunps-tba-bsa(a曲线)和cu2o-au-tba-bsa(b曲线);(b)cu2o-au-tba-bsa(a曲线)和hemin/g-quadreplex标记的cu2o-au-bsa(b曲线);(c)hemin/g-quadreplex标记的cu2o-au-bsa(a曲线)和tb和hemin/g-quadreplex标记的cu2o-au-bsa(b曲线)。
图6显示为本发明实施例中aunps的电沉积时间(a)、tba的浓度(b)、tb的孵育时间(c)、工作缓冲液的ph值(d)、haucl4的浓度(e)、cu2o-au的浓度(f)对适配体传感器的电化学信号影响图。
图7显示为本发明实施例中适配体传感器对不同浓度tb的电流响应(a),从a至h:0,100fm,1pm,10pm,100pm,1nm,10nm,20nm;以及适应传感器对不同浓度tb(n=3)的标准曲线(b)。
图8显示为本发明实施例中目标tb(1nm)与其他干扰物质:bsa(10nm),hb(10nm)和cea(10nm),及其与1nmtb的混合物相比,电化学适应传感器的电化学信号响应图(a);以及适配体传感器在保存不同周(n=3)后检测10nmtb的电化学信号反应图(b)。
图9显示为本发明实施例中电化学适配体传感器组装的示意图和信号标签的制备过程示意图。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
须知,下列实施例中未具体注明的工艺设备或装置均采用本领域内的常规设备或装置;所有压力值和范围都是指绝对压力。
此外应理解,本发明中提到的一个或多个方法步骤并不排斥在所述组合步骤前后还可以存在其他方法步骤或在这些明确提到的步骤之间还可以插入其他方法步骤,除非另有说明;还应理解,本发明中提到的一个或多个设备/装置之间的组合连接关系并不排斥在所述组合设备/装置前后还可以存在其他设备/装置或在这些明确提到的两个设备/装置之间还可以插入其他设备/装置,除非另有说明。而且,除非另有说明,各方法步骤的编号仅为鉴别各方法步骤的便利工具,而非为限制各方法步骤的排列次序或限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容的情况下,当亦视为本发明可实施的范畴。
1.概述
纳米材料具有独特的性质,如表面积与体积之比较大,生物相容性好,电导率高,受体分子负载量高,催化能力强。如今,纳米材料已广泛用作信号放大分子和纳米载体,以提高传感器的灵敏性。金纳米粒子(aunps)由于表面积大,氧化还原活性好,生物相容性好,是纳米材料中最常用的材料。近些年来,氧化亚铜(cu2o)纳米材料已经引起了研究人员的广泛关注,因为它们具有优异的催化h2o2能力以及较低的成本。weichen的小组报道了使用石墨烯包裹的cu2o纳米管用于检测葡萄糖和过氧化氢的非酶电化学传感器。huiminwu的研究小组报道了cu2o-pt核壳纳米粒子作为基底用于多巴胺敏感检测。有研究表明,八面体cu2o纳米晶体显示出比其他形状的cu2o纳米晶体更优异的电催化性能。另外,八面体cu2o纳米晶体具有较大的表面积,并且具有可逆氧化还原活性的通用结构单元。与单金属氧化物相比,掺杂贵金属的纳米复合材料与其单金属相比具有更明显的独特特征。因此,通过简便的原位方法合成了cu2o-au纳米复合材料。aunps覆盖在八面体cu2o纳米晶体的表面,进一步增加表面积以便固定更多的识别元件和电活性物质,同时cu2o-au纳米复合材料显示出优异的催化h2o2能力。
适配体自1990年的首次报导以来,已广泛应用于疾病诊断和生物测定。与传统的识别元件抗体相比,适配体具有许多独特的性质,包括低成本,可大规模生产,对检测目标没有限制等。近年来,出现大量基于适配体的传感器,如荧光适配体传感器、电化学适配体传感器、比色适配体传感器和表面等离子体共振适配体传感器。在这些传感器中,电化学适配体传感器因其具有操作简单,可小型化,响应时间快,成本相对较低的特点而被广泛使用。此外,凝血酶适配体(tba)可以折叠成g-四链体结构,并且其构象开关通过与凝血酶结合触发。血红素(hemin)可作为辅助因子插入tba中,形成血红素/g-四链体,并能催化h2o2介导的氧化反应。因此,hemin/g-quadruplex(一种已知的辣根过氧化物酶模拟dna酶)可广泛用于电化学适配体传感器的信号放大策略中。
本发明研究了一种基于aunps功能化八面体cu2o纳米晶体作为信号放大分子和纳米载体的无酶型电化学适配体传感器检测凝血酶。首先,aunps通过简单的原位反应直接生长在八面体cu2o纳米晶体的表面上。与八面体cu2o纳米晶体相比,合成的cu2o-au纳米复合材料具有更大的表面积、更显著的催化能力和良好的稳定性,可以固定更多的电活性物质和识别探针,以此改善电化学信号,提高传感器灵敏度。甲苯胺蓝(tb)通常作为电子转移介质提供电化学信号。具有氨的tb和氨基封端的tba通过au-n键附着在cu2o-au纳米复合材料表面上。随着hemin的引入,形成了大量的hemin/g-quadruplex模拟dna酶,进一步提高了适配体传感器的灵敏性。通过电沉积将aunps固定在玻碳电极(gce)的表面上以捕获tba。捕获的tba、靶蛋白凝血酶、tb和henmin/g-quadruplex标记的cu2o-au纳米复合材料一起形成夹心型电化学适应传感器。将h2o2引入工作缓冲液中后,cu2o、hemin/g-quadruplex共催化h2o2,促进tb的电子转移,获得优异的电化学信号响应。本发明所提出的无酶型适配体传感器对人血清中凝血酶的定量测定具有较高的灵敏度,在临床和诊断方面具有相当大的应用潜力。
2.实验方法
2.1试剂和化学品
凝血酶(tb)、氯金酸(haucl4·4h2o)、氯化血红素(hemin)和牛血清白蛋白(bsa)均购买自sigma-aldrichchemical(st.louis,usa,www.sigmaaldrich.com)。水合肼(n2h4·h2o98%)、聚乙烯吡咯烷酮(pvpk29-32)和甲苯胺蓝(tb)均购买自阿拉丁试剂有限公司(中国上海),无水氯化铜(ii)(cucl2)和凝血酶适配体(tba)购自sangonbiotechco.,ltd。(上海,中国),寡核苷酸序列如下:
tba:5'-nh2-(ch2)6-ggttggtgtggttgg-3'。
以含有1mmmgcl2、1mmcacl2、5mmkcl和140mmnacl的20mmtris-hcl缓冲液(ph=7.4)作为适体缓冲液。以含有0.1mna2hpo4、0.1mkh2po4和0.1mkcl的磷酸盐缓冲盐水(pbs,ph=6.8)作为所有电化学测量的工作缓冲液。所有化学品均为分析试剂级。超纯蒸馏水和去离子水(18.2mω)用于所有溶液制剂。
2.2仪器设备
电化学测量包括计时电流法(i-t)、循环伏安法(cv)、电化学阻抗谱(eis),均在autolabpgstat302n电化学工作站(瑞士万通科技有限公司)上进行。场发射扫描电子显微镜fe-sem)图像使用hitachis4800(hitachilimited,japan)获得。使用具有alkax射线(1486.6ev)作为光源的vgscientificescalab250光谱仪(thermoelectricityinstruments,usa)实现x射线光电子能谱(xps)。原子力显微镜(afm)图像由brukerdimension图标(美国)监测。使用jeoljsm-6700f显微镜(日本)对能量色散x射线光谱(eds)进行标定。常规的三电极系统用于所有电化学测量,由铂丝电极作为对电极,ag/agcl(包含3mkcl)作为参比电极,以及改性玻璃碳电极(gce,4mm直径)作为工作电极。使用pbs作为所有电化学测量的工作缓冲液,使用前用氮气吹扫30分钟以除去pbs中的溶解氧。所有实验在室温(25±1℃)环境下进行。
2.3八面体cu2o纳米晶体的合成
首先,在室温剧烈搅拌条件下,向烧杯中加入1ml0.1mcucl2溶液和28ml去离子水。然后,加入1ml的1.0mnaoh溶液。所得溶液立即变蓝,表明形成了cu(oh)2。在cu(oh)2沉淀完全形成后,通过移液管在3秒钟内将120μl1mn2h4·h2o快速注入烧杯中。将烧杯中的溶液在室温下保持搅拌10分钟,然后以5000rpm离心5分钟。将离心出来的cu2o再分散在30ml去离子水中,然后加入10μl的1mn2h4·h2o,并继续搅拌60分钟进行纳米晶体生长。将制备的cu2o纳米晶体以5000rpm离心5分钟,并用10ml去离子水洗涤3次以除去未反应的化学物质。最后的洗涤步骤使用10ml乙醇,将沉淀物分散在4ml乙醇中进行存储和分析。
2.4cu2o-au纳米复合材料的合成
为了合成cu2o-au纳米复合材料,首先将7.2mgcu2o八面体纳米晶体溶解在26ml去离子水中。将3ml1%pvp溶液滴入cu2o八面体溶液中,然后向样品中加入1ml5mmhaucl4水溶液。haucl4水溶液的典型黄色和cu2o的砖红色立即消失,形成黑色产物。将溶液在室温下放置在磁力搅拌器上,剧烈搅拌3小时。反应结束后,将制备的cu2o-au纳米复合材料在5000rpm离心5分钟,并用20ml去离子水洗涤3次以除去未反应的化学物质。最后的洗涤步骤使用10ml乙醇,并将该纳米复合材料在真空中干燥过夜。反应式如下:
3cu2o+2aucl4-+6h+=6cu2++2au+3h2o+8cl-
2.5制备tb和hemin/g-quadruplex标记的cu2o-au纳米复合材料(信号标签)
为了固定nh2-tba,将1ml制备的cu2o-au(2mg/ml)纳米复合材料与100μlnh2-tba(2.0μm)和50μltb混合,随后在4℃下轻轻搅拌12小时。因此,nh2-tba和tb通过aunps和-nh2基团之间的相互作用附着在cu2o-au纳米复合材料上。然后,将200μl血红素(0.5mg/ml)加入到混合物中,并在4℃下搅拌2小时以便形成hemin/g-quadruplex。接着,将50μlbsa(w/w,1%)引入混合物中,保持30分钟以阻断剩余的活性位点。将最终产物离心,重悬于1ml水中,储存在4℃下以便进一步使用。
2.6适配体传感器的制备
电化学适应传感器的制备过程如图9所示。将gce用0.3μm和0.05μm氧化铝浆料重复抛光成镜面,并用去离子水彻底冲洗。然后,将gce在无水乙醇中超声清洗5分钟,随后在水中超声清洗5分钟。将gce在室温下干燥后,将其浸泡在haucl4(w/w,1%)溶液中,并在-0.2v下电沉积30秒,金纳米颗粒(aunps)成功固定在gce表面上。接下来,20μlnh2-tba(2.0μm)滴加到aunps改性的gce表面上在室温下孵育16小时。为了阻止电极表面的非特异性结合,将10μlbsa溶液(w/w,1%)滴加到电极表面上孵育40分钟。然后将20μl不同浓度的(如图7b所示)tb标准溶液在室温下滴加到改性电极上孵育40分钟,然后洗涤。最终,将15μltb和hemin/g-quadruplex标记的cu2o-au纳米复合材料(信号标记)滴加到所得修饰的电极上并再孵育40分钟。经过大量清洗以除去未结合的信号标签后,电极准备进行测量。
2.7电化学测试
所有电化学测试在含有三电极布置的常规电化学电池中进行。cv和eis测量在含有0.1mkcl的5mm[fe(cn)6]3-/4-溶液中逐渐进行。cv测量以100mv/s的扫描速率和-0.2至0.6v的电压范围进行,eis参数包括10mv幅度和在室温下从0.1至105hz的频率扫描。为了进行电化学测量,在室温和-0.4v电压条件下,记录8ml工作缓冲液(ph=6.8)中的电流-时间曲线,在背景电流稳定后,向溶液中加入10μl5mh2o2,记录电化学信号变化。
3.结果与讨论
3.1八面体cu2o纳米晶体和cu2o-au纳米复合材料的表征
从fe-sem图像(图1a)可以看出,大多数合成的cu2o纳米晶体表现出清晰的八面体结构,平均直径约为250nm。图1b显示了均匀涂覆在八面体cu2o纳米晶体表面上的约30-50nm直径的aunps,表明cu2o-au纳米复合材料已经被成功合成。此外,应用eds和xps进一步证实了cu2o-au纳米复合材料的合成。如图所示,在图1c中,在eds图像中存在对应的o、cu和au的峰。同时,在xps图像的cu2o-au纳米复合材料中,cu2p3,o1s,c1s和au4f核心水平区域的特征峰被清楚地观察到(图1d)。cu2p3、au4f和o1s的光谱分别如图1e、图1f、图1g所示,与先前文献(zhu,h.,du,m.l.,yu,d.l.,wang,y.,wang,l.n.,zou,m.l.,zhang,m.,fu,y.q.,2012.anewstrategyforthesurface-free-energy-distributioninducedselectivegrowthandcontrolledformationofcu2o–auhierarchicalheterostructureswithaseriesofmorphologicalevolutions.journalofmaterialschemistrya1(3),919-929.)报告一致。结合上述实验结果证明cu2o-au纳米复合材料已经成功合成。
3.2逐步修饰电极的电化学表征
为了表征改性电极的界面性质,通过eis和cv测量在每个步骤后对感应界面的组装步骤进行了研究。不同步骤制备电极的cv谱如图2a所示。反应条件为:2.0μmnh2-tba和40分钟tb孵育时间。随着铁氰化物离子在玻碳电极表面的可逆氧化还原反应,记录了明确的氧化还原波(曲线a)。随着aunps固定在电极上(曲线b),氧化还原峰电流随着aunps促进电子转移而明显增加。接下来,在aunps/gce捕获tba后,峰值电流明显下降(曲线c)。原因是非电活性的tba可以严重阻碍氧化还原探针的电子转移。类似地,当使用非导电性bsa阻断非特异性位点时,峰电流进一步降低(曲线d)。最后,当适配体传感器与10nm凝血酶一起孵育时,其中tba捕获凝血酶形成的凝血酶-适配体复合物导致氧化还原峰电流的进一步降低,因为其严重阻碍了电子的转运(曲线e)。
此外,eis是一种成熟的技术,常用于验证电极的逐步修饰过程。在奈奎斯特图中,半圆直径等于电子转移电阻,低频曲线的线性部分代表扩散过程。如图2b所示。裸露的gce表现出较小的电阻(曲线a)。由于aunps的电传输性能很高,当aunps电沉积到电极表面(曲线b)时,半圆直径减小。当tba滴加到电极表面时,电阻显着增加(曲线c),证明tba通过aunps和-nh2基团之间的相互作用附着在电极上。随后加入非导电性bsa作为阻断剂,再次引起电阻增加。在孵育凝血酶后(曲线d),电阻进一步增加(曲线e),意味着凝血酶已被tba成功捕获。
为了确认电极的制备过程,我们进行了afm图像表征,图3a-图3d所示为afm的三维图像。图3a显示通过电沉积形成的aunps层。在tba被涂覆到电极上之后,由于dna吸附到电极上,表面变得相对光滑(图3b)。当电极被bsa阻断时,表面粗糙度增加一点(图3c)。在与tb孵育后,电极表面粗糙度略有增加(图3d),表明tba成功捕获了tb。所获得的所有结果进一步支持了传感器成功的制造,并与先前研究的结果一致。
3.3比较八面体cu2o纳米晶体和cu2o-au纳米复合材料的性能
通过对h2o2的催化反应的电流响应评估了八面体cu2o纳米晶体修饰电极(图4a)和cu2o-au纳米复合材料修饰电极(图4b)的性能。曲线a显示为不含h2o2的0.1mpbs中电极的cv响应。曲线b显示为在含有15mmh2o2的0.1mpbs中的cv的响应。因此,我们发现八面体cu2o纳米晶体修饰电极的电流响应远远小于cu2o-au纳米复合材料修饰电极的响应。这种现象的原因可能是aunps通过原位方法在八面体cu2o纳米晶体的表面生长,这显着提高了纳米复合材料的催化能力和导电性。
3.4比较不同的信号放大策略
为了验证提出的适配体传感器的信号放大性能,我们准备了四种信号标签来检测相同的分析物浓度。四种信号标签包括(a)aunps-tba-bsa,(b)cu2o-au-tba-bsa,(c)hemin/g-quadruplex标记的cu2o-au-bsa,和(d)tb和hemin/g-quadruplex标记的cu2o-au-bsa。如图5a所示,与使用aunps-tba-bsa作为信号标签的适配体传感器相比,cu2o-au-tba-bsa作为信号标签时电化学信号的明显增加,因为cu2o具有优异的催化h2o2的能力。当适配体传感器与hemin/g-quadreplex标记的cu2o-au-bsa一起孵育时,hemin/g-quadruplex模拟过氧化物酶可以催化h2o2,导致电化学信号增加(图5b)。值得注意的是,当tb和hemin/g-quadreplex标记的cu2o-au-bsa作为信号标签时具有比其他信号标签更大的电化学信号响应(图5c)。这个现象可能的原因是cu2o、aunps和hemin/g-quadruplex共催化h2o2,促进了tb的电子转移导致电化学信号的增强。因此,本发明所提出的信号放大方法(tb和hemin/g-quadreplex标记的cu2o-au-bsa作为信号标签)是适配体传感器的合适选择。
3.5优化实验条件
以下优化实验,除了优化参数不同以外,其他步骤、参数均与步骤2.1-2.6一致。
适配体传感器的电化学信号受许多因素的影响。为了确保适配体传感器的最佳性能,我们研究了几个关键因素。aunps电沉积时间决定了aunps层的厚度和aunps的数量,进而影响tba的固定和电子转移。图6a显示了aunps不同电沉积时间的影响。电化学信号变化随着电沉积时间的增加而增加,30s时可以观察到最大电化学信号,随后降低。这个现象的原因是长的电沉积时间形成过量的aunps,其阻碍了电子转移。因此,适配体传感器的aunps电沉积时间优选为30s。
tba的浓度是捕获凝血酶和影响检测范围的另一个重要因素。如图6b所示,可以看出,电化学信号随着tba的浓度增加而逐渐增加,tba浓度在2.0μm时电化学信号最大,随后基本保持稳定。因此,选择2.0μm作为tba的最佳浓度。
tb和tba之间的反应的孵育时间也是影响适配体传感器分析性能的重要参数。如图6c所示,随着孵化时间的增加,电化学信号变化先增加并在约40min后保持稳定。这一发现表明,适体和tb的结合是饱和的。因此,选择40min作为最佳孵育时间。
ph值主要影响信号标签的催化能力和生物蛋白的活性。制备各种ph值的工作缓冲液,以调查适配体传感器的性能。如图6d所示,ph为6.8时有最佳电化学信号响应。原因是cu2o在弱酸性条件下性能最好,弱碱性条件对cu2o的性能产生影响。当ph>7.0时,cu2o的增强作用减弱,导致电化学信号降低。因此,选择6.8作为工作缓冲液的ph值时能获得最佳的电化学信号响应。
在cu2o-au纳米复合材料的合成过程中,haucl4·4h2o的浓度决定了cu2o-au纳米复合材料中aunps的含量,这进一步影响了tb和hemin/g-quadreplex的固定量。因此,使用不同浓度的haucl4·4h2o合成的cu2o-au纳米复合材料作为信号标签来研究适配体传感器的性能。如图6e所示,随着haucl4·4h2o的浓度从1.25mm增加到5.0mm,电化学信号增加,但当浓度从5.0mm增加到7.5mm时,电化学信号降低。这种现象的原因可能是过量的haucl4·4h2o消耗了更多的cu2o,造成电化学信号降低。因此,在cu2o-au纳米复合材料的合成过程中,选择5mm作为haucl4·4h2o的最佳浓度,适配体传感器有最佳性能。
cu2o-au纳米复合材料的浓度也是影响适体传感器催化功效的重要因素。合成信号标签的cu2o-au纳米复合材料的浓度不同,表现出电化学信号响应如图6f所示。随着cu2o-au纳米复合材料的浓度从0.5mg/ml增加到2.0mg/ml,电化学信号响应的变化迅速增加,随后后来减少。推测,cu2o-au纳米复合材料膜厚度的增加可能导致界面电子转移电阻的增加;在这种情况下,电子转移变得更加困难。因此,选择2.0mg/ml作为cu2o-au纳米复合材料的最佳浓度。
3.6适配体传感器的性能
在最佳实验条件下(aunps电沉积时间优选为30s,tba浓度为2.0μm,tb和tba之间的反应的孵育时间为40min,工作缓冲液ph为6.8,haucl4·4h2o的浓度为5mm,cu2o-au纳米复合材料的浓度为2.0mg/ml),采用tb和hemin/g-quadreplex标记的cu2o-au-apt-bsa作为信号标签的制备的适配体传感器,通过在-0.4v电压下,8mlpbs(ph=6.8)中的计时电流曲线对不同浓度的tb进行定量检测。电化学信号和tb浓度的关系如图7a所示。如图7b所示,在100fm至20nm的范围内观察到电化学信号与tb浓度的对数值之间的线性关系,通过计算可得检测极限为23fm(基于s/n=3)。回归方程为y=25.44logctb+553.24,相关系数r=0.9989。较低的检测限可能归因于几个因素。一方面,aunps作为基底具有良好的生物相容性,可以捕获更多的tba来扩增检测范围。另一方面,cu2o-au纳米复合材料不仅具有良好的催化能力和高导电性,并且具有大的比表面积,可以固定大量tb和hemin/g-quadreplex辣根过氧化物酶模拟dna酶,这进一步增强了电化学信号并获得了更高的灵敏度。与先前检测tb的方法的比较如表1所示,从表中数据可以看出,本发明所提出的适配体传感器具有比现有传感器更低的检测限。
表1凝血酶适配体传感器的比较
3.8电化学适配体传感器的特异性,稳定性和重复性
适配体传感器的特异性在分离生物样品中起着非常重要的作用。一些非靶标物质,如bsa、hb和cea被作为干扰物质测试适配体传感器的特异性。如图8a所示,适配体传感器与bsa(10nm),hb(10nm)和cea(10nm)一起孵育时与空白信号相比,可以观察到电化学信号基本没有改变。然而,在用tb(1nm)和其与上述三种非靶标(10nm)的混合物孵育后,电化学信号增加明显。这些结果表明提出的适应传感器的具有很高的特异性。
为了研究适应传感器的稳定性,将制备的适配体传感器储存在4℃环境下,使用时再取出。如图8b所示,1周后,适配体传感器的电化学信号为初始电化学信号的98.07%,仅有较小变化。4周后,电化学信号保持了其初始电化学信号的87.88%,表明提出的适配体传感器具有可接受的稳定性。此外,我们还通过在三种不同浓度(1nm,100pm,1pm)下记录电流响应来测试适配体传感器的重复性。为每个浓度制备了五个电极。相对标准偏差(rsd)范围为0.49%至1.29%,如表2所示。结果表明,提出的适应传感器具有可接受的重复性。
表2五种不同电极对三种浓度分析物的重现性
3.9血清样品分析应用
为了评估提出的适配体传感器的实际适用性和准确性,将稀释10倍的人血清样品(重庆医科大学附属大学城医院获得)中加入各种浓度的tb(如表3所示),其后用所提出的电化学传感器进行检测,得到的样品的电流曲线记录。如表3所示,检测结果的相对标准偏差(rsd)范围为1.24%至3.77%,回收率为91.75%至107.2%。结果表明,本发明制得的适配体传感器对于检测凝血酶是可行的,可以满足实际分析的需要。
表3采用本发明制得的适配体传感器测定人血清中的凝血酶(n=3)
4.结论
在发明制备了灵敏的夹心型电化学适配体传感器,用tb和hemin/g-quadruplex标记的cu2o-au纳米复合材料作为信号标签,aunps作为基底检测凝血酶。归功于cu2o-au纳米复合材料的八面体的表面积和优异的生物相容性其被用作理想的纳米载体,用于固定大量电活性tb和hemin/g-quadruplex辣根过氧化物酶模拟dnazyme。此外,aunps、cu2o和hemin/g-quadruplex的合作催化能力可以放大电化学信号,提高适配体传感器的灵敏度。结合这些优点,所提出的电化学适配体传感器具有良好的灵敏度(检测限为23fm),具有高特异性和可接受的重复性,同时也可用于人血清样品中的检测。此外,cu2o-au纳米复合材料还具有优异的光催化活性,因此,本发明制得的cu2o-au纳米复合材料在电致发光传感器领域具有广泛的应用前景。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!