一种检测CP4‑EPSPS蛋白的电化学免疫传感器及其制备方法与应用与流程
本发明属于cp4-epsps蛋白快速检测技术领域,具体涉及一种检测cp4-epsps蛋白的电化学免疫传感器及其制备方法与应用。
背景技术:
epsps(5-烯醇式丙酮莽草酸-3-磷酸合酶)是莽草酸途径中的一个关键酶,广泛存在于植物及微生物中,并且是广普高效除草剂草甘膦的靶标酶,而cp4-epsps对草甘膦具有非常高的抗性,因此被广泛应用于农作物转基因工程中。自1996年首批转基因抗草甘膦大豆40-3-2商业化以来,抗草甘膦作物的种植面积迅速增长。面对大量含有cp4-epsps的转基因农作物,我们迫切地需要建立科学灵敏的检测方法对其进行定性定量检测。
目前,检测cp4-epsps蛋白的方法主要有酶联免疫吸附法、多重实时pcr法、蛋白质印迹法等。但这些方法操作较繁琐,比如引物的制备、质粒的提取等,仪器较昂贵,且对操作人员的技术要求高。因此建立一种更加便捷灵敏高效地检测方法仍然非常必要。
电化学免疫传感器作为一种新型检测平台,以其鉴定物质的高度特异性、敏感性和稳定性受到青睐,它的问世使传统的免疫分析发生了很大的变化。它将传统的免疫测试和生物传感技术融为一体,集两者的诸多优点于一身,不仅减少了分析时间、提高了灵敏度和测试精度,也使得测定过程变得简单,易于实现自动化,有着广阔的应用前景。
另外,纳米抗体是一种从骆驼血液中提取的具有完整功能的最小抗原结合片段,分子量仅有15kda,具有可溶性高,不易聚集,能耐高温、强酸、强碱等致变性条件等诸多优于传统抗体的特点。
而目前,尚未有技术利用纳米抗体构建电化学免疫传感器实现对cp4-epsps蛋白的高效检测。
技术实现要素:
本发明的目的是提供一种基于纳米金介孔碳(aunps-cmk-3)和纳米抗体的电化学免疫传感器及其制备方法,通过该方法实现对cp4-epsps蛋白高灵敏度高特异性的定性定量检测。
本发明中技术术语的缩写如下:
玻碳电极:gce;纳米金介孔碳:aunps-cmk-3;介孔碳:cmk-3;纳米金颗粒:aunps;硫堇:th;纳米抗体:nb。
为实现上述目的,本发明的技术方案如下:
一种检测cp4-epsps蛋白的电化学免疫传感器的制备方法,基底电极表面依次经aunps-cmk-3分散液修饰,edc和nhs的混合溶液活化,cp4-epsps抗体和硫堇的混合溶液共价结合。
所述基底电极为玻碳电极。玻碳电极长8cm,有效导电面积直径为3mm。
所述aunps-cmk-3分散液按如下步骤制备得到:
(1)aunps的制备
取haucl4溶液在冷凝回流装置中加热煮沸,在搅拌条件下向其加入柠檬酸钠溶液作为还原剂,继续搅拌10~30min,至颜色变为橙红色,撤去加热源逐渐冷却至室温,得到aunps溶液;
(2)aunps-cmk-3的制备
称取cmk-3加入aunps溶液中,室温下充分搅拌反应4~6h后,将混悬液真空抽滤,收集所得的aunps-cmk-3真空干燥;称量上述干燥复合物溶于dmf溶液中,得到aunps-cmk-3分散液。
所述步骤(1)中haucl4.3h2o溶液的溶剂为去离子水,浓度为0.12mg/ml;柠檬酸钠溶液的溶剂为去离子水,浓度为38.8mm,haucl4和柠檬酸钠的质量比为1:2.375。
所述步骤(1)中haucl4和步骤(2)中cmk-3的质量比为1~4:5。
优选地,所述步骤(1)中haucl4和步骤(2)中cmk-3的质量比为2:5。
所述cp4-epsps抗体为cp4-epsps纳米抗体。
一种检测cp4-epsps蛋白的电化学免疫传感器的制备方法,包括以下步骤:
(1)滴加aunps-cmk-3分散液:取aunps-cmk-3分散液,滴加于经过处理的基底电极表面,室温下放置12~24h;
(2)活化aunps-cmk-3:将步骤(1)得到的电极用去离子水清洗,晾干,滴加edc和nhs的混合溶液于电极表面,室温放置1~2h;
(3)共价连接抗体和信号探针分子:将步骤(2)得到的电极用去离子水清洗,晾干,滴加cp4-epsps纳米抗体和硫堇的混合溶液,2~4℃放置10~12h;
(4)封闭非特异性位点:将步骤(3)得到的电极用去离子水清洗,晾干,滴加bsa溶液室温放置10~40min。
其中,基底电极用粒径为0.3μm和0.05μm的氧化铝粉依次进行抛光处理,然后用乙醇和去离子水清洁电极,此步骤在超声清洗器中操作。
所述步骤(1)中aunps-cmk-3分散液的浓度为0.5mg/ml。aunps-cmk-3分散液是过量的,用去离子水清洗未结合的aunps-cmk-3。
所述步骤(2)中edc和nhs的混合溶液,溶剂为0.1mpbs,edc的浓度为20mg/ml,nhs的浓度为10mg/ml,edc和nhs的质量比为2:1。edc和nhs的混合溶液是过量的,用去离子水清洗未结合的edc和nhs。
所述步骤(3)中cp4-epsps抗体和硫堇的混合溶液,溶剂为0.1mpbs,cp4-epsps抗体的浓度为10μg/ml,硫堇的浓度为0.1mg/ml。cp4-epsps抗体和硫堇的混合溶液是过量的,用去离子水清洗未结合的cp4-epsps和硫堇。
所述步骤(4)中bsa溶液的溶剂为0.1mpbs,浓度为10mg/ml。bsa溶液是过量的。
至此,一个基于aunps-cmk-3和纳米抗体nb的电化学免疫传感器构建完成,它的组装顺序如下:
通过查找借助该传感器绘制的抗原浓度对数与信号探针电流衰减比率之间关系的标准曲线图,该平台可以检测到对应抗原浓度的大小。
上述制备方法制备得到的电化学免疫传感器。
上述制备方法制备得到的电化学免疫传感器在定量检测cp4-epsps蛋白中的应用。
有益效果:相对于现有技术,本发明的优势如下:
1、本发明通过设计和调控纳米金的质量,制备最佳质量比纳米金介孔碳复合物(aunps-cmk-3),使其发挥最佳的信号增强作用;本发明中引入硫堇作为信号探针分子,硫堇作为经典的氧化还原活性分子,具有非常可靠的电化学活性。
2、本发明利用纳米抗体作为捕获抗体,使免疫传感器的检测性能更加稳定和可靠。
3、本发明电化学免疫传感器具有灵敏度高、特异性强、仪器轻便易携带等明显优势,可以在生物大分子的检测方面发挥重要作用,具有广泛的应用前景。
附图说明
图1为aunps-cmk-3增强信号的循环伏安图;
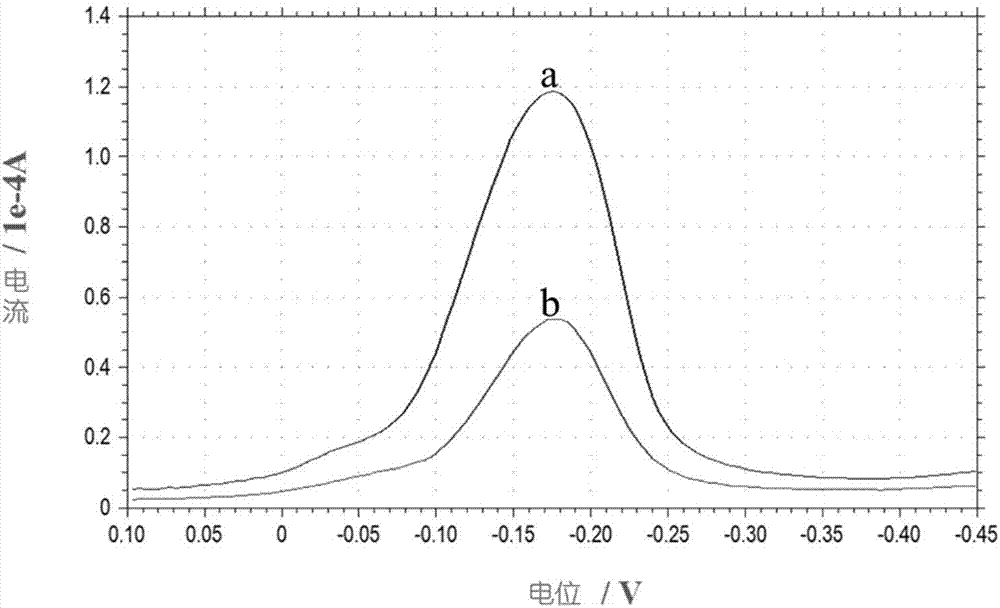
图2为孵育待测抗原前后的差分脉冲伏安图;
图3为抗原浓度与电流衰减比率之间的线性关系图;
图4为本发明电化学免疫传感器的特异性图。
具体实施方式
根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
cp4-epsps纳米抗体及其抗原由中国科学院上海药物研究所万亚坤研究组提供,制备方法在专利申请号201510048148.7中公开。
实施例1aunps-cmk-3的制备
(1)aunps的制备
取100ml浓度为0.12mg/ml的haucl4溶液在冷凝回流装置中加热煮沸,在搅拌条件下向其加入2.5ml38.8mmc6h5na3o7.2h2o溶液作为还原剂,继续搅拌加热15min后,颜色变为橙红色,撤去加热源逐渐冷却至室温,得到aunps溶液。
(2)aunps-cmk-3的制备
称取30mgcmk-3加入上述100mlaunps溶液中,室温下充分搅拌反应4h,将混悬液通过孔径为0.22μm的滤膜真空抽滤收集,收集所得的aunps-cmk-3用真空干燥泵真空干燥1h。称量上述干燥aunps-cmk-3溶于dmf中,制得终浓度为0.5mg/ml的aunps-cmk-3分散液。
实施例2aunps-cmk-3的制备
(1)aunps的制备
取50ml浓度为0.12mg/ml的haucl4溶液在冷凝回流装置中加热煮沸,在搅拌条件下向其加入1.25ml38.8mmc6h5na3o7.2h2o溶液作为还原剂,继续搅拌加热10min后,撤去加热源逐渐冷却至室温,得到aunps溶液。
(2)aunps-cmk-3的制备
称取30mgcmk-3加入上述50mlaunps溶液中,室温下充分搅拌反应4h,将混悬液通过孔径为0.22μm的滤膜真空抽滤收集,收集所得的aunps-cmk-3用真空干燥泵真空干燥1h。称量上述干燥aunps-cmk-3溶于dmf中,制得终浓度为0.5mg/ml的aunps-cmk-3分散液。
实施例3aunps-cmk-3的制备
(1)aunps的制备
取200ml浓度为0.12mg/ml的haucl4溶液在冷凝回流装置中加热煮沸,在搅拌条件下向其加入5ml38.8mmc6h5na3o7.2h2o溶液作为还原剂,继续搅拌加热30min后,撤去加热源逐渐冷却至室温,得到aunps溶液。
(2)aunps-cmk-3的制备
称取30mgcmk-3加入上述200mlaunps溶液中,室温下充分搅拌反应4h,将混悬液通过孔径为0.22μm的滤膜真空抽滤收集,收集所得的aunps-cmk-3用真空干燥泵真空干燥1h。称量上述干燥aunps-cmk-3溶于dmf中,制得终浓度为0.5mg/ml的aunps-cmk-3分散液。
实施例4aunps-cmk-3增强信号的循环伏安图
(1)th/gce:将玻碳电极用0.5mh2so4水溶液处理,使其表面产生羧基,并滴加10μledc和nhs的混合溶液(edc浓度20mg/ml,nhs浓度10mg/ml)活化羧基,再滴加10μl0.1mg/ml的th溶液,室温反应1h,利用电化学工作站(上海辰华电化学工作站(chi660e软件)),检测th/gce的循环伏安结果。
(2)aunps-cmk-3/gce:将5μlaunps-cmk-3分散液(0.5mg/ml)滴到gce上,干燥后利用电化学工作站,检测aunps-cmk-3/gce的循环伏安结果。
(3)th/aunps-cmk-3/gce:将5μlaunps-cmk-3分散液(0.5mg/ml)滴到gce上,干燥后,滴加10μledc和nhs的混合溶液(edc浓度20mg/ml,nhs浓度10mg/ml)活化复合物表面羧基,再滴加10μl0.1mg/ml的th溶液,室温反应1h,利用电化学工作站,检测th/aunps-cmk-3/gce的循环伏安结果。
aunps-cmk-3增强信号的循环伏安图见图1。当信号探针分子th修饰到玻碳电极上只会产生微弱的氧化还原信号,峰电流值非常小(如a曲线所示);当aunps-cmk-3修饰到电极上则没有氧化还原信号,无峰电流的出现,但电容电流却明显增宽(如b曲线所示),由此说明aunps-cmk-3的导电性能佳;而当将信号探针分子th修饰到已修饰aunps-cmk-3的电极上时,峰电流出现了明显的增大(如c曲线所示),由此说明aunps-cmk-3能够显著增强信号探针分子th的峰电流信号,具有非常优异的信号放大作用。除此之外,aunps-cmk-3作为传感器件还可用于捕获纳米抗体,从而实现传感器的逐步组装。
本实施例主要说明aunps-cmk-3优异的增强电流信号的作用,基于此,aunps-cmk-3可以用作构建传感器的基底复合物。
实施例5测定cp4-epsps蛋白的电化学免疫传感器的制备
(1)滴加aunps-cmk-3分散液:取5μl浓度为0.5mg/ml的aunps-cmk-3分散液,滴加到用抛光粉处理过的玻碳电极表面,室温下放置24h,确保复合物完全结合在电极表面;
(2)活化aunps-cmk-3:将步骤(1)得到的电极用去离子水清洗,洗去未结合在电极表面的aunps-cmk-3,晾干,然后滴加10μledc和nhs的混合溶液(edc浓度20mg/ml,nhs浓度10mg/ml)于电极表面,室温放置2h,以此活化aunps-cmk-3表面羧基;
(3)共价连接纳米抗体和信号探针分子:将步骤(2)得到的电极用去离子水清洗,洗去未结合的edc和nhs,晾干,然后滴加10μlcp4-epsps纳米抗体(10μg/ml)和硫堇(0.1mg/ml)的混合溶液,4℃放置12h,使纳米抗体、信号探针分子th与aunps-cmk-3发生共价结合而充分连接;
(4)封闭非特异性位点:将步骤(3)得到的电极用去离子水清洗,洗去未结合的纳米抗体和信号探针分子th,晾干,滴加10μl10mg/mlbsa溶液室温放置30min,封闭未被纳米抗体及探针分子结合的位点,避免非特异信号干扰,形成纳米抗体层;
(5)孵育待测抗原:将步骤(4)得到的电极用去离子水清洗,洗去多余的bsa,晾干,滴加10μl100ng/ml的待测抗原cp4-epsps蛋白,室温反应2h,此时抗原会和电极表面已修饰的纳米抗体发生特异性结合,抗原浓度越大则结合到电极表面的抗原越多,信号探针的信号越弱,由此通过纳米抗体层的信号探针分子电流强弱变化实现对待测抗原cp4-epsps蛋白的定性定量检测。
至此,一个基于纳米金介孔碳复合物和纳米抗体的电化学免疫传感器构建完成。
上述步骤(5)孵育待测抗原前后对应的峰电流值(如图2a、b曲线所示)变化明显,证明抗原结合到修饰电极表面后,相对应地,信号探针的峰电流值会减弱。由此通过纳米抗体层的信号探针的峰电流衰减变化实现对待测抗原cp4-epsps蛋白的定性定量检测。
实施例6测定cp4-epsps蛋白的电化学免疫传感器的制备
(1)滴加aunps-cmk-3分散液:取5μl浓度为0.5mg/ml的aunps-cmk-3分散液,滴加到用抛光粉处理过的玻碳电极表面,室温下放置12h,确保复合物完全结合在电极表面;
(2)活化aunps-cmk-3:将步骤(1)得到的电极用去离子水清洗,洗去未结合在电极表面的aunps-cmk-3,晾干,然后滴加10μledc和nhs的混合溶液(edc浓度20mg/ml,nhs浓度10mg/ml)于电极表面,室温放置1h,以此活化aunps-cmk-3表面羧基;
(3)共价连接纳米抗体和信号探针分子:将步骤(2)得到的电极用去离子水清洗,洗去未结合的edc和nhs,晾干,然后滴加10μlcp4-epsps纳米抗体(10μg/ml)和硫堇(0.1mg/ml)的混合溶液,2~4℃放置10h,使纳米抗体、信号探针分子硫堇与aunps-cmk-3发生共价结合而充分连接;
(4)封闭非特异性位点:将步骤(3)得到的电极用去离子水清洗,洗去未结合的纳米抗体和探针分子,晾干,滴加10μl10mg/mlbsa室温放置10min,封闭未被纳米抗体及探针分子结合的位点,避免非特异信号干扰,形成纳米抗体层;
(5)孵育待测抗原:将步骤(4)得到的电极用去离子水清洗,洗去多余的bsa,晾干,滴加10μl100ng/ml的待测抗原cp4-epsps蛋白,室温反应2h,此时抗原会和电极表面已修饰的纳米抗体发生特异性结合,抗原浓度越大则结合到电极表面的抗原越多,信号探针的信号越弱,由此通过纳米抗体层的信号探针分子电流强弱变化实现对待测抗原cp4-epsps蛋白的定性定量检测。
实施例7抗原浓度对数与电流衰减比率之间的线性关系
设置抗原cp4-epsps蛋白的6个浓度梯度,分别为100ng/ml、10ng/ml、1ng/ml、0.1ng/ml、0.01ng/ml、0.001ng/ml,每个浓度下又分别做了若干平行对照,其溶剂为0.1mpbs;免疫传感器的制备方法同实施例5,测定峰电流强度,绘制标准曲线,结果图3所示。
随着抗原浓度的不断增大,对应的峰电流值不断减小,而对应的峰电流衰减比率(i0-ii/i0)则逐渐增大,经过数据分析,抗原浓度的对数值与对应的峰电流衰减比率之间呈相关系数较高的线性关系。
本发明中cp4-epsps蛋白的有效检测浓度低至0.001ng/ml,与现有市面上elisa技术的最低检测浓度94ng/ml相比较,本发明电化学免疫传感器对cp4-epsps蛋白的检测具有高度的灵敏度。
实施例8测定cp4-epsps蛋白的电化学免疫传感器的特异性
利用浓度均为100ng/ml的其他转基因蛋白作为抗原,分别为cry1aa、cry1b、cry1f,并设置了若干平行对照,其溶剂均为0.1mpbs,将实施例5中的电化学免疫传感器测定的抗原改为上述三种转基因蛋白;最终测定出所对应的峰电流强度变化,并与同浓度的目标抗原cp4-epsps蛋白结果相比较,绘制柱形图,结果图4所示。
经过数据分析,相同浓度条件下的转基因蛋白cry1aa、cry1b、cry1f所对应的峰电流衰减比率明显小于目标抗原cp4-epsps蛋白,说明本发明电化学免疫传感器具有较强的特异性,受其他物质干扰小。
- 还没有人留言评论。精彩留言会获得点赞!