一种苯并吲哚半菁衍生物pH荧光探针及其制备方法与流程
本发明涉及ph荧光探针及其制备方法。
背景技术:
ph值是生物体内的一个重要指标,特定的ph值在很多生理、病理过程中起着重要的作用。生物膜ph值或细胞内ph值对细胞周期相关生命活动如内吞、酶作用、组织活性、细胞凋亡等有显著影响。生物体内ph值异常容易导致癌症和阿尔茨海默氏症等疾病产生。这些疾病中细胞的ph值总是低于人体内正常细胞的ph值。因此监测细胞内ph值的变化可以为研究生理和病理过程提供重要信息。
2018年第152期的《染料和颜料》(dyesandpigments)在第155–160页的文章《一种用于活细胞ph值变化的检测和成像的比率型荧光探针》(aratiometricemissionnir-fluorescentprobeforsensingandimagingphchangesinlivecells)报道了一种吲哚–肉桂醛ph探针,该探针是以哌啶作为溶剂并加入催化剂进行合成的,它的发射波长较长,在ph值3.5~5.2的范围内随着ph值增大,荧光值逐步减小,且呈现良好的线性关系。但该探针的光稳定性差。
2016年第12期的《染料和颜料》(dyesandpigments)在165–169页的文章《苯并咪唑-bodipy的荧光ph探针》(benzimidazole-bodipyasopticalandfluorometricphsensor)报道了一类苯并咪唑ph探针,该探针在ph至为3.05~8.09的范围内,随着ph值增大荧光值逐渐降低,但是该探针的stokes'位移仅为15nm。
技术实现要素:
本发明是要解决现有的ph荧光探针光稳定性差和stokes位移变化较小的技术问题,而提供一种苯并吲哚半菁衍生物ph荧光探针及其制备方法。
本发明的苯并吲哚半菁衍生物ph荧光探针(bidd),其结构式为:
上述的苯并吲哚半菁衍生物ph荧光探针(bidd)的制备方法,按以下步骤进行:
一、依次向带有回流装置的反应容器中加入2,3,3–三甲基–3h–苯并[e]吲哚、2,4–二羟基苯甲醛、无水乙醇和酸性溶液;升温至75~85℃保持回流进行反应,在反应过程中采用薄层层析法(tlc)跟踪反应进程,当硅胶板上出现新的产物点,且两种原料点消失时,停止反应;其中薄层层析法(tlc)是以石油醚与乙酸乙酯的体积比为1:1的混合液作为展开剂的;
二、将反应容器中的产物滴入到碱性溶液中,调节ph值至7~8,然后加水,有固体析出,抽滤,滤饼用乙酸乙酯洗涤,干燥,得到苯并吲哚半菁衍生物ph荧光探针,该探针为深红色固体,缩写为bidd。
本发明的合成过程如下所示:
本发明的苯并吲哚半菁衍生物ph荧光探针(bidd)的合成步骤少,合成过程中的溶剂无毒,提纯方法简单,发射波长可达550nm以上,斯托克斯位移(stokesshift)达到153nm~162nm,斯托克斯位移较大,有利于降低荧光自吸收,减小电子转移过程中的能量损失,荧光效率高,在2h内探针溶液在不同ph值下的荧光强度非常稳定,光稳定性高,检测时不受生物体的背景荧光影响。本发明的苯并吲哚半菁衍生物ph荧光探针在ph值为4.4~6.2以及9.8~10.6的范围内,具有高选择性、高灵敏性,并具有良好的线性关系,而且不受各种阴离子、阳离子的干扰,可以用于生物体内的ph值检测。
附图说明
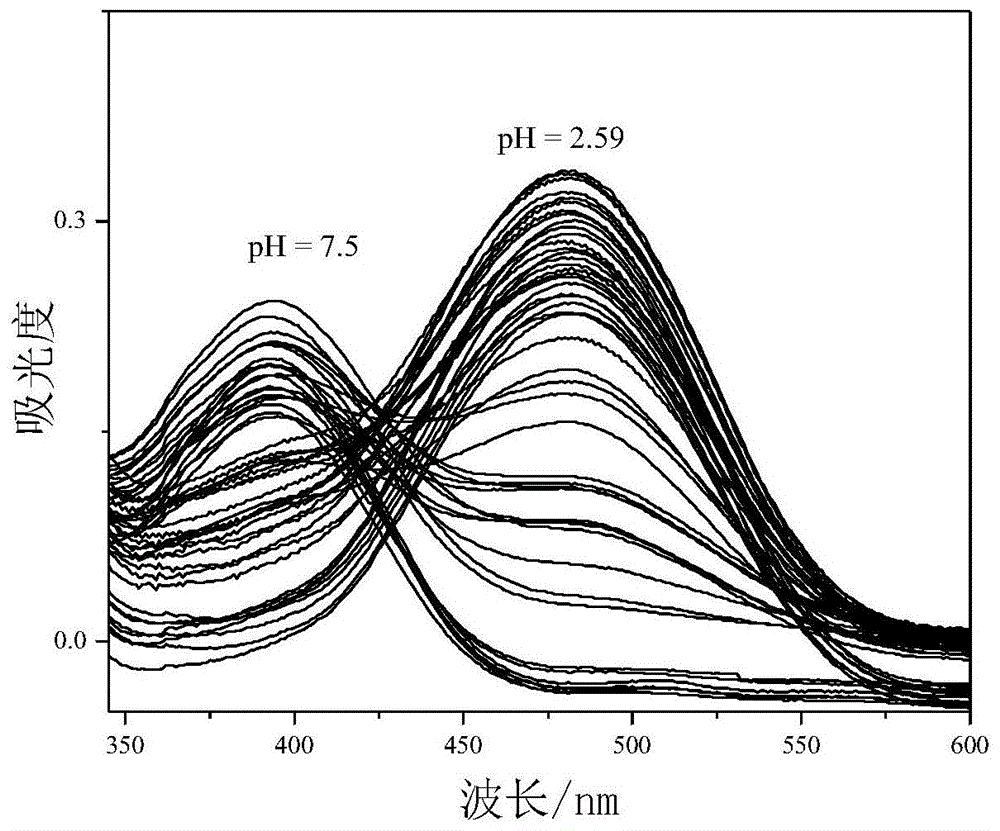
图1是实施例1制备的苯并吲哚半菁衍生物ph荧光探针的etoh/hepes缓冲溶液(v/v=1/1),在不同ph条件下(ph=2.59~7.50)的紫外–可见吸收光谱图。横坐标为波长,纵坐标为吸光度。
图2是实施例1制备的苯并吲哚半菁衍生物ph荧光探针的etoh/hepes缓冲溶液(v/v=1/1),在不同ph条件下(ph=2.59~7.50)的荧光发射光谱(λex=393nm,狭缝宽度为10/12)。横坐标为ph值,纵坐标为荧光强度。
图3是实施例1制备的苯并吲哚半菁衍生物的ph荧光探针etoh/hepes缓冲溶液(v/v=1/1,ph=7.40)紫外–可见吸收光谱和荧光发射光谱的归一化曲线图(λex=393nm,狭缝宽度为10/12)。横坐标为波长。
图4是实施例1制备的苯并吲哚半菁衍生物ph荧光探针的etoh/hepes缓冲溶液(v/v=1/1),在λem=517nm处最大荧光强度随ph值变化(ph=2.59~7.50)的s曲线图(λex=393nm,狭缝宽度为10/12)。横坐标为ph值,纵坐标为最大荧光强度。
图5是实施例1制备的苯并吲哚半菁衍生物ph荧光探针的etoh/hepes缓冲溶液(v/v=1/1,ph=4.40~6.20),在λem=517nm处荧光强度和ph值呈线性关系的ph范围内荧光强度和ph值的线性关系图(λex=393nm,狭缝宽度为10/12)。横坐标为ph值,纵坐标为荧光强度。
图6是实施例1制备的苯并吲哚半菁衍生物ph荧光探针的etoh/hepes缓冲溶液(v/v=1/1,ph=2.59~7.50),在λem=517nm处荧光强度与此波长下最大荧光强度之比i/imax随ph变化的曲线(λex=393nm,狭缝宽度为10/12)。横坐标为ph值,纵坐标为i/imax。当i/imax=0.5时,根据公式pka=ph±lg[(i–imin)/(imax–i)],计算出pka=4.98±0.42829。
图7是实施例1制备的苯并吲哚半菁衍生物ph荧光探针的etoh/hepes缓冲溶液(v/v=1/1),在λem=517nm处ph=4.9和ph=7.1之间的荧光可逆光谱图(λex=393nm,狭缝宽度为10/12)。横坐标为循环次数,纵坐标为荧光强度。
图8是各种阴离子、阳离子对实施例1制备的苯并吲哚半菁衍生物ph荧光探针的etoh/hepes缓冲溶液(v/v=1/1)在λem=517nm处荧光发射光谱的干扰图(λex=393nm,狭缝宽度为10/12)。横坐标为各种离子,纵坐标为荧光强度。
图9是实施例1制备的苯并吲哚半菁衍生物ph荧光探针的etoh/hepes缓冲溶液(v/v=1/1),ph值分别为7.00,4.99,2.60条件下,在λem=517nm处荧光光谱时间稳定性曲线图(λex=393nm,狭缝宽度为10/12)。横坐标为时间,纵坐标为荧光强度。
图10是实施例1制备的苯并吲哚半菁衍生物ph荧光探针的etoh/hepes缓冲溶液(v/v=1/1),在不同的ph条件下(ph=7.50~11.88)的紫外–可见吸收光谱图。横坐标为波长,纵坐标为吸光度。
图11是实施例1制备的苯并吲哚半菁衍生物ph荧光探针的etoh/hepes缓冲溶液(v/v=1/1),在不同的ph条件下(ph=7.50~11.88)的荧光发射光谱图(λex=393nm,λem=517nm,狭缝宽度为10/12)。横坐标为ph值,纵坐标为荧光强度。
图12是实施例1制备的苯并吲哚半菁衍生物ph荧光探针的etoh/hepes缓冲溶液(v/v=1/1,ph=10.56)紫外–可见吸收光谱和荧光发射光谱的归一化图(λex=393nm,狭缝宽度为10/12)。横坐标为波长。
图13是实施例1制备的苯并吲哚半菁衍生物ph荧光探针的etoh/hepes缓冲溶液(v/v=1/1),在λem=517nm处的最大荧光强度随ph值变化(ph=7.50~11.88)的s曲线图(λex=393nm,狭缝宽度为10/12)。横坐标为ph值,纵坐标为最大荧光强度。
图14是实施例1制备的苯并吲哚半菁衍生物ph荧光探针的etoh/hepes缓冲溶液(v/v=1/1,ph=7.50~11.88),在λem=517nm处的荧光强度与ph值之间的线性关系图(λex=393nm,狭缝宽度为10/12)。横坐标为ph值,纵坐标为荧光强度。
图15是实施例1制备的苯并吲哚半菁衍生物ph荧光探针的etoh/hepes缓冲溶液(v/v=1/1),在λem=517nm处ph=7.50和ph=11.83之间的荧光可逆光谱图(λex=393nm,狭缝宽度为10/12),横坐标为循环次数,纵坐标为荧光强度。
图16是实施例1制备的苯并吲哚半菁衍生物ph荧光探针的etoh/hepes缓冲溶液(v/v=1/1),各种离子对λem=517nm处荧光发射干扰光谱图(λex=393nm,狭缝宽度为10/12)。横坐标为各种离子,纵坐标为荧光强度。
图17是实施例1制备的苯并吲哚半菁衍生物ph荧光探针的etoh/hepes缓冲溶液(v/v=1/1),在ph值分别为7.50、9.23、10.26条件下,λem=517nm处荧光光谱的稳定性曲线图。横坐标为时间,纵坐标为荧光强度。
具体实施方式
具体实施方式一:本实施方式的苯并吲哚半菁衍生物ph荧光探针(bidd),其结构式为:
具体实施方式二:具体实施方式一所述的苯并吲哚半菁衍生物ph荧光探针(bidd)的制备方法,按以下步骤进行:
一、依次向带有回流装置的反应容器中加入2,3,3–三甲基–3h–苯并[e]吲哚、2,4–二羟基苯甲醛、无水乙醇和酸性溶液;升温至75~85℃保持回流进行反应,在反应过程中采用薄层层析法(tlc)跟踪反应进程,当硅胶板上出现新的产物点,且两种原料点消失时,停止反应;其中薄层层析法(tlc)是以石油醚与乙酸乙酯的体积比为1:1的混合液作为展开剂的;
二、将反应容器中的产物滴入到碱性溶液中,调节ph值至7~8,然后加水,有固体析出,抽滤,滤饼用乙酸乙酯洗涤,干燥,得到苯并吲哚半菁衍生物ph荧光探针,该探针为深红色固体,缩写为bidd。
具体实施方式三:本实施方式与具体实施方式二不同的是步骤一中2,3,3–三甲基–3h–苯并[e]吲哚与2,4–二羟基苯甲醛的摩尔比为1:(2.5~3.5);其它与具体实施方式二相同。
具体实施方式四:本实施方式与具体实施方式二或三不同的是步骤一中2,3,3–三甲基–3h–苯并[e]吲哚的物质的量与无水乙醇的体积的比为1mmol:(7~8)ml;其它与具体实施方式二或三相同。
具体实施方式五:本实施方式与具体实施方式二至四之一不同的是步骤一中所述的酸性溶液为质量分数为36%~37%的浓盐酸、质量分数为98%的浓硫酸或质量分数为50%~70%的冰乙酸。其它与具体实施方式二至四之一相同。
具体实施方式六:本实施方式与具体实施方式二至五之一不同的是步骤一中2,3,3–三甲基–3h–苯并[e]吲哚的物质的量与酸性溶液的体积的比为1mmol:(4.5~5.5)ml。其它与具体实施方式二至五之一相同。
具体实施方式七:本实施方式与具体实施方式二至六之一不同的是步骤二中所述的碱性溶液为质量分数为30%~40%的氢氧化钠溶液、质量分数为50%~70%的碳酸氢钠溶液或质量分数为30%~40%的氢氧化钾溶液。其它与具体实施方式二至六之一相同。
用以下实施例验证本发明的有益效果:
实施例1:本实施例的苯并吲哚半菁衍生物ph荧光探针(bidd)的制备方法,按以下步骤进行:
一、依次向带有回流装置的50ml三口瓶中加入0.450g(2.0mmol)2,3,3–三甲基–3h–苯并[e]吲哚、0.800g(6.0mmol)2,4–二羟基苯甲醛、15.0ml无水乙醇和10.0ml质量分数为98%的浓硫酸溶液,加热至80℃保持回流反应,反应过程中采用tlc(展开剂v石油醚:v乙酸乙酯=1:1)跟踪反应进程,当反应6.5h后,硅胶板上出现新的产物点,且两种原料点消失,停止反应;
二、将反应容器中的产物滴入到质量分数为40%的氢氧化钠溶液中,调节ph值至7.5,然后加水,有固体析出,抽滤,滤饼用乙酸乙酯洗涤3次,在温度为90℃的烘箱中干燥8小时,得到苯并吲哚半菁衍生物ph荧光探针,该探针为深红色固体,缩写为bidd。
本实施例中苯并吲哚半菁衍生物ph荧光探针(bidd)的熔点为289~291℃,质量百分纯度为93%,产率为78%。
将本实施例制备的本实施例中苯并吲哚半菁衍生物ph荧光探针用核磁共振谱及质谱进行表征,得到的结果如下:
1hnmr(600mhz,dmso-d6):δ(ppm):1.6[s,6h,c(ch3)2],6.89[d,j=8.9hz,2h,arh],7.15(d,j=15.6hz,1h,ch=ch),7.53(t,j=6.8hz,1h,arh),7.69(t,j=7.8hz,1h,arh),7.74(d,j=9.6hz,1h,arh),7.97(d,j=8.8hz,2h,arh),8.02(d,j=7.6hz,1h,arh),8.04(d,j=8.8hz,1h,arh),8.18(d,j=8.8hz,1h,arh),8.78(d,j=8.8hz,1h,arh),10.64(s,1h,oh),10.90(s,1h,oh).13cnmr(600mhz,dmso):δ(ppm):191.33,186.33,165.63,163.71,133.18,130.02,128.61,123.22,115.70,109.09,103.00,102.66,54.09,40.41,40.28,40.14,40.00,39.86,39.72,39.58,23.18.hrms(esi-tof)m/zcalcdforc22h20no2+,[m-h]+330.1489;found:330.1489.mol.wt:330.3992.
从以上的表征结果可知苯并吲哚半菁衍生物ph荧光探针(bidd)的结构式为:
将0.0066g实施例1制备的苯并吲哚半菁衍生物ph荧光探针加入到100ml容量瓶中,用乙醇定容,即为探针储备液。从探针储备液中取0.5ml转移到5ml容量瓶中,用vetoh:vhepes=1:1的混合溶液定容,得到探针溶液。利用探针溶液进行以下的试验。
在不同ph条件下(ph=2.59~7.50)测试探针溶液的紫外–可见吸收光谱,得到的紫外–可见吸收光谱图如图1所示。横坐标为波长,纵坐标为吸光度。从图1可以看出,中性条件下探针溶液最大吸收波长在393nm处。随着探针溶液ph值减小,最大吸收波长红移至482nm处,并且在425nm处出现了等吸收点。
在不同ph条件下(ph=2.59~7.50)测试探针溶液的荧光发射光谱(λex=393nm,狭缝宽度为10/12),得到的荧光发射光谱如图2所示。横坐标为波长,纵坐标为荧光强度。从图2可以看出,中性条件下探针的最大发射波长为517nm。随着探针溶液ph值减小,最大发射波长从517nm处红移至555nm处,说明探针在酸性条件下被质子化,证明了此过程中存在ict机理。
探针溶液的紫外–可见吸收光谱和荧光发射光谱的归一化曲线图(λex=393nm,狭缝宽度为10/12)如图3所示。横坐标为波长。从图3可以看出,探针溶液的斯托克斯位移值(stokesshift)较大,为162nm,有利于减小激发干扰和荧光自吸收,减少电子转移过程中的能量损失。
探针溶液在λem=517nm处最大荧光强度随ph值变化(ph=2.59~7.50)的s曲线图(λex=393nm,狭缝宽度为10/12)如图4所示。横坐标为ph值,纵坐标为最大荧光强度。从图4可以看出,随着探针溶液酸性增加,探针的最大荧光强度逐渐减小。
在ph=2.59~7.50范围内,探针溶液在λem=517nm处荧光强度和ph值的线性关系图(λex=393nm,狭缝宽度为10/12)如图5所示。横坐标为ph值,纵坐标为荧光强度。从图5可以看出,探针在ph=4.5~6.5范围内的荧光强度(imax)与ph有良好的线性关系,且符合公式y=165.57271x-483.92282,r2=0.97046,说明探针在ph=4.5~6.5范围内可以定量检测溶液ph值。
在ph=2.59~7.50范围内,探针溶液在λem=517nm处荧光强度与此波长下最大荧光强度之比i/imax随ph变化的曲线(λex=393nm,狭缝宽度为10/12)如图6所示,横坐标为ph值,纵坐标为i/imax。从图6可以看出,当i/imax=0.5时,根据公式pka=ph±lg[(i–imin)/(imax–i)],计算出pka=4.98±0.42829。
在λem=517nm处ph=4.9和ph=7.1之间的荧光可逆光谱图(λex=393nm,狭缝宽度为10/12)如图7所示,横坐标为循环次数,纵坐标为荧光强度。从图7可以看出,重复7次ph值循环后,探针的荧光强度几乎保持不变,说明探针对h+的识别具有良好的可逆性。
在探针溶液中加入各种阴离子、阳离子,然后测试溶液在λem=517nm处荧光发射光谱(λex=393nm,狭缝宽度为10/12),得到阳离子对探针荧光发射光谱的干扰如图8所示。横坐标为各种离子,纵坐标为荧光强度。其中(1)空白、(2)k+(150mm)、(3)na+(150mm)、(4)ba2+(0.2mm)、(5)zn2+(0.2mm)、(6)ca2+(10mm)、(7)cd2+(0.2mm)、(8)co2+(0.2mm)、(9)pb2+(0.2mm)、(10)ni2+(0.2mm)、(11)mg2+(2mm)、(12)hg2+(0.2mm)、(13)fe2+(0.2mm)、(14)fe3+(0.2mm)、(15)al3+(0.2mm)、(16)i-(0.2mm)、(17)cl-(0.2mm)、(18)br-(0.2mm)、(19)co32-(0.2mm)、(20)hco3-(0.2mm)、(21)no2-(0.2mm)、(22)f-(0.2mm)、(23)no3-(2mm)。从图8可以看出,无论溶液中存在阴离子还是阳离子都不会对探针识别ph产生干扰,说明探针对ph的选择具有良好的专一性。
调节探针溶液的ph值分别为7.00、4.99、2.60,测试探针溶液在λem=517nm处荧光光谱时间稳定性(λex=393nm,狭缝宽度为10/12),得到的荧光光谱时间稳定性曲线图如图9所示。横坐标为时间,纵坐标为荧光强度。从图9可以看出,探针对ph的响应非常迅速,在测试时间2h内探针溶液在三个不同ph值下的荧光强度非常稳定,说明此探针可以在较长的时间内使用。
探针溶液在不同的ph条件下(ph=7.50~11.88)的紫外–可见吸收光谱图如图10所示。横坐标为波长,纵坐标为吸光度。从图10可以看出,中性条件下探针溶液在393nm波长处有最大吸收。随着探针溶液ph值增加,最大吸收波长红移至493nm处,并且在425nm处出现了等吸收点。
在不同的ph条件下(ph=7.50~11.88)探针溶液的荧光发射光谱图(λex=393nm,λem=517nm,狭缝宽度为10/12)如图11所示。横坐标为ph值,纵坐标为荧光强度。从图11可以看出,中性条件下探针的最大发射波长为517nm。随着探针溶液ph值增加,最大发射波长从517nm处红移至555nm处。
探针溶液的紫外–可见吸收光谱和荧光发射光谱的归一化图(λex=393nm,狭缝宽度为10/12)如图12所示。横坐标为波长。从图12可以看出,探针溶液的荧光发射光谱相比于紫外–可见吸收光谱产生了153nm的红移,说明探针的斯托克斯位移(stokesshift)值为153nm,斯托克斯位移较大,有利于减小激发干扰和电子转移过程中的能量损失。
探针溶液在λem=517nm处的最大荧光强度随ph值变化(ph=7.50~11.88)的s曲线图(λex=393nm,狭缝宽度为10/12)如图13所示。横坐标为ph值,纵坐标为最大荧光强度。从图13可以看出,随着探针溶液碱性增加,探针的最大荧光强度逐渐减小。
测试探针溶液在ph=7.50~11.88范围内在λem=517nm处的荧光强度与ph值之间的线性关系,得到的荧光强度与ph值之间的线性关系图(λex=393nm,狭缝宽度为10/12)如图14所示。横坐标为ph值,纵坐标为荧光强度。从图14可以看出,探针在ph=9.0~11.0范围内的荧光强度(imax)与ph有良好的线性关系,且符合公式y=1876.52602x-146.59352,r2=0.96623,说明探针在ph=9.0~11.0范围内可以定量的检测ph。
探针溶液在λem=517nm处ph=7.50和ph=11.83之间的荧光可逆光谱图(λex=393nm,狭缝宽度为10/12)如图15所示,横坐标为循环次数,纵坐标为荧光强度。从图15可以看出,重复七次ph值循环后,探针的荧光强度几乎保持不变,说明探针对h+的识别具有良好的可逆性。
再向探针溶液中加入各种离子,测试λem=517nm处荧光发射光谱(λex=393nm,狭缝宽度为10/12),得到各种离子对探针溶液荧光发射光谱的干扰如图16所示。横坐标为各种离子,其中(1)空白,(2)k+(150mm)、(3)na+(150mm)、(4)ba2+(0.2mm)、(5)zn2+(0.2mm)、(6)ca2+(10mm)、(7)cd2+(0.2mm)、(8)co2+(0.2mm)、(9)pb2+(0.2mm)、(10)ni2+(0.2mm)、(11)mg2+(2mm)、(12)hg2+(0.2mm)、(13)fe2+(0.2mm)、(14)fe3+(0.2mm)、(15)al3+(0.2mm)、(16)i-(0.2mm)、(17)cl-(0.2mm)、(18)br-(0.2mm)、(19)co32-(0.2mm)、(20)hco3-(0.2mm)、(21)no2-(0.2mm)、(22)f-(0.2mm)、(23)no3-(2mm);纵坐标为荧光强度。从图16可以看出,无论溶液中存在阴离子还是阳离子都不会对探针识别ph产生干扰,说明探针对ph的选择具有良好的专一性。
探针溶液在ph值分别为7.50、9.23、10.26条件下,λem=517nm处荧光光谱的稳定性曲线图如图17所示。横坐标为时间,纵坐标为荧光强度。从图17可以看出,探针对ph的响应非常迅速,在测试时间2h内探针溶液在三个不同ph值下的荧光强度非常稳定,说明此探针可以在较长的时间内使用。
实施例2:本实施例的苯并吲哚半菁衍生物ph荧光探针(bidd)的制备方法,按以下步骤进行:
一、依次向带有回流装置的50ml三口瓶中加入0.450g(2.0mmol)2,3,3–三甲基–3h–苯并[e]吲哚、0.800g(6.0mmol)2,4–二羟基苯甲醛、15.0ml无水乙醇和10.0ml质量分数为37%的浓盐酸,升温至(75~85℃)出现回流现象,并保持在回流温度下反应6~8h;在反应过程中采用tlc(展开剂v石油醚:v乙酸乙酯=1:1)跟踪反应进程,当硅胶板上出现新的产物点,且两种原料点消失时即停止反应。
二、将反应容器中的产物滴入到质量分数为60%的碳酸氢钠溶液中,调节ph值至7~7.4,然后加水,有固体析出,抽滤,滤饼用乙酸乙酯洗涤3次,在温度为90℃的烘箱中干燥8小时,得到苯并吲哚半菁衍生物ph荧光探针,该探针为深红色固体,缩写为bidd。
本实施例中苯并吲哚半菁衍生物ph荧光探针(bidd)的结构式为:
- 还没有人留言评论。精彩留言会获得点赞!
- 4‑乙烯基苯并环丁烯的合成方法与制造工艺
- 羟基苯并三唑衍生物和/或羟基吲唑衍生物作为塑料材料的阻燃剂的用途以及阻燃塑料材料模塑料的制造方法与工艺
- 扩展的非线性并苯衍生物和它们作为有机半导体的用途的制造方法与工艺
- 苯并双(噻二唑)衍生物、包含其的油墨、以及使用了其的有机电子装置的制造方法
- 具有含硫取代基的杀有害生物活性杂环衍生物的制造方法与工艺
- 具有含硫取代基的杀有害生物活性杂环衍生物的制造方法与工艺
- 一种苯并噻咯类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并二氮杂*衍生物的2-萘磺酸盐及晶型和它们的制备方法与制造工艺
- 靛红杂合喹唑啉类化合物合成的靛红衍生物及其在制备抗肿瘤药物中的应用的制造方法与工艺