利用HPLC检测硫酸氢氯吡格雷片溶出度的方法与流程
本发明涉及硫酸氢氯吡格雷片溶出度测定技术领域,具体涉及利用hplc检测硫酸氢氯吡格雷片溶出度的方法。
背景技术:
硫酸氢氯吡格雷片是由法国赛诺菲公司开发的一种血小板聚集抑制剂,于1997年首次经fda批准上市。硫酸氢氯吡格雷片的主要成分为硫酸氢氯吡格雷,其能选择性地抑制adp与血小板受体的结合,随后抑制激活adp与糖蛋白gpⅱb/ⅲa复合物,从而抑制血小板的聚集,主要用于预防和治疗因血小板高聚集状态引起的心、脑及其它动脉的循环障碍疾病。中国药典2015版中采用紫外分光光度法测定,但在做一致性评价的过程中,按照中国药典的方法配置的ph4.5溶出介质,采用药典中紫外分光光度法在240nm条件测定时,空白介质的吸光度一直不稳定,导致无法准确测定各个取样点的溶出度。
技术实现要素:
针对中国药典提供的紫外分光光度测定硫酸氢氯吡格雷片溶出度存在的技术问题,本发明提供一种利用hplc检测硫酸氢氯吡格雷片溶出度的方法,该方法可以克服空白介质的吸光度不稳定的问题,而且该方法的溶出介质含吐温80,在避免使用有机溶剂的同时增加硫酸氢氯吡格雷的溶解度,同时经过对该方法的一系列验证,其专属性强、结果准确、稳定性好,可以准确地测定硫酸氢氯吡格雷片在ph4.5溶出介质中的溶出度。
本发明所提供的技术方案具体如下:
一种利用hplc检测硫酸氢氯吡格雷片溶出度的方法,包括以下步骤:
(1)标准溶液的配制:取硫酸氢氯吡格雷标准品加甲醇溶解后,再用溶出介质依次稀释并分别配制成一系列浓度梯度的标准溶液;
(2)标准曲线的绘制:将步骤(1)所配制的标准溶液分别进行hplc检测,设定检测条件,根据峰面积与标准溶液浓度的对应关系分别建立标准曲线;
(3)硫酸氢氯吡格雷片供试品溶液的制备:按照中国药典2015版4部通则0931第二法依法操作,取硫酸氢氯吡格雷片置于溶出介质中,转速为每分钟50转,分别于5-60min的时间内选择各时间点取液并用0.45μm微孔滤膜滤过,作为供试品溶液;
(4)供试品溶液的测定:将步骤(3)所制备的供试品溶液分别进行hplc检测,设定检测条件,再分别通过峰面积及标准曲线计算出供试品溶液中硫酸氢氯吡格雷的浓度,然后计算出硫酸氢氯吡格雷片的溶出度;
其中,步骤(1)和步骤(3)中所用的溶出介质均为含0.1-0.3%吐温80的ph4.5醋酸缓冲液。
优选地,步骤(2)和步骤(4)的hplc检测条件如下:色谱柱为卵黏蛋白键合硅胶手性色谱柱;流动相为体积比为75-82:25-18的0.01mol/l磷酸二氢钾溶液和乙腈的混合溶液,柱温20-30℃;检测波长240nm;流速0.8-1.0ml/min。
优选地,所述0.01mol/l磷酸二氢钾溶液和乙腈的体积比为80:20。
优选地,所述柱温为25℃。
优选地,所述流速为1.0ml/min。
优选地,所述ph4.5醋酸缓冲液含吐温80的重量比为0.2%。
中国药典提供的紫外分光光度法在240nm条件测定时,空白介质的吸光度一直不稳定,导致无法准确测定硫酸氢氯吡格雷各个取样点的溶出度,本发明另辟蹊径,选择了hplc的方法,在该方法中,所采用的溶出介质含吐温80,提高了硫酸氢氯吡格雷的溶解度,能真实、准确测定硫酸氢氯吡格雷片在ph4.5溶出介质的溶出度,更有效的对药品质量进行对比控制,而且本发明所提供的的硫酸氢氯吡格雷测定方法专属性好、线性、精密度、稳定性试验等均符合分析要求。
附图说明
图1为硫酸氢氯吡格雷空白片、标准品和供试品溶液叠加色谱图;
图2为硫酸氢氯吡格雷标准品溶液的色谱图;
图3为硫酸氢氯吡格雷片供试品溶液的色谱图;
图4为硫酸氢氯吡格雷片的溶出曲线。
具体实施方式
下面结合具体实施例对本发明的技术方案做进一步的描述,同时对本发明的方法做了一系列验证。
1仪器与试剂
thermou3000型高效液相色谱仪;
agilent溶出仪(agilent);
硫酸氢氯吡格雷片(规格75mg/片,批号20170923);
硫酸氢氯吡格雷标准品(购自中检院,含量99.5%);
甲醇、乙腈为色谱纯(merk)。
2hplc法测定硫酸氢氯吡格雷片的溶出度
溶出度测定的检测色谱条件:色谱柱为卵黏蛋白键合硅胶手性色谱柱ultrones-ovm;流动相为0.01mol/l磷酸二氢钾溶液:乙腈(80:20),柱温25℃;检测波长240nm;流速1.0ml/min;
溶出度测定的步骤如下,以下均以含0.2%(重量体积比,单位是g/ml)吐温80的ph4.5醋酸缓冲液1000ml为溶出介质:
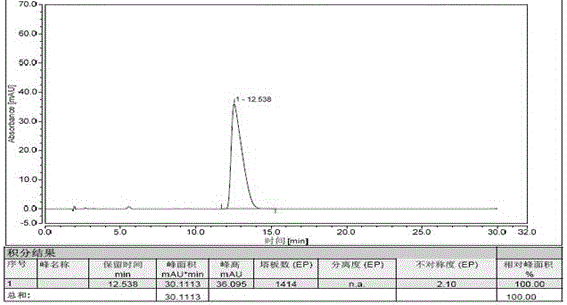
(1)取硫酸氢氯吡格雷标准品16.3mg,精密称定,置于50ml量瓶中,加甲醇溶解并定容,摇匀,精密量取该溶液10ml置于50ml量瓶中,加溶出介质稀释至刻度,摇匀,作为贮备液,依次稀释,分别配制成每1ml含氯吡格雷5.0µg/ml、12.5µg/ml、20µg/ml、25µg/ml、30µg/ml的一系列标准溶液;精密量取上述标准溶液各10µl注入液相色谱仪,记录色谱图,其中一个色谱图如图2所示;
结果表明,氯吡格雷在浓度为5.0µg/ml~30µg/ml时,浓度与峰面积呈线性,回归方程为y=20.56x+0.0042,线性相关系数r为1.0000,线性关系良好;
(2)取硫酸氢氯吡格雷片供试品12片,按照中国药典2015版4部通则0931第二法,以含0.2%(重量体积比,单位是g/ml)吐温80的ph4.5醋酸缓冲液1000ml为溶出介质,转速为每分钟50转,依法操作,分别于5min、12min、15min、20min、30min、45min、60min取溶液(补液模式)10ml,用0.45μm微孔滤膜滤过,作为供试品溶液;
(3)取硫酸氢氯吡格雷标准品适量,精密称定,加溶出介质溶解并定量稀释制成每1ml中含25μg硫酸氢氯吡格雷的溶液,作为标准品溶液。取标准品溶液和供试品溶液在以上色谱条件下进行测定分析,精密量取供试品溶液、标准品溶液各10μl,分别注入液相色谱仪,记录供试品溶液色谱图,其中一个色谱图如图3所示。按外标法计算各点的累计溶出量,结果见图4和表1。
表112片硫酸氢氯吡格雷片供试品的溶出度测定结果
3方法验证
3.1色谱条件
色谱柱为卵黏蛋白键合硅胶手性色谱柱ultrones-ovm;流动相为体积比为80:20的0.01mol/l磷酸二氢钾溶液和乙腈的混合溶液,柱温25℃;检测波长220nm;流速1.0ml/min。
3.2干扰性试验
取硫酸氢氯吡格雷片样品和空白片各1片,分别置于溶出杯内,按照上述的溶出度测定法操作,另取硫酸氢氯吡格雷标准品加流动相溶解并制成0.025mg/ml的标准品溶液。按“3.1色谱条件”分别进样10μl,结果表明硫酸氢氯吡格雷出峰处,空白片溶液无任何色谱峰出现,表明空白辅料与溶出介质对标准品溶液和供试品溶液的测定无干扰,结果见图1。
3.3线性试验
取硫酸氢氯吡格雷标准品16.3mg,精密称定,置于50ml量瓶中,加甲醇溶解并定容,摇匀,精密量取该溶液10ml置于50ml量瓶中,再加溶出介质稀释至刻度,摇匀,作为贮备液,依次稀释,分别配制成每1ml含硫酸氢氯吡格雷5.0µg/ml、12.5µg/ml、20µg/ml、25µg/ml、30µg/ml的一系列标准溶液。精密量取上述标准溶液各10µl注入液相色谱仪,记录色谱图。结果表明,硫酸氢氯吡格雷在浓度为5.0µg/ml~30µg/ml时,浓度与峰面积呈线性关系,回归方程为y=20.56x+0.0042,线性相关系数r为1.0000,线性关系良好。
3.4精密度试验
取浓度为0.025mg/ml的标准品溶液,重复进样6次,rsd为0.38%,符合精密度要求。
3.5稳定性试验
取“3.2项”下的供试品溶液,室温下放置0,2,4,6,8h分别进样测定峰面积,rsd=0.30%,表明供试品溶液在8h内基本稳定。
3.6回收率试验
分别取硫酸氢氯吡格雷标准品19.6,26.1,32.7mg,精密称定,置于100ml量瓶中,分别按处方量加入空白辅料,并用适量甲醇超声溶解后加溶出介质稀释至刻度,摇匀,滤过,精密量取续滤液1ml置于10ml量瓶中,再加溶出介质稀释至刻度,摇匀,按“3.1”项下色谱条件测定,按外标法计算回收率。结果表明,平均回收率为99.4%,rsd=0.70%(n=9)。
4讨论
鉴于硫酸氢氯吡格雷在ph4.5的介质中溶解度很低,本发明的溶出介质含0.2%(w/v)吐温80,在避免使用有机溶剂的同时增加硫酸氢氯吡格雷的溶解度,可使其在30min达到80%以上,便于与原研制剂的对比;该方法专属性好,稳定,能真实、准确测定硫酸氢氯吡格雷片在ph4.5溶出介质的各取样时间的溶出度,便于绘制其在ph4.5溶出介质中的溶出曲线,能够更有效地对药品质量进行对比研究。
最后所应说明的是:上述实施例仅用于说明而非限制本发明的技术方案,任何对本发明进行的等同替换及不脱离本发明精神和范围的修改或局部替换,其均应涵盖在本发明权利要求保护的范围之内。
- 还没有人留言评论。精彩留言会获得点赞!