量子点免疫荧光检测试剂条包含其的试剂盒及其应用的制作方法
本发明涉及生物检测技术领域,尤其是涉及一种量子点免疫荧光检测试剂条包含其的试剂盒及其应用。
背景技术:
现有核酸检测和ct影像学是新冠病毒感染者筛查的主要方法。其中,核酸检测假阴性率高、操作人员和场地设备要求高、检测时间长。ct检查其它病毒性肺炎鉴别性诊断难、易交叉感染、卫生经济学可操作性不强。更为重要的是,以上两种方法均无法实现现场快速、大规模筛查,现阶段急需开发灵敏度更高、可信度更强、操作更便捷的快速检测产品。
现有临床使用的新型冠状病毒抗体检测方法主要有酶联免疫法、化学发光法以及胶体金法。酶联免疫法和化学发光法可进行定量检测,是抗体检测的主要方法。胶体金法是一种即时检测(point-of-caretesting,poct)方法,具有快速、检测场地不受限制以及操作者要求低的优点,但胶体金法只能定性检测,与定量检测方法比较灵敏度和特异度欠佳。
目前,国内外商业化elisa、化学发光法和胶体金法covid-19抗体诊断产品主要包括总抗体以及igm、igg抗体联合检测试剂,然而各项检测方法特异性在96.6~99.7%之间,敏感性在66%~97.8%之间,该结果表明0.3%~3.4%被检者错误诊断为新冠肺炎,2.2%~34%的新冠肺炎患者漏检。同时,现有covid-19抗体检测试剂早期检出率低,无法达到精准防疫的目标。在低流行率人群中,现有的抗体测试可能产生和真实阳性结果一样多甚至更多的假阴性结果,造成不必要的人力物力浪费。
因此,研究开发一种量子点免疫荧光检测试剂盒,以提高早期诊断率和降低假阳性率,其临床意义重大。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一目的在于提供一种量子点免疫荧光检测试剂条,所述的试剂条采用量子点免疫层析技术,将新型冠状病毒n蛋白作为检测抗原,使用量子点荧光微球标记新型冠状病毒n蛋白抗体形成量子点特异性蛋白复合物,随后对患者的鼻咽拭子或口咽拭子进行检测。
本发明的第二目的在于提供一种量子点免疫荧光检测试剂盒,所述试剂盒包括上述量子点免疫荧光检测试剂条。
本发明的第三目的在于提供一种量子点免疫荧光检测试剂条或上述量子点免疫荧光检测试剂盒在新型冠状病毒检测中的应用。
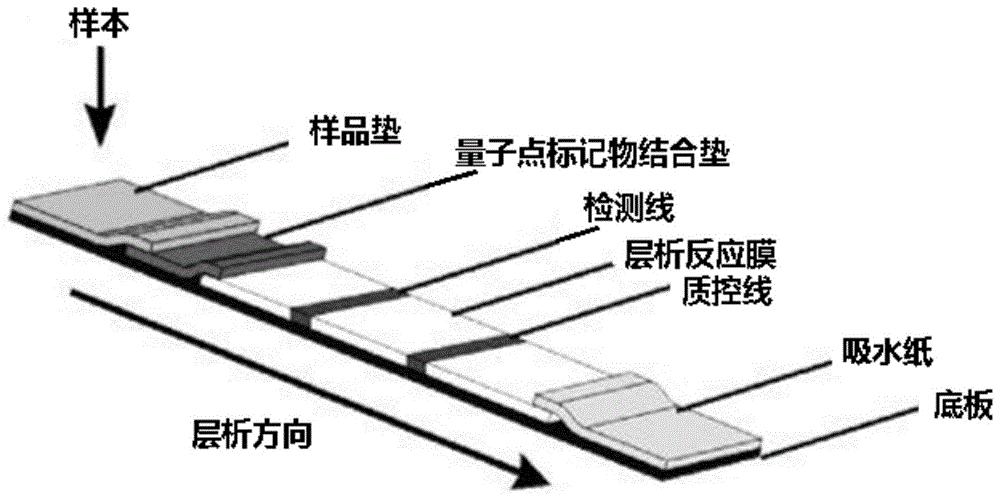
本发明提供的一种量子点免疫荧光检测试剂条,所述试剂条包括底板,底板上设置有样品垫、量子点标记物结合垫、层析反应膜和吸水纸;
其中,所述量子点标记物结合垫吸附有量子点特异性蛋白复合物,所述量子点特异性蛋白复合物主要由量子点和特异性蛋白偶联得到,所述特异性蛋白包括新型冠状病毒n蛋白;
所述层析反应膜上设置有检测线,所述检测线含有新型冠状病毒n蛋白抗体。
进一步的,所述层析反应膜设置于底板的中间,所述量子点标记物结合垫和样品垫依次搭接在层析反应膜的一端上,所述吸水纸搭接在层析反应膜的另一端上。
进一步的,所述新型冠状病毒n蛋白的氨基酸序列如seqno.01所示。
进一步的,所述层析反应膜上还设置有质控线。
进一步的,所述质控线含有羊抗兔igg抗体。
进一步的,所述新型冠状病毒抗原检测线中新型冠状病毒n蛋白抗体的浓度为0.2~2mg/ml。
进一步的,所述量子点标记物结合垫中量子点特异性蛋白复合物的浓度为0.001~0.01mg/ml。
进一步的,所述免疫荧光检测试剂条的检出限为15tcid50/ml,ct值为34.25。
本发明提供的一种量子点免疫荧光检测试剂盒,所述试剂盒包括上述量子点免疫荧光检测试剂条。
本发明提供的一种上述量子点免疫荧光检测试剂条或上述量子点免疫荧光检测试剂盒在新型冠状病毒检测中的应用。
与现有技术相比,本发明的有益效果为:
本发明提供的量子点免疫荧光检测试剂条,所述试剂条包括底板,底板上设置有样品垫、量子点标记物结合垫、层析反应膜和吸水纸;其中,所述量子点标记物结合垫吸附有量子点特异性蛋白复合物,所述量子点特异性蛋白复合物主要由量子点和特异性蛋白偶联得到,所述特异性蛋白包括新型冠状病毒n蛋白;所述层析反应膜上设置有检测线,所述检测线含有新型冠状病毒n蛋白抗体。上述试剂条采用量子点免疫层析技术,将新型冠状病毒n蛋白作为检测抗原,使用量子点荧光微球标记新型冠状病毒n蛋白抗体形成量子点特异性蛋白复合物,随后对患者的鼻咽拭子或口咽拭子进行检测。上述试剂条具有灵敏度高、特异度高以及可定量检测的优势,最大程度避免了弱阳性样本漏检和假阳性样本误检。同时本发明使用的量子点免疫层析法检测迅速,15分钟内出结果,使用血清检测样本可降低医护人员暴露风险,简单培训即可现场操作,而且每台便携式荧光检测仪1小时能检测上百个样本。
本发明提供的量子点免疫荧光检测试剂盒,所述试剂盒包括上述量子点免疫荧光检测试剂条。由上述试剂条的特性所决定,本申请试剂盒具有灵敏度高、特异度高以及可定量检测的优势,能够对新型冠状病毒抗原进行快速检测,同时能够最大程度避免了弱阳性样本漏检和假阳性样本误检。
本发明提供的上述量子点免疫荧光检测试剂条或上述量子点免疫荧光检测试剂盒可以广泛应用于新型冠状病毒的检测中。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例5提供的新型冠状病毒n抗原检测试剂条的结构示意图。
具体实施方式
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
根据本发明的一个方面,一种量子点免疫荧光检测试剂条,所述试剂条包括底板,底板上设置有样品垫、量子点标记物结合垫、层析反应膜和吸水纸;
其中,所述量子点标记物结合垫吸附有量子点特异性蛋白复合物,所述量子点特异性蛋白复合物主要由量子点和特异性蛋白偶联得到,所述特异性蛋白包括新型冠状病毒n蛋白;
所述层析反应膜上设置有检测线,所述检测线含有新型冠状病毒n蛋白抗体。
本发明提供的量子点免疫荧光检测试剂条,所述试剂条包括底板,底板上设置有样品垫、量子点标记物结合垫、层析反应膜和吸水纸;其中,所述量子点标记物结合垫吸附有量子点特异性蛋白复合物,所述量子点特异性蛋白复合物主要由量子点和特异性蛋白偶联得到,所述特异性蛋白包括新型冠状病毒n蛋白;所述层析反应膜上设置有检测线,所述检测线含有新型冠状病毒n蛋白抗体。上述试剂条采用量子点免疫层析技术,将新型冠状病毒n蛋白作为检测抗原,使用量子点荧光微球标记新型冠状病毒n蛋白抗体形成量子点特异性蛋白复合物,随后对患者的鼻咽拭子或口咽拭子进行检测。上述试剂条具有灵敏度高、特异度高以及可定量检测的优势,最大程度避免了弱阳性样本漏检和假阳性样本误检。同时本发明使用的量子点免疫层析法检测迅速,15分钟内出结果,使用血清检测样本可降低医护人员暴露风险,简单培训即可现场操作,而且每台便携式荧光检测仪1小时能检测上百个样本。
在本发明的一种优选实施方式中,所述层析反应膜设置于底板的中间,所述量子点标记物结合垫和样品垫依次搭接在层析反应膜的一端上,所述吸水纸搭接在层析反应膜的另一端上。
在本发明的一种优选实施方式中,所述新型冠状病毒n蛋白的氨基酸序列如seqno.01所示。
所述新型冠状病毒n蛋白的氨基酸序列如下:
msdngpqnqrnapritfggpsdstgsnqngersgarskqrrpqglpnntaswftaltqhgkedlkfprgqgvpintnsspddqigyyrratrrirggdgkmkdlsprwyfyylgtgpeaglpygankdgiiwvategalntpkdhigtrnpannaaivlqlpqgttlpkgfyaegsrggsqassrsssrsrnssrnstpgssrgtsparmagnggdaalalllldrlnqleskmsgkgqqqqgqtvtkksaaeaskkprqkrtatkaynvtqafgrrgpeqtqgnfgdqelirqgtdykhwpqiaqfapsasaffgmsrigmevtpsgtwltytgaiklddkdpnfkdqvillnkhidayktfpptepkkdkkkkadetqalpqrqkkqqtvtllpaadlddfskqlqqsmssadstqa(seqno.01);
在本发明的一种优选实施方式中,所述层析反应膜上还设置有质控线。
在上述优选实施方式中,所述质控线含有羊抗兔igg抗体。
在本发明的一种优选实施方式中,所述新型冠状病毒抗原检测线中新型冠状病毒n蛋白抗体的浓度为0.2~2mg/ml。
优选地,所述新冠蛋白特异性抗体包括新冠蛋白特异性抗体多克隆抗体(鼠源)、新冠蛋白特异性抗体单克隆抗体(鼠源)、新冠蛋白特异性抗体单克隆抗体(兔源)、新冠蛋白特异性抗体多克隆抗体(兔源)中的任意一种;
优选地,所述甲型流感病毒n蛋白抗体包括甲型流感病毒n蛋白抗体多克隆抗体(鼠源)、甲型流感病毒n蛋白抗体单克隆抗体(鼠源)、甲型流感病毒n蛋白抗体单克隆抗体(兔源)、甲型流感病毒n蛋白抗体抗体(兔源)中的任意一种;
优选地,所述乙型流感病毒n蛋白抗体包括乙型流感病毒n蛋白抗体多克隆抗体(鼠源)、乙型流感病毒n蛋白抗体单克隆抗体(鼠源)、乙型流感病毒n蛋白抗体单克隆抗体(兔源)、乙型流感病毒n蛋白抗体抗体(兔源)中的任意一种;
在上述优选实施方式中,所述层析反应膜包括nc膜、pvdf膜或尼龙膜中的任意一种;
在上述优选实施方式中,所述底板包括pvc底板、pc底板或ps底板中的任意一种;
在本发明的一种优选实施方式中,所述释放垫包括玻璃纤维膜、聚酯膜、滤血膜中的任意一种;
在本发明的一种优选实施方式中,所述样品垫包括玻璃纤维膜、聚酯膜、滤血膜中的任意一种;
在本发明的一种优选实施方式中,所述吸水纸包括厚滤纸、玻璃纤维或滤血膜中的一种。
在本发明的一种优选实施方式中,所述量子点标记物结合垫中量子点特异性蛋白复合物的浓度为0.001~0.01mg/ml。
在本发明的一种优选实施方式中,所述免疫荧光检测试剂条的检出限为15tcid50/ml,ct值为34.25。
根据本发明的一个方面,一种量子点免疫荧光检测试剂盒,所述试剂盒包括上述量子点免疫荧光检测试剂条。
本发明提供的量子点免疫荧光检测试剂盒,所述试剂盒包括上述量子点免疫荧光检测试剂条。由上述试剂条的特性所决定,本申请试剂盒具有灵敏度高、特异度高以及可定量检测的优势,能够对新型冠状病毒抗原进行快速检测,同时能够最大程度避免了弱阳性样本漏检和假阳性样本误检。
在本发明的一种优选实施方式中,所述量子点免疫荧光检测试剂盒还包括紫外照射装置。
根据本发明的一个方面,一种上述量子点免疫荧光检测试剂条或上述量子点免疫荧光检测试剂盒在新型冠状病毒检测中的应用。
本发明提供的上述量子点免疫荧光检测试剂条或上述量子点免疫荧光检测试剂盒可以广泛应用于新型冠状病毒的检测中。
下面将结合实施例对本发明的技术方案进行进一步地说明。
实施例1
制备得到抗体:
(1)、采用基因克隆技术,pcr扩增编码新型冠状病毒抗原n蛋白的基因;
(2)、将上述新型冠状病毒抗原n蛋白的基因转入大肠杆菌表达获得新型冠状病毒重组抗原n蛋白。
(3)、采用本领域常规方法利用上述新型冠状病毒重组抗原n蛋白制备得到新型冠状病毒n蛋白抗体。
所述抗体的制备方法,示例性的如下:
所需试剂:
小鼠骨髓瘤细胞株sp2/0为本公司保存;
balb/c小鼠为上海斯莱克动物中心提供;
peg1500、次黄嘌呤、胸腺嘧啶、氨基喋呤、dmso购自sigma公司;
hrp购自bbisolutions公司;
rpmi1640基础培养基购自gibco公司;
胎牛血清购自lonsasciencesrl公司;
羊抗鼠标记辣根过氧化酶、igm、igg1、igg2a、igg2b、igg3为serotec公司产品。
单抗制备:
按常规杂交瘤制备方法,选用6周龄的雌性balb/c小鼠(上海斯莱克动物中心),经皮下注射免疫目的蛋白,免疫剂量为100μg/只,初免用等量福氏完全佐剂,免疫加强用等量不完全福氏佐剂,加强免疫4次,免疫间隔2周,融合前3天静脉注射100μg蛋白。收集免疫小鼠的脾脏b细胞与小鼠骨髓瘤细胞株(sp2/0-ag14,sp2/0)用peg1500进行细胞融合,形成的杂交瘤细胞经过elisa检测、克隆化操作﹑腹水诱导和纯化获得单抗。单抗采用改良过碘酸钠法标记辣根过氧化酶(hrp)。
实施例2
制备层析反应膜(新冠病毒n蛋白抗原检测线):
将25cm宽的nc膜有贴在pvc底板中间区域,之后将实施例1得到的新型冠状病毒n蛋白抗体以及羊抗兔igg抗体分别用pbs稀释液稀释成0.2~2mg/ml并用喷金划膜仪划在nc膜相应的检测线区和质控线区。37℃烘箱12-24h烘干,封袋备用。
实施例3
制备量子点-标记蛋白复合物(特异性蛋白为新型冠状病毒n蛋白抗体):
(1)取200μl的量子点加入800μl的mes(ph6)缓冲液中,加入40~160μgedc和10~40μgnhs活化,37℃活化15-60min。将活化后的溶液在一定条件下离心,用移液枪去除上清。
(2)将步骤(1)离心后沉淀用1000μl的10~50mmmes(ph6)缓冲液复溶沉淀,若复溶不彻底可用超声协助复溶。将复溶后的溶液在一定条件下离心,用移液枪去除上清,1000μl的10~50mmmes(ph6)缓冲液复溶沉淀,若复溶不彻底可用超声协助复溶。
(3)向复溶溶液中加入20~100μl的已用10~50mmmes(ph6)缓冲液稀释成1mg/ml的新型冠状病毒n蛋白抗体,37℃偶联60-300min。
(4)偶联结束后加入100μl的20~100mmtris-hcl稀释液(ph8.0,含100~500mm甘氨酸+10%bsa)进行封闭,37℃封闭30~120min。
(5)将封闭好后的溶液在一定条件下离心,用移液枪去除上清。500-1000μltris-hcl稀释液复溶沉淀,若复溶不彻底可用超声协助复溶,继续在一定条件下离心,用移液枪去除上清(可省略此步骤)。500-1000μl的20~100mmtris-hcl稀释液(ph8.0)复溶沉淀,若复溶不彻底可用超声协助复溶,4℃保存,得到量子点-标记蛋白复合物。
制备量子点标记物结合垫(特异性蛋白为新型冠状病毒n蛋白抗体):
将上述制备好的量子点-标记蛋白复合物用20~100mmtris-hcl稀释液(ph8.0,含0.5%bsa,2%海藻糖)根据需求稀释3-30倍后用划膜喷金仪喷点于已处理释放垫上,37℃12~24h烘干,得到量子点标记物结合垫。或者将上述制备好的量子点-标记蛋白复合物用20~100mmtris-hcl稀释液(ph8.0,含0.5%bsa,2%海藻糖)根据需求稀释20-100倍后用移液枪喷点在未处理的释放垫上,再用涂布棒涂布均匀,最后放入冷冻干燥机冷冻干燥,待程序运行完毕后封袋备用。
实施例4
制备样品垫:
用移液枪和涂布棒将20~100mmtris-hcl稀释液(ph8.0,含0.5%bsa,0.5%pvp,0.5%tween-20)均匀涂布在未处理释放垫上,37℃12~24h烘干,封袋备用。
实施例5
如图1所示,一种新型冠状病毒n抗原检测试剂条,所述试剂条的制备方法包括以下步骤:
将实施例2制备得到的含有新冠病毒n蛋白抗原检测线的层析反应膜、实施例3制备得到的量子点标记物结合垫、实施例4制得的样品垫以及吸水纸搭接粘附在pvc背板上;
其中样品垫和量子点标记物结合垫依次搭接在层析反应膜的一端,吸水纸搭接在层析反应膜的另一端,然后调整切条机参数进行切条,切成宽3-4mm的试纸条。
实施例6
一种量子点免疫荧光检测试剂盒,所述试剂盒包括:实施例5特异性蛋白为新型冠状病毒n蛋白抗体的新型冠状病毒抗原检测试剂条;
和,紫外照射装置。
试验例1
选取实施例6制备得到的量子点免疫荧光检测试剂盒,进行最低检出限lod测定,具体实验方法如下:
(1)、通过限制性稀释法建立了新型冠状病毒(sarscov-2)抗原快速检测试剂盒(荧光法)的最低检测限。病毒样本浓度为3.0×105tcid50/ml。
(2)、将浓度为3.0×105tcid50/ml的起始病毒样本加入混合鼻咽拭子样本基质选取一个批次的抗原试剂,取100ul稀释样本加入实施例6制备得到的量子点免疫荧光检测试剂盒加样孔,每个梯度的样本重复3人份,15min后用干式免疫荧光仪读数。
(3)、选择最后一次梯度稀释的3份样本3次阳性结果和第一次梯度稀释的3份样本3次阴性结果之间的浓度范围。
(4)、在最后一次梯度稀释的3份样本3次阳性结果的浓度上再开展2倍梯度稀释测试。最后一次稀释显示100%阳性的浓度确认为lod,再开展20个同样的重复测试。
实验结果如下表所示:
由此可见,本发明实施例6制备得到的量子点免疫荧光检测试剂盒(荧光法)lod为15tcid50/ml,对应达安核酸检测ct34.25,具有非常好的检测灵敏性。
试验例2
对本申请实施例6制得的量子点免疫荧光检测试剂盒进行效果评测,具体方法如下:
(1)、样本处理:
a、咽拭子样本:取含有咽拭子样本的病毒保存液,与检测缓冲液1∶1充分混合;
b、痰液样本:痰液样本高速离心去除粗颗粒物后,取离心上清液与缓冲液1∶1充分混合;
c、肺泡灌洗液:取肺泡灌洗液与缓冲液1∶1混合;
d、粪便样本:取100mg粪便样本,加入1ml生理盐水中混匀,离心后取上清液,与缓冲液1∶1混合;
(2)、试剂板检测:
取100μl上一步骤制备的经缓冲液处理的样本,滴加到试剂板,15min后将测试卡按指示方向插入荧光免疫分析仪,选择相应批次试剂的测试项目,点击“快速测试”。
(3)、核酸检测:
参照新型冠状病毒2019-ncov核酸检测试剂盒(荧光pcr法)说明书操作并检测。
具体阳性试验结果:
以医院临床实验室诊断标准及试剂敏感性等为参考,按照荧光pcr的ct值>40和无扩增曲线的判定为阴性。以下将按照pcr的ct值结果进行分级统计测评。
新冠患者157例临床样本,其中137份痰液样本、15份咽拭子样本、3份肺泡灌洗液样本,2份粪便样本。
(一)、其中,样本ct≤35,总计127例,其中112份痰液样本、11份咽拭子样本、3份肺泡灌洗液样本、1份粪便样本。
由上表可知,本申请实施例6制得的量子点免疫荧光检测试剂盒的阳性符合率:96.06%;阴性符合率:100.00%;总符合率:98.56%(97.31%~99.81%);kappa值为:0.969。
(二)、其中,样本ct≤38,总计144例,其中126份痰液样本、13份咽拭子样本、3份肺泡灌洗液样本、2份粪便样本。
由上表可知,本申请实施例6制得的量子点免疫荧光检测试剂盒的阳性符合率:89.58%;阴性符合率:100.00%;总符合率:95.88%(93.84%~97.92%);kappa值为:0.912。
(三)、核酸低拷贝样本(35<ct≤38)的检出率:
pcr阳性样本共17例,试剂板共检出7例阳性,阳性检出率为41.18%。
由上述实验结果可知,本申请实施例6制得的量子点免疫荧光检测试剂盒与荧光pcr检测结果为参照,在所有测评样本类型中:
当样本ct≤35时,测评试剂(免疫层析法)的阳性符合率:96.06%,阴性符合率:100.00%,总符合率:98.56%;当样本ct≤38时,测评试剂(免疫层析法)的阳性符合率:89.58%,阴性符合率:100.00%,总符合率:95.88%。因此,本申请在痰液样本和咽拭子样本,当样本ct值≤35时,测评试剂具有较高的检出率。肺泡灌洗液和粪便样本检测数量少于20例,检测数据仅供参考,不具有统计学意义。
本实施例阳性样本的原始检测数据如下:
本实施例阴性样本的原始检测数据如下:
试验例3
对本申请实施例6的试剂盒进行特异性验证,具体实验方法如下:
(1)收集各种病原体培养株(见下表)和一定量的正常人咽喉拭子样本;
(2)用正常人的延后拭子样本稀释下表病原体至相应浓度(细菌、酵母菌、支原体、衣原体均稀释至1.0×106cfu/ml;病毒则均稀释至1.0×105pfu/ml或1.0×105tcid50/ml;人鼻腔冲洗液采用使用生理盐水冲洗鼻腔,收集冲洗液后同正常人鼻咽拭子样本1:1混合);
(3)选择三批试剂,取100ul样本加入加样孔,每个批次每个样本检测1人份,15min后用干式免疫荧光仪读数;
实验结果:
本次临床共检测27种病原体和人鼻腔冲洗液,与新型冠状病毒抗原均无交叉反应。证实本研发试剂与对照试剂对新型冠状病毒抗原在干扰样本存在的情况下,具有极强的一致性。
试验例4干扰实验:
实验步骤:
(1)、收集各种内源性物质和正常人咽喉拭子样本;
(2)、用正常人鼻咽拭子样本将下表干扰物稀释至对应浓度;
(3)、选择三批试剂,取100ul样本加入加样孔,每个批次每个样本检测1人份,15min后用干式免疫荧光仪读数;
实验结果:
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
sequencelisting
<110>杭州宝临生物科技有限公司
<120>量子点免疫荧光检测试剂条包含其的试剂盒及其应用
<160>1
<170>patentinversion3.5
<210>1
<211>419
<212>prt
<213>新型冠状病毒n蛋白
<400>1
metseraspasnglyproglnasnglnargasnalaproargilethr
151015
pheglyglyproseraspserthrglyserasnglnasnglygluarg
202530
serglyalaargserlysglnargargproglnglyleuproasnasn
354045
thralasertrpphethralaleuthrglnhisglylysgluaspleu
505560
lyspheproargglyglnglyvalproileasnthrasnserserpro
65707580
aspaspglnileglytyrtyrargargalathrargargilearggly
859095
glyaspglylysmetlysaspleuserproargtrptyrphetyrtyr
100105110
leuglythrglyproglualaglyleuprotyrglyalaasnlysasp
115120125
glyileiletrpvalalathrgluglyalaleuasnthrprolysasp
130135140
hisileglythrargasnproalaasnasnalaalailevalleugln
145150155160
leuproglnglythrthrleuprolysglyphetyralagluglyser
165170175
argglyglyserglnalaserserargserserserargserargasn
180185190
serserargasnserthrproglyserserargglythrserproala
195200205
argmetalaglyasnglyglyaspalaalaleualaleuleuleuleu
210215220
aspargleuasnglnleugluserlysmetserglylysglyglngln
225230235240
glnglnglyglnthrvalthrlyslysseralaalaglualaserlys
245250255
lysproargglnlysargthralathrlysalatyrasnvalthrgln
260265270
alapheglyargargglyprogluglnthrglnglyasnpheglyasp
275280285
glngluleuileargglnglythrasptyrlyshistrpproglnile
290295300
alaglnphealaproseralaseralaphepheglymetserargile
305310315320
glymetgluvalthrproserglythrtrpleuthrtyrthrglyala
325330335
ilelysleuaspasplysaspproasnphelysaspglnvalileleu
340345350
leuasnlyshisileaspalatyrlysthrpheproprothrglupro
355360365
lyslysasplyslyslyslysalaaspgluthrglnalaleuprogln
370375380
argglnlyslysglnglnthrvalthrleuleuproalaalaaspleu
385390395400
aspasppheserlysglnleuglnglnsermetserseralaaspser
405410415
thrglnala
- 还没有人留言评论。精彩留言会获得点赞!