一种调控玻璃化冷冻牛卵母细胞中钙离子浓度的方法与流程
本发明涉及牛卵母细胞超低温冷冻技术领域,具体地说,涉及一种调控玻璃化冷冻牛卵母细胞中钙离子浓度的方法。
背景技术:
哺乳动物卵母细胞的冷冻保存是保护物种资源多样性和拯救濒危动物的有效手段,也可以为体外受精、单精子注射和体细胞核移植等胚胎生物技术提供丰富的实验材料,使卵母细胞的供给和使用不受时间和空间的限制。因此,卵母细胞的冷冻保存具有非常重要的理论意义和实用价值,一直是低温生物学领域的研究热点和焦点。目前,由于玻璃化冷冻具有降温速度快、冷冻损伤低、操作简单等优点,已经成为卵母细胞冷冻保存的有效手段(larmanandgardner,2014)。
尽管哺乳动物卵母细胞的玻璃化冷冻保存取得很大进展(vajtaetal.,1998;dinnyésetal.,2000;houetal.,2005;zhaoetal.,2011),但其仍远远满足不了畜牧业生产和胚胎生物技术快速发展的需要。究其原因,主要是由于玻璃化冷冻能引起卵母细胞中ca2+浓度异常升高,进而导致皮质颗粒的提前释放,透明带硬化,受精率降低(larmaneta1.,2006,2007;tianetal.,2007;boglioloetal.,2012;nikiforakietal.,2014),严重影响了玻璃化冷冻卵母细胞应用范围。目前,玻璃化冷冻引起卵母细胞中ca2+浓度升高的机制还不十分清楚,更缺乏能够有效调控玻璃化冷冻卵母细胞中ca2+浓度,提高玻璃化冷冻牛卵母细胞受精能力的有效措施。
技术实现要素:
本发明的目的是提供一种有效调控玻璃化冷冻牛卵母细胞中钙离子浓度的方法,进而提高玻璃化冷冻牛卵母细胞的体外受精及发育能力。
为了实现本发明目的,本发明首先提供一种用于牛卵母细胞冷冻保存的玻璃化冷冻液,所述冷冻液中含有5-20μmbapta-am(钙螯合剂)和0.5-2μmrr(线粒体钙单向转运体抑制剂,钌红),用edfsf40液配制。其中,所述edfsf40液由eg(乙二醇)、dmso(二甲基亚砜)和fsf液按照体积比2﹕2﹕6组成。fsf液为含有30w/v%聚蔗糖70(ficoll70)、0.5m蔗糖和20%fbs(胎牛血清)的dpbs溶液,不含钙镁。
优选地,本发明的玻璃化冷冻液中bapta-am的浓度为5μm、10μm、20μm,rr的浓度为0.5μm、1μm、2μm。更优选地,bapta-am的浓度为10μm,rr的浓度为1μm。
本发明还提供一种用于牛卵母细胞冷冻保存的试剂组合,包括体外成熟液、含bapta-am的体外成熟液、预处理液、玻璃化冷冻液、解冻液以及含rr的体外成熟液。
所述体外成熟液为含有10μg/mlfsh(卵泡刺激素)、10μg/mllh(黄体生成素)、1μg/ml雌二醇和10%fbs的m199培养液。
所述含bapta-am的体外成熟液为含有5-20μmbapta-am的体外成熟液。优选地,bapta-am的浓度为5μm、10μm、20μm。更优选地,bapta-am的浓度为10μm。
所述预处理液为含有10%eg和10%dmso的dpbs溶液(不含钙镁)。
所述解冻液为含有0.15-0.25m蔗糖的dpbs溶液(不含钙镁)。优选地,所述解冻液为含有0.15m或0.25m蔗糖的dpbs溶液。
所述含rr的体外成熟液为含有0.5-2μmrr的体外成熟液。优选地,rr的浓度为0.5μm、1μm、2μm。更优选地,rr的浓度为1μm。
本发明还提供所述试剂组合在制备用于玻璃化冷冻保存牛卵母细胞的试剂盒中的应用。
本发明还提供bapta-am和rr在调控玻璃化冷冻牛卵母细胞胞内ca2+、线粒体ca2+水平,提高玻璃化冷冻牛卵母细胞的卵裂率、囊胚率、受精及发育能力中的应用。
本发明进一步提供一种调控玻璃化冷冻牛卵母细胞中钙离子浓度的方法,其是将体外成熟22h的牛卵母细胞置于含bapta-am的体外成熟液中孵育2h,然后采用ops法进行冷冻,解冻后在含rr的体外成熟液中恢复30min。
所述方法包括以下步骤:
1)将卵丘-卵母细胞复合体(cocs)置于体外成熟液中培养22h,然后用透明质酸酶脱去卵丘细胞,收集mii期卵母细胞,转入含bapta-am的体外成熟液中孵育2h;
2)将卵母细胞在预处理液中孵育30s,再转入玻璃化冷冻液中处理25s,然后装入ops管中直接投入液氮中冻存;
3)解冻时,将ops管从液氮中取出,将装有卵母细胞的部分迅速置于38.5℃含0.25m蔗糖的dpbs溶液中,用吸管将卵母细胞从ops管吹出放于38.5℃含0.25m蔗糖的dpbs溶液中1min,然后转入38.5℃含0.15m蔗糖的dpbs溶液中5min,进行解冻;
4)解冻后,将卵母细胞在含rr的体外成熟液中恢复30min。
在本发明的一个具体实施方式中,所述方法包括以下步骤:
s1、从屠宰场收集牛卵巢,保存于含75μg/ml青霉素和50μg/ml链霉素的35℃生理盐水中2h内送回实验室,从直径为2-8mm的卵泡中抽出卵丘-卵母细胞复合体,挑选至少有3层致密卵丘细胞的复合体清洗后用于体外成熟,约50个卵丘-卵母细胞复合体为一组置于盛有500μl体外成熟液、且表面覆盖有矿物油的4孔板(即每500μl成熟液中含有约50个cocs)中,于38.5℃、5%co2培养箱中培养22h,然后用透明质酸酶脱去卵丘细胞,收集mii期卵母细胞,转入含bapta-am的体外成熟液中在38.5℃、5%co2的培养箱中孵育2h;
s2、将卵母细胞在预处理液中孵育30s,再转入玻璃化冷冻液中处理25s,然后装入ops管中直接投入液氮中冻存;
s3、解冻时,将ops管从液氮中取出,将装有卵母细胞的部分迅速置于38.5℃含0.25m蔗糖的dpbs溶液中,用吸管将卵母细胞从ops管吹出放于38.5℃含0.25m蔗糖的dpbs溶液中1min,然后转入38.5℃含0.15m蔗糖的dpbs溶液中5min,进行解冻;
s4、解冻后,将卵母细胞在含rr的体外成熟液中恢复30min。
本发明中采用的ops管为两端开口式塑料管(i.m.v,莱格勒,法国),管壁厚0.02mm,体积0.25ml;所述ops管的一端被人工拉细,用来盛放卵母细胞,拉细一端ops管的顶端外直径为0.23mm。
研究表明,玻璃化冷冻会显著性提高牛卵母细胞中胞内ca2+水平、线粒体ca2+水平,rr、bapta-am处理能够显著降低冷冻卵母细胞中线粒体ca2+水平和胞内ca2+水平,且与新鲜对照组无显著性差异。进一步研究表明,玻璃化冷冻会使牛卵母细胞中cg分布异常、atp含量减少。将牛卵母细胞采用含有1μmrr的玻璃化冷冻液冷冻、冷冻后在含有1μmrr的体外成熟液中恢复30min,能够有效维持玻璃化冷冻牛卵母细胞中线粒体ca2+水平、atp含量正常,进而提供玻璃化冷冻牛卵母细胞孤雌激活后的发育能力。而将体外成熟22h的牛卵母细胞放入10μmbapta-am中孵育2h,然后采用含10μmbapta-am的玻璃化冷冻液进行冷冻,能够有效维持玻璃化冷冻牛卵母细胞中胞内ca2+水平、cg分布正常,进而提高玻璃化冷冻牛卵母细胞体外受精后的卵裂率。最终,将体外成熟22h的牛卵母细胞放入10μmbapta-am孵育2h,然后采用含10μmbapta-am和1μmrr的玻璃化冷冻液进行冷冻,解冻后在含1μmrr的体外成熟液中恢复30min,可使玻璃化冷冻牛卵母细胞的卵裂率、囊胚率、囊胚细胞数,以及体外受精能力、发育能力得到显著性提高。
本发明提供的玻璃化冷冻牛卵母细胞方法具有操作简单,成本低,对卵母细胞无毒无害,能有效保护冷冻卵母细胞的线粒体功能及其发育能力,这对于拓展冷冻卵母细胞的应用范围,具有重要的理论和实际意义,将在牛卵母细胞超低温冷冻研究领域发挥巨大作用。
附图说明
图1为本发明实施例1中牛卵母细胞线粒体ca2+染色图。其中,a:新鲜卵母细胞中线粒体ca2+水平;b:冷冻卵母细胞中线粒体ca2+水平。
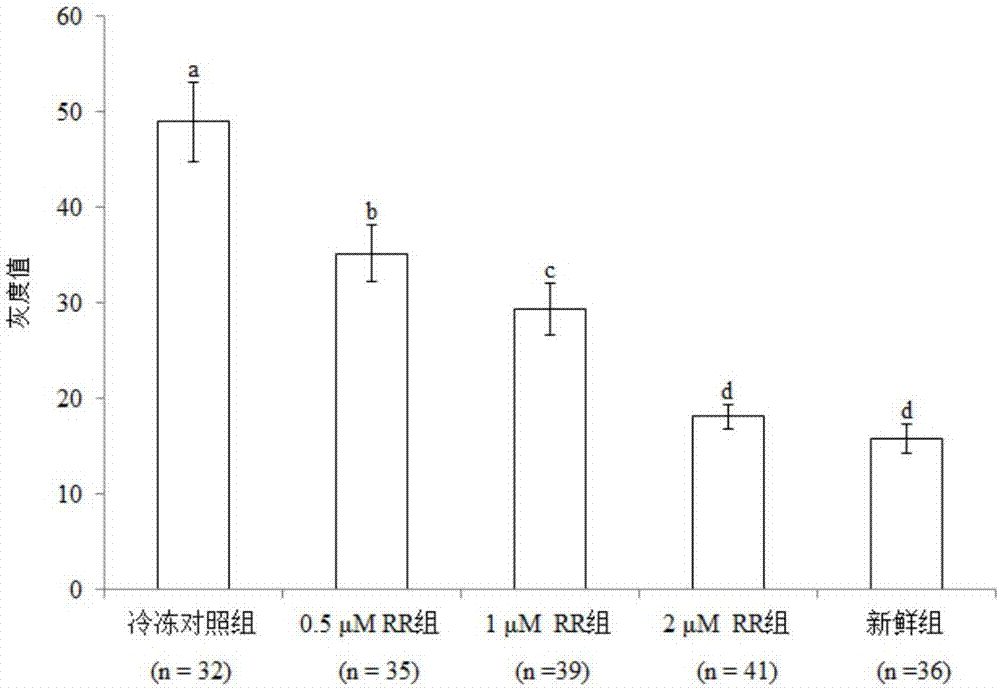
图2为本发明实施例1中rr处理对玻璃化冷冻牛卵母细胞线粒体ca2+的影响。其中,肩标不同小写字母表示差异显著(p<0.05)。
图3为本发明实施例1中atp测量过程中的标准曲线。
图4为本发明实施例1中rr处理对玻璃化冷冻牛卵母细胞atp含量的影响。
图5为本发明卵实施例1中卵母细胞胞内ca2+染色图。其中,a:正常情况下牛卵母细胞胞内ca2+浓度较低;b:玻璃化冷冻卵母细胞中胞内ca2+浓度显著升高。
图6为本发明实施例1中玻璃化冷冻对牛卵母细胞中胞内胞胞内ca2+的影响。
图7为本发明实施例1中牛卵母细胞中cg的染色图。其中,a:正常分布,cgs分布在胞质皮质区,呈环状分布。箭头:环状分布;b:异常分布,胞质中有大量分布,无环状分布。bar=20μm。
图8为本发明实施例1中牛卵母细胞精子穿卵染色图。其中,a:正常受精后形成雌、雄原核;b:异常受精后除雌、雄元原核外,还有未解聚的精子。bar=20μm。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
本发明中m199培养液购自gibcobrl公司(格兰德岛,纽约,美国),胎牛血清购自gibcobrldivision公司(格兰德岛,纽约,美国)。
实施例1rr、bapta-am处理对玻璃化冷冻牛卵母细胞体外受精能力的影响
1、卵母细胞的收集和体外成熟
牛卵母细胞从当地屠宰场收集,保存于含有75μg/ml青霉素和50μg/ml链霉素的35℃生理盐水中2h内送回实验室,从直径为2-8mm的卵泡中抽出卵丘-卵母细胞复合体,挑选至少有3层致密卵丘细胞的复合体清洗后用于体外成熟,50个卵丘-卵母细胞复合体为一组置于盛有500μl体外成熟液,且表面覆盖有矿物油的4孔板中,于38.5℃5%co2的培养箱内培养22-24h,然后用透明质酸酶脱去卵丘细胞,收集mii期卵母细胞,用于后续实验。。
体外成熟液:含有10μg/mlfsh、10μg/mllh、1μg/ml雌二醇和10%fbs的m199培养液。
2、ops管的制备
按照vajta等(1998)公开的方法,稍作改进制备ops管,0.25ml的塑料管(i.m.v,莱格勒,法国),高温变软后人工拉长,用显微控制仪测量使顶端外直径为0.23mm,管壁厚约0.02mm。
3、预处理和玻璃化冷冻液
预处理液:含有10%eg和10%dmso的dpbs溶液(不含钙镁)。
用于配制玻璃化冷冻液的edfsf40液:eg、dmso和fsf液按体积比2﹕2﹕6混匀。其中,fsf液:含有30w/v%聚蔗糖70、0.5m蔗糖和20%fbs的dpbs溶液,不含钙镁。
解冻液:含有0.15m或0.25m蔗糖的dpbs溶液。
4、卵母细胞的冷冻与解冻
卵母细胞在预处理液中孵育30s转入玻璃化冷冻液中处理25s,然后装入ops管中直接投入液氮中冻存。
解冻时,将ops管从液氮中取出,将装有卵母细胞的部分迅速溶于38.5℃含0.25m蔗糖的dpbs溶液中,用口吸管将卵母细胞从ops管吹出放于38.5℃含0.25m蔗糖的dpbs溶液中1min,然后转入38.5℃含0.15m蔗糖的dpbs溶液中5min。观察卵母细胞膜和透明带的完整性判断其存活情况。根据实验设计挑选存活的卵母细胞用于后续实验。
5、胞质ca2+水平检测
将卵母细胞置于10μmfluo-3/am中在38.5℃下孵育45min,然后用dbps/bsa液洗涤,最后在荧光显微镜下观察。利用nikonez-c1freeviewer分析荧光强度来反映胞质内ca2+的水平。所有操作均需在暗室中进行。
6、线粒体钙ca2+浓度测定
线粒体钙检测试剂盒购自美国杰美公司。线粒体ca2+浓度测定步骤如下:体外成熟液清洗卵母细胞3次,取300μla液放入1.5ml离心管中,并加入30μl染色液制成染色工作液;将清洗后的卵母细胞放入染色工作液中,室温(25℃)避光孵育30min,再放入37℃培养箱中孵育30min;用体外成熟液洗去细胞表面残余染色工作液,即刻封片后在激光共聚焦荧光显微镜下进行观察,激发波长550nm,散发波长590nm,线粒体ca2+呈现红色。采用图像分析软件(ez-c1freeviewer)进行荧光强度定量分析。
7、atp含量分析
采用vanblerkom等公开的方法,稍作改进分析atp数目,利用atp依赖性荧光素-荧光素酶,进行生物荧光分析(atp生物荧光分析,kithsii瑞士罗氏诊断股份有限公司,曼海姆,德国),测定荧光产生量定量测定atp数目。
将20μl细胞裂解试剂加到有20个卵母细胞的0.5ml离心管中,吹打混匀使这些细胞均匀地溶解。溶液中atp的浓度从0.01pm升至10.0pm,每个浓度分析一次,绘制一条标准曲线。atp待测液放到96孔板中平衡3-5min,随后分析标准液和样品发出的光,用光度计(infinitem200,tecan集团有限公司,奥地利)10s内即可测得。用连续稀释液的相对光强度绘制出一条标准曲线,从标准曲线上即可看出样品atp的浓度。
8、精子穿卵检测
精子穿卵检测:卵母细胞在含有精子的受精液中孵育12h后,在50μl0.1%的透明质酸酶中用口吸管吹打精子脱除干净。卵母细胞在固定液中4℃固定48h,用h33342染色9min,用脱色液脱去染色液,用指甲油封片。在相差显微镜测定细胞核状态。
9、体外受精
体外受精:冻精37℃水浴解冻,解冻后置于7ml洗精液中,轻轻混匀,1800rpm离心5min2次。离心后吸去上清,用受精液调整精子密度为5×106个/ml。吸取20μl精液加入含有20枚卵母细胞的80μl受精液中,在38.5℃、5%co2培养箱中进行体外受精。受精18-20h后,置于cr1aa中培养,培养48h后更换培养液(含10%fbs的cr1aa)。体外培养7d后,获得体外受精囊胚。
10、实验设计
(1)bapta-am处理对玻璃化冷冻牛卵母细胞胞内ca2+水平、cg分布和体外受精能力的影响
在cocs体外成熟过程中,在第22h时将其用透明质酸酶脱去卵丘细胞,选择胞质均匀的mii期卵母细胞,将卵母细胞分别移至含5μm、10μm、20μmbapta-am的体外成熟液中继续培养2h,而后分别用含5μm、10μm、20μmbapta-am的冷冻液进行玻璃化冷冻(先将卵母细胞在预处理液中孵育30s,再转入玻璃化冷冻液中处理25s,然后装入ops管中直接投入液氮中冻存),解冻后恢复30min,分别进行牛卵母细胞胞内ca2+水平、cg分布和精子穿卵能力、体外受精胚胎发育能力的检测。进而研究bapta-am处理对牛卵母细胞胞内ca2+、cg分布和体外受精能力的影响。
(2)rr处理对玻璃化冷冻牛卵母细胞中线粒体ca2+水平、atp含量和孤雌激活发育能力的影响
在cocs体外成熟24h后用透明质酸酶脱去卵丘细胞,选择胞质均匀的mii期卵母细胞,分别用含0.5μm、1μm、2μmrr的冷冻液进行玻璃化冷冻(先将卵母细胞在预处理液中孵育30s,再转入玻璃化冷冻液中处理25s,然后装入ops管中直接投入液氮中冻存),解冻后分别在含0.5μm、1μm、2μmrr的体外成熟液中恢复30min,进而研究rr处理对线粒体ca2+水平、atp含量和孤雌激活发育能力的影响。
(3)rr与bapta-am联合处理对玻璃化冷冻牛卵母细胞体外受精能力的影响
在cocs体外成熟过程中,在第22h时将其用透明质酸酶脱去卵丘细胞,选择胞质均匀的mii期卵母细胞,将卵母细胞移入含有10μmbapta-am的体外成熟液中继续培养2h,然后用含有10μmbapta-am和1μmrr的玻璃化冷冻液进行冷冻,解冻后放入含有1μmrr的体外成熟液中恢复30min,然后分别进行牛卵母细胞体外受精能力的检测。
13、数据统计
采用sas软件对实验数据进行分析,百分数比较时经反正旋转化后采用方差分析,结果以平均数依标准差表示,p<0.05为差异显著性标准。各处理组至少重复3次以上。
实验结果:
(一)rr处理对玻璃化冷冻牛卵母细胞中线粒体ca2+水平的影响
(1)不同浓度rr处理对玻璃化冷冻牛卵母细胞中线粒体ca2+水平的影响
牛卵母细胞线粒体ca2+染色图片见图1,新鲜牛卵母细胞(图1a)中线粒体ca2+浓度较低,而玻璃化冷冻对照组卵母细胞(图1b)中线粒体ca2+浓度较高。如图2所示,玻璃化冷冻组牛卵母细胞线粒体ca2+水平显著高于新鲜组(p<0.05);rr处理组线粒体ca2+水平均显著低于玻璃化冷冻组(p<0.05),其中0.5μm和1μm处理组仍显著高于新鲜组(p<0.05),而2μm组与新鲜组差异不显著(p>0.05)。
(2)rr处理对解冻后牛卵母细胞atp含量的影响
atp含量测定过程中绘制的标准曲线如图3所示,所得标准方程为:y=0.0049x+0.2133,标准曲线相关系数(r2)为0.9991。样品值除以样品数,即为每个卵母细胞中atp含量。如图4所示,玻璃化冷冻显著降低了牛卵母细胞中atp含量(p<0.05),rr处理组atp含量显著低于新鲜对照组(p<0.05),但显著高于冷冻对照组(p<0.05),且各处理组之间相互存在显著性差异(p<0.05)。
(3)rr处理对解冻后牛卵母细胞孤雌激活发育潜力的影响
如表1所示,卵母细胞孤雌激活后玻璃化冷冻组的卵裂率(72.22%)、囊胚率(23.08%)显著低于新鲜对照组(84.30%,41.18%;p<0.05),1μmrr处理组卵裂率(88.20%)、囊胚率(42.25%)与新鲜对照组(84.30%,41.18%)相比无显著性差异、但显著高于0.5μmrr处理组(77.18%,27.83%)。1μmrr处理组卵裂率(88.20%)显著性高于2μmrr处理组(79.29%)、但囊胚率两组(42.25%vs.34.23%)之间无显著性差异。1μmrr处理效果高于2μmrr,原因可能是由于2μmrr浓度较高,进而产生的毒性作用所致。
表1rr处理对玻璃化冷冻牛卵母细胞发育潜力的影响
注:同列数据肩标不同小写字母表示差异显著(p<0.05)。
(二)bapta-am处理对玻璃化冷冻牛卵母细胞胞内ca2+水平、cg分布和体外受精能力的影响
(1)bapta-am处理对玻璃化冷冻牛卵母细胞胞内ca2+和cg分布的影响
卵母细胞中胞内ca2+的染色如图5所示,正常情况下牛卵母细胞胞内ca2+浓度较低(图5a),玻璃化冷冻卵母细胞中胞内ca2+浓度显著升高(图5b)。如图6所示,新鲜对照组胞内ca2+浓度显著性低于玻璃化冷冻对照组,bapta-am各组胞内ca2+水平均显著低于玻璃化冷冻组(p<0.05),其中5μm处理组仍显著高于新鲜组(p<0.05),而10μm、20μm处理组与新鲜组差异不显著(p>0.05)。
卵母细胞cg的染色如图7示,正常情况下cg分布在胞质皮质区呈现环状分布(图7a),异常情况下cg从皮质区提前释放进入胞质内(图7b)。如表2所示,玻璃化冷冻组cg正常分布率(56.25%)显著性低于新鲜对照组(86.11%),bapta-am处理后cg正常分布率均显著提升(65.85%,75.56%,84.21%,86.11%),且10μmbapta-am冷冻组(75.56%)、20μmbapta-am冷冻组(84.21%)cg正常分布率与新鲜对照组(86.11%)无显著性差异。
表2bapta-am处理对玻璃化冷冻牛卵母细胞cg分布的影响
注:同列数据肩标不同小写字母表示差异显著(p<0.05)。
(2)bapta-am处理对玻璃化冷冻牛卵母细胞精子穿卵能力的影响
精子穿卵染色如图8所示,正常受精后卵母细胞中形成雌、雄原核(图8a),异常受精后卵母细胞中除雌、雄原核外,还有未解聚的精子(图8b)。如表3所示,玻璃化冷冻组正常受精率(60%)显著低于新鲜对照组(87.5%;p<0.05),10μmrr冷冻组正常受精率(84.85%)显著高于5μmrr冷冻组(63.33%)和20μmrr冷冻组(70.97%),且与新鲜对照组(87.5%)无显著性差异。
表3bapta-am处理对玻璃化冷冻牛卵母细胞体外受精能力的影响
注:同列数据肩标不同小写字母表示差异显著(p<0.05)。
(3)bapta-am处理对玻璃化冷冻牛卵母细胞体外受精效率的影响
实验结果如表4所示,冷冻对照组体外受精卵裂率(41.63%)、囊胚率(12.37%)显著低于新鲜对照组(75%,34.09%)。rr处理组中,10μmrr冷冻组卵裂率(65.73%)显著高于冷冻对照组(41.63%)、5μmrr冷冻组(52.54%)、20μmrr冷冻组(49.73%),但与新鲜对照组(75%)无显著性差异。各组之间囊胚率无显著性差异(11.96%-15.71%)、均显著性低于新鲜对照组(34.09%)。
表4bapta-am处理对玻璃化冷冻牛卵母细胞体外受精能力的影响
注:同列数据肩标不同小写字母表示差异显著(p<0.05)。
(三)rr与bapta-am联合处理对玻璃化冷冻牛卵母细胞体外受精能力的影响
经过rr、bapta-am前期实验,确定1μmrr和10μmbapta-am进行联合处理实验。实验结果如表5所示,冷冻对照组的卵裂率(58.24%)、囊胚率(10.53%)显著低于新鲜对照组(83.55%,34.72%;p<0.05),rr、bapta-am联合处理组的卵裂率(79.42%)、囊胚率(29.09%)显著性高于冷冻对照组(58.24%%,10.53%%;p<0.05)
表5rr与bapta-am联合处理对玻璃化冷冻牛卵母细胞体外受精效率的影响
注:同列数据肩标不同小写字母表示差异显著(p<0.05)。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
参考文献
[1]larmanmg,gardnerdk.ultrarapidvitrificationofmouseoocytesandembryos.methodsmol.biol.2014;1092:153-165.
[2]vajtag,holmp,kuwayamam,boothpj,jacobsenh,grevet,callesenh.openpulledstraw(ops)vitrification:anewwaytoreducecryoinjuriesofbovineovaandembryos.mol.reprod.dev.1998;51(1):53-58.
[3]dinnyésa1,daiy,jiangs,yangx.highdevelopmentalratesofvitrifiedbovineoocytesfollowingparthenogeneticactivation,invitrofertilization,andsomaticcellnucleartransfer.biol.reprod.2000.63(2):513-518.
[4]houyp,daiyp,zhuse,zhuhb,wuty,gonggc,wanghp,wangll,liuy,lir,wanr,lin.bovineoocytesvitrifiedbytheopenpulledstrawmethodandusedforsomaticcellcloningsupporteddevelopmenttoterm.theriogenology.2005;64(6):1381-1391.
[5]zhaoxm,duwh,wangd,haohs,liuy,qint,zhuhb.effectofcyclosporinepretreatmentonmitochondrialfunctioninvitrifiedbovinematureoocytes.fertil.steril.2011;95(8):2786-2788.
[6]larmanmg,katz-jaffemg,sheehancb,gardnerdk.1,2-propanediolandthetypeofcryopreservationprocedureadverselyaffectmouseoocytephysiology.hum.reprod.22(1):2007;250-259.
[7]larmanmg,sheehancb,gardnerdk.calcium-freevitrificationreducescryoprotectant-inducedzonapellucidahardeningandincreasesfertilizationratesinmouseoocytes.reproduction.2006;131(1):53-61.
[8]tiansj,yancl,yanghx,zhougb,yangzq,zhuse.vitrificationsolutioncontainingdmsoandegcaninduceparthenogeneticactivationofinvitromaturedovineoocytesanddecreasespermpenetration.anim.reprod.sci.2007;101(3-4):365-371.
[9]bogliolol,leddas,innocenzip,ariuf,bebbered,rosatii,leonigg,piccininim.ramanmicrospectroscopyasanon-invasivetooltoassessthevitrification-inducedchangesofovineoocytezonapellucida.cryobiology.2012;64:267-272.
[10]nikiforakid,vandenmeerschautf,qianc,decrooi,luy,deroot,vandenabbeele,heindryckxb,desutterp.oocytecryopreservationandinvitrocultureaffectcalciumsignallingduringhumanfertilization.hum.reprod.2014;29(1):29-40。
- 还没有人留言评论。精彩留言会获得点赞!