一种常温保存的细胞冻存液及其应用的制作方法
本发明涉及细胞培养
技术领域:
,具体的,本发明涉及了一种可以常温保存的适于单个核细胞的无血清细胞冻存液及其制备方法和应用。
背景技术:
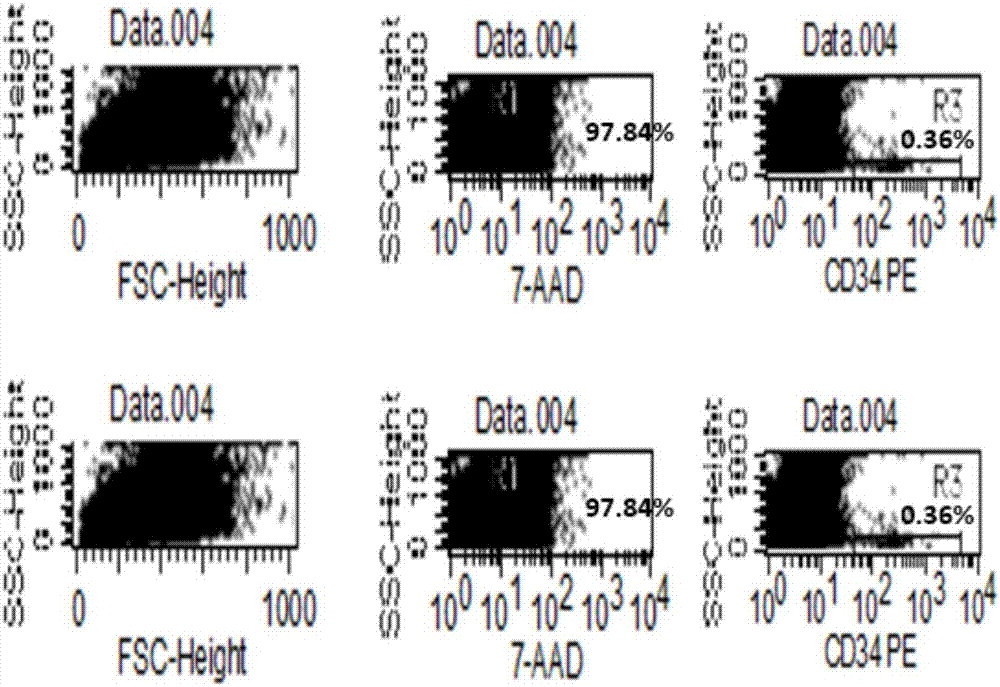
:单个核细胞,一般指的是脐带血和外周血中的只有一个细胞核的细胞,包括淋巴细胞、树突状细胞、单核细胞和造血干细胞等等。单个核细胞中的造血干细胞经常用于造血干细胞移植;同时单个核细胞在体外也可经细胞因子刺激诱导成不同的免疫细胞,多种细胞因子诱导的杀伤细胞(cytokine-inducedkiller,cik)和自然杀伤细胞(naturalkillercell,nk)等,在临床治疗抗肿瘤方面也具有重大的用途。在细胞培养技术广泛用于科学研究和临床治疗的令天,细胞的冷冻保存技术和解冻复苏技术显得日益重要。细胞冷冻保存是指将细胞保存在超低的温度中。细胞的生化反应极其缓慢甚至停止,但经过长期低温保存,在复苏后仍能保存正常的结构和功能。经不断的摸索研究证明,细胞在-196℃的液氮超低温条件下保存,是目前最佳的冷冻保存温度。因为在-196℃时,细胞的生命活动几乎完全停止,但复苏后细胞的结构和功能完好。细胞在没有冻存保护剂的情况下,直接冻存,细胞会随着温度的降低,细胞内外的水分结冰,所形成的冰晶会造成细胞膜和细胞器的破坏而死亡,造成细胞冻存失败。细胞冻存过程中加入了冷冻保护剂,则可保护细胞免受冰晶损伤。因为冷冻保护剂容易同溶液中的水分子结合,从而降低冰点,减少冰晶的形成,是细胞冷冻保存成功。冷冻保护剂根据其是否穿透细胞膜可分为渗透性和非渗透性两类。渗透性冷冻保护剂可以渗透到细胞内,一般是一些小分子物质,主要包括甘油、dmso、乙二醇、丙二醇、乙酰胺、甲醇等。非渗透性冷冻保护剂不能渗透到细胞内,一般是些大分子物质,主要包括聚乙烯吡咯烷酮(pvp)、蔗糖、聚乙二醇、葡聚糖、白蛋白以及羟乙基淀粉(hes)等。目前最常用的冷冻保护剂是dmso。虽然细胞在冷冻情况下,细胞的新陈代谢极其缓慢,但仍需要一定的营养物质或能量来消耗以维持基本活性。所以现在大多数细胞冻存液会加入胎牛血清(fbs)、培养基、人血清,白蛋白等。由于胎牛血清(fbs)可能携带动物源性病毒的风险,人血清也有可能含有人源病毒,培养基含有各种离子等问题,使目前冻存液的临床使用有种种限制和不方便。目前有些冻存液,需要在使用前配制终浓度为2倍浓度,放置2-8℃冰箱中预冷一段时间或长期保存,使用时再取出,用溶液重悬细胞后,再加入等量的2倍冻存液,使冻存液终浓度为1倍。该操作不能实现冻存液的现配现用,并且长期低温储存都导致操作繁琐,不利于产品质量控制,易发生污染,易发生失误等问题。因此,本领域还需要一种更便于储存和使用,并且改善用其冻存和复苏效果的细胞,特别是适合单个核细胞的复苏率和生存率的细胞冻存液。技术实现要素:本发明的宗旨在于解决以上所述的现有技术缺陷,提供一种可以现配现用或常温保存下使用的细胞无血清冻存液,特别是适合用于单个核细胞的细胞无血清冻存液。本发明的细胞冻存液和方法进行冷冻和复苏的细胞复苏后的细胞复苏率和生存率很高,并保存良好的细胞活性。具体的,本发明提供了一种无血清细胞冻存液,其特征在于,包括以下组分:质量体积比约30~40g/l的右旋糖酐。在本发明的其中一个方面,本发明提供了一种无血清细胞冻存液,其特征在于,包括以下组分:体积百分数约10%的二甲基亚砜;质量体积比约2.5g/l的葡萄糖;质量体积比约30~40g/l的右旋糖酐;质量体积比约6~12g/l的羟乙基淀粉;体积百分数约25~45%的复方电解质溶液。在本发明的其中又一个方面,上述本发明的无血清细胞冻存液中右旋糖酐质量体积比为约30-35g/l。在本发明的其中一个方面,所述无血清细胞冻存液按体积分数计包括以下组分:约10%的二甲基亚砜;约30~40%的质量体积比为100g/l的右旋糖酐溶液;约10~20%的质量体积比为60g/l的羟乙基淀粉溶液;约5%的质量体积比为50g/l的葡萄糖水溶液;余量为约25~45%复方电解质溶液。在本发明的其中又一个方面,所述无血清细胞冻存液中右旋糖酐溶液的溶质可以为0.9%氯化钠溶液。在本发明的其中又一个方面,所述无血清细胞冻存液中右旋糖酐为低分子右旋糖酐,例如右旋糖酐40。在本发明的其中又一个方面,所述无血清细胞冻存液中羟乙基淀粉溶液的溶质可以为0.9%氯化钠溶液。在本发明中使用的复方电解质溶液(或称为复方电解质注射剂)是临床上常用试剂,通常作为水、电解质的补充源,其含有的电解质成分与血液和血液成分相容,可在输血前或输血后输注,或作为血细胞的稀释液。在本发明的其中又一个方面,在本发明中使用的复方电解质溶液可具有以下组分:每1000ml含氯化钠5.26g,葡萄糖酸钠5.02g,醋酸钠3.68g,氯化钾0.37g,氯化镁0.30g;或是每1000ml含氯化钠2.34g,氯化钾0.75g,乳酸钠2.24g,葡萄糖27.00g。在本发明的其中又一个方面,所述无血清细胞冻存液适合用于冻存单个核细胞,例如为脐带血单个核细胞或外周血单个核细胞。在本发明的其中又一个方面,所述无血清细胞冻存液适合用于冻存单个核细胞经诱导形成的细胞,例如为杀伤细胞或自然杀伤细胞。在本发明的其中一个方面,所述无血清细胞冻存液适于现配现用。在本发明的其中又一个方面,所述无血清细胞冻存液适于常温保存。本申请的发明人出乎意料地发现,本发明的细胞冻存液无论是现配现用的还是在常温保存后取出马上使用,都能获得良好的效果,避免了使用细胞冻存液操作中在冻存细胞之前的预冷的步骤,提高了工作效率,并且证明经其冷冻和复苏的细胞的复苏率和生存率很高,并保存良好的细胞活性。因此本发明的无血清细胞冻存液不受低温保存的限制,可以在常温条件下保存或者运输,对本领域具有重要的实践意义。在不受特定理论的局限的情况下,发明人认为是因为本发明的无血清细胞冻存液含有特定范围的高浓度的右旋糖酐,在有效提高细胞渗透压,将细胞质的水分吸出,降低细胞在冻存过程中形成的冰晶的同时,又能够避免过高浓度的右旋糖酐引起的细胞聚集和破坏,从而在整体上提高细胞的复苏存活率和保持活性。在本发明的其中又一个方面,提供了上述本发明的无血清细胞冻存液在细胞的冻存和/或冻存后复苏中的应用。在本发明的其中又一个方面,所述细胞为单个核细胞,例如为脐带血单个核细胞或外周血单个核细胞。在本发明的其中又一个方面,所述细胞为单个核细胞经诱导形成的细胞,例如为杀伤细胞或自然杀伤细胞。在本发明的其中一个方面,提供了一种单个核细胞(例如脐带血和外周血单个核细胞)的冻存方法,其特征在于包括以下步骤:(1)分离得到单个核细胞;(2)配制如前所述的本发明的无血清细胞冻存液;(3)用所述无血清细胞冻存液重悬单个核细胞,然后分装于冻存管中,经程序降温后在低温中冷冻保存。在本发明的其中又一个方面,上述单个核细胞的冻存方法中,在步骤3之前,将步骤2配置得到的单个核细胞冻存液常温保存。在本发明的其中又一个方面,上述单个核细胞的冻存方法还包括将冻存的单个核细胞复苏的步骤。在本发明的其中又一个方面,上述单个核细胞的冻存方法的步骤(3)的细胞冻存过程中,所述单个核细胞的密度为1×106/~5×107/ml。在本发明的其中一个方面,提供了上述本发明的无血清细胞冻存液的制备方法,其包括将以下组分混合的步骤:按体积分数计,约10%的二甲基亚砜;约30~40%的质量体积比为100g/l的右旋糖酐溶液;约10~20%的质量体积比为60g/l的羟乙基淀粉溶液;约5%的质量体积比为50g/l的葡萄糖水溶液;余量为约25~45%复方电解质溶液。在本发明的其中又一个方面,上述制备方法在常温下进行。优选的,制备得到的无血清细胞冻存液可直接用于细胞的冻存和/或冻存后复苏。在本发明的其中一个方面,还提供了根据本发明的上述单个核细胞(例如脐带血和外周血单个核细胞)的冻存方法冻存和复苏后得到的单个核细胞、或所述单个核细胞经诱导分化得到的杀伤细胞或自然杀伤细胞、或采用发明的无血清细胞冻存液对所述单个核细胞经诱导分化得到的杀伤细胞或自然杀伤细胞进行冻存和复苏后的杀伤细胞或自然杀伤细胞在制备用于治疗肿瘤的药物中的用途。本发明的细胞冻存液无论是现配现用的还是在常温保存后取出马上使用,经其冷冻和复苏的细胞的复苏率和生存率很高,并保存良好的细胞活性。例如,将脐带血和外周血单个核细胞用本发明的细胞冻存液冷冻和复苏后保持了良好的活性,在诱导后能够高效地分化成杀伤细胞或自然杀伤细胞,并且所述杀伤细胞或自然杀伤细胞能够有效地杀伤肿瘤细胞。本文中出现的“约”,体现在生产或配置过程中具体操作与理论计算数值直接存在的可接受的差别。一般来说,本领域的技术人员能够理解,“约”是表示,例如±0.01、±0.05、±0.1、±0.5、±1、±2、±5、或±10。附图说明图1为单个核细胞使用示例性的不同组分本发明冻存液和冻存方法冻存的细胞的活率;图2脐带血单个核细胞使用示例性的本发明冻存液和冻存方法冻存前和冻存后的活率和cd34+检测结果;图3使用示例性的本发明冻存液和冻存方法的外周血单个核细胞复苏扩增的cik细胞图片40x;图4使用示例性的本发明冻存液和冻存方法冻存的脐带血单个核细胞复苏扩增的cik细胞图片40x;图5使用示例性的本发明冻存液和冻存方法冻存的外周血单个核细胞复苏扩增的nk细胞图片40x;图6使用示例性的本发明冻存液和冻存方法冻存的脐带血单个核细胞复苏扩增的nk细胞图片40x;图7使用示例性的本发明冻存液和冻存方法冻存的外周血单个核细胞复苏扩增的cik表面标识物检测图;图8使用示例性的本发明冻存液和冻存方法冻存的脐带血单个核细胞复苏扩增的cik表面标识物检测图;图9使用示例性的本发明冻存液和冻存方法冻存的外周血单个核细胞复苏扩增的nk表面标识物检测图;图10使用示例性的本发明冻存液和冻存方法冻存的脐带血单个核细胞复苏扩增的nk表面标识物检测图。具体实施方式下面利用具体实施例子进一步介绍本发明实施例1人外周血单个核细胞的分离方法采集来自志愿者(均签署知情同意书)的人抗凝外周血。使用淋巴细胞分离液分离人外周血的单个核细胞,包括以下步骤:1.1取样全血计数,用移液管将抗凝的外周血转移至50ml的离心管中,900g离心15分钟。1.2离心完后,取上清血浆进行56℃热失活,离心取上清备用。沉淀血细胞,加入0.9%氯化钠注射稀释后(血液体积:稀释液:淋巴细胞分离液为1:1:1),充分混匀后缓慢的加入至到已经分装有15ml淋巴细胞分离液的50ml离心管中,使界面清晰。1.3700g离心20分钟。1.4离心后,小心轻拿,此时已经可以看到离心管中间有一层白细胞层,用吸管小心吸出中间的白细胞层,转移至另一离心管中。1.5将吸出的白细胞层加入0.9%氯化钠注射液进行洗涤,600g离心10分钟。1.6离心后,去上清,则得到外周血的单个核细胞。实施例2可常温保存的无血清细胞冻存液的配制发明冻存液1:按体积百分数计,将10%的二甲基亚砜、20%右旋糖酐40注射液,10%的羟乙基淀粉注射液,5%的葡萄糖注射液,余量为复方电解质注射液,制备得到无血清细胞冻存液。发明冻存液2:按体积百分数计,将10%的二甲基亚砜、25%右旋糖酐40注射液,10%的羟乙基淀粉注射液,5%的葡萄糖注射液,余量为复方电解质注射液,制备得到无血清细胞冻存液。发明冻存液3:按体积百分数计,将10%的二甲基亚砜、30%右旋糖酐40注射液,10%的羟乙基淀粉注射液,5%的葡萄糖注射液,余量为复方电解质注射液,制备得到无血清细胞冻存液。发明冻存液4:按体积百分数计,将10%的二甲基亚砜、35%右旋糖酐40注射液,10%的羟乙基淀粉注射液,5%的葡萄糖注射液,余量为复方电解质注射液,制备得到无血清细胞冻存液。发明冻存液5:按体积百分数计,将10%的二甲基亚砜、40%右旋糖酐40注射液,10%的羟乙基淀粉注射液,5%的葡萄糖注射液,余量为复方电解质注射液,制备得到无血清细胞冻存液。其中右旋糖酐40注射液(hospirainc,货号0409-7419-14):右旋糖酐-40质量体积比为100g/l,0.9%氯化钠溶液。其中羟乙基淀粉注射液(hospirainc,货号0409-7248-143):羟乙基淀粉质量体积比为60g/l,0.9%氯化钠溶液。其中葡萄糖注射液(浙江都邦,国药准字:h33021289):含葡萄糖50g/l的葡萄糖水溶液。其中复方电解质注射液(四川科伦,国药准字h20113476),其组分为:每1000ml含氯化钠5.26g、葡萄糖酸钠5.02g、醋酸钠3.68g、氯化钾0.37g、氯化镁0.30g。对比冻存液1按体积百分数计,将10%的二甲基亚砜、10%的右旋糖酐40注射液,5%的葡萄糖注射液,75%的fbs(gibco,货号:10100-147-fbs)混合均匀,制备得到对比细胞冻存液1。对比冻存液2:按体积百分数计,将10%的二甲基亚砜、2%右旋糖酐40注射液,5%的葡萄糖注射液,83%的复方电解质注射液,制备得到对比细胞冻存液2。对比冻存液3:按体积百分数计,将10%的二甲基亚砜、5%的葡萄糖注射液,30%的羟乙基淀粉注射液,55%的复方电解质注射液,制备得到对比细胞冻存液3。实施例3无血清细胞冻存液中右旋糖酐40注射液浓度比例的影响1.按实施例2配置发明冻存液1-5,即其中含右旋糖酐40注射液分别为20%、25%、30%、35%、40%v/v。2.在外周血单个核细胞沉淀中加入冻存液,使细胞浓度为1×106/ml,用移液器轻慢速吸打混匀。3.将细胞悬液分装于冻存管内,每管1ml。4.在冻存管上贴好标签,包括样本编号、细胞数量、冻存液批号、冻存日期、操作者等相关信息。5.放置冻存管于装有异丙醇的程序降温盒中,于-80℃冰箱保存4h-12h,次日移入液氮罐。6.细胞冻存一个月后,复苏细胞检测活率。检测结果如图1所示。图1纵坐标是复苏细胞的活率。结果显示,对于单个核细胞的冻存液里面的右旋糖酐,在30-35%的浓度范围内,冻存复苏后的细胞活率最高。实施例4单个核细胞冻存测试(冻存液即配即用)4.1人外周血单个核细胞的冻存人脐带血或外周血单个核细胞冻存方法,具体的步骤为:1、实验启动前按实施例2配置发明冻存液3、发明冻存液4和发明冻存液5,配置后立刻进行下一步。2、取实施例1分离得到的外周血单个核细胞沉淀。3、向单个核细胞沉淀中加入冻存液使细胞浓度为1×107~5×107/ml,用移液器轻慢速吸打混匀。4、将细胞悬液分装于冻存管内,每管1ml。5、在冻存管上贴好标签,包括样本编号、细胞数量、冻存液批号、冻存日期、操作者等相关信息。6、放置冻存管于装有异丙醇的程序降温盒中,于-80℃冰箱保存4h-12h,次日移入液氮罐。4.2人外周血单个核细胞的复苏单个核细胞的复苏,具体方法如下:1、等待恒温水浴箱温度升高至37℃;从液氮中取出细胞冻存管,立即投入37℃温水中轻轻晃动,边晃动便用指尖轻弹冻存管,直至冰块溶解。2、用无尘布蘸取75%乙醇擦拭冻存管消毒;打开冻存管盖子,在冻存管中缓慢滴加4℃预冷培养基1ml,轻轻吹打混匀,放置5min左右。3、转入盛有10ml预冷培养基培养基的离心管中,300g离心10min,弃上清液;4、用5ml移液管加入预冷培养基5ml,轻轻吹打混匀悬液,取样0.3ml进行计数。4.3计算细胞总数和活率,并统计冻存复苏对细胞的损耗率。按照实施例2的发明冻存液3-5和对比冻存液1-3的配方,分别用4.1和4.2的方法和流程制备冻存和复苏10个批次的单个核细胞(10批外周血)。对冻存和复苏后的细胞进行计算细胞总数和活率,并统计冻存复苏对细胞的损耗率。计数结果显示,采用本发明的发明冻存液3、发明冻存液4和发明冻存液5复苏后的细胞的复苏活率平均为94%以上,细胞损耗率在20%以内,冻存效果优良,详情见表1。对冻存的单个核细胞进行了冻存前后的细胞活率和cd34+检测比较,如图1和图2所示,冻存后的活率为95.27%,cd34+为0.44,与冻存前无明显差异。采用现配现用方式准备的对比冻存液1-3细胞的复苏活率和细胞损耗率都显著不如采用本发明的冻存液。表1检测项目冻存前总数复苏后总数损耗率复苏活率发明冻存液33x1072.71x1079.6%96.7%发明冻存液43x1072.55x10715%94.9%发明冻存液53x1072.64x10712%95.8%对比冻存液13x1071.53x10749%78.8%对比冻存液23x1071.35x10755%83.4%对比冻存液33x1071.48x10750.3%86.7%实施例5单个核细胞冻存测试(冻存液配置常温保存三个月后使用)5.1人外周血单个核细胞的冻存人外周血单个核细胞冻存方法,具体的步骤为:1、实验启动前两个月提前按实施例2配置发明冻存液3、发明冻存液4和发明冻存液5。2、取实施例1分离得到的外周血单个核细胞沉淀。3、向单个核细胞沉淀中加入冻存液使细胞浓度为1×107~5×107/ml,用移液器轻慢速吸打混匀。4、将细胞悬液分装于冻存管内,每管1ml。5、在冻存管上贴好标签,包括样本编号、细胞数量、冻存液批号、冻存日期、操作者等相关信息。6、放置冻存管于装有异丙醇的程序降温盒中,于-80℃冰箱保存4h-12h,次日移入液氮罐。5.2人外周血单个核细胞的复苏单个核细胞的复苏,具体方法如下:1、等待恒温水浴箱温度升高至37℃;从液氮中取出细胞冻存管,立即投入37℃温水中轻轻晃动,边晃动便用指尖轻弹冻存管,直至冰块溶解。2、用无尘布蘸取75%乙醇擦拭冻存管消毒;打开冻存管盖子,在冻存管中缓慢滴加4℃预冷培养基1ml,轻轻吹打混匀,放置5min左右。3、转入盛有10ml预冷培养基培养基的离心管中,300g离心10min,弃上清液;4、用5ml移液管加入预冷培养基5ml,轻轻吹打混匀悬液,取样0.3ml进行计数。5.3计算细胞总数和活率,并统计冻存复苏对细胞的损耗率。按照实施例2的发明冻存液3-5和对比冻存液1-3的配方,分别用5.1和5.2的方法和流程制备冻存和复苏10个批次的单个核细胞(10批外周血)。对冻存和复苏后的细胞进行计算细胞总数和活率,并统计冻存复苏对细胞的损耗率。计数结果显示,采用本发明的发明冻存液3、发明冻存液4和发明冻存液5分别冻存2个月的10个批次外周血的单个核细胞复苏后的细胞,使用本发明的保存在常温两个月的冻存液,细胞复苏活率平均为90%以上,细胞损耗率在20%以内,冻存效果优良,详情见表2。而对比冻存液,明显不适合常温保存。表2检测项目冻存前总数复苏后总数损耗率复苏活率发明冻存液33x1072.51x10716.33%92.45%发明冻存液43x1072.61x10713%91.33%发明冻存液53x1072.49x10717%95.8%对比冻存液13x1071.13x10762.33%64.8%对比冻存液23x1071.05x10765%75.4%对比冻存液33x1071.09x10763.67%78.7%实施例6复苏后单个核细胞诱导为cik细胞单个核细胞向cik细胞诱导实验,具体方法如下:1、将实施例5冻存后复苏的单个核细胞后,加入1640培养基,使细胞密度为2×106/ml,重悬细胞沉淀,接种于t75细胞培养瓶中,在第1天加入rhifn-r1000u/ml和10%自体血浆,然后放于37℃、5%co2培养箱内培养。2、培养24小时后,向培养液中加入rhil-2500u/ml、cd3mcab50ng/ml后,继续培养。3、以后每三天补充新鲜培养液一次,并补加rhil-2。4、第14天,观察细胞状态,收集cik细胞,结果见附图3和图4(图3和图4分别为外周血和脐带血来源的单个核细胞冻存复苏后扩增的cik显微镜照片,40倍),细胞状态非常好,细胞增殖的细胞团很多。并对于扩增后的cik进行细胞表面抗原cd3+cd8+、cd3+cd56+检测,以及针对肿瘤细胞的杀伤活性实验。5、流式检测结果显示,cik细胞培养14天后,外周血单个核细胞扩增的cd3+cd8+为62.23%,cd3+cd56+细胞为26.05%;脐带血单个核细胞扩增的cd3+cd8+为85.02%,cd3+cd56+细胞为28.05%(图7和图8);显示诱导效果良好。6、cik对肿瘤细胞黑色素瘤,乳腺癌、膀胱癌细胞的杀伤活性,在杀伤细胞和靶细胞在20:1的时候,其杀伤活性都在70-90%,效果良好,结果见表3。表3cik/肿瘤细胞黑色素瘤细胞乳腺癌细胞膀胱癌细胞效靶比1:2072.53%86.74%%81.89%实施例7复苏后单个核细胞诱导为nk细胞单个核细胞向nk细胞诱导实验,具体方法如下:1、将实施例4冻存后复苏的单个核细胞,加入1640培养基,使细胞密度为2×106/ml,重悬细胞沉淀,接种于t75细胞培养瓶中,在第1天加入500-2000u/mlil-2、5-50ng/mlil-21、5-50ng/mlil-15和10%自体血浆,然后放于37℃、5%co2培养箱内培养。2、培养24小时后,向培养液中加入rhil-2500u/ml、cd3mcab50ng/ml后,继续培养。3、以后每三天补充新鲜培养液一次,并补加相应的因子和血浆。4、第14天,收集nk细胞,观察细胞状态(图5和图6分别为外周血和脐带血来源的单个核细胞冻存复苏后扩增的nk显微镜照片,40倍),细胞状态非常好,细胞增殖的细胞团很多。并对于扩增后的nk进行细胞表面抗原cd3-cd16+cd56+检测,以及针对肿瘤细胞的杀伤活性实验。4、流式检测结果显示,nk细胞培养14天后,外周血单个核细胞扩增的cd3-cd16+cd56+为30.49%;脐带血单个核细胞扩增的cd3-cd16+cd56+为35.88%(图9和图10),显示诱导效果良好。5、nk对肿瘤细胞k562的杀伤活性,在nk对k562细胞比例为20:1时,其杀伤率可达到68.96%,显示其杀伤活性良好的检测结果见表4。表4nk/k562重复1重复2重复3均值杀伤率(效靶比1:20)71.35%66.21%69.33%68.96%实施例8将实施例6和实施例7扩增后的cik或nk细胞加入发明冻存液4,冻存一个月后复苏进行检测活率。冻存和复苏操作如实施例4的4.1和4.2的方法和流程。如表5所示,冻存后的高密度cik免疫细胞活率均值为89%,nk免疫细胞活率均值为91.5%,现实其冻存效果很好。表5冻存细胞重复1重复2重复3均值cik91.61%87.28%89.58%89.49%nk86.61%92.11%87.89%88.87%上面是对本发明进行的说明,不能将其看成是对本发明进行的限制。除非另外指出,本发明的实践将使用有机化学、聚合物化学、生物技术等的常规技术,显然除在上述说明和实施例中所特别描述之外,还可以别的方式实现本发明。其它在本发明范围内的方面与改进将对本发明所属领域的技术人员显而易见。根据本发明的教导,许多改变和变化是可行的,因此其在本发明的范围之内。如无特别表示,本文中出现的温度的单位“度”是指摄氏度,即℃。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1