薏苡再生植株的制备方法及所用培养基与流程
本发明涉及生物技术领域中,薏苡再生植株的制备方法及所用培养基。
背景技术:
薏苡(coixlacryma-jobil.)在植物分类学上为禾本科薏苡属,又称草珠子、川谷、薏米、六谷子、药玉米、薏仁米等,原产我国及老挝、缅甸等东南亚一带,在中国至少有6000~10000年的栽培驯化史。薏苡的传统利用方式是作为保健食品和药用植物,《本草纲目》和《本草经疏》等医学名著中均有以薏苡治疗湿疹、风湿性关节炎、扁平疣等症的记载。近年来,人们从薏苡中提取的薏苡仁油和薏苡仁酯,已开始用来治疗癌症等病症,其中以薏苡作为主要原料生产的康莱特注射液和薏辛除湿止痛胶囊已在市场上销售。
薏苡为雌雄同株的异花授粉作物,该属多为2倍体,染色体数为2n=20,仅有少部分材料为4倍体2n=40。我国云南、四川、贵州、广西等地,是薏苡的起源地之一,野生薏苡资源十分丰富,常分布于河边、塘边、沼泽地、未开垦荒地等潮湿地带,存在丰富的形态和遗传变异,具有优异的耐湿性和良好的抗病性。自然状态下,野生薏苡通过种子和根茎两种方式繁殖,薏苡为碳4植物,具备高产的生物学基础,大多分蘖旺盛,植株高大,茎叶繁茂,在广西、云南和湖南等地农民,多把当地野生薏苡作为优良饲草直接利用。除此之外,在广西柳州、云南西双版纳等少数民族地区,至今仍有采摘野生薏苡种子、根、茎等作为中药的习惯,但未见利用野生薏苡选育新型牧草的研究。
自2000年以来,四川农业大学玉米研究所在国内外率先开展了利用野生薏苡选育多年生饲草的研究。先后在野生薏苡的起源地——我国的滇、川、贵等地和老挝、缅甸、越南等东南亚国家,广泛进行了野生薏苡种质资源的收集、整理、保存工作,建立了薏苡种质资源圃,系统开展了薏苡农艺性状、繁殖特性、遗传特点、抗逆性、饲用特性及抗病虫性的鉴定和评价等方面的研究。从中选育出综合性状优良、多年生、营养价值高的饲用型薏苡新品种-大黑山薏苡,于2016年12月通过四川省草品种审定委员会审定,并于2017年参加了国家牧草区域试验。在此基础上,以二倍体大黑山薏苡(2n=20)和四倍体水生薏苡(2n=40)为亲本,进行远源杂交,得到了一份体细胞染色体数为30的三倍体薏苡(2n=30),表现为抗逆性突出,长势旺盛,营养体发达,草产量优于双亲,将此株系命名为丰牧88,于2017年通过四川省草品种审定委员会审定。
薏苡的再生体系是通过愈伤组织进行诱变育种和功能基因验证的前提和基础。前人在薏苡再生体系诱导中的外植体、愈伤诱导培养基、愈伤分化培养基和培养条件等方面做了一定研究,但依然存在愈伤组织诱导率低、愈伤组织继代困难、继代后分化能力低等问题,尚缺乏系统的研究。尤其是近30年来,薏苡体外再生体系的研究,几乎没有新的进展,处于停滞不前的状态。
技术实现要素:
本发明所要解决的技术问题是如何制备薏苡再生植株。
为解决上述技术问题,本发明首先提供了薏苡再生植株的制备方法,所述方法包括:
1)在愈伤诱导培养基上培养薏苡芽,得到胚性愈伤组织;
2)在分化培养基上培养所述胚性愈伤组织,得到再生芽;
3)在生根培养基上培养所述再生芽,得到薏苡再生植株。
上述方法中,所述薏苡芽可为薏苡种子萌发后得到的芽,即薏苡种子萌发后得到的非种子、非根的组织。
所用薏苡芽可为无菌芽。所述无菌芽可通过在无菌环境中培养薏苡无菌种子得到。所述无菌种子可利用8%次氯酸钠溶液消毒得到。所述8%次氯酸钠溶液的有效氯含量为8%。所述8%次氯酸钠溶液由溶剂和溶质组成,溶剂为水,溶质及其在所述8%次氯酸钠溶液中的浓度为8g/100ml。利用8%次氯酸钠溶液对薏苡种子进行消毒的时间可为20分钟。
所述薏苡芽具体可为薏苡种子萌发后第2-5天的芽。进一步,所述薏苡芽可为薏苡种子萌发后第4天的芽。所述薏苡芽的长度可为0.5cm。
上述方法中,所述愈伤诱导培养基由溶剂和溶质组成,所述溶剂为ms培养基,所述溶质为naa和2,4-d;所述愈伤诱导培养基中naa的浓度为1mg/l,2,4-d的浓度为a1)、a2)或a3):
a1)1-4mg/l;
a2)1-3mg/l;
a3)1-2mg/l。
所述分化培养基由溶剂和溶质组成,所述溶剂为ms培养基,所述溶质为头孢霉素、6-ba和激动素;所述分化培养基中头孢霉素、6-ba和激动素的浓度分别为250mg/l、2mg/l和2mg/l。
所述生根培养基由溶剂和溶质组成,所述溶剂为1/2ms培养基,所述溶质为iba,所述生根培养基中iba的浓度为0.5mg/l;所述1/2ms培养基为将ms培养基中各溶质的浓度减半得到的培养基。
所述愈伤诱导培养基的ph值可为5.8-6.0。所述愈伤诱导培养基的ph值可为5.8。
所述分化培养基的ph值可为5.8-6.0。所述分化培养基的ph值具体可为5.8。
所述生根培养基的ph值可为5.8-6.0。所述生根培养基的ph值具体可为5.8。
上述方法中,步骤1)中培养的条件可为:光照强度为3000-3500lx,和/或,温度为25-28℃,和/或,光周期为光照16h/黑暗8h。步骤1)中培养的条件具体可为:光照强度为3000lx,和/或,温度为27℃,和/或,光周期为光照16h/黑暗8h。
步骤2)中培养的条件可为:光照强度为3000-3500lx,和/或,温度为25-28℃,和/或,光周期为光照12h/黑暗12h。步骤2)中培养的条件具体可为:光照强度为3000lx,和/或,温度为27℃,和/或,光周期为光照16h/黑暗8h。
步骤3)中培养的条件为:光照强度为3000-3500lx,和/或,温度为25-28℃,和/或,光周期为光照16h/黑暗8h。步骤3)中培养的条件具体可为:光照强度为3000lx,和/或,温度为27℃,和/或,光周期为光照16h/黑暗8h。
所述方法还可包括对所述胚性愈伤组织继代。
上述方法中,所述继代可在所述愈伤诱导培养基或继代培养基上进行;所述继代培养基可为向所述愈伤诱导培养基中添加硫酸铜或硝酸银得到的培养基。
上述方法中,所述继代培养基中硫酸铜或硝酸银的添加量可为0.85mg/l培养基。
所述继代的条件可为:光照强度为3000-3500lx,温度为25-28℃,光照周期为:光照16h,黑暗8h。所述继代的条件具体可为:光照强度为3000lx,温度为27℃,光照周期为:光照16h,黑暗8h。
本发明还提供了下述m1)或m2)或m3)的方法:
m1)薏苡胚性愈伤组织的诱导方法,包括:在所述愈伤诱导培养基上培养所述薏苡芽,得到薏苡胚性愈伤组织;
m2)薏苡胚性愈伤组织的分化方法,包括:在所述分化培养基上培养薏苡胚性愈伤组织,得到薏苡再生芽;
m3)薏苡胚性愈伤组织的继代方法,包括:在所述继代培养基中培养薏苡胚性愈伤组织,实现薏苡胚性愈伤组织的继代。
m1)中培养所述薏苡芽的条件可为:光照强度为3000-3500lx,和/或,温度为25-28℃,和/或,光周期为光照16h/黑暗8h。步骤1)中培养的条件具体可为:光照强度为3000lx,和/或,温度为27℃,和/或,光周期为光照16h/黑暗8h。
m2)中培养薏苡胚性愈伤组织的条件可为:光照强度为3000-3500lx,和/或,温度为25-28℃,和/或,光周期为光照12h/黑暗12h。步骤2)中培养的条件具体可为:光照强度为3000lx,和/或,温度为27℃,和/或,光周期为光照16h/黑暗8h。
m3)中培养薏苡胚性愈伤组织的条件可为:光照强度为3000-3500lx,温度为25-28℃,光照周期为:光照16h,黑暗8h。所述继代的条件具体可为:光照强度为3000lx,温度为27℃,光照周期为:光照16h,黑暗8h。
本发明还提供了下述y1)或y2)或y3)或y4)的试剂:
y1)培养基,为所述愈伤诱导培养基、所述分化培养基、所述生根培养基或所述继代培养基;
y2)成套培养基,由所述愈伤诱导培养基和所述分化培养基组成;
y3)成套培养基,由所述愈伤诱导培养基、所述分化培养基和所述生根培养基组成;
y4)成套培养基,由所述愈伤诱导培养基、所述分化培养基、所述生根培养基和所述继代培养基组成。
y2)、y3)和y4)所述成套培养基均可用于薏苡植株再生。
本发明还提供了下述x1)-x3)中任一所述的应用:
x1)所述试剂在制备薏苡再生植株中的应用;
x2)所述试剂在薏苡遗传转化中的应用;
x3)所述薏苡再生植株的制备方法,或所述薏苡胚性愈伤组织的诱导方法,或所述薏苡胚性愈伤组织的分化方法,或所述薏苡胚性愈伤组织的继代方法在薏苡遗传转化中的应用。
本发明中,各培养基均为无菌培养基。
本发明的薏苡再生植株的制备方法解决了目前薏苡愈伤组织诱导率低、愈伤组织继代困难、继代后分化能力低等问题,可在较短的时间内获得薏苡的体外再生植株,又可进行遗传转化,具有更广泛的应用前景。
附图说明
图1为利用薏苡叶片诱导愈伤组织。(a)、(b)分别为薏苡叶片接种后第4d和第7d的情况。
图2为利用薏苡根尖诱导愈伤组织。(a)整个根膨大长的出愈伤组织,(b)根一端膨大长出的愈伤组织。
图3为利用薏苡茎诱导愈伤组织。(a)诱导培养基培养7d,(b)诱导培养基培养20d。
图4为利用薏苡气生根诱导愈伤组织。(a)气生根培养10d,(b)气生根培养15d。
图5为利用薏苡芽诱导愈伤组织。(a)诱导10d;(b)诱导15d;(c)芽诱导出的胚性愈伤组织。
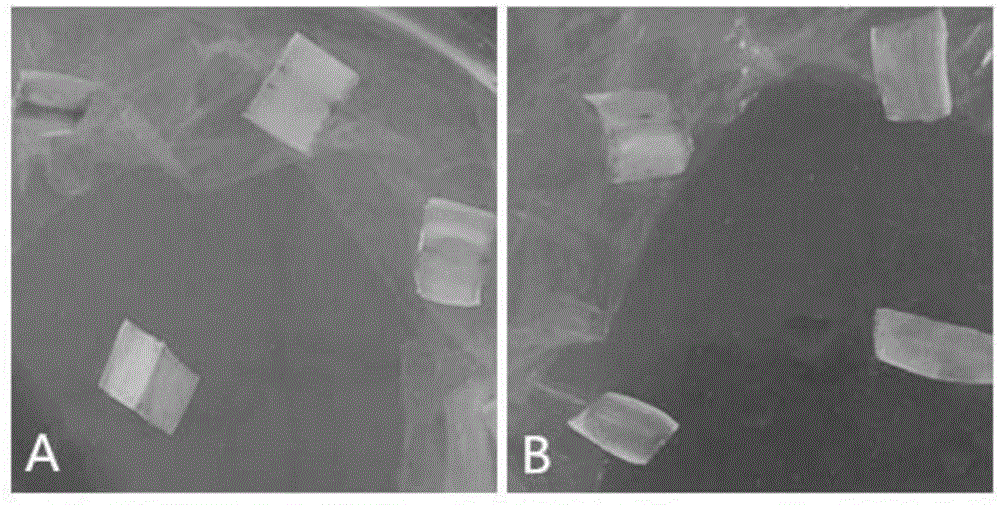
图6为不同抗褐变剂对愈伤组织培养的影响。c0:不添加抗褐变剂培养得到的愈伤组织;c1:添加2mg/l维生素c进行培养得到的愈伤组织;c2:添加0.85mg/l硫酸铜进行培养得到的愈伤组织;c3:添加0.85mg/l硝酸银进行培养得到的愈伤组织。
图7为薏苡芽愈伤组织的分化。a:接种到d18培养基7d的愈伤组织,开始出现绿点;b:接种到d18培养基20d的愈伤组织,已分化出芽。
图8为薏苡再生芽的生根和移栽。(a)愈伤组织分化成的芽;(b)再生芽生根;(c)炼苗开盖培养;(d)移栽前清洗掉根部培养基后的再生苗;(e)移栽到盆栽中的再生苗。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
实施例1、薏苡再生植株的制备
本实施例以薏苡(四川川单种业有限责任公司)种子为研究材料,获得无菌苗后,再利用不同外植体,诱导愈伤组织以及植株的再生。具体步骤如下:
一、薏苡胚性愈伤组织的诱导
1、不同消毒剂对种子发芽率和染菌率的影响
薏苡种子外有一层膜质总苞,携带有很多病菌,较难得到无菌苗,为此发明人首先研究了不同消毒剂对薏苡种子发芽率和染菌率的影响。所用消毒剂为0.1%升汞溶液和8%次氯酸钠溶液,其中0.1%升汞溶液(称取0.1g氯化汞,用超纯水定容至100ml即得到0.1%升汞溶液),8%次氯酸钠溶液的有效氯含量为8%(生工生物工程(上海)股份有限公司产品,称取8克次氯酸钠,定容至100ml即得到8%次氯酸钠溶液)。
利用消毒剂对薏苡种子进行消毒,消毒时间如表1所示,然后利用清水清洗干净,置于ms培养基中培养1周后统计发芽率和染菌率(表1)。所用培养条件为:光照强度为3000lx,温度为27℃,光照周期为:光照16h,黑暗8h。
据表1可知,0.1%升汞溶液和8%次氯酸钠溶液均能起到对薏苡种子的杀菌作用,消毒效果随着处理时间的增加越来越好,但种子的发芽率却越来越低,说明伴随消毒时间的增加,消毒剂对种子的毒害也越来越大。相同处理时间下,0.1%升汞溶液的消毒效果要优于8%次氯酸钠溶液。但考虑到升汞是剧毒物品,且8%次氯酸钠溶液消毒20min与0.1%升汞溶液消毒15min种子发芽率差异不大。故,后续实验中采取的对薏苡种子的消毒方法为:8%次氯酸钠溶液消毒20min。
表1、不同消毒试剂对薏苡种子的消毒效果
2、外植体的选择
良好的胚性愈伤组织是再生体系建立的最关键一步。同一材料,不同外植体愈伤组织的诱导率存在很大差异,为此发明人分别对薏苡叶片、根尖、茎、气生根和芽,进行了愈伤组织的诱导,统计出愈率和胚性愈伤率以确定最合适的外植体。
所用诱导培养基为向基本培养基1中添加2,4-d得到的无菌培养基,ph值5.8-6.0,五种诱导培养基(分别记为a1、a2、a3、a4和a5)中2,4-d的浓度分别为1mg/l、2mg/l、3mg/l、4mg/l和6mg/l,所用基本培养基1为向ms固体培养基中添加naa得到的培养基,每升基本培养基1中naa的含量为1mg。
出愈率=诱导出愈伤组织的外植体数/外植体总数*100%,胚性愈伤率=诱导出胚性愈伤组织的外植体数/诱导出愈伤组织的外植体总数*100%。
其中,胚性愈伤组织为增长缓慢、呈淡黄绿色、粗糙的颗粒状愈伤组织;非胚性愈伤组织为增长快速、含水量较高、白色或淡黄色松软的愈伤组织,或,紧实的、不透明的,不易分离的光滑或粗糙愈伤组织。
下文中用到的愈伤诱导的培养条件均为:光照强度为3000lx,温度为27℃,黑暗下培养。
2.1利用叶片诱导胚性愈伤组织
将消毒后的薏苡种子接种到ms固体培养基上培养,培养条件为:光照强度为3000lx,温度为27℃,光照周期为:光照16h,黑暗8h。待无菌苗长至“三叶一心”期,用无菌剪刀和镊子将叶片剪成0.5cm长的小段,接种到5种不同2,4-d浓度的诱导培养基上,每种培养基均接种100片叶段,每个培养皿接种10片,3个重复,20d后统计出愈率和胚性愈伤率,如表2所示。
由表2可以看出,在所用2,4-d浓度范围内,薏苡叶片均没有脱分化形成愈伤组织。此外,利用更为幼嫩的叶片也未能诱导出愈伤组织。薏苡叶片在接种后第4d叶片便开始变黄,7d以后即开始褐化死亡(图1),说明薏苡叶片没有脱分化形成愈伤组织的能力,不宜用作诱导胚性愈伤组织的外植体。
表2、薏苡叶片愈伤组织的诱导
2.2利用根尖诱导胚性愈伤组织
待薏苡无菌苗根长至1-3cm时,用无菌剪刀和镊子截取根约0.5cm长,接种到5种不同2,4-d浓度的诱导培养基上,每种培养基均接种100段,每个培养皿接种10段,3个重复,20d后统计出愈率和胚性愈伤率,如表3所示。
结果显示,接种4d后,在薏苡根的伤口处即有乳白色、表面湿润的愈伤组织形成,有的根只有一端膨大长出愈伤,有的根则是整段膨大长出愈伤(图2)。从表3可以看出,2,4-d浓度在1-6mg/l范围内,薏苡根尖均能诱导出愈伤组织。在2,4-d浓度为1mg/l和2mg/l时,出愈率最高,为96.67%,此后,随着2,4-d浓度的升高,出愈率呈现出有规律的下降趋势,在2,4-d浓度为6mg/l时,出愈率最低,为11.67%。另外,利用根尖未能直接得到胚性愈伤组织。
表3、薏苡根尖愈伤组织的诱导
20d后,将上述愈伤组织接入同种诱导培养基上继代培养,愈伤组织均逐渐褐化而死亡,说明薏苡的根仅能诱导出愈伤,但是无法继代培养。
2.3利用茎诱导胚性愈伤组织
待无菌苗长至到8-10cm高时,用无菌剪刀和镊子将茎剪成0.5cm左右小段,接种到不同2,4-d浓度的诱导培养基上,每种培养基均接种100段,每个培养皿接种10段,3个重复,30d后统计出愈率和胚性愈伤率。
从图3可以看出,薏苡茎接种于诱导培养基7d后,部分茎的内部会伸长,20d后,伸长部分开始膨大长出愈伤组织,部分未伸长的茎端也会膨大长出愈伤组织。茎诱导出的愈伤组织为淡黄色、粗颗粒状,愈伤组织内部为实心的未脱分化的嫩茎(图3)。在1-3mg/l2,4-d浓度梯度内,随着2,4-d浓度的增加,出愈率逐渐增加;在3-6mg/l2,4-d浓度梯度内,随着2,4-d浓度的增加出愈率逐渐降低,其中在2,4-d浓度为3mg/l时,薏苡茎愈伤组织的诱导率最大,出愈率为26.0%(表4)。
将上述愈伤组织转接入相同诱导培养基上继代培养,绝大部分愈伤组织逐渐褐化死亡,极少部分愈伤组织会逐渐变大,用手术刀切割发现内部是未脱分化的嫩茎,仅表面部分是愈伤组织,将该愈伤组织剥离下来继续培养均逐渐褐化死亡,表明薏苡的茎不能诱导出可以继代的愈伤组织。另外,利用茎未能直接得到胚性愈伤组织。
表4、薏苡茎愈伤组织的诱导
2.4利用气生根诱导胚性愈伤组织
取20d薏苡无菌苗,将其主根切除,诱导气生根生长,将气生根剪成0.5cm左右小段,接种到不同2,4-d浓度的诱导培养基上,每种培养基均接种100段,每个培养皿接种10段,3个重复,30d后统计出愈率和胚性愈伤率。
结果显示,与薏苡主根类似,气生根在诱导培养基上培养7d后,根的一端膨大出现淡黄色、表面湿润的愈伤组织,20d后愈伤组织不再变大仍为淡黄色,表面出现细小的颗粒状结构,用镊子轻夹即散,内部则为白色透明状(图4)。
从表5中可以看出,在本所用的2,4-d浓度范围内,薏苡的气生根均能诱导出愈伤组织,但不同培养基上出愈率差异较大,在a1培养基上,2,4-d浓度为1mg/l时,薏苡气生根的出愈率最高,为52%,在a5培养基上,2,4-d浓度为5mg/l时,出愈率最低,为8%。
表5、薏苡气生根愈伤组织的诱导
将上述愈伤组织继代,发现在继代5d后,愈伤组织开始出现褐化,逐渐死亡,丧失继代能力。另外,利用气生根未能直接得到胚性愈伤组织。
2.5利用芽诱导胚性愈伤组织
取薏苡种子萌动(萌发后第4天)后,0.5cm左右幼芽,接种到不同2,4-d浓度的诱导培养基上,每种培养基均接种100个幼芽,每个培养皿接种10段,3个重复,30d后统计出愈率和胚性愈伤率。
从表7可以看出,所用5种诱导培养基均能诱导出愈伤组织。出愈率表现出了随2,4-d浓度上升而下降的规律性变化,其中在a1培养基2,4-d浓度为1mg/l时,出愈率最高,为79.33%;a5培养基,2,4-d浓度为1mg/l为6mg/l时,出愈率最低,为46%。这五种诱导培养基除了a5培养基不能诱导胚性愈伤组织外,a1、a2、a3和a4培养基,均可诱导出胚性愈伤组织,其中a1培养基胚性愈伤诱导率为18.67%。所得到的愈伤组织如图5所示。
a1、a2、a3和a4愈伤诱导培养基具体由溶剂和溶质组成,溶剂为ms培养基,溶质为naa和2,4-d,naa在a1、a2、a3和a4愈伤诱导培养基中的浓度均为1mg/l,2,4-d在a1、a2、a3和a4愈伤诱导培养基中的浓度分别为1mg/l、2mg/l、3mg/l和4mg/l,ph值5.8-6.0。
表6、薏苡芽愈伤组织的诱导
二、抗褐变剂对胚性愈伤组织继代的影响
发明人研究了不同抗褐变剂(维生素c、硫酸铜和硝酸银)对薏苡胚性愈伤组织的影响。所用培养基如下:
c0培养基:步骤一中的a1诱导培养基。
c1培养基:向c0培养基中添加维生素c得到的培养基,维生素c的添加量为2mg/l培养基。
c2培养基:向c0培养基中添加硫酸铜得到的培养基,硫酸铜的添加量为0.85mg/l培养基。
c3培养基:向c0培养基中添加硝酸银得到的培养基,硝酸银的添加量为0.85mg/l培养基。
将步骤一得到的胚性愈伤组织(表现为颜色淡黄色,质地松软)分别在上述四种培养基中进行培养,每种培养基上的愈伤组织的接种量均为10块,所接种的愈伤组织长0.5cm,培养20d后,观察愈伤组织的生长情况,并统计存活数及长度(即初始长度方向的长)。所用培养条件为:光照强度为3000lx,温度为27℃,黑暗中培养。
从表7和图6中可以看出,维生素c对于抑制薏苡愈伤组织褐化,改善愈伤组织状态无明显作用(图6中c1),硫酸铜、硝酸银则明显的提高了愈伤组织的存活数,并能有效的改善愈伤组织的状态(图6中c2和c3)。薏苡愈伤组织在继代培养之前,颜色暗淡,转接入添加有硝酸银的继代培养基后,愈伤组织变得有光泽,呈淡黄色颗粒状。因此,在继代培养基中可加入硝酸银或硫酸铜,有减轻愈伤组织褐化、改善愈伤组织状态的作用。
表7、不同抗褐变剂对愈伤组织继代培养的影响
三、愈伤组织的再分化
将利用薏苡芽诱导的胚性愈伤组织,接种到不同分化培养基上,每种分化培养基中接种100颗愈伤组织,每个培养皿上接种10颗,20d后统计愈伤组织存活数、愈伤组织的长度、出绿点的愈伤组织数、出芽的愈伤组织数以及愈伤组织的生长状况。
所用培养条件为:光照强度为3000lx,温度为27℃,光周期为光照12h/黑暗12h。
所用培养基为d1-d18分化培养基,各分化培养基均为向基本培养基2中添加激素得到的培养基,ph值5.8-6.0,各分化培养基中添加的激素的种类和添加量如表8所示。基础培养基2为向ms固体培养基中添加头孢霉素得到的无菌培养基,每升分化培养基中头孢霉素的含量为250mg/l。
表8、愈伤组织分化培养基
注:表8中kt为激动素。
结果如表9所示,除d10分化培养基外,薏苡芽诱导出的胚性愈伤组织在其余17种分化培养基上,均能分化出绿点,并逐渐膨大,呈颗粒状,但仅有d18分化培养基可分化出芽(图7)。说明不同激素及浓度组合对薏苡胚性愈伤组织的分化有很大的影响,d18分化培养基可以用于薏苡胚性愈伤组织的分化。d18分化培养基具体由溶剂和溶质组成,溶剂为ms培养基,溶质及其在d18分化培养基中的浓度分别为头孢霉素250mg/l、6-ba2mg/l和激动素2mg/l,ph值5.8-6.0。
表9、薏苡芽愈伤组织在不同分化培养基上的分化
四、薏苡再生芽生根及炼苗
待分化培养基中的芽长至2-3cm高时,转移至生根培养基中进行培养,培养条件为光照强度为3000lx,温度为27℃,光周期为光照16h/黑暗8h,7d即可生根,最后长成完整植株,炼苗后,移栽到土壤中,即得到薏苡再生植株(图8)。
所用生根培养基为向1/2ms培养基中添加iba得到的培养基,该培养基中iba的浓度为0.5mg/l,ph值5.8-6.0。1/2ms培养基为将ms培养基中各溶质的浓度减半得到的培养基。
- 还没有人留言评论。精彩留言会获得点赞!