一种抗肿瘤益生菌发酵功能性食品及其制备方法与流程
本发明属于微生物发酵应用领域,涉及利用益生菌发酵姜黄、黑胡椒、余甘子等生产的功能性食品,以及功能性食品的制备方法,所述功能性食品主要用于预防癌症,同时具有抗菌消炎功能。
背景技术:
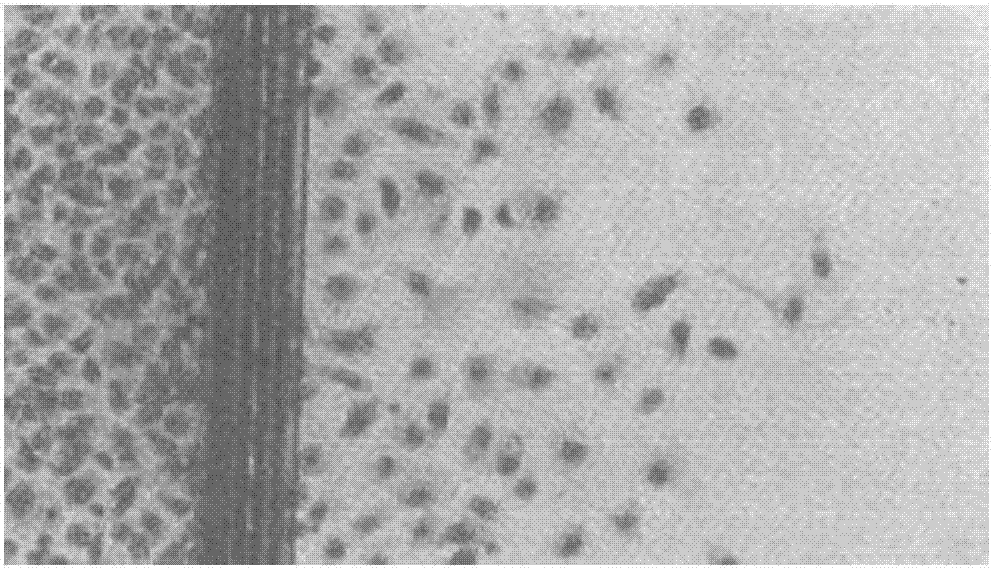
:癌症作为危害人类健康,导致人类死亡的主要疾病,癌症和病毒性疾病、老年性疾病一起称为现代医学的三大挑战。研发抗癌药物和食物是当今的一个世界课题,特别是从天然产物中筛选具有抗癌功能的活性物质,现在已成为研发的热点。自二十世纪年代末期,从长春花中发现抗癌活性成分长春碱以来,政府、科学家们运用各种方法从大量的天然植物中筛选抗癌活性成分,经过抗肿瘤活性实验表明:姜黄、余甘子、黑胡椒、核桃、杏仁、大豆、覆盆子这些天然植物中的某些活性成分具有较强的抑制癌细胞增殖的效果,在治疗癌临床应用中起到了非常显著的促进作用。肿瘤的形成是多种因素互相作用的结果,环境因素、生活方式、饮食问题等等都会导致肿瘤的形成,如何有效改善人们的生活方式,仍是科学家不断探索的课题。但是针对抗肿瘤食品方面的研究并不多,主要为以下这些:公开号:103494255A的发明《一种抗肿瘤鱼肉膏》公开了一种抗肿瘤功能性食品及其制备方法,由以下重量份原料组成:鲫鱼100-130、鲤鱼60-80、玉米淀粉30-50、糯米粉50-60、西兰花30-40、南瓜花20-40、芝麻20-30、杏仁20-30、玉米汁30-40、八股绳4-5、半枝莲3-4、山慈菇3-4、白花蛇舌草3-4、玉米须3-4、山茱萸4-5、大豆叶3-4、豆浆80-100、橄榄油20-30、食盐10-40、白砂糖0-60、水适量。公开号:1956725B的发明《抗肿瘤剂》提供了含有夹竹桃科植物、百合科植物的叶、花、茎、皮或球根的干燥粉末、或者它们的水性提取物或有机溶剂提取物的抗肿瘤剂、以及含有这些的食品。公开号:106857854A的发明《抗肿瘤奶粉》公开了一种抗肿瘤奶粉功能性食品及其制备方法,包括下述质量份的组分:奶粉60-70份、乳清蛋白粉10-20份、卵磷脂5-15份、低聚糖5-20份、胭脂红杏0.5-3份、黑枸杞粉0.5-3份、硒麦芽粉0.5-3份、猴头菇提取物0.01-0.1份、桑黄粉0.5-1份、米糠粉0.5-5份、羊胎精华素0.05-0.1份、鱼油0.01-0.1份、可溶性膳食纤维10-15份、维生素A0.0001-0.0003份、矿物质0.0001-0.0005份。上述现有技术公开的针对抗肿瘤的食品多是各种天然食品提取物和各营养素复配成的抗肿瘤保健食品,制备方法一般为简单的加工混合,采用益生菌发酵制备抗肿瘤保健食品未见报道。技术实现要素:本发明旨在开发抑制肿瘤的功能性饮料和食品,并为相关产品的生产提供研究思路。同时相关产品具有抗菌消炎功能。通过益生菌发酵姜黄和黑胡椒、余甘子等生产功能性的饮料和食品,不仅能够保留其活性成分,而且还对机体具有保健作用。姜黄属于药食同源物品,中药姜黄是一味活血化瘀药,其中的总姜黄素,姜黄醇提物能抑制人体的肿瘤生长和抑制培养的肿瘤细胞增殖,具有显著的抗肿瘤活性。但传统方法提取的姜黄素含量少、提取难度大并不能发挥姜黄的功效。本发明将姜黄与黑胡椒等配合,并采用益生菌发酵法,能够提高姜黄素及其衍生物的含量。本发明的目的在于利用益生菌混菌对姜黄,必要时还包括黑胡椒、余甘子、核桃、杏仁、大豆、覆盆子进行发酵获得一种益生菌功能性食品。一种抗肿瘤益生菌混菌发酵功能性食品,是将姜黄,必要时还包括辅料按比例发酵;采用植物乳杆菌、动物双歧杆菌、副干酪乳杆菌、青春双歧杆菌、凝结芽孢杆菌和枯草芽孢杆菌多种菌株进行混菌液态或固态发酵后制备而得;所述辅料较佳的为黑胡椒、余甘子、核桃、杏仁、大豆、覆盆子中的至少一种;本发明提供一种抗肿瘤益生菌液态发酵功能性饮料,原料组成如下:每100mL水中加入1-10%(质量体积比)的姜黄粉,同时还可以加入不多于10%的黑胡椒粉、不多于10%的余甘子粉、不多于5%的核桃粉、不多于5%的杏仁粉、不多于5%的大豆粉、不多于5%的覆盆子粉中的至少一种,搅拌均匀;较佳的,所述抗肿瘤益生菌液态发酵功能性饮料,原料组成还包括1-10%的黑胡椒粉和/或1-10%的余甘子粉和/或1-5%的核桃粉和/或1-5%的杏仁粉和/或1-5%的大豆粉和/或1-5%的覆盆子粉。本发明提供一种抗肿瘤益生菌液态发酵功能性饮料的制备方法,具体步骤如下:(1)将姜黄、黑胡椒、余甘子、核桃仁、杏仁、大豆、覆盆子清洗后晾干,然后粉碎,分别磨粉过100目筛,得姜黄粉和黑胡椒粉、余甘子粉、核桃粉、杏仁粉;大豆粉和覆盆子粉。(2)配制活化培养基:每100ml水中添加10g大豆粉,得活化培养基;对活化培养基进行灭菌,条件为,121℃,20min;(3)配制发酵培养基:所述发酵培养基为:在水中添加姜黄粉,也可以同时添加黑胡椒粉、余甘子粉、核桃粉、杏仁粉、大豆粉、覆盆子粉中的至少一种;所述配制发酵培养基具体为:每100ml水中添加1-10g姜黄粉,另外可添加1-10g的黑胡椒粉和/或1-10g余甘子粉和/或1-5g核桃粉和/或1-5g杏仁粉和/或1-5g的大豆粉和/或1-5g的覆盆子粉,得液态发酵培养基;(4)菌种活化:植物乳杆菌、动物双歧杆菌、副干酪乳杆菌、青春双歧杆菌和凝结芽孢杆菌、枯草芽孢杆菌的甘油管分别按1%(v/v活化培养基的体积比)接种于活化培养基进行活化,pH自然,控制温度为37℃;分别活化20h后,按10%(v/v)的接菌量再次转接活化培养基进行二次活化,再活化24h后得二级种子液;(5)益生菌发酵:将动物双歧杆菌的接种量为106-107CFU/g,植物乳杆菌的接种量为106-107CFU/g,副干酪乳杆菌的接种量为105-106CFU/g,青春双歧杆菌的接种量为106-107CFU/g,凝结芽孢杆菌的接种量为105-106CFU/g,枯草芽孢杆菌的接种量为105-106CFU/g接种于发酵培养基中,混菌液态发酵24-48h,温度为37℃;(6)发酵结束后,发酵液经乳化、加稳定剂、调酸、调香、均质、杀菌后即得抗肿瘤益生菌液态发酵饮料;所述姜黄、黑胡椒、余甘子、核桃、杏仁、大豆、覆盆子均为市售;优选的,液态发酵培养基的组成为:每100ml水中添加10g姜黄粉,9g的黑胡椒粉,8g的余甘子粉,3g的核桃粉,2g的杏仁粉,1g的大豆粉,1g的覆盆子粉;优选的,混菌液态发酵时间为24h;优选的,所述植物乳杆菌为植物乳杆菌(Lactobacillusplantarum)TK9,该菌株已于2015年12月17日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮编100101,保藏编号为CGMCCNo.11891;此株植物乳杆菌具有较好的抗胃酸、抗胆盐的能力,在pH3时2h存活率88.03%,0.3%胆盐4h存活率81.06%,并且具有广泛的抗真菌性,不需要添加额外的防腐剂,也可以延长饮料和食品保藏时间。由王海宽于2009年7月采集于中国包头市居民家中天然发酵酸粥;优选的,所述动物双歧杆菌为动物双歧杆菌(Bifidobacteriumanimalis)937,该菌株已于2015年12月17日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮编100101,保藏编号为CGMCCNo.11892;由王海宽于2007年5月采集于中国天津市;优选的,所述副干酪乳杆菌为副干酪乳杆菌(Lactobacillusparacasei)TK1501,该菌株已于2016年10月21日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101,保藏编号为CGMCCNo.13130;由王海宽于2015年8月采集于中国包头市居民家中天然发酵酸粥;优选的,所述青春双歧杆菌为青春双歧杆菌(Bifidobacteriumadolescentis)TK99,该菌株已于2016年7月14日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101,保藏编号为CGMCCNo.12784;由王海宽于2015年1月采集于中国天津市;优选的,所述凝结芽孢杆菌为凝结芽孢杆菌(Bacilluscoagulans)TQ33,该菌株已于2011年9月9日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101,保藏编号为:CGMCCNo.5233;由王海宽于2002年5月采集于中国天津市脱脂奶粉中;优选的,所述枯草芽孢杆菌为枯草芽孢杆菌(Bacillussubtilis)TK-1,该菌株已于2011年4月2日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101,保藏编号为CGMCCNo.4731;由王海宽于2008年10月采集于中国内蒙古呼和浩特。本发明同时提供一种抗肿瘤益生菌固态发酵食品的制备方法,包括如下步骤:将姜黄、黑胡椒、大豆、余甘子、核桃、杏仁、覆盆子作为发酵基质,采用植物乳杆菌、动物双歧杆菌、副干酪乳杆菌、青春双歧杆菌、凝结芽孢杆菌和枯草芽孢杆菌经固态混菌发酵后制备而得;一种抗肿瘤益生菌固态发酵功能性食品的制备方法,具体步骤如下:(1)选取姜黄粉,以及黑胡椒粉、余甘子粉、核桃粉、杏仁粉、大豆粉、覆盆子粉其中一种或者几种按一定重量比混合,得到姜黄与辅料的混合物:水=1:0.8-2制得固态发酵培养基;所述姜黄与辅料的混合物:水的比例为重量比;(2)对固态发酵培养基进行灭菌,条件为,121℃,20min;(3)菌种活化:方式同上述液态发酵;(4)将二级种子液接入固态发酵培养基中,使得每克固态培养基中,动物双歧杆菌的接种量为106-107CFU/g,植物乳杆菌的接种量为106-107CFU/g,副干酪乳杆菌的接种量为105-106CFU/g,青春双歧杆菌的接种量为106-107CFU/g,凝结芽孢杆菌的接种量为105-106CFU/g,枯草芽孢杆菌的接种量为105-106CFU/g;(5)混菌固态发酵24-48h,37℃;发酵结束后,放置于-80℃预冻12小时后,放入真空冷冻干燥机内24小时,制得抗肿瘤益生菌固态发酵食品;所述姜黄、黑胡椒、余甘子、核桃、杏仁、大豆、覆盆子均为市售;优选的,所述姜黄与辅料的混合物:水=1:1;优选的,所述固态发酵真空冷冻干燥条件为-80℃预冻6h后进行真空冷冻干燥24h,至含水量不大于5%;优选的,所述植物乳杆菌为植物乳杆菌(Lactobacillusplantarum)TK9,保藏编号为CGMCCNo.11891;优选的,所述动物双歧杆菌为动物双歧杆菌(Bifidobacteriumanimalis)937,保藏编号为CGMCCNo.11892;优选的,所述副干酪乳杆菌为副干酪乳杆菌(Lactobacillusparacasei)TK1501,保藏编号为CGMCCNO.13130;优选的,所述青春双歧杆菌为青春双歧杆菌(Bifidobacteriumadolescentis)TK99,保藏编号为CGMCCNo.12784;优选的,所述凝结芽孢杆菌为凝结芽孢杆菌(Bacilluscoagulans)TQ33,保藏编号为:CGMCCNo.5233;优选的,所述枯草芽孢杆菌为枯草芽孢杆菌(Bacillussubtilis)TK-1,保藏编号为CGMCCNo.4731。有益效果中药姜黄是一味活血化瘀药,也称总姜黄素,研究证明姜黄醇提物能降低血清胆固醇和甘油三酯,对抗脂质过氧化物,抑制平滑肌细胞和内皮细胞增殖,具有明显的降血脂抗动脉粥样硬化作用,姜黄醇提物还能抑制人体的肿瘤生长和抑制培养的肿瘤细胞增殖,具有显著的抗肿瘤活性。余甘子(Phyllanthusemblica,PE)是一种分布于东南亚热带和亚热带地区的水果。PE是一种极具潜力的食物和药物资源,含有丰富的维生素C、氨基酸、矿物质以及大量的药学相关化合物。大量的临床前期研究表明PE具有抗癌和防癌的作用,包括抑制肿瘤细胞的体外增殖和扩散、诱导其凋亡、降低异种移植肿瘤的发生率和体积、预防致癌物、诱变剂和电离辐射的致癌效应。黑胡椒的主要成分是黑胡椒碱,赋予了其强烈的芳香和辛辣味道,还含有一定量的芳香油、粗蛋白和淀粉等物质,黑胡椒的整个植株都具有药用和食用价值,常用于治疗便秘、慢性疟疾、淋病、腹湾等疾病,此外黑胡椒还具有消炎、抗癌、缓解抑郁、降血糖、降血脂、减肥、治疗肝损伤等功能,还可刺激肠胃,促进肠道蠕动,内服可作为驱风、健胃剂,外敷可作为刺激剂,所含的黑胡椒碱曾用做解热和驱风剂,并有微弱的抗拒作用,调节免疫力等。核桃为蔷蘅科李属植物杏的成熟种子,呈扁心形,长宽,种皮红色或深黄色。核桃富含蛋白质、脂肪、维生素、矿物质和膳食纤维,营养价值高。据报道,核桃中含蛋白质约26%左右,油脂约50%左右,粗纤维及碳水化合物约15%,还含有多种微量元素和维生素。除此之外,长期食用核桃可以防癌、抗癌,发散风寒、止咳平喘、清热解毒和通便,药用价值高。大豆富含不饱和脂肪酸和大豆磷脂,富含皂角苷、蛋白酶抑制剂、异黄酮、钼、硒等抗癌成份。所以大豆具有预防癌症发生的功效,不同的癌症它都具有一定的抑制作用。其中尤其是对于乳腺癌,其抑制效果最为明显。覆盆子干果为药食两用果实,味甘,略带涩味,含有的黄酮、有机酸、糖类、维生素、鞣花酸、β-谷甾醇及微量元素等具有抗衰老、调节生殖系统、促进细胞免疫机能、减肥之功效、有助阳缩尿、补肾固精功能,用于治疗阳萎、肾虚遗精、尿频和遗尿等病症,因此,覆盆子具有很强的药用及保健作用。益生菌是一类通过改善肠道微生态环境从而对宿主产生有益影响的微生物。它可通过参与肠道微生态平衡来抑制病原菌生长,避免了长期使用抗生素产生的耐药性和二重感染,因此,益生菌产品近年来备受人们的关注。本发明所述一种抗肿瘤益生菌发酵功能性食品,既保存了天然抗癌植物的营养价值,又具有益生菌发酵制品的营养保健作用,口感独特;该益生菌发酵的抗癌食品通过特殊方法制备而得,通过益生菌发酵,使天然植物中的抗癌活性成分,更易于人体吸收,进而降低人类患癌症的风险。通过益生菌发酵来制备益生菌发酵的抗癌食品和益生菌粉剂,在保证发酵基质均匀的同时,易于实现大规模的生产。附图说明图1为对照组内皮细胞迁移显微影像;图2为10mol/mL抗肿瘤益生菌发酵液态饮料内皮细胞迁移显微影像;图3为20mol/mg抗肿瘤益生菌发酵固态食品内皮细胞迁移显微影像。具体实施方式为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图、表格及实施例,对本发明做进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,但本发明并不限于以下具体实施例子。实施例中涉及到的百分号“%”,若未特别说明,指质量百分比,溶液的百分比指100mL中含有溶质的克数,液体之间的百分比,是指在25℃时溶液的体积比例。实施例1一种抗肿瘤益生菌发酵功能性饮料制备方法1、原料中姜黄与辅料配比的确定(1)将姜黄、黑胡椒、余甘子、核桃、杏仁、大豆、覆盆子分别清洗后晾干,磨粉过100目筛。(2)配制活化培养基:每100ml水中添加10g大豆粉;对活化培养基进行灭菌,条件为,121℃,20min;(3)配制发酵培养基:每100ml水中添加1-10g的姜黄粉、1-10g的黑胡椒粉、1-10g余甘子粉、1-5g核桃粉、1-5g杏仁粉、1-5g大豆粉、1-5g覆盆子粉;(4)菌种活化,植物乳杆菌、动物双歧杆菌、副干酪乳杆菌、青春双歧杆菌、凝结芽孢杆菌和枯草芽孢杆菌的甘油管分别按1%接种于活化培养基进行活化,pH自然,控制温度为37℃;分别活化20h后,按10%(v/v)的接菌量再次转接活化培养基进行二次活化,再活化24h后得二级种子液;(5)益生菌发酵:将植物乳杆菌、动物双歧杆菌、副干酪乳杆菌、青春双歧杆菌、凝结芽孢杆菌和枯草芽孢杆菌接种于发酵培养基中;植物乳杆菌和动物双歧杆菌、副干酪乳杆菌、青春双歧杆菌、凝结芽孢杆菌和枯草芽孢杆菌接菌量体积比为1:1:1:1:1:1,混菌液态发酵24h,温度为37℃;分别对发酵液中的益生菌活菌数进行检测,结果如表1:菌种标号:1号为植物乳杆菌TK9单菌,2号为动物双歧杆菌379单菌,3号为副干酪乳杆菌TK1501单菌,4号为青春双歧杆菌TK99单菌,5号为凝结芽孢杆菌TQ33单菌,6号为枯草芽孢杆菌TK-1单菌。本发明进行了多种天然原料混合液态发酵,每100ml按照不同比例加入姜黄粉、黑胡椒粉、余甘子粉、核桃仁粉、杏仁粉、大豆粉、覆盆子粉若干进行液态发酵,发酵后活菌数结果见表1。表1不同比例的姜黄与辅料天然植物组合发酵后益生菌活菌数以标号表示各组别:组合一:姜黄:黑胡椒:余甘子:核桃仁粉:杏仁粉:大豆粉:覆盆子粉=6:4:3:2:3:4:1,组合二:姜黄:黑胡椒:余甘子:核桃仁粉:杏仁粉:大豆粉:覆盆子粉=1:10:3:1:1:2:5,组合三:姜黄:黑胡椒:余甘子:核桃仁粉:杏仁粉:大豆粉:覆盆子粉=5:5:1:1:3:5:2,组合四:姜黄:黑胡椒:余甘子:核桃仁粉:杏仁粉:大豆粉:覆盆子粉=5:1:10:5:5:2:1,组合五:姜黄:黑胡椒:余甘子:核桃仁粉:杏仁粉:大豆粉:覆盆子粉=10:9:8:3:2:1:1。由表1可知姜黄粉与多种天然植物混合发酵后,组合五:姜黄:黑胡椒:余甘子=10:9:8:3:2:1:1,即每100ml水中加入10g姜黄粉、9g黑胡椒粉、8g余甘子粉、3g核桃仁粉、2g杏仁粉、1g大豆粉、1g覆盆子粉时活菌数达到最高,3.7×109CFU/mL。2、益生菌接种量的确定其他条件同上,按每100ml水中加入10g姜黄粉、9g黑胡椒粉、8g余甘子粉、3g核桃仁粉、2g杏仁粉、1g大豆粉、1g覆盆子粉配制发酵培养基,将植物乳杆菌TK9按以下接菌量1×106、5×106、1×107、5×107CFU/mL分别接种于发酵培养基中,其他菌种与植物乳杆菌的比例如下:植物乳杆菌TK9、动物双歧杆菌937、副干酪乳杆菌TK1501、青春双歧杆菌TK99、凝结芽孢杆菌TQ33、枯草芽孢杆菌TK-1的接菌量比为1:1:1:1:1:1,37℃发酵,发酵完成之后测定发酵液中的益生菌活菌数。表2不同接种量下的活菌数(CFU/mL)结果如表2所示:最佳接种量植物乳杆菌TK9、动物双歧杆菌937、副干酪乳杆菌TK1501、青春双歧杆菌TK99、凝结芽孢杆菌TQ33、枯草芽孢杆菌TK-1均为1×107CFU/mL。测得的总活菌数为6.4×109CFU/mL。3、培养时间的确定在接种量已优化的条件下,液态发酵培养基选择每100ml水中加入10g姜黄粉、9g黑胡椒粉、8g余甘子粉、3g核桃仁粉、2g杏仁粉、1g大豆粉、1g覆盆子粉。植物乳杆菌TK9、动物双歧杆菌937、副干酪乳杆菌TK1501、青春双歧杆菌TK99、凝结芽孢杆菌TQ33、枯草芽孢杆菌TK-1的甘油管按1%接种于大豆粉活化培养基进行一次活化,均活化20h,然后均按10%(v/v)的接种量转接入二次活化培养基中,二次活化24h。在液态发酵培养基中接种植物乳杆菌TK9、动物双歧杆菌937、副干酪乳杆菌TK1501、青春双歧杆菌TK99、凝结芽孢杆菌TQ33、枯草芽孢杆菌TK-1种子液混菌发酵。使得接入到抗肿瘤益生菌发酵液态饮料培养基中植物乳杆菌TK9、动物双歧杆菌937、副干酪乳杆菌TK1501、青春双歧杆菌TK99、凝结芽孢杆菌TQ33、枯草芽孢杆菌TK-1,均为1×107CFU/mL;pH自然,培养温度37℃,混菌发酵12、24、36、48h,分别对发酵液中的益生菌活菌数进行检测。表3不同发酵时间培养的益生菌活菌菌种标号:1号为植物乳杆菌TK9单菌,2号为动物双歧杆菌379单菌,3号为副干酪乳杆菌TK1501单菌,4号为青春双歧杆菌TK99单菌,5号为凝结芽孢杆菌TQ33单菌,6号为枯草芽孢杆菌TK-1单菌。12h24h36h48h1号3.8×1085.8×1083.5×1083.9×1082号4.2×1086.9×1083.6×1086.4×1083号8.4×1079.5.×1077.5×1077.9×1074号8.6×1078.9×1078.1×1076.2×1075号6.8×1077.6×1075.9×1073.9×1076号5.8×1054.9×1053.8×1054.2×105总活菌数9.3×1084.5×1092.7×1093.6×109结果如表3所示:混菌液态发酵最佳培养时间为24h,总活菌数为4.5×109CFU/ml。4、一种抗肿瘤益生菌发酵液态饮料的制备方法(1)将姜黄和天然植物清洗后晾干,分别磨粉过100目筛得姜黄粉和各种辅料粉末;(2)配制活化培养基:每100ml水中添加10g大豆粉;对活化培养基进行灭菌,条件为,121℃,20min;(3)配制发酵培养基:每100ml水中加入10g姜黄粉、9g黑胡椒粉、8g余甘子粉、3g核桃仁粉、2g杏仁粉、1g大豆粉、1g覆盆子粉;(4)菌种活化,植物乳杆菌、动物双歧杆菌、副干酪乳杆菌TK1501、青春双歧杆菌TK99、凝结芽孢杆菌TQ33、枯草芽孢杆菌TK-1甘油管分别按1%接种于活化培养基进行活化,pH自然,控制温度为37℃;分别活化20h后,按10%(v/v)的接菌量再次转接活化培养基进行二次活化,再活化24h后得二级种子液;(5)益生菌发酵:将植物乳杆菌按接菌量为1×107CFU/mL接种于发酵培养基中,同时接种动物双歧杆菌、副干酪乳杆菌TK1501、青春双歧杆菌TK99、凝结芽孢杆菌TQ33、枯草芽孢杆菌TK-1,植物乳杆菌、动物双歧杆菌、副干酪乳杆菌TK1501、青春双歧杆菌TK99、凝结芽孢杆菌TQ33、枯草芽孢杆菌TK-1,接菌量体积比为1:1:1:1:1:1,混菌液态发酵24h,温度为37℃发酵;(6)发酵结束后发酵液经乳化后加稳定剂,稳定剂按与发酵液质量体积比进行添加,添加量为羧甲基纤维素钠0.5%,黄原胶0.3%,乳化剂0.6%;添加发酵液质量体积比为8%的异麦酮糖进行调酸调香;在65℃,30MPa的条件下均质一次,经80℃杀菌15min,得抗肿瘤益生菌发酵液态饮料。5、抗肿瘤益生菌发酵液态饮料工艺-发酵前后培养基活性成分变化其他条件同前,单菌发酵时接种量为1×107CFU/mL,每100ml水中加入10g姜黄粉、9g黑胡椒粉、8g余甘子粉、3g核桃仁粉、2g杏仁粉、1g大豆粉、1g覆盆子粉配制发酵培养基,经24小时37℃发酵后得抗肿瘤液体发酵饮料。利用GB/T223.75-2008法测定姜黄素;利用高效液相法测定GABA含量;利用福林酚反应测定总酚类含量;利用GB/T23788-2009法测定黄酮类含量;利用GB/T12143.2-89法测定氨基态氮的含量;利用活氧指数法(ORAC)测定抗氧化物含量,结果见表4。表4:抗肿瘤益生菌液态饮料发酵前后活性成分变化以编号表示各阶段:1-发酵前含量;2-混菌发酵后含量;3-植物乳杆菌TK9发酵后含量;4-动物双歧杆菌937发酵后含量;5-副干酪乳杆菌TK1501发酵后含量;6-青春双歧杆菌TK99发酵后含量;7-凝结芽孢杆菌TQ33发酵后含量;8-枯草芽孢杆菌TK-1发酵后含量;由以上数据可知,姜黄粉、黑胡椒粉、余甘子粉、核桃粉、杏仁粉、大豆粉、覆盆子粉在经过益生菌液态发酵后活性成分都有提高,特别是混菌发酵后各活性成分增加尤为明显。其中,混菌发酵后姜黄素含量达到2.96mg/ml,姜黄素的增加可以抑制某些肿瘤的生长,且具有消炎坑氧化的作用。GABA含量在经发酵后有所增加,混菌发酵后液态饮料GABA含量达到为1.86mg/ml,均高于单菌发酵,该成分对高血压有缓解和治疗的功效;经混菌发酵后,总酚类含量达到1.75mgGAE/ml,均高于单菌发酵,总酚类物质都具有抗氧化功效;混菌后发酵后抗氧化活性显著提高,可延长产品的保质期;经混菌发酵后,液态饮料中黄酮类物质含量明显增加,含量达到0.67mg/ml,黄酮类物质具有抗氧化、抗发炎反应功效,也可抵抗或减缓肿瘤的形成;混菌发酵功能性饮料中氨基态氮含量相对于发酵前以及单菌发酵后的增加显著,氨基态氮含量较发酵前增加三倍以上。混菌发酵益生菌饮料相对于未发酵姜黄以及使用单菌发酵,其DPPH清除率达到了54%。实施例2:抗肿瘤益生菌发酵固态食品制备方法1、原料配比的确定(1)将姜黄、黑胡椒、余甘子、核桃仁、杏仁、大豆、覆盆子分别清洗后晾干,磨粉过100目筛。(2)配制活化培养基:每100ml水中添加10g大豆粉;对活化培养基进行灭菌,条件为,121℃,20min;(3)配制发酵培养基:按不同的比例配制姜黄粉、黑胡椒粉、余甘子粉、核桃粉、大豆粉、杏仁粉、覆盆子粉,料水比为1:1;(4)菌种活化,植物乳杆菌、动物双歧杆菌、副干酪乳杆菌、青春双歧杆菌、凝结芽孢杆菌和枯草芽孢杆菌的甘油管分别按1%接种于活化培养基进行活化,pH自然,控制温度为37℃;分别活化20h后,按10%(v/v)的接菌量再次转接活化培养基进行二次活化,再活化24h后得二级种子液;(5)益生菌发酵:将植物乳杆菌、动物双歧杆菌、副干酪乳杆菌、青春双歧杆菌、凝结芽孢杆菌和枯草芽孢杆菌接种于发酵培养基中;植物乳杆菌和动物双歧杆菌、副干酪乳杆菌、青春双歧杆菌、凝结芽孢杆菌和枯草芽孢杆菌接菌量体积比为1:1:1:1:1:1,混菌固态发酵24h,温度为37℃;分别对发酵样品中的益生菌活菌数进行检测,结果如表5:菌种标号:1号为植物乳杆菌TK9单菌,2号为动物双歧杆菌379单菌,3号为副干酪乳杆菌TK1501单菌,4号为青春双歧杆菌TK99单菌,5号为凝结芽孢杆菌TQ33单菌,6号为枯草芽孢杆菌TK-1单菌原料选取姜黄粉、黑胡椒粉、余甘子粉、大豆粉四种,原料配比标号:组合一:5:4:3:2,组合二:2:3:4:5,组合三:5:2:4:5,组合四:3:3:2:2,组合五:5:2:1:5。表5姜黄粉与其他天然植物的配比组合一组合二组合三组合四组合五1号1.6×1082.7×1085.2×1085.5×1088.4×1082号2.7×1074.8×1074.1×1074.9×1079.3×1083号5.9×1076.2×1077.3×1076.4×1087.7×1084号3.6×1077.7×1074.9×1087.1×1084.6×1085号1.7×1073.5×1077.5×1073.7×1076.1×1086号4.5×1057.4×1058.8×1059.6×1077.4×107总活菌数1.7×10107.3×1099.8×1081.4×1091.9×1010由表5可知得到的最优配比组合五,即为姜黄粉:黑胡椒粉:余甘子粉:大豆粉=5:2:1:5,总活菌数为1.9×1010CFU/mL。2、菌种接种量的确定植物乳杆菌TK9、动物双歧杆菌937、副干酪乳杆菌TK1501、青春双歧杆菌TK99、凝结芽孢杆菌TQ33、枯草芽孢杆菌TK-1甘油管分别按1%接种于活化培养基(每100ml水中添加10g大豆粉,灭菌条件为,121℃,20min;)进行一次活化;均活化20h,然后均按10%(v/w)的接菌量转接入二次活化培养基(同一次活化培养基)中,二次活化24h,按姜黄粉:黑胡椒粉:余甘子粉:大豆粉粉=5:2:1:5,料水比为1:1制得固态发酵培养基,同时接种植物乳杆菌TK9、动物双歧杆菌937、副干酪乳杆菌TK1501、青春双歧杆菌TK99、凝结芽孢杆菌TQ33、枯草芽孢杆菌TK-1种子液进行混菌发酵,混菌固态发酵36h,37℃,pH自然。对发酵后培养基中的益生菌活菌数进行检测。接种量:将植物乳杆菌TK9(L.plantarumTK9)、动物双歧杆菌937(B.animalis937)、副干酪乳杆菌TK1501(LactobacillusparacaseiTK1501)、青春双歧杆菌TK99(BifidobacteriumadolescentisTK99)、凝结芽孢杆菌TQ33(BacilluscoagulansTQ33)、枯草芽孢杆菌TK-1(BacillussubtilisTK-1)同时接入固态发酵培养基,接种量为:1×106CFU/mL;5×106CFU/mL;1×107CFU/mL;5×107CFU/mL四组,结果如表6所示:表6固态发酵不同接种量下的活菌数(CFU/g)结果如表6所示:植物乳杆菌TK9(L.plantarumTK9)、动物双歧杆菌937(B.animalis937)、副干酪乳杆菌TK1501(LactobacillusparacaseiTK1501)、青春双歧杆菌TK99(BifidobacteriumadolescentisTK99)、凝结芽孢杆菌TQ33(BacilluscoagulansTQ33)、枯草芽孢杆菌TK-1(BacillussubtilisTK-1)的最佳接种量为5×107CFU/g,即测得所得抗肿瘤益生菌发酵固态食品中的总活菌数为8.4×1010CFU/g。其中,植物乳杆菌活菌数为6.9×109CFU/g,动物双歧杆菌的活菌数达到9.3×108CFU/g,副干酪乳杆菌活菌数为8.9×107CFU/g,青春双歧杆菌活菌数为7.7×108CFU/g,凝结芽孢杆菌活菌数为8.1×107CFU/g,枯草芽孢杆菌的活菌数为6.6×106CFU/g。3、料水比的确定固态发酵培养基:原料和水的比例(质量体积比)分别为1:0.8,1:1,1:1.2,1:1.6,1:1.8,1:2。植物乳杆菌TK9、动物双歧杆菌937、副干酪乳杆菌TK1501、青春双歧杆菌TK99、凝结芽孢杆菌TQ33、枯草芽孢杆菌TK-1甘油管分别按1%接种于大豆粉液态培养基进行一次活化,均活化20h,然后均按10%(v/w)的接菌量转接入二次活化培养基(同一次活化培养基)中,二次活化24h,以姜黄粉:黑胡椒粉:余甘子粉:大豆粉=5:2:1:5,料水比分别为1:0.8,1:1,1:1.2,1:1.6,1:1.8,1:2制得固态发酵培养基,并同时接种植物乳杆菌TK9、动物双歧杆菌937、副干酪乳杆菌TK1501、青春双歧杆菌TK99、凝结芽孢杆菌TQ33、枯草芽孢杆菌TK-1种子液,接种量分别均为5×107CFU/mL,进行混菌发酵。培养条件:密闭24h,37℃,pH自然。对发酵后培养基中的益生菌活菌数进行检测,结果如表7所示:表7姜黄粉及辅料与水的配比为1:0.8-2时,所得功能性食品中益生菌活菌数(CFU/g)比例1:0.81:11:1.21:1.61:1.81:2TK9单菌3.3×1088.8×1086.5×1083.2×1083.8×1081.5×108937单菌4.7×1076.7×1083.3×1082.8×1085.6×1082.6×108TK15018.8×1075.6×1083.9×1084.5×1082.8×1083.3×108TK992.6×1077.8×1084.4×1085.8×1084.9×1082.7×108TQ337.3×1075.8×1077.5×1087.3×1078.6×1076.5×107TK-13.9×1077.9×1077.3×1076.7×1075.4×1074.2×107总活菌数6.8×1089.7×1096.7×1092.8×1092.1×1093.9×109结果如表7所示:最佳料水比为1:1时测得所得姜黄益生菌发酵功能性食品中的总活菌数为9.7×109CFU/g。其中,植物乳杆菌活菌数为8.8×108CFU/g,动物双歧杆菌的活菌数达到6.7×108CFU/g,副干酪乳杆菌的活菌数为5.6×108CFU/g,青春双歧杆菌的活菌数为7.8×108CFU/g,凝结芽孢杆菌的活菌数为5.8×107CFU/g,枯草芽孢杆菌的活菌数为7.9×107CFU/g。4、培养时间的确定植物乳杆菌TK9、动物双歧杆菌937、副干酪乳杆菌TK1501、青春双歧杆菌TK99、凝结芽孢杆菌TQ33、枯草芽孢杆菌TK-1甘油管分别按1%接种于大豆粉液态培养基进行一次活化,均活化20h,然后均按10%(v/w)的接菌量转接入二次活化培养基(同一次活化培养基)中,二次活化24h,在料水比已经优化的固态发酵培养基中同时接种植物乳杆菌TK9、动物双歧杆菌937、副干酪乳杆菌TK1501、青春双歧杆菌TK99、凝结芽孢杆菌TQ33、枯草芽孢杆菌TK-1种子液,接种量分别均为5×107CFU/g,进行混菌发酵。分别混菌密闭发酵12、24、36、48h,37℃,pH自然。对发酵后培养基中的益生菌活菌数进行检测。表8不同发酵时间培养的益生菌活菌菌种标号:1号为植物乳杆菌TK9单菌,2号为动物双歧杆菌379单菌,3号为副干酪乳杆菌TK1501单菌,4号为青春双歧杆菌TK99单菌,5号为凝结芽孢杆菌TQ33单菌,6号为枯草芽孢杆菌TK-1单菌。12h24h36h48h1号4.8×1085.6×1086.7×1087.6×1082号2.2×1082.7×1083.7×1082.9×1083号5.1×1076.3×1076.3×1084.3×1084号8.4×1077.6×1071.8×1081.0×1085号5.3×1061.8×1071.6×1079.3×1066号3.7×1053.3×1053.4×1052.8×105总活菌数5.5×1098.4×1091.6×10108.6×109结果如表8所示:最佳培养时间为接种后再混菌发酵36h,总活菌数为1.6×1010CFU/g。5、固态发酵前后培养基活性成分变化植物乳杆菌TK9、动物双歧杆菌937、副干酪乳杆菌TK1501、青春双歧杆菌TK99、凝结芽孢杆菌TQ33、枯草芽孢杆菌TK-1甘油管分别按1%接种于大豆粉液态培养基进行一次活化,均活化20h,然后均按10%(v/w)的接菌量转接入二次活化培养基(同一次活化培养基)中,二次活化24h,以姜黄粉:黑胡椒粉:余甘子粉:大豆粉=5:2:1:5制得固态发酵培养基,并同时接种植物乳杆菌TK9、动物双歧杆菌937、副干酪乳杆菌TK1501、青春双歧杆菌TK99、凝结芽孢杆菌TQ33、枯草芽孢杆菌TK-1种子液,接种量分别均为5×107CFU/mL,在37℃,pH自然,混菌发酵36h。利用GB/T223.75-2008法测定姜黄素;利用高效液相法测定GABA含量;利用福林酚反应测定总酚类含量;利用GB/T23788-2009法测定黄酮类含量;利用GB/T12143.2-89法测定氨基态氮的含量;利用活氧指数法(ORAC)测定抗氧化物含量,结果见表9:表9姜黄固态食品发酵前后活性成分变化以编号表示各阶段:1-发酵前含量;2-混菌发酵后含量;3-植物乳杆菌TK9发酵后含量;4-动物双歧杆菌937发酵后含量;5-副干酪乳杆菌TK1501发酵后含量;6-青春双歧杆菌TK99发酵后含量;7-凝结芽孢杆菌TQ33发酵后含量;8-枯草芽孢杆菌TK-1发酵后含量.由以上数据可知,以姜黄粉、黑胡椒粉、余甘子粉、大豆粉按照一定比例制得的发酵培养基,在经过益生菌液态发酵后活性成分都有提高。经混菌发酵后各成分增加尤为明显,姜黄素在发酵后含量达到9.96mg/g;GABA含量在经发酵后有所增加,混菌发酵后液态饮料GABA含量达到为5.23mg/g,均高于单菌发酵,总酚类含量达到11.88mgGAE/g;经混菌发酵后,黄酮类物质含量明显增加,含量达到2.31mg/g,氨基态氮含量较发酵前均增加。混菌发酵样品相对于发酵前以及使用单菌发酵,其DPPH清除率达到了55%。实施例3:益生菌液态发酵饮料和固态发酵食品在细胞体外增殖抑制试验人肺癌细胞80ID和小鼠腹腔巨噬细胞J744.I用DMEM高糖培养基于37℃,含5%CO2空气及100%湿度条件的细胞培养箱传代培养,取对数生长期细胞用于实验。用DMEM高糖培养基培养的细胞,以约1×104孔接种于96孔板,每孔100ul置37℃,含5%CO2空气细胞培养箱中培养24小时;分别添加不同浓度的发酵物,对照组只有细胞不加发酵样品,然后在37℃,含5%CO2空气及100%湿度的细胞培养箱中孵育72小时;将5×MTT用稀释缓冲液稀释成1×MTT;每孔加50ul1×MTT,在37℃孵育4小时,使MTT还原为甲臜;吸出上清液,每孔加150ul的二甲基亚砜使甲臢(DMSO)溶解,用摇床摇匀;用酶标仪在490nm波长处检测各孔光密度;计算不同浓度的样品对细胞的半数抑制浓度(IC50)和最大抑制率。不同浓度的发酵样品对小鼠腹腔肺癌细胞80ID和巨噬细胞J744.I(正常细胞)的体外增殖抑制作用情况分别如下所示:表10姜黄发酵液态饮料对细胞生长的抑制作用产品浓度(mg/mL)80ID细胞最大抑制率J744.I细胞最大抑制率0.545.26±3.3410.21±1.001.053.13±2.1711.32±0.455.066.58±3.6213.84±0.4525.074.26±1.3715.26±0.57125.087.38±4.6627.89±1.41IC50(mg/mL)19.52±4.04>100表11姜黄发酵固态食品对细胞生长的抑制作用产品浓度(mg/g)80ID细胞最大抑制率J744.I细胞最大抑制率0.553.26±3.4312.67±0.461.055.13±2.5413.85±0.435.068.75±2.8615.67±0.3825.084.33±4.3720.33±0.24125.097.28±3.9530.69±0.34IC50(mg/g)10.52±4.65>100由表10和表11可知,抗肿瘤益生菌发酵功能性食品对小鼠巨噬细胞体外增殖的抑制作用不明显,最大致死率在10.21±1.00和30.69±0.34之间,IC50(mg/mL)均大于100,说明对正常细胞的副作用小。抗肿瘤益生菌发酵功能性饮料对人肺癌细胞均具有明显的体外增殖抑制作用。实例4:姜黄益生菌发酵液态饮料和固态食品对小鼠肉瘤S180瘤重的影响取小鼠肉瘤S180(S180)细胞腹腔内接种8d的种鼠,无菌条件下用5ml注射器抽吸出1~2ml乳白色粘稠状腹水,先用0.4%苔盼蓝染色,计活细胞率>90%,再用白细胞稀释液计数瘤细胞数,然后以灭菌生理盐水稀释调整肿瘤细胞浓度为2×106/ml,接种于小鼠右前肢腋窝皮下,每只0.1ml。于接种24h后随机分成三组:对照组、姜黄发酵液体饮料组、姜黄发酵固态食品组,每组10只。每日喂食3次,连续90d,各组喂食分别是250、500、1000mg/kg/d,对照组给予等量的生理盐水。第91d脱颈椎法处死小鼠,剥取瘤块在电子天平中称重,计算抑瘤率。抗肿瘤益生菌发酵功能性食品喂食S180荷瘤小鼠90d后,对照组小鼠一般状况较差,活动差、肉瘤呈浸润性生长;而喂食抗肿瘤益生菌发酵功能性食品的两组小鼠皮毛光泽,较活泼、瘤体包膜完整。完整剥出瘤56块后称重,结果如表12:表12抗肿瘤益生菌发酵功能性食品对S180实体瘤瘤重的影响组别n瘤重抑制率模型组101.05±0.35—喂食姜黄发酵液态饮料组100.31±0.1569.73%喂食姜黄发酵固态食品组100.24±0.2676.33%由表12可知,姜黄发酵液态饮料组和姜黄发酵固态食品组的移植性肿瘤重量明显低于模型组,抑制率为69.73%和76.33%。实例5姜黄发酵液态饮料和固态食品对内皮细胞迁移的影响参照Trochon介绍的方法,将琼脂在平皿上制成胶,并切去其中的2/3,将消化好的内皮细胞接种在切去胶的部分,培养3天后待内皮细胞长满单层后,刮去另一部分胶,并分别加入含有姜黄发酵液态饮料和固态食品的培养基,每组4个平板,对照组只加等量的DMSO培养液。继续培养48h后取出培养物,甲醛固定,染色后显微摄影记录见附图1-3。由图可知,经10mol/mL的抗肿瘤益生菌发酵液态饮料和20mol/mg的抗肿瘤益生菌发酵固态食品处理48h后,内皮细胞的迁移较对照组明显减少,差异有显著(P<0.01)。内皮细胞数随着姜黄素浓度的增加而减少,可见抗肿瘤益生菌发酵液态饮料和固态食品对内皮细胞迁移有明显的抑制作用。实例6:姜黄益生菌发酵液态饮料和固态食品抗炎性质的测定抗肿瘤益生菌发酵功能性食品对二甲苯致小鼠耳廓肿胀的影响:取健康小鼠60只,体重18-22g,随机分为5组,每组12只,分别为模型对照组,姜黄素浓度为高(520mg/kg)、中(260mg/kg)、低(130mg/kg)剂量组,阿司匹林组(0.3g/kg)。灌胃给药,连续7天,模型对照组给予等量NS(生理盐水)。在最后一次给药30min后,于右耳廓两侧均匀涂抹二甲苯30μL做为致炎耳,左耳作为对照,致炎2h后剪下两耳,用9mm打孔器,在同一耳面部位打孔,以等同打孔耳片称重,以两耳重量差为肿胀度,并求抑制率。试验结果见表13表13姜黄发酵功能性食品对二甲苯致小鼠耳廓肿胀的影响由表13可知:姜黄发酵功能性液体饮料和固体食品的高、中、低剂量组均有抑制二甲苯引起的小鼠耳肿胀趋势。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本专利构思的前提下,上述各实施方式还可以做出若干变形、组合和改进,这些都属于本专利的保护范围。因此,本专利的保护范围应以所附权利要求为准。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1