含有角蛋白的生物材料的处理的制作方法
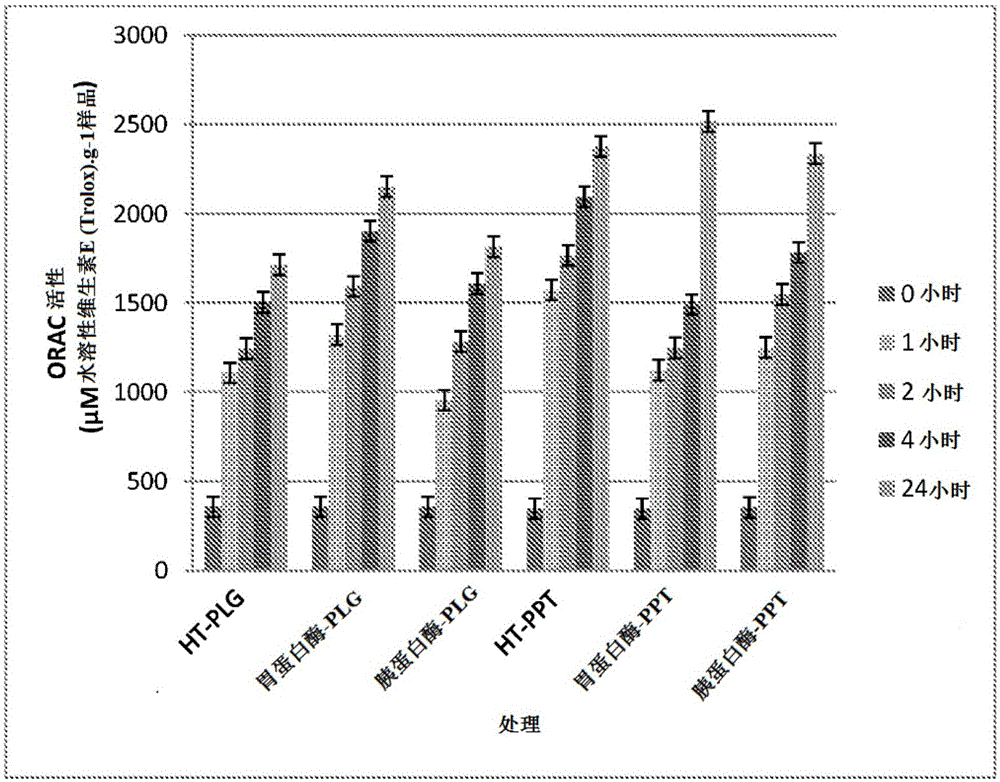
本发明总体涉及从含角蛋白的生物材料中提取富含氨基酸的级分的新方法,以及通过本文所述方法产生的富含氨基酸的蛋白质级分。
背景技术:
:高蛋白质营养源对于运动营养市场以及为营养不良的人提供均衡的食物补充剂是重要的。硫及其生物衍生物,例如半胱氨酸和谷胱甘肽,在影响体内氧化还原平衡和影响基于细胞的过程和相关的整体健康方面非常重要。角蛋白来源如羊毛、羽毛、角和蹄,蛋白质和含硫氨基酸非常高,但由于与角蛋白蛋白质中存在的半胱氨酸残基之间的二硫键相关的高交联度,通常具有低的消化率和营养价值。用于从羊毛中溶解角蛋白蛋白质的山内(yamauchi)方法(yamauchi等人(1998)生物材料科学杂志(journalofbiomaterialscience),聚合物版(polymeredition)3:259)涉及作为变性剂以破坏角蛋白结构的尿素、作为还原剂以破坏二硫键的β-巯基乙醇和作为表面活性剂的十二烷基硫酸钠(sds)。然而,所用化学变性剂/还原剂的性质使得该方法不适用于(特别是)食品级材料的商业生产。在美国专利第5,276,138号中描述了另一种由羊毛生产可溶性角蛋白蛋白质产品的方法。然而,从该文献的教导中可以清楚地看出,如果液体介质的ph小于7,则氧化剂不能很好地起作用,并且需要高浓度(>20%)的氧化剂。尽管发明人断言该产品可用作食品添加剂,但由于最终产品中存在痕量尿素,因此预计这些产品对人类来说不具有适口性。ep2461680中描述了另一种由羊毛生产可溶性角蛋白蛋白质产品的方法。该专利描述了一种营养补充剂,其包含通过以下方法制备的角蛋白蛋白质粉末,所述方法包括在ph为1.5至5.0的溶液中氧化角蛋白源,并通过一系列加热和冷却反应以及ph调节,产生角蛋白蛋白质粉末。然而,基于原料重量的相对总转化率低。为了解决现有技术方法的局限性,本发明提供了改进的方法,包括处理含角蛋白的生物材料以产生富含含硫氨基酸半胱氨酸的级分(以及代谢上重要的氨基酸精氨酸),该方法学产生显著提高的蛋白质转化效率。有利地,这些氨基酸级分可以掺入营养补充剂和食物中,供人和动物食用。技术实现要素:本文描述和要求保护的发明具有许多属性和实施方案,包括但不限于本
发明内容中阐述或描述或引用的那些。其并非旨在包括所有内容,并且本文描述和要求保护的发明不限于本
发明内容中所表明的特征或实施方案或不由本
发明内容中所表明的特征或实施方案所限定,所包括的特征或实施方案仅出于说明的目的而不是限制的目的。在第一方面,本发明提供了一种从含角蛋白的生物材料中提取富含氨基酸的级分(aminoacid-richfraction)的方法,该方法包括以下步骤:i.提供包含含角蛋白的生物材料和至少一种酸的反应混合物,其中反应混合物的ph为ph1.1至6.9;ii.将反应混合物暴露于包含温度和压力的能量源一段时间,所述时间足以在至少一种酸的存在下引起含角蛋白的生物材料的降解;和iii.从降解的含角蛋白的生物材料中提取富含氨基酸的级分其中,从含角蛋白的生物样品中提取的富含氨基酸的级分基本上不溶。在本发明的另一方面,提供了一种富含氨基酸的级分,所述级分由根据本文所述任一方法的含角蛋白的生物材料获得。在本发明的另一个方面,提供了包含富含氨基酸的级分的营养补充剂或食品,所述级分是根据本文所述的任意一种方法由含角蛋白的生物材料获得。附图说明图1显示了ht蛋白酶、胃蛋白酶和胰蛋白酶处理的来自绵羊毛(sheep’swool)处理的块(plug)和沉淀物样品的氧自由基吸收能力(oxygenradicalabsorbancecapabilities,orac)。图2显示了对于ht蛋白酶、胃蛋白酶和胰蛋白酶处理的来自绵羊毛处理的块和沉淀物样品的2,2-二苯基-1-苦肼基(2,2-diphenyl-1-picrylhydrazyl,dpph)抑制活性。图3显示了ht蛋白酶、胃蛋白酶和胰蛋白酶处理的来自绵羊毛处理的块和沉淀物样品的铁还原抗氧化能力。图4显示了ht蛋白酶、胃蛋白酶和胰蛋白酶处理的来自绵羊毛处理的块和沉淀物样品的l-亮氨酸水解度。图5显示了ht蛋白酶、胃蛋白酶和胰蛋白酶处理的来自绵羊毛处理的块和沉淀物样品的血管紧张素转换酶(angiotensin-convertingenzyme)活性。图6显示了从来自鸡羽毛的上清液、沉淀物和块(泳道2-4)获得的富含氨基酸的级分的sds/page蛋白质凝胶,以及从来自绵羊毛的沉淀物和块(泳道5、6)和来自鸡羽毛的上清液、沉淀物和块(泳道7-9)获得的富含氨基酸的级分的bolt-1d蛋白质凝胶。具体实施方式所选的定义除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。尽管与本文描述的那些类似或等同的任何测定、方法、装置和材料可用于本发明的实践或测试,但现在仍对各种测定、方法、装置和材料进行描述。旨在在引用本文公开的一系列数字(例如1至10)还包括引用该范围内的所有相关数字(例如,1、1.1、2、3、3.9、4、5、6、6.5、7、8、9和10)以及该范围内的任何有理数范围(例如2至8、1.5至5.5和3.1至4.7),因此,本文明确公开的所有范围的所有子范围都被明确地公开。这些仅是意图具体说明的实例,并且所列举的最低值和最高值之间的数值的所有可能组合应被认为在本申请中以类似方式明确陈述。如本说明书中所使用的,词语“包括”,“包含”和类似词语不应以排他性或穷举性的方式解释。换句话说,它们的意思是“包括但不限于”。如本说明书中所使用的,术语“含角蛋白的生物材料”和“含有角蛋白的生物材料”包括任何包含角蛋白蛋白质的生物材料。含角蛋白的生物材料的实例包括但不限于羊毛、羽毛、角、蹄、动物毛发(包括人发)和羽毛。如本说明书中所用,术语“富含氨基酸的级分”是指从根据本发明的方法产生的降解产物中提取的级分,并且包括单个氨基酸、包含两个或更多个通过肽键连接的氨基酸的肽或肽片段,以及具有一级、二级、三级和/或四级结构的全长/完整蛋白(in-tactprotein)。如本说明书中所使用的,首字母缩写词“wdp”的意思是“源自羊毛的蛋白质”,是由根据本发明的过程和方法产生的源自羊毛的蛋白质内容物(proteincontent)。根据定义,这包括已从羊毛获得的单个氨基酸、肽、肽片段和/或全长蛋白质。如本说明书中所用,首字母缩写词“kdp”的意思是“角蛋白衍生的蛋白质”,是源自通过根据本发明的过程和方法产生的含角蛋白的生物材料的富含氨基酸的级分。根据定义,这包括源自含角蛋白的生物材料的单个氨基酸、肽、肽片段和/或全长蛋白质。根据本发明的方法产生的wdp和kdp还可以包含柠檬酸、抗坏血酸和存在于原始的含角蛋白的生物材料中的其它矿物质。详细说明申请人试图采用山内(yamauchi)方法(yamauchi等人(1998)生物材料科学杂志,聚合物版3:259)以将尿素和sds水平降低到食品安全水平,并用偏亚硫酸氢钠代替β-巯基乙醇作为还原剂。然而,这种方法取得的成功有限,因为总收率低(<30%;数据未显示)。此外,在提取的蛋白质中保留了相对高的量的尿素。为了提高从含角蛋白的生物材料中提取的蛋白质的总收率,申请人设想了包含机械和化学(即食物酸)的提取方案,其意味着以最小的残留化学物质含量实现增加的收率,使得所得蛋白质能安全食用(即食品安全的)且适口。申请人惊奇地发现,该提取方法产生富含含硫氨基酸半胱氨酸和代谢重要的氨基酸精氨酸的产物。参考(例如)实施例14,其列出了从羊毛获得的蛋白质/肽级分的氨基酸含量(含角蛋白的生物材料的实例)。在根据本发明的某些方面,申请人已经开发了用于从含角蛋白的生物材料比如(例如)羊毛、羽毛等中提取富含氨基酸的级分的新方法。该方法包括酸和温度/压力处理步骤的新组合,以实现(i)提高的总收率,(ii)提取的含有所需氨基酸含量的蛋白质和(iii)提取的级分/产物中不含有毒化学物质。这记录在实施例1-8中,特别是实施例1-3(方案开发和优化),以及氨基酸含量分布(实施例14)。因此,在本发明的第一方面,提供了一种从含角蛋白的生物材料中提取富含氨基酸的级分的方法,该方法包括以下步骤:i.提供包含含角蛋白的生物材料和至少一种酸的反应混合物,其中反应混合物的ph为ph1.1至6.9;ii.将反应混合物暴露于包含温度和压力的能量源一段时间,所述时间足以在至少一种酸的存在下引起含角蛋白的生物材料的降解;和iii.从降解的含角蛋白的生物材料中提取富含氨基酸的级分其中,从含角蛋白的生物样品中提取的富含氨基酸的级分基本上不溶。在根据本发明该方面的实施例中,包含温度和压力的能量源是电磁能。在相关实施例中,电磁能选自微波和射频波。在另一相关实施例中,电磁能选自由煤气(gas)、电、化石燃料、木炭(charcoal)或柴火(woodfire)组成的组。可以使用任何电磁波源,如微波或射频波,只要它产生所需的温度/压力分布(profile)。这在以下实施例中说明(例如)实施例1-12使用台式微波单元(即cem微波反应系统mars6);实施例13描述了由申请人设计和制造的具有3l容量压力容器的原型微波装置的使用;并且实施例14描述了由申请人设计和制造的具有30l容量压力容器的商业规模微波装置的使用。本领域技术人员将认识到需要配置根据本发明的方法使用的微波装置的能量输出特征,以便产生所需的温度和压力组合。这通过实施例15中呈现的数据进一步说明,其中提供了对于台式3l原型和30l半工业规模微波装置的从它们中每富含氨基酸的降解产物(参见下文)获得的氨基酸含量的比较。也就是说,不管微波设备或能量源如何,只要它被优化以产生所需的能量输出(即温度和压力),那么根据本发明的方法产生的所需氨基酸级分将非常相似。在根据本发明的其它实例中,所述至少一种酸包括任意酸,包括但不限于抗坏血酸、柠檬酸、乙酸、苯甲酸、丙酸、甲酸、山梨酸、马来酸和没食子酸。在相关实例中,至少一种酸是食品级酸。食品级酸的实例是本领域技术人员已知的。在另一相关实例中,反应混合物中酸的浓度范围为1mm至8m。为避免任何疑问,1mm至8m包括但不限于1mm、2mm、3mm、4mm、5mm、6mm、7mm、8mm、9mm、10mm、11mm、12mm、13mm、14mm、15mm、16mm、17mm、18mm、19mm、20mm、30mm、40mm、50mm、60mm、70mm、80mm、90mm、100mm、150mm、200mm、250mm、300mm、350mm、400mm、450mm、500mm、550mm、600mm、650mm、700mm、750mm、800mm、850mm、900mm、950mm、1m、1.1m、1.2m、1.3m、1.4m、1.5m、1.6m、1.7m、1.8m、1.9m和2.0m、2.1m、2.1m、2.2m、2.3m、2.4m、2.5m、2.6m、2.7m、2.8m、2.9m、3.0m、3.1m、3.2m、3.3m、3.4m、3.5m、3.6m、3.7m、3.8m、3.9m、4.0m、4.1m、4.2m、4.3m、4.4m、4.5m、4.6m、4.7m、4.8m、4.9m、5.0m、5.1m、5.2m、5.3m、5.4m、5.5m、5.6m、5.7m、5.8m、5.9m、6.0m、6.1m、6.2m、6.3m、6.4m、6.5m、6.6m、6.7m、6.8m、6.9m、7.0m、7.1m、7.2m、7.3m、7.4m、7.5m、7.6m、7.7m、7.8m、7.9m和8.0m的酸。在根据本发明该方面的另一个实例中,所述至少一种酸是抗坏血酸。抗坏血酸可以以1mm至2m抗坏血酸的浓度存在于反应混合物中。即,1mm、2mm、3mm、4mm、5mm、6mm、7mm、8mm、9mm、10mm、11mm、12mm、13mm、14mm、15mm、16mm、17mm、18mm、19mm、20mm、40mm、60mm、80mm、100mm、200mm、300mm、400mm、500mm、600mm、700mm、800mm、900mm和1m、1.1m、1.2m、1.3m、1.4m、1.5m、1.6m、1.7m、1.8m、1.9m和2.0m的抗坏血酸。在一个具体实例中,抗坏血酸以约6mm的浓度存在于反应混合物中。在根据本发明该方面的另一个实例中,所述至少一种酸是柠檬酸。柠檬酸可以在20℃下以50mm至8m柠檬酸的浓度存在于反应混合物中。即,50mm、51mm、52mm、53mm、54mm、55mm、56mm、57mm、58mm、59mm、60mm、61mm、62mm、63mm、64mm、65mm、66mm、67mm、68mm、69mm、70mm、71mm、72mm、73mm、74mm、75mm、76mm、77mm、78mm、79mm、80mm、81mm、82mm、83mm、84mm、85mm、86mm、87mm、88mm、89mm、90mm、91mm、92mm、93mm、94mm、95mm、96mm、97mm、98mm、99mm、100mm、101mm、102mm、103mm、104mm、105mm、106mm、107mm、108mm、109mm、110mm、111mm、112mm、113mm、114mm、115mm、116mm、117mm、118mm、119mm、120mm、150mm、200mm、300mm、400mm、500mm、600mm、700mm、800mm、900mm和1m、2m、3m、4m、5m、6m、7m和8m柠檬酸。在特定实例中,柠檬酸以约90mm的浓度存在。在根据本发明该方面的又一个实例中,反应混合物的ph为3.0至4.5,即3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4和4.5。在特定实例中,反应混合物的ph为3.5。在根据本发明该方面的另一个实例中,酸/温度/压力降解的含角蛋白的生物材料的ph在2.5和3.5之间。即2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4和3.5。在特定实例中,酸/温度/压力降低的含角蛋白的生物材料的ph为3.3。在根据本发明该方面的又一个实例中,由能量源(例如微波或射频波)施加的温度在110℃和200℃之间施加。即取决于期望的能量输入,为110℃、115℃、120℃、125℃、130℃、135℃、140℃、145℃、150℃、155℃、160℃、165℃、170℃、175℃、180℃、185℃、190℃、195℃和200℃,以及它们之间的整数。在特定实例中,由能量源施加的温度在160℃和180℃之间施加。即,160℃、161℃、162℃、163℃、164℃、165℃、166℃、167℃、168℃、169℃、170℃、171℃、172℃、173℃、174℃、175℃、176℃、177℃、178℃、179℃和180℃。在相关示例中,使用递增方案(rampedprotocol)施加由能量源施加的温度。其原因是为了确保在提取方法中使用的反应混合物(一个或多个容器)中的内容物的均匀加热,使得含角蛋白的生物材料以最大化转化效率并由此最大化收率的方式进行处理。在根据本发明该方面的另一个实例中,由能量源施加的压力在75磅/平方英寸(psi)和220psi之间施加。即,75psi、76psi、77psi、78psi、79psi、80psi、81psi、82psi、83psi、84psi、85psi、86psi、87psi、88psi、89psi、90psi、91psi、92psi、93psi、94psi、95psi、96psi、97psi、98psi、99psi、100psi、101psi、102psi、103psi、104psi、105psi、106psi、107psi、108psi、109psi、110psi、111psi、112psi、113psi、114psi、115psi、116psi、117psi、118psi、119psi、120psi、121psi、122psi、123psi、124psi或125psi、130psi、135psi、140psi、145psi、150psi、155psi、160psi、165psi、170psi、175psi、180psi、185psi、190psi、195psi、200psi、205psi、210psi、215psi和220psi。基于本说明书提供的教导,本领域技术人员将理解,由能量源提供的温度和压力的组合(与反应混合物中包含的酸组合)对于实现所需的角蛋白蛋白质到富含氨基酸的一种或多种级分的转化是必要的。通过“富含氨基酸”,该级分不仅可以包括单个氨基酸,还可以包括形成肽或肽片段一部分的氨基酸,以及全长/完整的角蛋白蛋白质(具有一级、二级、三级和/或四级结构)。在根据本发明该方面的另一个实例中,在能量暴露步骤之后将至少一种稳定剂加入到反应混合物中,以便维持还原环境以防止角蛋白蛋白质通过角蛋白二硫键的重新形成而再聚合。这允许通过根据本发明的方法产生的各种级分(即上清液、沉淀物和/或块降解产物)在提取富含氨基酸的级分之前储存。根据本发明的稳定剂的实例包括但不限于抗坏血酸。对于本领域技术人员显而易见的是,可以改变根据本发明的方法中使用的处理参数,以产生例如(i)取决于它们的预期效用(例如包含在营养补充剂、食品级产品或个人卫生产品中),包含不同分子量多肽和/或蛋白质(例如,低分子量、中分子量或高分子量)的富含氨基酸的级分,(ii)在非/还原条件下自发地再聚合或在处理后保持未聚合(即没有二硫键/三级结构)的富含氨基酸的级分。通过改变例如酸的类型、酸浓度、温度和/或压力分布,在分离和/或组合中,通过根据本发明的方法产生的富含氨基酸的级分具有不同的结构特征(即大小、再聚合倾向、气味、味道等),使它们适合包含在不同的产品(例如)食品和/或营养补充剂中,或个人卫生产品中。在又一个实例中,根据本发明该方面的方法产生分离的降解产物,包括但不限于上清液、沉淀物和块。仅作为说明,参考实施例7、9、11-14和17。本领域技术人员将熟悉这些术语。因此,富含氨基酸的级分可以从任何一种或多种降解产物中提取,尽管在特定的实例中,富含氨基酸的级分是从沉淀物和/或块中获得的。可以对根据本发明方法产生的富含氨基酸的级分进行洗涤方案,以减少或消除与不希望有的气味和/或味道相关的问题。仅作为说明,实施例18描述了旨在用于包含在个人卫生产品中的角蛋白衍生蛋白的洗涤方案,其涉及水基洗涤步骤。通过进一步说明,实施例19描述了旨在用于包含在食品或营养补充剂中的角蛋白衍生蛋白的洗涤方案,其涉及稀释的醇和低盐的组合。作为常规问题,本领域技术人员将理解,根据所用处理的性质,可以使用不同的洗涤方案来减少或消除不希望有的气味和/或味道。在根据本发明该方面的又一个实例中,含角蛋白的生物材料包括但不限于羊毛、角、蹄、鱼加工废物,包括人类头发的动物毛发和羽毛。在特定的实例中,羊毛来自绵羊或山羊,羽毛来自鸟类如鸡(母鸡)。有利地,根据本发明的方法从含角蛋白的生物材料中提取的富含氨基酸的级分含有高百分比的所需氨基酸,如精氨酸和半胱氨酸。参考实施例14(使用3l原型微波装置处理羊毛),从沉淀物和块中提取的相对半胱氨酸含量分别为5.9/79.5(~7.5%)和11.8/77.8(~15%),并且从沉淀物和块级分中提取的相对精氨酸含量分别为8.3/79.5(~10%)和6.5/77.8(~8%)。半胱氨酸是所需的,因为它富含硫,并且精氨酸是所需的,因为它具有代谢重要性。根据本发明的方法从含角蛋白的生物材料中提取的富含氨基酸的级分基本上不溶。术语“基本上不溶”意指富含氨基酸的级分大部分(如果不是这种情况,则完全)不溶。然而,本领域技术人员将认识到,例如,包含单个氨基酸的级分可具有小的可溶性组分,也就是术语基本上不溶。富含氨基酸的级分基本上不溶,降低了游离半胱氨酸残基经历氧化的可能性,从而赋予稳定性。在含角蛋白的生物材料降解后(即能量暴露步骤后),反应混合物的ph通常在2.5至3.5的范围内,特别是3.3。重要的是,这意味着与从生物材料中提取含角蛋白的蛋白质的本领域已知方法相比,从降解的含角蛋白的生物材料中提取的富含氨基酸的级分具有增加的保质期、适口性和可消化性。此外,重要地,从各种降解产物中获得的富含氨基酸的级分具有抗氧化剂/自由基清除活性,例如氧自由基吸收能力(orac)、2,2-二苯基-1-苦肼基(dpph)自由基清除活性和铁还原抗氧化能力(frap)。参见实施例16。因此,在本发明的另一个方面,提供了一种富含氨基酸的级分,其由根据本文所述的任何一种方法的含角蛋白的生物材料获得。最后,从含角蛋白的生物材料中提取的富含氨基酸的蛋白质级分可以配制在营养补充剂中或作为人和动物食用的替代原料提供。由于包括化学(例如食物酸)和物理(温度和压力)参数的组合的独特的提取方法,富含氨基酸的蛋白质级分是食品安全的并且出乎意料的可口,使其成为有用的替代原料。实施例10(小鼠喂养研究)中提供的数据说明了这一点,该数据证明了补充了10%富含氨基酸的蛋白质和10%酪蛋白蛋白质级分的餐食就成分和动物总重量而言和含有20%酪蛋白(蛋白质)的饮食进行得一样好。因此,在本发明的另一个方面,提供了营养补充剂或食品,其包含从根据本文所述任一方法的含角蛋白的生物材料获得的富含氨基酸的蛋白质级分。在本说明书中对现有技术文献的任何引用不应被认为是承认这种现有技术是众所周知的或构成本领域公知常识的一部分。参考以下实施例进一步描述本发明。应当理解,要求保护的本发明不受这些实施例的任何限制。实施例实施例1处理方案开发使用从质量纱线有限公司(qualityarnslimited)(米尔顿)获得的洗净的新西兰绵羊毛作为含角蛋白的生物材料的来源,通过化学和物理降解方法的组合来试验/开发初始处理方案。令人惊讶的是,申请人表明食物酸处理和作为能量源的微波的特定组合,任选地包括温度升高以根据所用的微波装置实现所需的温度输出,可以实现含角蛋白的生物材料的所需降解。1.1.微波处理申请人使用台式分析cem微波反应系统mars6试用微波作为能量源来溶解/降解羊毛(作为含角蛋白的生物材料),在水中以1∶40的羊毛∶水的比在150℃/10分钟(min)的条件下微波羊毛。然而,这种方法本身并不成功,因为羊毛形态保持不变。1.2.温度递增为了减轻不同管之间的温度变化,申请人试用了一种温度递增技术,其中温度在20分钟(min)期间内从室温(rt)升高到150℃,然后在150℃保持10分钟(min)。虽然羊毛的外观从白色变为棕色,但是在扫描电子显微镜(sem)下羊毛纤维的形态保持不变。1.3.在羊毛处理过程中含有酸(微波+温度)使用台式分析cemmars微波消解仪(xpressmarsmicrowave),申请人在羊毛反应混合物中添加酸,以促进降解过程以及防止肾毒性lal的产生。申请人使用一系列无机酸和有机酸:盐酸(hcl;ph3.1和4.6)、乙酸(ph3.1)和乙酸钠(在ph3和ph4.5下缓冲)、柠檬酸钠(在ph3和ph4.5下缓冲)和抗坏血酸钠(在ph3和ph4.5下缓冲)。缓冲用于在微波期间维持酸性ph。所有溶液均以0.1m使用(除了hcl,其以略微>0.1m使用)。选择使用的ph以便在食物的可接受范围内,例如橙汁的ph值为3.3至4.2。除了降低ph的能力之外,还选择抗坏血酸作为还原剂。羊毛∶水的比例为1∶40。试验了三种温度方案,每种方案持续10分钟(min):150℃、170℃和190℃。递增包括在10分钟(min)内从室温(rt)到最终温度(即150℃、170℃或190℃)加热,然后在最高温度下保持10分钟(min),然后冷却40分钟(min)至~40℃以允许安全地打开管。1.4.结果使用扫描式电子显微镜(sem)和光学显微镜(lm)评价微波羊毛。抗坏血酸管中的羊毛变成棕色。所有190℃管“发臭”。hcl在170℃下非常臭(指向h2s?)。排除标准:臭味/h2s存在;深色/“烧焦”;(特别是)角质层的破坏程度低。150℃/10min:变化非常小;在所有sem中都可见完整的角质层。170℃/10min:更大幅度的变化。hcl(ph4.6)/乙酸钠(ph4.5)仅剩下小球状羊毛,剩余的羊毛块具有“果冻状、毛毡状核心”。抗坏血酸钠(ph3)具有“全程棕色/毡合的(felted)”羊毛块。sem还显示出具有毡合外观的羊毛束(woolstrands)。抗坏血酸钠(ph4.5)具有“非常深棕色的球状羊毛”。柠檬酸钠(ph3和4.5)得到白色混浊液体/沉淀物(ppt)。190℃/10min:所有管发臭(指向h2s?)。hcl管(ph3.0和4.6)得到非常混浊的黄白色溶液,含有ppt。柠檬酸钠(ph3和4.5)得到白色混浊溶液。抗坏血酸钠ph3具有所有管的最佳外观:淡黄色和少量ppt。剩余的羊毛(块)具有肉的外观,即非纤维状。在sem下,羊毛角质层几乎完全被破坏。抗坏血酸钠ph4.5:深棕色溶液,大量沉淀物(ppt)。sem:角质层比在ph3下的抗坏血酸钠破坏较少。柠檬酸钠ph3具有“淡黄色,少量ppt”,而柠檬酸钠ph4.5产生残留的羊毛块,其为非纤维状,“外观为硬的/冰状”。1.5.微波后步骤的溶液的最终ph测量由于抗坏血酸和柠檬酸都是有机酸,其降解温度接近处理方案中使用的温度(即150-190℃),申请人在微波处理后测量溶液的最终ph值,以便了解有多少一种或多种酸仍未降解。除了一个含有未缓冲蒸馏水的对照管外,所有管的ph(在所有三个温度下)的ph均<5。此外,所有缓冲的抗坏血酸钠和柠檬酸钠管(在所有三个温度下)的最终ph值均在反应混合物的初始ph值的0.4ph单位内,例如<ph3.4和<ph4.9。1.6.结论(i)抗坏血酸对羊毛降解至关重要;(ii)ph3比ph4.5获得更好的结果;(iii)柠檬酸也会分解羊毛,并产生比抗坏血酸更多的沉淀物;(iv)在190℃下,抗坏血酸和柠檬酸(在较低的ph下?)的组合是优选的实施例2处理方案优化#1所有抗坏血酸钠管中的羊毛变成棕色,这可能是由于高浓度的抗坏血酸盐(0.1m=100mm)。因此,申请人降低抗坏血酸浓度并保持柠檬酸盐浓度相同,后者部分地为了维持低ph。还希望降低抗坏血酸盐浓度以降低成本,因为抗坏血酸比柠檬酸贵得多。2.1.无缓冲抗坏血酸和柠檬酸的使用在之前的实验中,较低的ph可使羊毛更好地降解。因此,申请人选择试用无缓冲的抗坏血酸和柠檬酸。一个优点是含羊毛溶液的初始ph值会降低;虽然可能的缺点是缺乏“缓冲”能力可能导致微波期间ph值升高。抗坏血酸的氧化似乎在较低的ph下被抑制:与在ph4.5下的相同溶液相比,已经留在台上的0.1m抗坏血酸钠ph3溶液瓶的黄化较慢。在最后的实验中,抗坏血酸氧化可以解释ph4.5的抗坏血酸190℃管中羊毛的棕色。2.2试用不同浓度的无缓冲抗坏血酸/柠檬酸然后试用了不同浓度的无缓冲抗坏血酸/柠檬酸,即:1.100mm(=0.1m)柠檬酸(ca)2.1,000mm(=1m)ca(在ph1.51下测量ph)3.10mm抗坏血酸(aa)+900mm(=0.9m)ca(在ph1.63下测量ph)4.10mmaa+90mmca5.25mmaa+75mmca6.50mmaa+50mmca7.75mmaa+25mmca8.5mmaa+90mmca(仅190℃/30min)9.100mmaa10.100mm抗坏血酸钠ph3.132.3增加微波时间为了降低最高温度,申请人尝试更长的微波时间:从190℃到170℃/30min以及190℃/30min(抗坏血酸(~190℃至192℃)和柠檬酸(≥175℃)的文献分解温度)。2.4使用最小的温度递增1.在10分钟(min)内室温(rt)递增至(->)170℃2.保持在170℃/30分钟(min)2.5结果在这些实验中使用的酸/微波处理产生三个分离的级分(discretefraction),即上清液(s/n)、沉淀物(ppt)和块(plg)。使用10mm抗坏血酸+90mm柠檬酸在170℃/30min达到整体最佳结果:羊毛为纯黄色(solidyellow),良好降解;溶液为较深的橙色。最有希望的是,黄色溶液加羊毛出现严重破碎。羊毛:水的比例为1∶33。相比之下,相同浓度的酸在190℃/30分钟(min)产生更深的溶液,块很少,大多数变成溶液/棕黑色;深棕色溶液;微弱的“马麦酱(marmitey)”气味。几乎所有浓度的化学物质在190℃/30min都会产生深棕色/黑色溶液,这表明羊毛过度煮熟(over-cooked)。最佳结果是5mmaa+90mmca,其得到浑浊的黄棕色ppt/溶液;ppt更“呈泥状(sludgey)”-可能会与水乳化。干燥后,该管中为毡合“橡胶状”块。该管中缺少黑色可能是由于较低的aa浓度(5mm)。深色可能是由于抗坏血酸氧化造成的。2.6结论5mmaa在190℃/30min为190℃管的最少棕色。较低的aa浓度与ca在190℃/30分钟(min)无递增组合:1.1mmaa+90mmca2.2.5mmaa+90mmca3.5mmaa+90mmca4.7.5mmaa+90mmca5.1mmaa+50mmca6.5mmaa+50mmca7.2.5mmaa+75mmca8.5mmaa+75mmca这些实验产生了不一致的结果,可能是由于管之间微波加热的差异:例如1mmaa+90mmca产生更好的颜色/浅色ppt;2.5mmaa+90mmca产生黑色;5mmaa+90mm给出了良好的结果。通过sem分析的一些管的沉淀物样品都具有类似的看上去无定形的结构。实施例3处理方案优化#23.1在190℃/30分钟(min)下低aa浓度的重复由于实施例2中列出的实验的结果不一致,进行随后的实验(一式三份),每种条件用三个管。申请人尝试了aa浓度范围(均与90mmca组合):1mmaa、2.5mmaa、5mmaa、7.5mmaa以及5mmaa(无ca)。三次重复之间的外观差异很大。对于5mmaa+90mmca和7.5mmaa+90mmca的管观察到最佳结果。基于这些数据,申请人选择6mmaa+90mmca作为微波的反应混合物。随后,在微波处理后加入10mmaa至液体(包括上清液(s/n)和沉淀物(ppt)降解产物)和用于储存块(plg)的蒸馏水,以便在还原环境中维持降解的羊毛蛋白质,使得角蛋白蛋白质不会通过角蛋白二硫键的重新形成而再聚合。反应混合物配方90mm柠檬酸17.293克/升6mm抗坏血酸1.057克/升用milli-q水补足1升。申请人最初使用来自超市的汉塞尔(hansell)的食品级柠檬酸(100g容器)和科学级抗坏血酸。3.2温度递增方案+结果在最后的实验中三次重复之间的不一致结果之后,表明热的管可以吸收更多的微波,从而增加温度差异。为了解决这个问题,采用温度递增方案以逐步增加每个管的温度,从而产生更多的可重复性温度:在中等温度下保持温度应允许所有管的时间都“赶上”。使用的温度递增方案如下:1.在5min内从rt递增到(->)100℃。2.在100℃保持5min。3.在5min内从100℃递增至(->)150℃。4.在150℃保持5min。5.在5min内从150℃递增至(->)190℃。6.在190℃保持30min。7.使冷却~40℃。然后申请人将微波羊毛的量从0.4g增加到1g,并将反应混合物/marsxpress管的体积从10ml增加到25ml,得到相同的1∶25的羊毛∶水的比。温度递增似乎增加了该过程的有效温度,因此申请人假设最高微波温度可以从190℃/30min降低到170℃/30min。有利地,这也将温度降低到低于如文献报道的(≥175℃)柠檬酸的分解温度。然后使用的温度递增方案如下:1.在5min内从rt递增到(->)100℃。2.在100℃保持2min。3.在4min内从100℃递增至(->)140℃。4.在140℃保持2min。5.在4min内从140℃递增至(->)170℃。6.在170℃保持30min。7.使冷却~40℃。观察到的结果再次不一致。交替使用良好管和过度蒸煮的管。申请人还观察到许多未煮熟的管,其中留有纤维状羊毛。然后申请人尝试将最高温度(170℃)的时间长度从30min延长至40min。此外,所有递增和保持时间延长至5min,以尝试提高管之间加热的一致性:1.在5min内从rt递增到(->)100℃。2.在100℃保持5min。3.在5min内从100℃递增至(->)140℃。4.在140℃保持5min。5.在5min内从140℃递增至(->)170℃。6.在170℃保持40min。7.使冷却~40℃。采用这种改进的温度递增方案的结果是正面的,观察到黄色(所需的)。一些管(3-4根管)具有非常大量的沉淀物,申请人归因于破碎的块。一根管中没有块。微波羊毛的量从1克增加到1.5克。这使得羊毛∶水的比例从1∶25变为1∶17,并且仍然导致羊毛完全转化为三种降解产物(上清液、沉淀物和块)。实施例4处理方案优化#34.1称重羊毛微波实验然后申请人使用改进的温度递增方案(如上所述)在170℃/40min下测试已知重量的微波羊毛样品,分离成上清液、沉淀物和块降解产物,然后冷冻干燥并称重,以便获得羊毛到(->)级分的转化率(即)收率的准确估计。羊毛样品平均为~1.250克(范围为1.198克-1.302克)。申请人还尝试了三种不同浓度的柠檬酸(ca),因为尚未充分研究较低ca浓度的影响。反应混合物ph初始溶液ph最终s/n(平均4根管)6mmaa+90mmca2.34.16mmaa+50mmca2.44.66mmaa+25mmca2.64.7在微波后将10mmaa加入到最终上清液和沉淀物溶液中以维持还原环境,因此微波后随即溶液的ph值将高于上面给出的值(即添加的抗坏血酸会降低最终s/n溶液的ph)。所有浓度均以一式四份进行测试,即总共3×4=12根管。4.2结果90mmca管尚好(ok)/良好;50mmca大多数管良好/尚好(ok);25mmca这三个管具有很好/浅色(“白色”)但块明显更大/纤维状。因此,这些数据表明溶解块需要90mmca。将微波羊毛+溶液收集到单独的上清液、沉淀物和块的管中以进行氨基酸分析(参见下面的实施例5)。实施例5微波羊毛级分的氨基酸分析制备上清液、沉淀物和块级分的每种的冷冻干燥级分,并送至新西兰梅西大学(masseyuniversity)营养实验室进行氨基酸分析。该方法包括在浓hcl中过夜水解肽键,得到总氨基酸浓度。注意,这些分析并不表明氨基酸是游离氨基酸,还是形成肽、蛋白质等的一部分的氨基酸。使用过甲酸将胱氨酸氧化成半胱氨酸以减少二硫键;所以这些分析也没有提供有关半胱氨酸氧化态的信息。还将蛋氨酸氧化成甲硫氨酸亚砜。5.1结果氨基酸以mg/100mg(=重量百分比)定量。色氨酸基于先前对源自羊毛的蛋白的分析的氨基酸分析进行估计。每个值代表单独样品。s/nppt块(plug)总蛋白质(包含色氨酸(trp)(估计(est.)))(mg/100mg)56.885.384.4半胱氨酸(包含胱氨酸)3.99.616.2沉淀物和块级分在胱氨酸/半胱氨酸方面的含量高(注意:半胱氨酸含量高的角蛋白蛋白质)。而且,申请人在s/n降解产物中观察到大量残留食物酸。实施例6反应混合物的离子电导率测量由于反应混合物是高酸性的,因此为了在半工业规模的微波设备中使用而研究离子导电性。使用奥塔哥大学(universityofotago)化学系提供的设备进行分析。使用0.1n(=0.1m)kcl溶液校准离子电导率探针。6.1结果溶液成分电导率6mmaa+50mmca2,540μs/cm6mmaa+90mmca3,050μs/cm0.1m(=100mm)ca3,180μs/cm1m(=1,000mm)ca7,580μs/cm这些数据表明,6mmaa+90mmca反应混合物具有约为~3000μs/cm的离子电导率。相比之下,0.1mkcl=12,150μs/cm;海水~50,000μs/cm。6mmaa+90mmca反应混合物的电导率低于kcl(0.1m)当量浓度的原因是抗坏血酸和柠檬酸是弱酸,因此在溶液中不会完全电离(=解离),不像完全电离的kcl(盐)。实施例7三种源自羊毛的蛋白(wdp)级分中的柠檬酸和抗坏血酸的hplc分析由于从冷冻干燥的s/n级分(~56%)的低氨基酸/蛋白质回收,申请人希望确定在源自羊毛的蛋白质级分中剩余多少柠檬酸和抗坏血酸。这些分析在0.5%h3po4(磷酸;ph1.74)缓冲系统存在下进行,该缓冲系统通过将0.5ml浓h3po4加入1升纯化(milli-q)水中制备。流速1.5毫升/分钟(ml/min)。在208纳米(nm)下检测,这对柠檬酸是最佳的。在注射之前,所有样品通过0.45μm过滤器预过滤。样品制备:从上清液、沉淀物和块级分的每个中取出三个单独的样品,其已先前压碎并过筛。特别是块大且分离,外观有些纤维状;然而,使用石杵(stonepestle)将所有粉末(包括块和上清液)通过金属筛并研磨成细粉。沉淀级分未经过筛分/粉碎,因为它是细粉末形式并且具有分离的、非常小的固体小块的外观。上清液粉末具有不均匀的外观,具有不同颜色的斑块,可能是由于存在白色柠檬酸(white-ishcitricacid);所以也将这种粉末通过筛。与降解产物相关的所有粉末的相对溶解度存在显著差异。上清液完全溶解,没有残留的颗粒,产生颜色非常少(1ittlecolour)的溶液。沉淀物在纯化水中产生混浊的悬浮液,在管底部沉积非常小的颗粒。悬浮液具有略微黄色的外观,大部分沉淀物级分保持未溶解。块级分产生淡黄色悬浮液,其中含有大量不溶解的固体颗粒。管未涡旋或在室温下温育以提取酸;因此,沉淀物和块级分中对于酸所得到的值构成下限。所有溶液均通过0.45μm过滤器过滤。7.1hplc数据(w/w)%+结果羊毛/角蛋白来源的蛋白质级分中抗坏血酸和柠檬酸的估计量。来自2.5升反应混合物的wdp级分中的残余抗坏血酸和柠檬酸:3.6g抗坏血酸和23.7g柠檬酸。还研究了合并级分中残留酸的量:wdp级分中残留的抗坏血酸和柠檬酸的量可能代表下限,因为从沉淀物和块级分不完全提取(还有由于在10mmaa中块的储存导致的块级分中的一些额外的抗坏血酸)。这些数据表明,从最初的反应混合物中,45%的柠檬酸和100%的抗坏血酸在微波过程中已经降解。残留的抗坏血酸小于微波加入后的添加量,表明在随后的级分储存期间微波后添加的额外抗坏血酸会有一些降解。实施例8三种wdp级分中的硒浓度评估了三种角蛋白衍生的蛋白质级分的硒浓度。s/nppt块硒(μg/100g)7.419.527.4虽然硒的量远远低于巴西坚果(1,917μg/100g,最富含硒的食物),但沉淀物和块级分在互联网上最富含硒的食物列表中排名第10:http://www.healthalliciousness.com/articles/foods-high-in-selenium.php实施例9用于从羊毛获得的三种wdp级分的矿物质含量分析的干灰化hplc分析后,分析来自羊毛的角蛋白衍生的蛋白质级分粉末以确定灰分/矿物质含量。级分干灰分(w/w))s/n0.44ppt0.05块0.14相比之下,羊毛干灰分/矿物质含量的文献值从~0.5%到~2.3%变化。实施例1028天小鼠喂养研究10.1混合三种角蛋白衍生的蛋白质级分用于小鼠喂养研究申请人使用氨基酸分析结果来确定用于小鼠喂养研究中三种wdp级分的比例。从先前的氨基酸分析结果(平均在0.84mg色氨酸/100mg总氨基酸,或总蛋白质的0.84%)估计色氨酸浓度。级分的干灰分含量估计为在~7%;这可能在级分之间不同。虽然上清液级分可能具有最高浓度的游离氨基酸/短肽(可能更容易消化),但申请人决定由于其高浓度的柠檬酸(hplc测量~31%)而最少化地使用上清液级分。但是请注意,少量上清液级分保留在混合物中。申请人选定上清液:沉淀物:块的比例为5∶55∶40。该比例含有~9%的柠檬酸。由于wdp混合物将占小鼠餐食中总蛋白质的50%,因此4.5%的总蛋白质将包含柠檬酸(即每100克蛋白质4.5克)。实验和对照餐食都补充了额外的蛋氨酸。申请人的混合物含有11.9%的半胱氨酸/胱氨酸、8.9%的柠檬酸和1.4%的抗坏血酸。10.228天小鼠喂养研究的结果在wdp/酪蛋白(50∶50;实验)和酪蛋白(对照)餐食28天后,对小鼠实施安乐死并取出其血浆样品由新西兰兽医病理学有限公司(newzealandveterinarypathologyltd)进行分析。实验组中有十只小鼠,对照组中有十只小鼠。wdp补充组和对照组在总蛋白、白蛋白、球蛋白、alp(碱性磷酸酶)、ast(天冬氨酸氨基转移酶)、胆红素、hdl、ldl和胆固醇之间没有观察到显著差异。两组之间的最终体重也没有显著差异。实验组餐食中酪蛋白的量低于最低蛋白质需要量,表明wdp是可消化的并且能够被该组中的动物用作蛋白质来源。实验组小鼠血清中蛋白质(例如总蛋白、白蛋白和球蛋白)的量与对照组相同(其中100%的膳食蛋白来自酪蛋白),表明实验组中的蛋白质摄入量足够。此外,两组动物的体重和其食物摄入量相同。实施例11使用可变柠檬酸浓度微波的已知重量的wdp的三个级分中的蛋白质回收百分比将羊毛样品称重至三位有效数字。将wdp级分冷冻干燥并称重。基于梅西大学营养学系对wdp级分的氨基酸分析计算每个级分中的蛋白质的量,其给出每个级分中氨基酸(=蛋白质)的总百分比(=mg/100mg)。然后使用该数字计算从羊毛样品中回收蛋白质的百分比,假设羊毛是100%蛋白质。通常认为羊毛仅含有95%的蛋白质,因此获得的百分比是回收百分比的低估值。表中的数字是具有相同酸(例如6mm抗坏血酸和90mm柠檬酸)浓度的3或4个管的平均值。结果表明所有上清液和沉淀物的管都是所需的颜色(即白色/黄色)。6mm抗坏血酸+25mm柠檬酸的管具有最浅色的块(4个中的3个被描述为“淡色”、“浅色”和“浅的”)。11.1产生的wdp蛋白质级分的总重量将6升含微波羊毛的溶液(6mmaa+90mmca)冷冻干燥(2.5l+3.5l)。使用小型家用咖啡研磨机将所有冷冻干燥的粉末研磨成细粉。基于梅西大学营养学系进行的wdp级分的氨基酸分析计算每个级分中的蛋白质的量,其给出每个级分中氨基酸(=蛋白质)的总百分比(=mg/100mg)。计算6l反应混合物中的总蛋白质为~1.3g羊毛/25ml反应混合物×240(6l=6000ml/25ml)=~312g羊毛总量。11.2结果kdp级分冷冻干燥粉末的重量/g计算的蛋白质/g总蛋白质百分比/%s/n192.05108.644ppt94.058032块71.660.224总量357.7248.8100248.8g蛋白质/312g羊毛×100=从羊毛中回收~80%蛋白质。实施例12三种wdp级分的蛋白质/sdspage凝胶三种wdp级分在sds-page凝胶上跑胶。将来自三个wdp级分的两个1mg等分试样的粉末称重并使用两种样品分析方法对每个级分进行分析:ief(等电聚焦)再水化缓冲液(iefrb)和bolt1d-page缓冲系统。12.1iefrb将100μliefrb加入1mg粉末中,悬浮并在室温下浸泡1小时,然后将5ul等分试样加载到凝胶上。12.2bolt1d-page将100μl1bolt1d-cage样品缓冲液(包括还原剂)、悬浮粉末加热至90℃/5min(相比于方案中70℃/10min),然后将2μl和5μl等分试样加载到凝胶上。12.3结果1.可溶性物质呈现主要来自~3.5kda-10/15kda。2.在凝胶上仅可见溶解/降解的内容物。iefrb不能提供更好的溶解性,实际上对于块的情况更不好。3.上清液和沉淀物泳道中可溶性物质的比例较高。在块的泳道中,获得从3.5kda拖尾(smearing)到(->)加载(loading)良好,表明高比例的不溶性/较高分子量产品。4.两种缓冲液均含有大量的还原剂(ief具有50mmdtt;bolt1d-page系统还原剂专有)。实施例13使用3l压力容器容量原型微波装置的处理方案13.1微波规格3l压力容器容量原型微波炉(prototypemicrowaveapparatus)采用三个家用型2450mhz磁控管微波发生器,单独的电源供给至中央3l六角形压力容器。申请人设计出每个磁控管三个短截线调谐器,以调节微波强度并最小化反馈。然而,调谐器由铝制成,并且这些调谐器通过微波的电弧放电而逐渐与调谐器插座融合。因此,申请人用黄铜调谐器代替以优化功能性。13.2样品制备在2.30l微波反应混合物中加入130g羊毛(从新西兰马里诺(nzmarino)获得,经过洗涤但未经索氏提取(soxhlet-extracted))(羊毛:水比为1∶18)。微波反应混合物包含:90mm柠檬酸38.472克/升6mm抗坏血酸2.352克/升用milli-q水补足至2.225l。13.3微波温度优化至160℃原型微波更有效;原始温度递增方案(即最大温度170℃/40min,与marsxpress分析台式微波一起使用时,产生“非常大的暗的‘肉馅状(rissole)’块”;在3l原型微波炉中温度/时间下降至170℃/30min,但羊毛仍然过度蒸煮)。控制器的温度读数取自四个外部热电偶“棒”,其与压力容器的外部接触。由于这些棒过低估计温度读数10℃,在控制器上将最高温度调节到160℃/30min以补偿这个误差。13.4减少微波羊毛量使用160℃/30min的处理方案,观察到小的(~2g)似乎是“未煮过的”羊毛的残留物,主要包含在块内。申请人将每个循环的羊毛量从130g减少到120g,然后减少到110g,最后减少到100g。这消除了未加工羊毛残留物的产生。13.5液体级分的离心(含有s/n和ppt级分)液体级分在1l瓶中以1000转每分钟(rpm)/10分钟(min)离心,然后以4000rpm/2min离心成丸状并分离沉淀级分(离心转子保持6×1l的瓶子)。将微波液体冷冻过夜,然后解冻。离心时,沉淀物的量显著增加。在一些情况下,在冻融之前和之后通过离心除去沉淀物。在没有羊毛和没有微波的情况下,将反应混合物(含有柠檬酸和抗坏血酸)冷冻过夜,解冻,然后离心以检查在此过程中食物酸本身是否沉淀。这些实验证实,在没有羊毛和微波的情况下没有发生沉淀。微波步骤:160℃,持续30min,然后任其冷却。“160℃”下最大容器压力为(标称值)=95-96psi。相当于6.55巴(1巴=14.5psi)。从压力/温度图看出,6.55巴~168℃,羊毛的蒸煮温度实际上是~170℃。13.6商用的冷冻干燥由新西兰因弗卡吉尔的回乡烹饪(backcountrycuisine)进行通过3l和30l微波单元(参见实施例14,关于30l单元)产生的ppt和块wdp级分的冷冻干燥。13.7冻结-干燥效率将块冷冻干燥24小时;沉淀级分因为其较高的初始含水量需要另外12h(总共36h)。冷冻干燥机单元非常有效:最终产品具有非常低的水分活度(aw)。水含量越低,产品保存期限越长(aw水=1)。细菌生长通常需要>0.91的aw,而真菌生长通常需要>0.7的aw。级分冷冻干燥时间/h水活度/aw块240.00027沉淀物240.02沉淀物360.00213.8氨基酸分析三种降解产物(即上清液、沉淀物和块)的氨基酸含量由梅西大学营养系进行分析。氨基酸以mg/100mg(=重量百分比)定量。对于三种级分中的每一种,从之前的wdp制剂以0.8g/100g估计色氨酸。值代表三个管的平均值(一式三份)。s/nppt块总蛋白(包括trp(估计))(mg/100mg)58.684.880.7半胱氨酸(包括胱氨酸)3.5813.4实施例14使用30l压力容器容量奥克兰半商用微波设备在微波nz车间进行的基于微波的处理14.1微波规格30l微波炉使用单个20kw2450mhz磁控管微波发生器,带有循环器和发生器,包括流量为每分钟40l的水冷却系统。它具有wg243铝法兰波导系统,单个wg243石英微波窗口和辅助安全窗口,以保护发电机,以防石英窗爆裂。14.2样品制备在26l蒸馏水中加入1.1kg羊毛(从羊毛服务国际[woolserviceinternational,wsi]获得但未经索氏提取的双洗(double-scoured)羊毛)(羊毛:水比为1∶24)。微波反应混合物包含:90mm柠檬酸431克(gm)6mm抗坏血酸26.3克(gm)用蒸馏水补足至26l14.3氨基酸分析用于三个级分(即上清液、沉淀物和块)的每一个的三个样品由梅西大学营养系进行分析。氨基酸和总蛋白质定量为(w/w)%(mg/100mg)。包括色氨酸在内的基于wdp的先前的氨基酸分析估计色氨酸(trp)值。值以mg/100mg(w/w)%为单位,并且对每个级分分析三个样品(即一式三份)。氨基酸上清液沉淀物块天冬氨酸4.72.91.8苏氨酸3.24.35.2丝氨酸4.15.46.2谷氨酸10.112.28.4脯氨酸3.24.37.2甘氨酸2.64.14.2丙氨酸332.9缬氨酸3.74.85.3异亮氨酸2.23.32.7亮氨酸5.37.45.1酪氨酸2.55.44.3苯丙氨酸1.83.92.9组氨酸0.60.70.5赖氨酸1.92.51.8精氨酸6.38.36.5半胱氨酸2.85.911.8蛋氨酸0.40.40.4色氨酸(估计)0.50.70.6总氨基酸58.979.577.8实施例15三种微波装置产生的wdp中氨基酸组成的比较氨基酸以mg/100mg(=g/100g)定量。对于三种级分中的每一种,从先前的wdp以0.8g/100g的氨基酸分析估计色氨酸。值代表三个管的平均值(一式三份)。wdp级分半胱氨酸(cys)/总氨基酸(g/100g)(包括trp(估计))分析用微波(即实施例1-12)、原型微波(即实施例13)和商用微波(即实施例14)。进行傅里叶变换红外光谱(ftir)以鉴定在没有水解的情况下所有三种降解产物中wdp中游离巯基的存在(指示半胱氨酸残基减少)。使用ftir测量三个wdp级分的一式三份的样品,并与乳清蛋白样品比较。在wdp级分中观察到代表巯基的小峰,但在乳清蛋白的情况下没有,表明wdp含有比乳清蛋白更高水平的还原半胱氨酸残基/游离半胱氨酸。实施例16wdp级分的抗氧化/自由基清除潜力使用三种已建立的评估蛋白酶处理后的抗氧化能力的测定进行评估wdp上清液、沉淀物和块级分的抗氧化性能/自由基清除潜力的体外试验:1.氧自由基吸收能力(orac)2.2,2-二苯基-1-苦肼基自由基清除活性(dpph)3.铁还原抗氧化能力(frap)16.1测定上清液级分中的dpph抑制%分别一式三份测量六个上清液级分。样品:羊毛蛋白的上清液级分1-6,溶于去离子水中至终浓度为1mg/ml。结果如下:s/n样品#123456dpph抑制%194121575356orac17518021621617419616.2在0小时、1小时、2小时、4小时和24小时通过ht蛋白酶酶促水解kdp沉淀(ppt)和块级分测定蛋白质水解产物中的dpph抑制%样品:0.1516g+20ml去离子水,ph调节至ph6.5,45℃温育,在蛋白质悬浮液中添加0.0055ht蛋白酶。在0小时、1小时、2小时、4小时和24小时,收集水解产物,在90℃加热20min,以13000g离心15min,收集上清液并在分析前保持在-4℃。结果如下:抗氧化剂/自由基清除潜力的研究结果可归纳为如下:1.通常,与块相比,沉淀物级分具有更高的抗氧化活性。2.与胰蛋白酶和胃蛋白酶相比,蛋白酶ht处理的抗氧化活性更高。3.由于wdp的水解增加,活性随着处理时间而提高4.血管紧张素i转化酶(angiotensiniconvertingenzyme,ace)抑制活性遵循与上述抗氧化活性测定相同的模式(图4)。16.3沉淀物(ppt)和块(plg)wdp级分的近似分析(食物营养价值指数)总之,wdp的蛋白质含量非常高,平均占其总重量的86%。16.4微量矿物分析使用电感耦合等离子体质谱(icp-ms)对上清液、沉淀物和块级分进行痕量矿物分析。元素分析表明,有毒重金属如铅、汞、镉和砷在所有三种级分中都处于安全水平。实施例17从鸡羽毛中制备角蛋白衍生蛋白17.1鸡羽毛准备申请人从克赖斯特彻奇的布林克斯农场(brinksfarm)采购10kg鸡羽毛,10袋,每袋1kg。这些羽毛已用漂白剂溶液清洗消毒,这有助于羽毛的白度。申请人使用几滴洗涤剂清洁羽毛,并用清水和洗涤剂重复六次。此后,冲洗羽毛以除去洗涤剂。将羽毛在75℃的烘箱中干燥3天,然后在食物研磨机中研磨。这将羽毛和羽茎剁碎成小块。还有少量细粉产生,可能来自羽茎。17.2微波处理由于鸡羽毛的物理结构似乎不如羊毛强健,申请人决定最初尝试较温和的条件,即短时间较低的微波温度。与羊毛的初始试验一样,申请人使用台式分析cem微波反应系统mars6试验微波,羽毛:反应混合物的比为1∶20,将1g羽毛加入20ml反应混合物中。17.3在125℃下的初始实验125℃/10min、20min或30min,具有以下温度递增方案:在5min内,从室温升至(->)50℃在50℃下保持5min在5min内,从50℃升至(->)100℃在100℃下保持5min在5min内,从100℃升至(->)125℃在125℃下保持10min、20min或30min采用该方案,申请人试验了反应混合物中的三种不同浓度的食物酸以及仅有阴性mq水的对照(在一式三份中进行:3管/不同反应混合物,在盘的最外圈/排中总共给出12个管):mq水对照mq中25mm柠檬酸+6mm抗坏血酸mq中50mm柠檬酸+6mm抗坏血酸mq中90mm柠檬酸+6mm抗坏血酸结果该实验的结果令人失望,即使在90mm柠檬酸/6mm抗坏血酸的管中最长的30min微波持续时间也没有羽毛降解。有趣的是,在所有食物酸浓度下,许多10min的管中都存在局部的通常为单个的亮黄色点;原因尚不清楚。17.4在170℃下的初始实验在125℃没有观察到降解,因此申请人试用了与羊毛相同的条件,结果成功,即170℃/10min。在5min内,从室温升至(->)100℃在100℃下保持5min在5min内,从100℃升至(->)140℃在100℃下保持5min在5min内,从140℃升至(->)170℃在170℃下保持10min申请人再次试验了反应混合物中的三种不同浓度的食物酸以及仅有阴性mq水的对照(在一式三份中进行:三个管/不同反应混合物,在盘的最外圈/排中总共给出12个管):mq水对照mq中25mm柠檬酸+6mm抗坏血酸mq中50mm柠檬酸+6mm抗坏血酸mq中90mm柠檬酸+6mm抗坏血酸结果该实验是成功的,在90mm柠檬酸/6mm抗坏血酸中具有最佳溶解度,与发现羊毛溶解最佳的食物酸浓度相同。mq(对照)羽毛没有或很少溶解;在一个管中,溶液略微变暗成浅棕色,让人联想到之前仅在蒸馏水中微波的羊毛所看到的“燃烧”。25mm柠檬酸/6mm抗坏血酸一个管中有合理的羽毛降解,微波反应混合物变成“乳脂状”,但非常大的“块”可能留有一些羽毛状。其他管颜色为较深的棕色。50mm柠檬酸/6mm抗坏血酸与25mm柠檬酸管具有类似的结果。一个管有合理的羽毛降解,微波反应混合物变成“乳脂状”,但非常大的“块”可能留有一些羽毛状。其他管颜色为较深的棕色。90mm柠檬酸/6mm抗坏血酸羽毛很好地降解。两个管具有乳脂色,并且在第三管中,反应混合物具有棕色。所有管都有小块。在所有管中,沉淀物和块级分占据溶液体积的约一半。与羊毛降解结果非常相似,但微波羽毛的颜色可能稍微浅一些。微波鸡羽毛的味道几乎与微波羊毛相同(由于角蛋白中存在高水平的含硫半胱氨酸)。由于这种处理方法成功地降解了羽毛,因此申请人使用相同的方案对另外12个管进行微波处理:170℃,进行10min,递增;在20ml微波反应混合物(90mm柠檬酸+6mm抗坏血酸)中加入1g羽毛。将所有管置于冰箱中过夜,然后手动移出块,通过离心分离上清液和沉淀级分。将级分冷冻干燥并在咖啡研磨机中粉末化,并将约1ml样品送至梅西(massey)进行氨基酸分析。17.5结论使用相同的反应混合物(90mm柠檬酸+6mm抗坏血酸)在170℃下较短暂的10min微波时间足以降解鸡羽毛,从而产生富含氨基酸的粉末化级分,其质地、气味和粉末外观几乎与使用绵羊毛制成的富含氨基酸的级分完全相同。实施例18洗涤方案-用于个人护理产品的角蛋白衍生的蛋白质18.1背景角蛋白衍生蛋白(kdp)主要是基本上不溶于水的肽和游离氨基酸的混合物,其是由本文所述方法产生的大分子角蛋白的所得分解产物。由于这些游离氨基酸和短肽中的一些引起kdp的令人不快的气味、味道和浓重的橙色,因此在其作为用于个人护理产品的蛋白质的考虑中成为主要障碍。因此,必须消除气味和/或味道问题。申请人因此努力开发了以下水基洗涤方法以减轻kdp的气味、味道和颜色,以进一步纯化蛋白质并增加其对个人护理应用的适用性。由于反复洗涤,申请人能够达到显著水平的纯度,这在很大程度上减少了令人不快的气味和味道,并且减褪了所得蛋白质的颜色。18.2方法根据以下方法,将kdp的块和沉淀物级分分别进行洗涤:1.将300g细粉末化的块和沉淀物各在1l塑料离心瓶(50g/瓶)中分别取出。2.向每个瓶中加入500ml蒸馏水(每50g粉末),使粉末与水的比例保持在1∶10。3.将瓶充分摇动2分钟,以分别促使块和沉淀物的可溶性组分最大程度地溶解。4.然后将它们以2000转每分钟(rpm)离心10分钟。5.离心后,弃去上清液,且用新鲜蒸馏水重新装满瓶。6.重复步骤3、4和5共五次,直到块和沉淀物各经历五次洗涤。7.在第五次洗涤结束时,弃去上清液并舀出剩余的糊状物并均匀地铺展在箔托盘上。8.然后覆盖箔托盘并冷冻干燥72h。9.在72小时结束时,将干燥的块和沉淀物分别称重以测量最终产物的收率,并将其真空包装到箔袋中。18.3观察结果水中块和沉淀物粉末两者的颜色强度从开始时的深棕色到五次洗涤结束时减弱为淡黄色。在气味方面观察到类似的趋势,气味在很大程度上减少。上述变化表明基于洗涤的方法有效地消除了导致kdp令人不快的颜色和气味的短肽和游离氨基酸的不良影响。18.4收率块洗涤前块重量=300.0g冷冻干燥后的收率=153.0g沉淀物洗涤前沉淀物的重量=300.0g冷冻干燥后的收率=169.5g实施例19洗涤方案-用于食品的角蛋白衍生的蛋白质根据本发明的方法生产的用于食品中的应用/包含在食品内的基本上不溶于水的角蛋白衍生的蛋白质(即富含氨基酸的级分)使用以下方案洗涤,以减少或消除与气味和/或味道相关的问题:1.制备含有10%nacl(10g/100ml)的15%乙醇的洗涤溶液。2.以1份kdp与9份洗涤液(10gkdp/90mlnacl溶液)的比例加入kdp。3.将其混合直至所有颗粒悬浮在溶液中,通常为5分钟。4.使其至少浸泡24小时。5.于4度下在离心机中旋转,3000rpm,进行10分钟。6.倾倒上清液并回收水合蛋白。***尽管已经通过示例描述了本发明,但是应当理解,在不脱离权利要求所限定的本发明的范围的情况下,可以进行变化和修改。此外,在特定特征存在已知等同方案的情况下,这些等同方案被并入,如同在本说明书中具体提及的那样。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1