微生物中的蛋白质糖基化的修饰的制作方法
交叉引用本申请要求于2018年8月21日提交的美国临时专利申请号62/720,785(代理人案卷号49160-712.101)的优先权。该美国临时专利申请的全部公开内容通过引用并入本文。
背景技术:
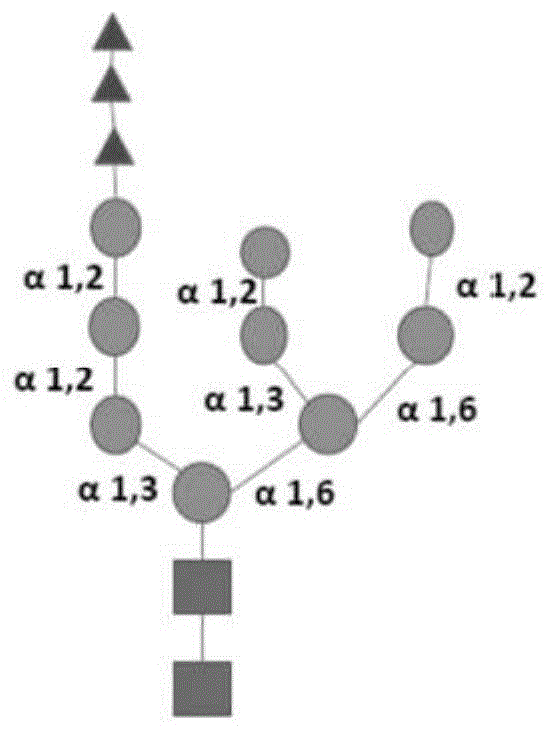
:需要鉴定用于制备蛋白质、尤其是供人和动物食用的蛋白质的方法,以提供提高的安全性、功效和营养价值。在微生物宿主中产生蛋白质可为蛋白质生产的有价值的工具。然而,重组蛋白质肽主链的翻译后修饰(ptm)可影响蛋白质的酶功效、安全性、纯化的容易程度、分泌和/或表达水平。例如,在毕赤酵母(pichiapastoris)中产生的异源蛋白质已知为“高甘露糖基化的”,因为它们的肽主链的糖基化位点可携带甘露糖基的延伸分支(有时超过100个甘露糖基团;serhuyteh,1munyikfong,2和zulqarnainmohamed1,3genetmolbiol.2011jul-sep;34(3):464–470)。在异源蛋白质旨在用于治疗用途的情况下,这种异常的糖基化可增加免疫原性的风险。在一些情况下,ptm对重组蛋白质的预期用途可为有益的,然而,存在宿主的ptm带来有害的不期望的共价连接的情形。需要鉴定用于制备蛋白质、尤其是供人和动物食用的蛋白质的方法,其采用表达所需的ptm模式(profile)的改进方法以利用ptm的有益方面,同时避免有害的特征。援引并入本说明书中所提及的所有出版物、专利和专利申请均通过引用并入本文,其程度犹如具体地且单独地指出每个单独的出版物、专利或专利申请均通过引用而并入。技术实现要素:本文提供了用于在微生物宿主中产生动物蛋白质的方法、蛋白质序列和产物,所述方法、蛋白质序列和产物引入了有利的ptm并且避免了ptm的其他不期望的作用。在一些实施方案中,本文的方法、组分和所得产物利用ptm的修饰来改善在微生物宿主中产生的重组动物蛋白质的营养含量和/或营养价值。在一些实施方案中,营养含量和/或营养价值通过改变由微生物宿主产生的重组蛋白质的糖基化来改善。在一些实施方案中,重组蛋白质可用于供人或动物食用的食品、营养品或其他产品中。在一些实施方案中,重组蛋白质可为用于一种或多种工业过程的酶。本文提供了生产可食用组合物的方法。该方法可包括在宿主细胞中重组表达营养蛋白质,其中营养蛋白质可从宿主细胞中分泌出来。该方法还可包括在宿主细胞中重组表达α-1,2-甘露糖苷酶。所述α-1,2-甘露糖苷酶可减少由宿主细胞分泌的营养蛋白质的大于50%的糖基化。营养蛋白质可与至少另一种组分混合以形成可食用组合物。α-1,2-甘露糖苷酶可具有seqidno:7的序列、其功能等同物,或与seqidno:7具有85%同源性或更高同一性的序列。α-1,2-甘露糖苷酶可具有seqidno:150的序列、其功能等同物,或与seqidno:150具有85%同源性或更高同一性的序列。可食用组合物的营养含量可等于或大于对照组合物的营养含量,其中使用从天然来源分离的相同蛋白质或未经α-1,2-甘露糖苷酶修饰的重组营养蛋白质来生产所述对照组合物。营养含量可为组合物的蛋白质含量。可食用组合物的蛋白质含量可比对照组合物高至少5%。可食用组合物的蛋白质含量可比对照组合物高至少10%。可食用组合物的蛋白质含量可比对照组合物高至少20%。至少50%的由宿主细胞分泌的营养蛋白质可具有修饰的糖基化模式。至少75%的由宿主细胞分泌的营养蛋白质可具有修饰的糖基化模式。至少80%的由宿主细胞分泌的营养蛋白质可具有修饰的糖基化模式。至少90%的由宿主细胞分泌的营养蛋白质可具有修饰的糖基化模式。与对照组合物相比,具有修饰的糖基化模式的营养蛋白质的热稳定性可提高,其中使用从天然来源分离的相同蛋白质或未经α-1,2-甘露糖苷酶修饰的重组营养蛋白质来生产所述对照组合物。宿主细胞可为毕赤酵母属物种,例如毕赤酵母。营养蛋白质的氮碳比可等于或大于由其天然来源分离的营养蛋白质的氮碳比。营养蛋白质可为动物蛋白质。营养蛋白质可为禽类蛋白质。营养蛋白质可为卵清蛋白。在一些实施方案中,可食用组合物可使用本文所述的方法生产。可食用组合物可为饮料。可食用组合物可为食品。在一些实施方案中,本文提供了用于表达重组营养蛋白质的宿主细胞。宿主细胞可包含驱动营养蛋白质表达的第一启动子和驱动α-1,2-甘露糖苷酶表达的第二启动子,其中所述α-1,2-甘露糖苷酶具有seqidno:7或seqidno:150的序列、其功能等同物或与seqidno:7或seqidno:150具有85%或更高同一性的序列。由于α-1,2-甘露糖苷酶的表达,营养蛋白质的甘露糖基化可被减少。宿主细胞可为真菌或酵母。宿主细胞可为毕赤酵母属物种,例如毕赤酵母。营养蛋白质和α-1,2-甘露糖苷酶可使用一个或多个表达盒来表达。营养蛋白质和α-1,2-甘露糖苷酶可在单独的表达构建体上表达。营养蛋白质可从宿主细胞中分泌出来。与对照组合物相比,所分泌的营养蛋白质可具有相等的或更高的营养含量,其中使用从天然来源分离的相同蛋白质或未经α-1,2-甘露糖苷酶修饰的重组营养蛋白质来生产所述对照组合物。营养含量可为蛋白质含量。所分泌的营养蛋白质可具有不同程度的糖基化。至少50%的所分泌的营养蛋白质可具有修饰的糖基化模式。本文提供了可食用组合物。所述可食用组合物可包含在异源宿主细胞中产生的重组动物蛋白质和一种或多种另外的成分。所述动物蛋白质可具有适用于可食用组合物中的糖基化水平。所述动物蛋白质可为可食用组合物提供一种或多种食品功能特征。在一些实施方案中,本文提供了包含编码营养蛋白质的第一核酸和编码α-1,2-甘露糖苷酶的第二核酸的微生物。α-1,2-甘露糖苷酶可与微生物异源,并且α-1,2-甘露糖苷酶可以能够修饰营养蛋白质的糖基化结构。营养蛋白质可用作食品成分或食品产品。α-1,2-甘露糖苷酶可包含seqidno:150、seqidno:7的氨基酸序列或与其具有大于80%或85%同源性的序列。第一核酸序列和第二核酸序列可包含在一个或多个表达盒中。微生物可为毕赤酵母属物种。α-1,2甘露糖苷酶可为原鸡(gallusgallus)α-1,2甘露糖苷酶。α-1,2甘露糖苷酶可为里氏木霉(trichodermareesei)α-1,2甘露糖苷酶,并且微生物可为毕赤酵母属物种。营养蛋白质可为卵清蛋白。卵清蛋白可包含seqidno:11-26中任一个的氨基酸序列或与其具有80%同源性的任何序列。可对核酸序列中的至少一个进行密码子优化以在微生物中表达。在一些实施方案中,在微生物宿主中表达的重组动物蛋白质具有营养价值,并且可单独使用或在组合物中用作营养源。在一些实施方案中,异源表达的蛋白质为动物或人的蛋白质的营养来源。在本文的一些实施方案中,与在微生物宿主细胞中表达的不具有其糖基化结构修饰的相同重组蛋白质相比,重组动物蛋白质的糖基化修饰改变了蛋白质中的氮碳比。在一些实施方案中,与来自其天然来源的蛋白质相比,糖基化修饰改变或增加了重组动物蛋白质的营养价值。在一些实施方案中,重组动物蛋白质具有酶促活性。在一些实施方案中,重组动物蛋白质具有用于工业过程的功能性。在一些实施方案中,与不具有其糖基化结构修饰的表达的相同蛋白质相比,重组动物蛋白质的糖基化修饰增加、减少或以其他方式改变了重组蛋白质的一种或多种功能特性。在本文的方法的一些实施方案中,步骤包括通过改变、缺失或添加一种或多种糖基化酶来改变微生物宿主的糖基化机制。在一些实施方案中,微生物宿主的糖基化机制的改变导致产生具有改善的营养含量或改善的营养价值的重组蛋白质。在一些实施方案中,用于所述方法的微生物宿主为丝状真菌。在一些实施方案中,微生物宿主为毕赤酵母(现在称为法夫驹形氏酵母(komagataellaphaffii))。在本文的一些实施方案中,重组表达的动物蛋白质的营养含量或营养价值还通过在微生物宿主中表达阿尔法-1,2甘露糖苷酶(α-1,2-甘露糖苷酶)进行改善。在该方法的一些实施方案中,步骤包括在丝状真菌宿主细胞中重组表达动物蛋白质;在同一宿主细胞中重组表达阿尔法-1,2甘露糖苷酶(α-1,2甘露糖苷酶);以及从宿主中分离重组动物蛋白质。在该方法的一些实施方案中,用于重组表达的微生物在糖基化机制的两种或更多种组分中改变。所述改变可包括例如酵母宿主中och1的缺失或敲除。在该方法的一些实施方案中,重组动物蛋白质从宿主细胞分泌,而α-1,2甘露糖苷酶不从宿主细胞分泌。在该方法的一些实施方案中,表达α-1,2甘露糖苷酶,其中没有任何异源分泌信号或异源细胞内靶向序列;并且表达重组动物蛋白质,其中具有引起动物蛋白质分泌的分泌信号序列或其他氨基酸序列。在该情况下,α-1,2甘露糖苷酶保留在细胞内,因为宿主识别非天然定位信号,α-1,2甘露糖苷酶作用于细胞内重组表达的动物蛋白质,然后分泌具有改变的糖基化修饰的重组动物蛋白质。在该方法的一些实施方案中,然后可将所分泌的动物蛋白质与甘露糖苷酶和其他与微生物相关的蛋白质分离。在该方法的一些实施方案中,将重组动物蛋白质从宿主细胞外部的生长培养基中分离。在该方法的一些实施方案中,α-1,2甘露糖苷酶与微生物宿主细胞异源。α-1,2甘露糖苷酶可来自真菌来源、禽类来源或哺乳动物来源。在一些实施方案中,α-1,2甘露糖苷酶源自里氏木霉。在其他实施方案中,α-1,2甘露糖苷酶源自禽类物种,例如原鸡物种。在一些实施方案中,两种或更多种α-1,2甘露糖苷酶蛋白质在该方法中被重组表达。两种或更多种α-1,2甘露糖苷酶蛋白质可源自相同、相似或不同的物种。在一些实施方案中,用于表达的一种或多种α-1,2甘露糖苷酶蛋白质为seqid:no.1-10或145-151中的任何一个或多个、seqidno.152-153编码的氨基酸序列、或与其具有至少80%或85%同源性的序列。在一些实施方案中,一种或多种α-1,2甘露糖苷酶在还重组表达重组动物蛋白质的宿主细胞中表达。在一些实施方案中,微生物包含有包含在一个或多个表达盒中的第一核酸序列和第二核酸序列。这些盒可通过同源或非同源重组整合在宿主基因组的一个或多个位点处。在一些实施方案中,第一核酸序列和第二核酸序列包含在同一表达盒中。在其他实施方案中,第一核酸序列和第二核酸序列包含在单独的表达盒中,并且这些单独的盒可一起、分开地、伴随地或顺序地整合到宿主基因组中。在一些实施方案中,第一核酸还包含异源启动子。在一些实施方案中,第二核酸包含异源启动子。在一些实施方案中,第一核酸和第二核酸可各自包含异源启动子,并且这些启动子可彼此相同或不同。本文中用于表达α-1,2甘露糖苷酶和重组动物蛋白质的方法包括多种宿主微生物,包括酵母。在该方法的一些实施方案中,微生物为甲基营养型酵母。在一些实施方案中,酵母是毕赤酵母属物种(pichiasp.)或法夫驹形氏酵母属物种(komagataellasp.)。在一些实施方案中,酵母为毕赤酵母或法夫驹形氏酵母。本文提供的方法适合于生产具有改善的营养含量或改善的营养价值的重组动物蛋白质。在一些实施方案中,改善的营养含量或改善的营养价值改变了重组动物蛋白质的氮碳比。在一些实施方案中,重组动物蛋白质的氮碳比大于约0.25、约0.3、约0.35和/或约0.4。在一些实施方案中,与由其天然来源分离的动物蛋白质相比,重组动物蛋白质的糖基化程度相等或降低。在一些实施方案中,与由其天然来源分离的蛋白质相比,重组动物蛋白质的甘露糖基化相等或降低。在一些实施方案中,重组产生的动物蛋白质包含一个或多个man5glcnac2残基。在一些实施方案中,重组动物蛋白质的man5glcnac2比例大于与该蛋白质相关的man8glcnac2的比例。在一些实施方案中,重组动物蛋白质的manxg1cnac2与manyglcnac2的比率大于1,并且manxg1cnac2的x为选自1、2、3、4和5的整数,且manyglcnac2的y为大于或等于6的整数。在一些实施方案中,y为选自6、7、8、9和10的整数。本文提供了包含一种或多种具有一个或多个man5glcnac2残基的重组动物蛋白质的组合物,其中重组蛋白质具有改善的营养含量或改善的营养价值。在一些实施方案中,改善的营养含量或改善的营养价值包括使重组动物蛋白质的氮碳比大于或等于约0.25、约0.30、约0.35或约0.4。本文所述的组合物可配制成食品、营养补充剂、营养粉或可食用饮料。本文所述的组合物也可配制成动物饲料或饲料补充剂。在本文的方法和组合物的一些实施方案中,重组动物蛋白质为重组卵清蛋白。在一些实施方案中,卵清蛋白为卵类粘蛋白(ovd)、卵白蛋白(ova)、卵球蛋白、β-卵粘蛋白、α-卵粘蛋白和溶菌酶中的一种或多种。在一些实施方案中,重组动物蛋白质为重组卵清蛋白,并且用于产生蛋白质的宿主细胞为毕赤酵母属。在一些实施方案中,重组动物蛋白质为重组卵清蛋白,并且毕赤酵母属中表达的蛋白质的糖基化结构被修饰,使得重组卵清蛋白的氮碳比与从天然存在的鸡蛋中分离的卵清蛋白相等或更大。在一些实施方案中,重组动物蛋白质为重组卵清蛋白,并且毕赤酵母属中表达的蛋白质的糖基化结构被修饰,使得该蛋白质的营养价值与来自其天然来源的蛋白质基本上相同或比来自其天然来源的蛋白质更好。在一些实施方案中,与从天然存在的鸡蛋中分离的卵清蛋白相比,重组卵清蛋白的糖基化程度相等或降低。在一些实施方案中,与从天然存在的鸡蛋中分离的卵清蛋白相比,重组卵清蛋白的甘露糖基化相等或降低。在一些实施方案中,重组卵清蛋白包含一个或多个man5glcnac2残基。在一些实施方案中,重组卵清蛋白的man5glcnac2比例大于与卵清蛋白相关的man8glcnac2的比例。在一些实施方案中,重组卵清蛋白的manxg1cnac2与manyglcnac2的比率大于1,并且manxg1cnac2的x为选自1、2、3、4和5的整数,且manyglcnac2的y为大于或等于6的整数。在一些实施方案中,y为选自6、7、8、9和10的整数。本文提供的方法适合于产生重组卵清蛋白,使得重组卵清蛋白的氮碳比大于约0.25、约0.3、约0.35和/或约0.4。在一些实施方案中,组合物包含第二卵清蛋白,其可为天然卵清蛋白、重组卵清蛋白或已被修饰以改变糖基化结构和/或第二蛋白质的氮碳比的卵清蛋白(天然的或重组的)。通过本文描述的方法生产的组合物可配制成食品、营养补充剂、营养粉或可食用饮料。在一些实施方案中,具有改变的氮碳比的重组卵清蛋白为卵类粘蛋白、卵白蛋白、卵球蛋白、β-卵粘蛋白、α-卵粘蛋白、胱抑素、卵抑制剂和溶菌酶。在一些实施方案中,具有改变的氮碳比的重组卵清蛋白为在seqidno:11-26或与其具有至少80%同源性的序列中所阐述的任何一种或多种蛋白质。附图说明本发明的新颖特征在所附权利要求书中具体阐述。通过参考以下对利用了本发明的原理的说明性实施方案加以阐述的详细描述和附图(本文中也称为“图”),将会获得对本发明的特征和优点的更好理解,在附图中:图1a-1d示出了manxglcnac2子结构。图2示出了包含可操作地连接至转基因的启动子的示例性载体。图3a-b示出了样品的质谱结果,其显示了样品中存在的各糖型的相对量。图4a-b示出了菌株2(表达trmds2的菌株)与其亲本菌株1sf17(a)和sf22(b)相比较的sds-page条带图。2个菌株产生相似量的ovd。到目前为止,菌株1产生了可见于法夫驹形氏酵母(k.phaffii)的特征ovd图,具有7个在(a)中标记的主要条带。除了条带6和7之外,所有主要条带似乎都发生了偏移。图5示出了法夫驹形氏酵母的常见n-糖基化模式。正方形表示n-乙酰氨基葡萄糖(glcnac),而圆圈表示甘露糖(man)。图6示出了trmds2和ggman1a1的去糖基化功能的比较。图7示出了trmds2和ggman1a1的共表达的结果。图8示出了表达hsorm1的各个转化体的培养基上清液的sds-page结果。图9a-c示出了trmds2诱导的hsorm1的去糖基化的sds-page结果和用于转化的载体示意图。图10示出了卵白蛋白(ova)的去糖基化的sds-page结果。图11示出了天然ova和变性ova的sds-page结果。图12示出了用trmds2使ova去糖基化的sds-page结果。图13示出了mds1对ggovd缺乏去糖基化活性的结果。图14示出了trmds2对ggovd的去糖基化活性的结果。具体实施方式本文提供的方法、核酸、表达构建体、微生物、组合物和方法提供了用于在宿主中表达重组动物蛋白质并修饰所表达的蛋白质的糖基化的工具、方法和组合物。本文考虑的一种此类宿主为毕赤酵母属物种(现在重分类为法夫驹形氏酵母属物种)。本公开内容考虑用本文所述的任何一种或多种方法例如在毕赤酵母中修饰毕赤酵母属物种的糖基化机制。本公开内容考虑修饰重组蛋白质的糖基化以改变或增强该蛋白质和/或其生产的一种或多种功能特征。与没有修饰糖基化机制的在宿主微生物中产生的重组蛋白质相比,通过这种修饰可制得具有更高营养价值的重组蛋白质。与没有修饰糖基化机制的在宿主微生物中产生的重组蛋白质相比,和/或与由其天然来源或另一个异源宿主产生的相同蛋白质相比,重组动物蛋白质可具有更高的氮碳比。与没有修饰糖基化机制的在宿主中产生的重组蛋白质相比,通过这种修饰,与重组表达一种或多种蛋白质相协同,可制得具有改善的表达、分泌、纯化的重组蛋白质。与没有修饰糖基化机制的在宿主微生物中产生的重组蛋白质相比,通过这种修饰,与重组表达一种或多种蛋白质相协同,可制得具有改善的酶促功能或活性的重组蛋白质。一种在酵母宿主中影响糖基化的方法利用高尔基体中核心man8glcnac2底物所需的och1蛋白质的α-1,6-甘露糖转移酶活性(图1c),作为在称为“外链延伸”的步骤中进一步延伸聚糖结构的甘露糖基化的必要步骤。在具有中断och1功能的敲除体或突变体中,甘露糖基化无法通过高尔基体中的该基础底物,从而消除了高甘露糖基化。在一些实施方案中,可修饰酵母宿主以敲除och1功能。在一些实施方案中,可修饰酵母宿主以使och1功能部分中断或下调。可替代地或另外地,技术人员还可敲入er驻留的异源的甘露糖苷酶,例如里氏木霉α-1,2甘露糖苷酶,或其他类似功能的酶,以在新生多肽易位至高尔基体之前将聚糖切割成man5glcnac2核心结构,从而有效消除有效的och1的α-1,6-甘露糖转移酶活性所需的man8glcnac2底物。已表明,och1的α-1,6-甘露糖转移酶活性对man8glcnac2聚糖结构具有特异性,而对man5glcnac2结构不具有特异性。因此,如果易位至高尔基体的大多数肽结合的er处理的聚糖结构通过er驻留的异源α-1,2-甘露糖苷酶的活性被切割成man5glcnac2结构,则可有效消除och1活性。根据该原理,本文公开了一种制备相对于野生型具有改变的糖基化的微生物的简化方法,其中所述微生物仅包含一种或多种异源α-1,2甘露糖苷酶,并且在一些实施方案中,还保留了功能齐全的野生型och1。在各种实施方案中,糖基化的均质性(即,在其肽主链上仅携带man5glcnac2结构的蛋白质的比例)可通过控制异源甘露糖苷酶的表达来调节。在一些实施方案中,宿主微生物表达一种或多种异源α-1,2甘露糖苷酶。异源α-1,2甘露糖苷酶可为真菌来源的、禽类来源的和/或哺乳动物来源的。异源α-1,2甘露糖苷酶来自里氏木霉,例如具有seqidno:7的mds2酶。在一些实施方案中,异源α-1,2甘露糖苷酶来自鸡,例如原鸡,例如seqidno:150。在其他实施方案中,某些α-1,2甘露糖苷酶选自但不限于与seqidno1-10和seqidno.145-150对应的那些蛋白质、seqidno.151-152编码的氨基酸序列。在一些实施方案中,蛋白质可具有与seqidno1-10或seqidno.145-150中的任一个具有80%、85%或更高的序列同一性的序列。在一些情况下,序列同一性可大于90%、95%、98%。在一些实施方案中,蛋白质可由具有与seqidno.152-153中的任一个具有80%、85%或更高的序列同一性的序列的核酸序列编码。在一些情况下,核苷酸序列同一性可大于90%、95%、98%。异源甘露糖苷酶可为与seqidno:7具有大于70%、75%、80%、85%、90%、92%、95%、97%、98%、99%的序列同一性的甘露糖苷酶。异源甘露糖苷酶可为与seqidno:150具有大于70%、75%、80%、85%、90%、92%、95%、97%、98%、99%的序列同一性的甘露糖苷酶。所使用的甘露糖苷酶可为具有seqidno.1-10或seqidno.145-151中的任一个的酶的功能等同物或功能片段。如本文所用,“功能片段”意指基本上保留全长蛋白质的酶促活性的酶的多肽片段。甘露糖苷酶可为seqidno:7的基本上等同的功能片段。甘露糖苷酶可为seqidno:150的基本上等同的功能片段。“基本上”意指保留全长α-1,2-甘露糖苷酶的至少约40%或优选至少50%或更高的酶促活性。某些α-1,2甘露糖苷酶可比其他α-1,2甘露糖苷酶对靶蛋白具有更有效的活性。在一些实施方案中,两种或更多种异源α-1,2甘露糖苷酶被重组表达。两种或更多种α-1,2甘露糖苷酶可来自相同、相似或不同的来源。本文所述的两种或更多种干预的组合还可用于减少重组蛋白质的高甘露糖基化。例如,技术人员可在宿主中表达重组α-1,2甘露糖苷酶以及包含och1突变、缺失或以其他方式减少或消除的表达的菌株中的重组蛋白质。在其他实施方案中,如此设计表达一种或多种异源α-1,2甘露糖苷酶的所得微生物,以实现一种或多种在同一微生物中还表达为异源蛋白质的靶蛋白(选自但不限于与seqidno.11-26对应的那些蛋白质或肽子序列)的所需均质性和/或糖基化程度的降低。在本文的一些实施方案中,在宿主中表达重组α-1,2甘露糖苷酶,并且表达一种或多种重组蛋白质。在本文的一些实施方案中,重组α-1,2甘露糖苷酶的表达以及表达一种或多种重组蛋白质产生具有改善的营养价值或营养含量的重组蛋白质。在本文的一些实施方案中,重组α-1,2甘露糖苷酶的表达以及表达一种或多种重组蛋白质提供了一种重组蛋白质,所述重组蛋白质的氮碳比等于或大于从其天然来源和/或从不同异源宿主分离的蛋白质的氮碳比。所述重组蛋白质可从宿主细胞中分泌出来。重组蛋白质可为营养蛋白质。营养蛋白质可为包含期望量的必需氨基酸的蛋白质。营养蛋白质可包含至少30重量%的必需氨基酸。营养蛋白质可包含至少40重量%的必需氨基酸。营养蛋白质可包含至少50重量%的必需氨基酸。营养蛋白质可包含以可食用形式天然存在的蛋白质或蛋白质片段,或由以可食用形式天然存在的蛋白质或蛋白质片段组成。营养蛋白质可为动物蛋白质。营养蛋白质可为禽类蛋白质。营养蛋白质可为卵清蛋白。在本文的一些实施方案中,在宿主中表达重组α-1,2甘露糖苷酶,并且表达一种或多种卵清蛋白。在一些实施方案中,蛋白质或肽可具有与seqidno11-26中的任一个具有80%或更高的序列同一性的序列。在一些情况下,序列同一性可大于90%、92%、95%、98%。在本文的一些实施方案中,重组α-1,2甘露糖苷酶的表达以及表达一种或多种卵清蛋白提供了具有改善的营养价值的卵清蛋白。在本文的一些实施方案中,重组α-1,2甘露糖苷酶的表达以及表达一种或多种卵清蛋白提供了一种卵清蛋白,所述卵清蛋白的氮碳比等于或大于从天然存在的鸡蛋中分离的卵清蛋白的氮碳比。营养蛋白质可在宿主细胞中重组产生,所述宿主细胞除营养蛋白质之外还表达异源甘露糖苷酶。可替代地,重组营养蛋白质可用本文所述的甘露糖苷酶处理。所得重组蛋白质可为糖基化减少的蛋白质或去糖基化蛋白质。糖基化减少或去糖基化可指与野生型、未修饰的微生物菌株相比,当重组糖蛋白在如本文所述的经修饰的微生物中表达时,重组糖蛋白上的碳水化合物部分的尺寸减少,特别是具有更少的甘露糖残基。与不是在甘露糖苷酶的存在下或不是在以其他方式暴露于甘露糖苷酶的情况下产生的相同蛋白质的n-连接糖基化水平相比,“去糖基化”蛋白质的n-连接糖基化水平可减少至少约10%(例如10%、20%、30%、40%、50%、60%、70%、80%、90%或100%)。用于减少一种或多种蛋白质的糖基化的酶可包括甘露糖苷酶,更优选α-1,2甘露糖苷酶。所述酶可减少由宿主细胞分泌的重组蛋白质的糖基化。例如,一部分重组蛋白质可通过酶去糖基化。所述酶可减少由宿主细胞分泌的营养蛋白质的大于1%的糖基化。所述酶可减少由宿主细胞分泌的营养蛋白质的大于5%的糖基化。所述酶可减少由宿主细胞分泌的营养蛋白质的大于10%的糖基化。所述酶可减少由宿主细胞分泌的营养蛋白质的大于20%的糖基化。所述酶可减少由宿主细胞分泌的营养蛋白质的大于30%的糖基化。所述酶可减少由宿主细胞分泌的营养蛋白质的大于40%的糖基化。所述酶可减少由宿主细胞分泌的营养蛋白质的大于50%的糖基化。所述酶可减少由宿主细胞分泌的营养蛋白质的大于60%的糖基化。所述酶可减少由宿主细胞分泌的营养蛋白质的大于75%的糖基化。所述酶可减少由宿主细胞分泌的营养蛋白质的大于80%的糖基化。所述酶可减少由宿主细胞分泌的营养蛋白质的大于90%的糖基化。所述酶可减少由宿主细胞分泌的营养蛋白质的大于95%的糖基化。可在宿主细胞中修饰单个蛋白质上的糖基化程度或聚糖单元的数目。重组蛋白质的糖基化程度可小于对照蛋白质的糖基化程度的90%。重组蛋白质的糖基化程度可小于对照蛋白质的糖基化程度的80%。重组蛋白质的糖基化程度可小于对照蛋白质的糖基化程度的75%。重组蛋白质的糖基化程度可小于对照蛋白质的糖基化程度的50%。重组蛋白质的糖基化程度可小于对照蛋白质的糖基化程度的30%。重组蛋白质的糖基化程度可小于对照蛋白质的糖基化程度的20%。重组蛋白质的糖基化程度可小于对照蛋白质的糖基化程度的15%。重组蛋白质的糖基化程度可小于对照蛋白质的糖基化程度的10%。重组蛋白质的糖基化程度可小于对照蛋白质的糖基化程度的5%。重组蛋白质的糖基化程度可小于对照蛋白质的糖基化程度的1%。包含重组蛋白质的组合物可食用组合物可包含一种或多种重组蛋白质。如本文所用,术语“可食用组合物”是指包含分离的重组蛋白质并且可供动物(包括但不限于人和其他哺乳动物)食用的组合物。可食用食品组合物包括食品产品、饮料产品、膳食补充剂、食品添加剂和营养品作为非限制性示例。可食用组合物除重组蛋白质之外还可包含一种或多种组分。所述一种或多种组分可包括用于形成食品、饮料的成分、溶剂等。例如,重组蛋白质可为粉末形式,其可与溶剂混合以制备饮料或与其他成分混合以形成食品产品。去糖基化的重组蛋白质的营养含量可高于相同量的对照蛋白质的营养含量。对照蛋白质可为重组产生但未用甘露糖苷酶处理的相同蛋白质。对照蛋白质可为在不表达异源甘露糖苷酶的宿主细胞中重组产生的相同蛋白质。对照蛋白质可为从天然来源分离的相同蛋白质。例如,对照蛋白质可为分离的卵清蛋白,例如ovd、ova或可从天然卵清中分离的其他蛋白质。包含重组营养蛋白质的组合物的营养含量可大于包含对照蛋白质的组合物的营养含量。所述营养含量可为蛋白质的蛋白质含量。所述组合物的蛋白质含量可比包含对照蛋白质的组合物的蛋白质含量高约1%至80%。所述组合物的蛋白质含量可比包含对照蛋白质的组合物的蛋白质含量高约1%至5%。所述组合物的蛋白质含量可比包含对照蛋白质的组合物的蛋白质含量高约1%至10%。所述组合物的蛋白质含量可比包含对照蛋白质的组合物的蛋白质含量高约1%至20%。所述组合物的蛋白质含量可比包含对照蛋白质的组合物的蛋白质含量高约1%至50%。所述组合物的蛋白质含量可比包含对照蛋白质的组合物的蛋白质含量高约1%至80%。所述组合物的蛋白质含量可比包含对照蛋白质的组合物的蛋白质含量高约5%-10%、5-15%、5-20%、5-30%、5-50%、5-80%。所述组合物的蛋白质含量可比包含对照蛋白质的组合物的蛋白质含量高约10%-80%、10-20%、10-30%、10-50%、10-70%、10-80%。所述组合物的蛋白质含量可比包含对照蛋白质的组合物的蛋白质含量高约1%、5%、10%、20%、30%、40%、50%、60%、70%或80%。组合物的蛋白质含量可使用常规方法测量。例如,蛋白质含量可通过如下来测量:使用通过燃烧的氮定量,然后使用转换因子来估算样品中蛋白质的量,然后计算干物质的百分比(重量/重量)。去糖基化蛋白质的氮碳比高于对照蛋白质的氮碳比。重组蛋白质的氮碳比可大于或等于约0.1。去糖基化蛋白质的氮碳比高于对照蛋白质的氮碳比。重组蛋白质的氮碳比可大于或等于约0.25。重组蛋白质的氮碳比可大于或等于约0.3。重组蛋白质的氮碳比可大于或等于约0.35。重组蛋白质的氮碳比可大于或等于约0.4。重组蛋白质的氮碳比可大于或等于约0.5。去糖基化蛋白质的溶解度可大于对照蛋白质的溶解度。包含去糖基化蛋白质的组合物的溶解度可高于包含对照蛋白质的组合物的溶解度。去糖基化蛋白质的热稳定性可大于对照蛋白质的热稳定性。重组蛋白质的糖基化程度可取决于所生产的可食用组合物。例如,可食用组合物可包含较低的糖基化程度以提高组合物的蛋白质含量。可替代地,糖基化程度可更高,以提高组合物中蛋白质的溶解度。携带异源表达的α-1,2甘露糖苷酶的微生物下文概述了表达异源α-1,2甘露糖苷酶的微生物的构建体。本文中,“α-1,2甘露糖苷酶”是指公认为催化包含manxglcnac2(其中x>=6)作为子结构的聚糖结构中的甘露糖基之间的α-1,2糖苷键(参考图1中所示的键)的切割的任何蛋白质。α-1,2甘露糖苷酶的示例为由seqidno1-10和seqidno.145-151组成的列表所示的任何多核苷酸序列或其中的子序列编码的或由seqidno.152-153编码的那些蛋白质。在真核生物中,在称为n-糖基化的第一步中,可将内质网(er)中合成的前体寡糖结构(glc3man9glcnac2)添加到多肽的天冬酰胺残基上(在共有序列asn-x-ser或asn-x-thr或asn-x-cys位点上,其中x为除脯氨酸之外的任何氨基酸)。在er的内腔中,前体寡糖被切割以除去各连接的glc3man9glcnac2寡糖的葡萄糖残基(图1a)。甘露糖基团的额外除去产生man8glcnac2核心结构(图1b)。糖蛋白易位至高尔基体后,该核心结构被进一步加工。在酵母高尔基体中,该加工涉及och1的活性,och1为在启动进一步添加甘露糖基的必要步骤中作用于man8glcnac2核心结构的α-1,6甘露糖转移酶,所述必要步骤最终可在完全加工的蛋白质上产生高甘露糖基化的聚糖基团。(图1d)示出了man5glcnac2,其是当man8glcnac2在α-1,2糖苷键处被α-1,2甘露糖苷酶切割时可能的产物。与man8glcnac2不同,och1对作为底物的man5glcnac2不具有有效的α-1,6甘露糖转移酶活性。三角号代表葡萄糖;正方形代表n-乙酰氨基葡萄糖;圆圈代表甘露糖。本文中,微生物的“转化”是指将多核苷酸引入微生物中。本文中,“转化体”是指已进行转化的微生物。本文中,“转基因”是指如果包含在微生物中,则可形成基因产物的多核苷酸。本文中,“表达盒”为包含编码转基因的子序列的任何多核苷酸,并且当包含在微生物中时可使该子序列表达,且与所述微生物异源。本文中,“启动子”是指表达盒的多核苷酸子序列,其位于转基因的上游或5’,并且当表达盒包含在微生物中时参与从该转基因启动转录。本文中,“糖蛋白”是指携带共价结合至其肽主链的碳水化合物的蛋白质。本文中,“糖型”是指糖蛋白的多种不同形式中的任一种,其中各自通过肽结合的多糖的不同结构而彼此区分。在一些实施方案中,宿主微生物携带一种或多种稳定整合的异源转基因,所述异源转基因当在宿主中表达为蛋白质时,为通过异源α-1,2甘露糖苷酶改变其聚糖基团的预期靶标。本文中,这样的转基因被称为“靶蛋白”。a.包含表达盒的载体的合成:首先,制备携带表达盒的载体,该表达盒包含待转化的α-1,2甘露糖苷酶。在一些实施方案中,可转化多种不同的α-1,2甘露糖苷酶,所述多种不同的α-1,2甘露糖苷酶位于携带多个表达盒的载体上或位于单独的载体上。本文所述的表达盒可使用化学合成、分子克隆或重组方法、dna或基因组装方法、人工基因合成、pcr或其任意组合而获得。化学多核苷酸合成的方法是本领域众所周知的,在本文中无需详细描述。本领域技术人员可使用本文提供的序列和商业dna合成仪来产生所需的dna序列。为了使用重组方法制备多核苷酸,可将包含所需序列的多核苷酸插入合适的克隆或表达载体中,并将所述克隆或表达载体进而引入合适的宿主细胞中以进行复制和扩增。合适的克隆载体可根据标准技术构建,或可选自本领域中可获得的大量克隆载体。尽管所选择的克隆载体可根据预期使用的宿主细胞有所不同,但是有用的克隆载体通常具有自我复制的能力,可具有特定限制性核酸内切酶的单一靶标,和/或可携带可用于选择含有表达载体的克隆体的标记物的基因。获得克隆和表达载体的方法是众所周知的(参见例如,green和sambrook,molecularcloning:alaboratorymanual,第4版,coldspringharborlaboratorypress,newyork(2012))。图2提供了通过这些方式制备的载体的示例;图2描述了包含(a)有效地连接至转基因(图2中的里氏木霉α-1,6甘露糖苷酶1-t.r.mds1)的启动子(图2中的fba1启动子)的载体。所述载体还包含c末端序列,该c末端序列编码与转基因框内融合的hdeler驻留信号(图2的hdel)。所述载体还包含终止子元件(图2中的aox1终止子)。这些元件在本文中统称为“表达盒”,但在一些实施方案中信号肽也可包括在设计中。在一些实施方案中,er驻留信号可存在或不存在。为了在转化到宿主微生物中之前辅助载体的扩增,本领域技术人员可依赖于载体中包含的复制起点(e)(图2中的ori)。为了辅助从不包含表达载体的微生物中选择出稳定转化有表达载体的微生物,本领域技术人员可依赖于载体中启动子元件下游包含的选择标记物(f)(图2中的博莱霉素(zeocin)抗性基因)。表达载体还可包含限制性酶切位点(g)(图2中的swai),其允许在转化到宿主微生物中之前使表达载体线性化,以利于表达载体稳定整合到宿主基因组中。在图2中,由于存在可通过cre/lox重组来催化干预区域的切除的侧翼loxp位点,本领域技术人员可在转化后将元件e、f从其基因组位置中去除(https://en.wikipedia.org/wiki/cre-lox_recombination)。通常,表达盒被设计成当整合到同源宿主微生物的基因组中时介导转基因的转录。在图2中,对于包含表达载体的元件,该宿主微生物为毕赤酵母,但在其他实施方案中该宿主生物可为其中本领域技术人员可将表达载体引入其基因组以使表达载体中的元件被细胞识别从而充分诱导转录以及随后将转录物加工成预期的全长蛋白质的任何微生物。在一些实施方案中,可对转基因进行密码子优化以在宿主生物中最佳地表达。本领域技术人员可将表达载体的基因元件设计成适合于提供在预期的微生物宿主中表达。在一些实施方案中,可设计另外的载体和/或另外的元件以辅助(如本领域技术人员认为是必要的)特定的转化方法(例如,cas9和grna载体,用于基于crispr/cas9的方法)。启动子元件(a)可包括但不限于组成型启动子、诱导型启动子和杂合启动子。启动子包括但不限于acu-5、adh1+、醇脱氢酶(adh1、adh2、adh4)、ahsb4m、ainv、alca、α-淀粉酶、替代氧化酶(aod)、醇氧化酶i(aox1)、醇氧化酶2(aox2)、axdh、b2、camv、纤维二糖水解酶i(cbh1)、ccg-1、cdna1、细胞丝多肽(cfp)、cpc-2、ctr4+、cup1、二羟基丙酮合酶(das)、烯醇酶(eno、eno1)、甲醛脱氢酶(fld1)、fmd、甲酸脱氢酶(fmdh)、g1、g6、gaa、gal1、gal2、gal3、gal4、gal5、gal6、gal7、gal8、gal9、gal10、gcw14、gdha、gla-1、α-葡糖淀粉酶(glaa)、3-磷酸甘油醛脱氢酶(gpda、gap、gapdh)、磷酸甘油酸变位酶(gpm1)、甘油激酶(gut1)、hsp82、invl+、异柠檬酸裂合酶(icl1)、乙酰羟酸异构还原酶(ilv5)、kar2、kex2、β-半乳糖苷酶(lac4)、leu2、melo、met3、甲醇氧化酶(mox)、nmt1、nsp、pcbc、pet9、过氧化物酶体蛋白质(peroxin)8(pex8)、磷酸甘油酸酯激酶(pgk、pgk1)、pho1、pho5、pho89、磷脂酰肌醇合酶(pis1)、pyk1、丙酮酸激酶(pki1)、rps7、山梨醇脱氢酶(sdh)、3-磷酸丝氨酸氨基转移酶(ser1)、ssa4、sv40、tef、翻译延伸因子1α-(tef1)、thi11、同型丝氨酸激酶(thr1)、tpi、tps1、丙糖磷酸异构酶(tpi1)、xrp2、ypt1、gcw14、gap、选自seqidno:31-47的序列或子序列,及其任意组合。在一些实施方案中,所使用的核苷酸可具有与seqidno31-47中的任一个具有80%或更高的序列同一性的序列。在一些情况下,序列同一性可大于90%、95%、98%。用于表达本文所述的甘露糖苷酶的启动子可与宿主细胞异源。用于表达本文所述的甘露糖苷酶的启动子可为宿主细胞原生的。用于表达本文所述的甘露糖苷酶的启动子可为组成型的或诱导型的。可使用强启动子来驱动α-1,2-甘露糖苷酶的表达。例如,如果期望较高的蛋白质含量,则载体可包含强启动子以提高重组蛋白质的去糖基化程度。可替代地,可使用较弱启动子来驱动α-1,2-甘露糖苷酶的表达。例如,如果需要较低的去糖基化程度,则可使用较弱启动子来驱动甘露糖苷酶的表达。宿主细胞可包含驱动重组营养蛋白质表达的第一启动子和驱动α-1,2-甘露糖苷酶表达的第二启动子。第一启动子和第二启动子可选自本文提供的启动子的列表。在一些情况下,α-1,2-甘露糖苷酶和重组营养蛋白质的表达可源自相同的启动子。可替代地,第一启动子和第二启动子可不同。信号肽(b),一种信号肽,其也称为信号序列、靶向信号、定位信号、定位序列、信号肽、转运肽、前导序列或前导肽,可支持蛋白质或多核苷酸的分泌。重组蛋白质或异源表达的蛋白质从宿主细胞的细胞外分泌可有助于蛋白质纯化。信号肽可源自蛋白质的前体(例如前肽原、前蛋白)。信号肽可源自蛋白质的前体,包括但不限于酸性磷酸酶(例如毕赤酵母pho1)、白蛋白(例如鸡)、碱性细胞外蛋白酶(例如解脂耶氏酵母(yarrowialipolytica)xrp2)、α-交配因子(α-mf、matα)(例如酿酒酵母(saccharomycescerevisiae))、淀粉酶(例如α-淀粉酶、米根霉(rhizopusoryzae)、粟酒裂殖酵母(schizosaccharomycespombe)推定淀粉酶spcc63.02c(amy1))、β-酪蛋白(例如牛)、碳水化合物结合模块家族21(cbm21)-淀粉结合结构域、羧肽酶y(例如粟酒裂殖酵母cpy1)、纤维二糖水解酶i(例如里氏木霉cbh1)、二肽蛋白酶(例如,粟酒裂殖酵母推定二肽蛋白酶spbc1711.12(dpp1))、葡糖淀粉酶(例如,泡盛曲霉(aspergillusawamori))、热休克蛋白(例如,细菌hsp70)、疏水蛋白(例如,里氏木霉hbfi、里氏木霉hbfii)、菊糖酶、转化酶(例如,酿酒酵母suc2)、致死蛋白质或致死毒素(例如128kdapgkl致死蛋白质、k1致死毒素的α-子单元(例如,乳酸克鲁维酵母(kluyveromyceslactis))、k1毒素kilm1、k28前原毒素、合金欢毕赤酵母(pichiaacaciae))、富含亮氨酸的人工信号肽cly-l8、溶菌酶(例如,鸡cly)、植物血凝素(pha-e))(例如,菜豆(phaseolusvulgaris))、麦芽糖结合蛋白(mbp)(例如,大肠杆菌(escherichiacoli))、p因子(例如,粟酒裂殖酵母p3)、毕赤酵母dse、毕赤酵母exg、毕赤酵母pir1、毕赤酵母scw和细胞壁蛋白pir4(具有内部重复序列的蛋白质)。信号肽的示例还可包含选自seqidno48-144的序列或子序列,及其任意组合。在一些实施方案中,不存在信号肽。在一些实施方案中,信号蛋白质或肽可具有与seqidno48-144中的任一个具有80%或更高的序列同一性的序列。在一些情况下,序列同一性可大于90%、95%、98%。er靶向/驻留信号该基序将发出所得蛋白质对于er的驻留信号。er驻留信号可源自蛋白质的前体(例如前肽原、前蛋白)。er驻留信号可源自蛋白质的前体,包括但不限于编码氨基酸序列kdel、hdel的多核苷酸,或可由seqidno1-10或145-149中包含的子序列所编码的跨膜结构域。er驻留信号通常框内融合在转基因orf的c末端上,但在一些实施方案中,它可紧接在信号肽的切割位点下游(如果存在)框内融合在转基因n末端上。在一些实施方案中,不存在er驻留信号。在一些实施方案中,表达的蛋白质、例如α-1,2-甘露糖苷酶将驻留在er中或否则不需要er驻留信号来提供异源蛋白质的细胞内去糖基化。转基因(c)可包括但不限于编码多肽的核酸,例如选自seqidno:1-30或145-150的那些多核苷酸。可设计这些序列进行改变以编码相同的蛋白质,并进行优化以在所选择的宿主中表达(即密码子优化);例如,编码α-1,2甘露糖苷酶的核酸序列和密码子优化构成seqidno.151-152。在该示例中,终止子元件(d)为aox1终止子,但是其可被选择为用于中止含有对应于转基因的mrna的新生转录物的继续延伸的任何合适的序列。选择性标记物(f)可包括但不限于:抗生素抗性基因(例如,博莱霉素、氨苄青霉素(ampicillin)、杀稻瘟素(blasticidin)、卡那霉素(kanamycin)、诺尔丝菌素(nurseothricin)、氯霉素(chloroamphenicol)、四环素(tetracycline)、三氯生(triclosan)、更昔洛韦(ganciclovir),及其任意组合)、营养缺陷型标记物(例如,fade1、arg4、his4、ura3、met2,及其任意组合)。用载体转化微生物宿主接下来,将表达载体或源自表达载体的包含编码遗传信息的表达盒的多核苷酸(dna或rna)插入宿主细胞中,并且可通过本领域已知的任何方法分离成功的转化体的克隆群。适于用携带表达盒的多核苷酸进行转化的微生物是本领域技术人员已知的,所述表达盒包含编码α-1,2甘露糖苷酶的子序列。这些微生物可包括但不限于:arxula物种、解腺嘌呤阿氏酵母(arxulaadeninivorans)、克鲁维酵母属物种(kluyveromycesspp.)、乳酸克鲁维酵母(kluyveromyceslactis)、毕赤酵母属物种(pichiaspp.)、安格斯毕赤酵母(pichiaangusta)、毕赤酵母、酵母属物种(saccharomycesspp.)、酿酒酵母(saccharomycescerevisiae)、裂殖酵母属物种(schizosaccharomycesspp.)、粟酒裂殖酵母(schizosaccharomycespombe)、耶氏酵母属物种(yarrowiaspp.)、解脂耶氏酵母(yarrowialipolytica)、蘑菇属物种(agaricusspp.)、双孢蘑菇(agaricusbisporus)、曲霉属物种(aspergillusspp.)、泡盛曲霉(aspergillusawamori)、烟曲霉(aspergillusfumigatus)、构巢曲霉(aspergillusnidulans)、黑曲霉(aspergillusniger)、米曲霉(aspergillusoryzae)、刺盘孢属物种(colletotrichumspp.)、盘长孢状刺盘孢(colletotrichumgloeosporiodes)、内座壳属物种(endothiaspp.)、寄生内座壳(endothiaparasitica)、镰孢属物种(fusariumspp.)、禾谷镰孢(fusariumgraminearum)、腐皮镰孢(fusariumsolani)、毛霉属物种(mucorspp.)、米黑毛霉(mucormiehei)、微小毛霉(mucorpusillus)、毁丝霉属物种(myceliophthoraspp.)、嗜热毁丝霉(myceliophthorathermophila)、脉孢菌属物种(neurosporaspp.)、粗糙脉孢菌(neurosporacrassa)、青霉属物种(penicilliumspp.)、沙门柏干酪青霉(penicilliumcamemberti)、变灰青霉(penicilliumcanescens)、产黄青霉(penicilliumchrysogenum)、埃默森青霉(踝节菌)(penicillium(talaromyces)emersonii)、绳状青霉(penicilliumfuniculosum)、产紫青霉(penicilliumpurpurogenum)、娄地青霉(penicilliumroqueforti)、侧耳属物种(pleurotusspp.)、糙皮侧耳(pleurotusostreatus)、根毛霉属物种(rhizomucorspp.)、米黑根毛霉(rhizomucormiehei)、微小根毛霉(rhizomucorpusillus)、根霉属物种(rhizopusspp.)、少根根霉(rhizopusarrhizus)、少孢根霉(rhizopusoligosporus)、米根霉(rhizopusoryzae)、木霉属物种(trichodermaspp.)、深绿木霉(trichodermaaltroviride)、里氏木霉(trichodermareesei)、绿色木霉(trichodermavireus)、米曲霉(aspergillusoryzae)、枯草杆菌(bacillussubtilis)、大肠杆菌(escherichiacoli)、嗜热毁丝霉(myceliophthorathermophila)、粗糙脉孢菌(neurosporacrassa)、毕赤酵母(pichiapastoris)、法夫驹形氏酵母(komagatellaphaffii)和巴斯德驹形氏酵母(komagatellapastoris)。细胞可通过引入外源多核苷酸来转化,例如通过直接吸收、胞吞、转染、f-交配、peg介导的原生质体融合、根癌农杆菌(agrobacteriumtumefaciens)介导的转化、基因枪转化、化学转化或电穿孔。一旦引入,外源多核苷酸可作为非整合表达载体(例如质粒)被保持在细胞内或整合到宿主细胞基因组中。细胞群可被选择为吸收外源表达载体的那些细胞(借助表达载体上携带的抗性基因),其通过平板接种到含有某些试剂(例如抗生素博莱霉素)的琼脂平板上进行,所述试剂否定地选择不携带赋予对该试剂抗性的基因的细胞。可替代地,技术人员可通过敲除合成必需代谢产物(例如尿嘧啶)所需的基因(例如毕赤酵母的ura3基因)来产生营养缺陷型菌株,使用包含补足敲除基因(即ura3基因)的基因作为选择标记物的表达载体转化该菌株,并借助其在缺乏所述必需代谢产物的培养基上生长的能力来选择转化的细胞。采用任一种方法将铺展有含有推定转化体的细胞群的平板在适于可手动选择的菌落的生长的温度下培育一定时间后(本领域技术人员已知),可挑选各个菌落并验证表达载体宿主细胞基因组中的整合,这通过本领域技术人员已知的标准分子生物学方法(即菌落pcr、基因组测序)进行。然后,可将来自这些平板的各个菌落用于接种各个培养皿,所述各个培养皿包含对于细胞系合适的生长培养基,所述培养基含有选择作为适于转化的表达载体中包含的选择标记物的选择试剂。适当的时间后(例如在摇瓶中于30摄氏度下过夜;或者本领域技术人员已知的其他方式),细胞系与重组载体的成功转化可在每个培养皿中通过转化的表达盒上的转基因编码的蛋白质(下文中称为“重组蛋白质”)的存在来确定。该表达可通过标准分子生物学方法(例如,蛋白质印迹、使用已知标准蛋白质的sds-page)来确定。然后,来自与显示重组蛋白质表达的培养皿相对应的那些平板的菌落可用于接种含有适于转化的细胞系的选择培养基的容器,以促进细胞系的生长和重组蛋白质的表达。可替代地,来自与显示重组蛋白质表达的培养皿相对应的那些平板的菌落可保存起来以备后用(例如在甘油储液中在-80摄氏度下)。转化的菌株的功效测定对证实用编码α-1,2甘露糖苷酶的整合转基因稳定转化的所得菌株进行测试,测试其表达对内源或异源表达的靶蛋白的糖基化的作用。在亲本野生型菌株中或含有异源α-1,2甘露糖苷酶的亲本菌株中表达的蛋白质的表达和纯化是本领域技术人员已知的。例如,在甲基营养型酵母菌株(例如毕赤酵母)中,如果靶蛋白与甲醇诱导的启动子(即aox1)有效地连接以进行强表达,则该靶蛋白可被诱导。如果该靶蛋白还包含信号肽,则可将该靶蛋白从培养基中回收,并使用本领域技术人员已知的技术对其进行充分纯化以进行分析。通常,技术人员可在来自具有和不具有(本文中称为“对照蛋白质”)α-1,2甘露糖苷酶的细胞的纯化的蛋白质样品之间比较目标蛋白质(例如靶蛋白)上存在的聚糖基团,或将其与从天然来源分离的相同蛋白质进行比较。这些样品制备和比较的措施可使用如下技术进行,包括但不限于例如以下的方法:毛细管电泳或sds-page(用于比较目标蛋白质的尺寸)、使用聚糖特异性抗体的免疫染色技术(例如蛋白质印迹法)和用于鉴定样品中的聚糖基团的定量质谱法(例如通过maldi-tof/tofms进行的n-连接的聚糖谱分析)。参见例如zivroth,galityehezkel和isamkhalailainternationaljournalofcarbohydratechemistryvolume2012(2012)。在一些实施方案中,可计算重组表达的卵清蛋白的manxglcnac2和manyglcnac2值的比率。在一些情况下,x值可小于或等于1、2、3、4或5。在一些情况下,y值可大于或等于6、7、8、9或10。在一些情况下,manxglcnac2:manyglcnac2的比率可大于1。在一些实施方案中,重组表达的卵清蛋白的聚合度可小于或等于9。在一些情况下,聚合度可小于9、8、7或6。以下实施例概述了样品的制备和分析,以用于测定靶蛋白(即对应于seqidno:12的蛋白质)上存在的聚糖基团。在一些实施方案中,靶蛋白或肽可具有与seqidno.12具有80%或更高的序列同一性的序列。在一些情况下,序列同一性可大于90%、95%或98%。在一些实施方案中,重组卵清蛋白的氮碳(n-c)比可大于0.25。在一些情况下,重组表达的蛋白质的n-c比可大于约0.25、约0.3、约0.35或约0.4。通过maldi-tof/tofms进行的n-连接的聚糖谱分析各样品的对应于300μg的等分试样可用于分析。将糖蛋白还原,烷基化,然后在三羟甲基氨基甲烷盐酸盐(tris-hcl)缓冲液中用胰蛋白酶消化过夜。蛋白酶消化后,使样品通过c18seppak小柱,用低重量/重量百分比的乙酸洗涤,并将糖肽用异丙醇于低浓度乙酸中的混合物洗脱,然后通过speedvac干燥。将干燥的糖肽洗脱物用肽-n-糖苷酶f(pngasef)处理以释放n-连接的聚糖,然后将消化物通过c18seppak小柱以回收n-聚糖。n-连接的聚糖的全-o-甲基化将n-连接的聚糖全甲基化以通过质谱法进行结构表征(anumula和taylor,1992)。简而言之,将干燥的洗脱物用二甲基亚砜溶解,并用naoh和碘甲烷进行甲基化。将反应用水淬灭,并将全-o-甲基化的碳水化合物用二氯甲烷萃取,并在n2下干燥。通过基质辅助的激光解吸飞行时间质谱仪(maldi-tof/tofms)进行谱分析将全甲基化的聚糖用甲醇溶解,并用α-二羟基苯甲酸(dhba)基质结晶。样品中存在的聚糖通过maldi-tof/tof-ms使用absciextof/tof5800(appliedbiosystems)进行分析。图3a和图3b示出了上述过程的样品质谱结果,旨在告知实际工作者对照样品(图3a)中存在的各糖型相对于从表达异源α-1,2甘露糖苷酶的细胞系获得的样品(图3b)的相对量。表1和表2中列出了每种鉴定出的糖型的相对量,表1和表2分别对应于对照样品和α-1,2甘露糖苷酶样品。该图中示出的数据表示预期结果,其中相对于对照样品而言,甘露糖苷酶的活性增加了该样品中man5glcnac2型结构相对于其他聚糖结构的相对存在量。在样品2中,man5glcnac2占鉴定糖型的77.1%(表2),而在样品1中,man5glcnac2不在所鉴定的糖型中(表1)。正方形-n-乙酰氨基葡萄糖(glcnac);绿色圆圈-甘露糖(man);白色圆圈-己糖(hex)。1所有质量(质量+na)均为单电荷的。2由检测到的n-连接的聚糖的面积单位计算。实施例实施例1:α-1,2甘露糖苷酶的鉴定blastp用于搜索与已知的α-1,2甘露糖苷酶具有同一性的蛋白质序列,所述α-1,2甘露糖苷酶可赋予对在毕赤酵母属物种(当前已归类为法夫驹形氏酵母属物种)中异源表达的蛋白质上的聚糖结构进行修饰。鉴定的示例性真菌α-1,2甘露糖苷酶蛋白质序列包括seqidno.1-10。进行进一步搜索以找出原鸡的序列。示例性的原鸡α-1,2甘露糖苷酶蛋白质序列包括seqidno.145-150。实施例2:用于毕赤酵母属中的α-1,2甘露糖苷酶表达的表达载体的构建选择真菌α-1,2甘露糖苷酶蛋白质序列seqidno.7(称为trmds2)与原鸡α-1,2甘露糖苷酶蛋白质序列seqidno.150(称为ggman1a1)一起进行表达。对于ggman1a1,对cdna(seqidno.152)进行密码子优化以增加在毕赤酵母属中的表达(seqidno.153,称为ggman1a1c)。将各cdna、trmds2和ggman1a1c克隆到毕赤酵母属表达载体中甲醇诱导型启动子的下游,所述载体包含用于博莱霉素抗性的选择性标记物。通过电穿孔将α-1,2甘露糖苷酶表达载体转化到先前证实分泌ovd的法夫驹形氏酵母菌株(菌株1)中。将2个α-1,2甘露糖苷酶的表达盒单独地或一起转化到表达ovd的菌株中。在含有博莱霉素的琼脂平板上选择转化的细胞,并使各个菌落在微量滴定96孔板中生长,以评价分泌的ovd的品质。实施例3:α-1,2甘露糖苷酶在毕赤酵母属中的表达以高通量形式进行布拉德福德(bradford)蛋白质测定法,以证实生长培养基中分泌的蛋白质的存在。然后通过sds-page筛选来自选择孔的上清液。然后在40ml摇瓶和/或高达40l生物反应器中按比例放大来自sds-page的显示出所需蛋白质模式的克隆体,以证实转化的去糖苷酶的活性。在一种表达trmds2的菌株(菌株2)上使用以摇瓶模式产生的材料进行通过lc/ms的外部聚糖分析。检查来自表达trmds2的毕赤酵母属的sds-page结果表明,在测试条件下不分泌该异源蛋白。这意味着天然的trmds2蛋白序列包含被毕赤酵母属识别的细胞内定位信号。trmds2蛋白足够大,从而可在ovd以上很好地运行并且应在蛋白凝胶上可见。实施例4:trmds2在毕赤酵母中的异源表达的活性分析在摇瓶实验中,与其亲本菌株1相比,菌株2中trmds2的异源表达没有显著降低ovd表达。在其最初的摇瓶运行中,与菌株1副本株的平均分泌水平相比,sf17菌株2分泌了95%的ovd(图4a)。然而,这种差异在摇瓶实验的误差之内。在随后的运行中,与菌株1副本株相比,菌株2副本株sf22分泌了109%的ovd(图4b)。在所有实验中,菌株2产生了分泌的ovd的可见的条带图下移,如通过sds-page分析所观察到的(图4a-b)。该条带位移表明了从菌株1到菌株2的ovd的表观分子量降低,理论上是由于蛋白质上存在的聚糖减少。菌株2菌株中ovd糖基化的减少通过外部lc/ms进行证实(表3)。在菌株1产生的ovd上发现的几乎所有聚糖均具有9个或更高的甘露糖分支模式。相反,在菌株2产生的ovd上发现的大多数聚糖含有8个或更少的甘露糖分支。已知的法夫驹形氏酵母甘露糖基化的分支模式如图5所示。表3.在由菌株1和菌株2分泌的ovd上发现的聚糖的相对分布总结。实施例5:ggman1a1在毕赤酵母属中的异源表达ggman1a1在菌株1中的异源表达产生一系列的去糖基化作用,其中最强的作用接近于菌株2的条带图,其中最弱的作用近似于菌株1的条带图并具有非常轻微的下移。进行sds-page分析以比较ggman1a1功能性的两个极端(extreme)与trmds2以及菌株1条带图(图6)。在分析中,将菌株3(菌株1的衍生菌株,其产生更多的ovd但保持相同的糖基化模式)用作标准ovd条带图。尽管trmds2表达在转化体之间有所不同,但较弱的trmds2克隆体仍显示出与菌株2非常接近的条带图。图6中的比较还包括了“弱”mds2克隆体。trmds2与ggman1a1的条带图存在微小差异。实施例6:ggman1a1在毕赤酵母属中的定位样品ggman1a1.a代表在筛选期间发现的最强的去糖基化作用,ggman1a1.b代表最弱的。在凝胶的左侧,从mds2到ggman1a1.b存在渐进向上的条带位移,表明一系列的去糖基化作用。然后将各样品与在凝胶右侧的菌株3进行单独比较,以证实去糖基化。检查来自表达ggman1a1的毕赤酵母属的sds-page结果表明,该异源蛋白在测试条件下不分泌。ggman1a1蛋白足够大,从而可在ovd以上很好地运行,并且应在蛋白凝胶上可见。这意味着天然的ggman1a1蛋白序列包含被毕赤酵母属识别的细胞内定位信号。在由星号标记的条带中观察到强和弱trmds2去糖基化之间的主要差异。该条带似乎是接近的双联体。在强trmds2图中,双联体偏向底部条带,而弱trmds2图则偏向顶部条带。除星号标记的条带之外,ggman1a1.a显示出与mds2相似的条带图。ggman1a1.a的该条带的尺寸似乎介于双联体之间。ggman1a1.b显示出所有条带的进一步向上位移。当与凝胶右侧紧挨着的标准ovd图进行比较时,其轻微向下位移,并显示出trmds2去糖基化模式中可见的最顶部条带的特征消失。在菌株1中共表达trmds2和ggman1a1,并且通过sds-page分析检查糖基化模式。观察到一系列的去糖基化模式,包括单独的trmds2的去糖基化模式(图7)。实施例7:hsorm1的去糖基化人血清糖蛋白“血清类粘蛋白1”(智人orm1;hsorm1;单向转运p02763)在天冬酰胺残基33、56、72、93和103处具有五个预测的n-糖基化共有基序。hsorm1编码序列位于甲醇诱导的启动子的下游。α-交配因子信号序列融合到hsorm1编码序列的n末端。翻译的融合物提供了多肽序列seqidno:154(粗体表示hsorm1序列,非粗体表示信号序列氨基酸)。将表达构建体转化到毕赤酵母(也称为法夫驹形氏酵母)muts菌株中,选择初代转化体,然后使用甲醇作为hsorm1转录的诱导剂进行96h时程的过程。通过培养基上清液的sds-聚丙烯酰胺凝胶电泳(sds-page)来分析表达。毕赤酵母属表达的hsorm1迁移为六个不同的多肽种类(参见下文图8);预测最低分子量种类(21.5kda)为非糖基化形式,其他形式可能对应于单糖基化至五糖基化形式。为了证明毕赤酵母表达的hsorm1具有高的甘露糖聚糖,将来自菌株4的包含hsorm1的上清液用1000单位的内切葡聚糖酶h(eh)在37℃下体外处理1h。eh处理后,通过sds-page分析样品,仅剩余完全去糖基化的21.5kda多肽种类,这进一步支持了其为完全去糖基化的形式的观察结果。图8:左分图-mw为分子量蛋白质参考梯;mw右侧的泳道为表达hsorm1的各个转化体。右分图-泳道1为分子量蛋白质参考梯;泳道2为表达hsorm1的转化体的提取物;泳道3为用糖苷内切酶h处理的相同转化体的提取物。黑色箭头表示外源添加的内切h酶;灰色箭头表示21.5kda的体外去糖基化hsorm1蛋白质种类。在菌株纯化后,使菌株4(对应于孔c11上清液;上面的红色箭头)适于dna电穿孔,随后在甲醇诱导型启动子(seqidno:38)和甲醇诱导的转录终止子的控制下用trmds2cdna表达构建体对其进行转化。在含甲醇的诱导培养基中进行96h时程实验后,通过其hsorm1条带位移图来选择hsorm1+/pex11-trmds2共表达子。图9a和图9b显示了hsorm1在推定的trmds2转化体的sds-page上的条带图。对于上述测试的转化体的子集,通过pcr使用引物在开放阅读框中扩增内部1066bppcr产物验证了trmds2的存在,如图9c所示。pcr产生的1066bp产物为所有的测试转化体a2、a8、b3、c3、c7、d3、e4、f4、g8,而在未转化的对照中未发现pcr产物。在最初的诱导实验之后,比较了hsorm1+/trmds2共表达子的子集的hsorm1去糖基化程度(下图10)。由左至右,pcr基因型菌株(对trmds2构建体为阳性)显示出不同水平的hsorm1去糖基化(从非常轻微到显著的糖基化),如从sds-page上较小的hsorm1多肽种类增加所观察到的。这些菌株的比较表明,表达的动物蛋白质(例如hsorm1)的糖基化程度可通过选择各种水平的去糖基化模式进行微调,例如通过不同水平的trmds2表达所产生的去糖基化模式。实施例8:卵白蛋白(ova)的去糖基化通过在氨基酸残基292(seqidno:26,粗体)处的天冬酰胺连接的(n-连接的)糖基化,对天然原鸡卵白蛋白(ova)进行翻译后修饰,并且在文献中也已经指出氨基酸残基311有时被糖基化(seqidno:26粗体/带下划线的字体)。在甲醇诱导型启动子和甲醇诱导型终止子的转录控制下,制备了包含毕赤酵母属密码子偏性(codon-biased)的卵白蛋白cdna的ova表达构建体。随后,将该多拷贝表达构建体转化到muts毕赤酵母属菌株5中以产生菌株6。然后,对毕赤酵母菌株6进行抗生素抗性标记物(arm)去除,以产生菌株7,随后使该菌株适于进行trmds2转化。在毕赤酵母属dna转化后,在含甲醇的培养基中96h时程后,表达的重组ova(rova)以三种不同的种类出现在转化体的培养基上清液中;未糖基化的以及单糖基化和二糖基化的ova在sds-page上迁移在一起呈现三重态(参见图11中的“输入”)。为了进一步表征毕由赤酵母属表达的ova,将上清液用市售的糖苷内切酶endoh(eh;newenglandbiolabs)和pngase(pf;newenglandbiolabs)均各自使用“天然”(n)和“变性”(d)方案(如制造商所述)(https://www.neb.com/protocols/2012/10/18/endo-hf-protocol;https://www.neb.com/protocols/2014/07/31/pngase-f-protocol))进行体外处理。使用糖苷内切酶中任一种的处理产生未糖基化的ova的条带位移图。黑色箭头表示添加到反应中的pngasef,凝胶上的灰色箭头表示添加到反应中的endoh;出现在灰色箭头和黑色箭头上方的条带为去糖基化的ova蛋白。用甲醇诱导的trmds2构建体转化表达ova的毕赤酵母属菌株(菌株7;上文所述)(参见实施例7)。将ova+/trmds2+转化体进行10%sds-page以观察条带位移图。下面图12示出的是分子量(mw)梯(泳道1,最左侧)。标有“c”的泳道包含由表达ova的亲本菌株(无trmds2)产生的rova。泳道a9、d10、f5、g5、g7、g10、h1和h2来自用甲醇诱导的trmds2构建体转化的ova菌株。这些结果表明,trmds2能够从毕赤酵母属表达的rova上的各聚糖链除去约1.5-2.5kda的碳水化合物。通过pcr验证转化体存在trmds2(参见实施例7)。转化体a9、d10、f5、g5、g7、g10、h1和h2(均在上面的条带位移凝胶中示出)为trmds2阳性转化体。例9:trmds1测试将两个不同的密码子偏性的trmds1构建体转化入表达原鸡ovd(ggovd)的菌株。为了进行表达,将trmds1置于若干诱导型和组成型启动子之后。将构建体1工程化为在组成型启动子之后表达非毕赤酵母属密码子偏性的(nco)trmds1cdna,将构建体2工程化为在组成型gap1启动子之后表达毕赤酵母属密码子优化的(co)trmds1cdna,将构建子3工程化为在甲醇诱导型启动子之后表达毕赤酵母属密码子优化的trmds1cdna,将构建体4工程化为在甲醇诱导型启动子之后表达毕赤酵母属密码子优化的trmds1cdna,将构建体5工程化为在甲醇诱导型启动子之后表达非毕赤酵母属密码子优化的trmds1cdna,并将构建体6工程化为在甲醇诱导型启动子之后表达非毕赤酵母属密码子优化的trmds1cdna。在甲醇诱导时程之后,分析上清液的ggovd条带位移。尽管进行了表达这些多种mds1的工作,但是条带位移分析表明mds1不能使ggovd去糖基化。这与以上例示的新的甘露糖苷酶、mds2和原鸡甘露糖苷酶相反。图13示出了mds1对ggovd缺乏去糖基化活性的条带位移凝胶。凝胶1(由左至右):分子量梯、构建体2gap-co_trmds1转化体1-8、单独的ggovd菌株(无甘露糖苷酶表达)、构建体1组成型nco_trmds1转化体1、构建体3甲醇诱导型trmds1转化体1和2、单独的ggovd菌株(无甘露糖苷酶表达)、构建体3转化体3。图14:凝胶2(由左至右):单独的ggovd菌株(无甘露糖苷酶表达)、分子量梯、构建体4甲醇诱导型co_trmds1转化体1-8、单独的ggovd菌株(无甘露糖苷酶表达)、构建体5甲醇诱导型co_trmds1转化体1-4。总体来看,对mds1构建体的240个单独的转化体针对用于使ggovd去糖基化的能力进行了筛选,但没有一个具有活性。实施例10:ovd糖基化模式的比较使用标准燃烧方法分析了由来自毕赤酵母属发酵的蛋白质样品和来自市售来源的天然鸡卵类粘蛋白的蛋白质样品组成的干粉的总的粗蛋白。在该方法中,总的粗蛋白基于样品类型由进料的氮含量计算得出,并在表4中显示为粉末的百分比蛋白质。应用氮结果的蛋白质因子为6.25。该方法的检出限为0.1%蛋白质(干基)。mds2(seq7)与鸡ovd在毕赤酵母属细胞中共表达,并使用标准蛋白质色谱法从发酵上清液中纯化所得的重组ovd(rovd)。使用膜过滤法从所得的蛋白质溶液中除去非蛋白质污染物。使用冻干法将纯化的蛋白质溶液干燥成粉末。然后将蛋白粉送去进行总的粗蛋白分析。制备的不具有任何mds2功能的rovd粉末具有平均74%的蛋白质,但是当共表达mds2时,其高达85%的蛋白质。相对于天然鸡ovd样品ovd,85%的经mds2处理的材料也具有更高%的蛋白质,这归因于mds2除去蛋白质上碳水化合物的功能。表4:ovd样品的蛋白质含量样品类型菌株n(总计)%蛋白质具有mds2的rovd菌株213.785.625未去糖基化的rovd菌株1未得到74天然ovd重复序列1-12.3577.1875天然ovd重复序列2-12.4477.75表5:序列虽然本文已经示出并描述了本发明的优选实施方案,但对于本领域技术人员明显的是,这些实施方案仅以示例的方式提供。在不脱离本发明的情况下,本领域技术人员将会想到许多变化、改变和替换。应当理解,可采用本文所述的本发明的实施方案的各种可替代方案来实践本发明。旨在由所附权利要求限定本发明的范围,并且由其涵盖这些权利要求范围内的方法和结构及其等同方案。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 基料、含有该基料的产物、其制备方法及用图
- 一种晚期糖基化终产物受体的特异性拮抗肽及其衍生物与应用
- 一种用于预测急性脑梗死患者发生微出血的试剂的制作方法
- 高级糖化终产物的去糖化的制作方法
- 经历经皮冠状动脉介入术的患者中再狭窄的诊断的制作方法
- 糖链识别受体的新用途的制作方法
- 放射性配基N<sub>2</sub>S<sub>2</sub>-Memantine和脑受体显像剂<sup>99m</sup>Tc-Memantine的油水分配系数测定方法
- 处理合成的金属加工液体和含油基产物的膜生物反应器系统的制作方法
- 由生物基材料的反应性挤出产物制得的热成型制品的制作方法
- [3-(4-{2-丁基-1-[4-(4-氯-苯氧基)-苯基]-1h-咪唑-4-基}-苯氧基)-丙基]-二乙基-胺 ...的制作方法