作为医疗用材料使用的高浓度胶原蛋白制备方法与流程
本发明涉及一种制成适合作为医疗用材料的高浓度胶原蛋白制备方法,更详细地说,为了把胶原蛋白作为医疗用材料使用而能够制备成多种浓度,其中,高浓度胶原蛋白在其相应的目的上发挥出优异的性能,相比于低浓度更容易保管。本发明能提高产品品质与可靠性而得以满足需求者的众多要求,因此是一种非常有用的发明。
背景技术:
胶原蛋白(collagen)分布在动物的各种组织,也称为胶原质,是一种占整体重量的30%左右的蛋白质。
胶原蛋白通常是纤维状态的蛋白质并且是构成皮肤、骨、筋的蛋白质之一。胶原蛋白在身体的结合组织上分布较广,人体大约含有20%的蛋白质,其中胶原蛋白大约占有30%。上述胶原蛋白的分子结构具备了以3个多肽链缠绕并且以氢键互相结合的三螺旋结构。具备该结构的胶原蛋白具有细胞的粘结、身体与脏器的支持、细胞功能的激活、细胞增殖作用、止血、免疫力之类的功能,在形成身体的同时还能赋予有机功能,因此是身体必需的蛋白质。
具备该特性的胶原蛋白目前在包含美容、健康饮料、健康食品、医药品及化妆品领域在内的众多领域作为原料或添加剂使用,得益于其功能特性而使得应用领域日益扩展中。
如前所述,胶原蛋白收集牛或猪的骨和皮后为了从组织中分离出胶原蛋白质而通常进行有机溶剂提取、酸/碱处理后使胰酶、透明质酸酶发挥作用以非溶性物质得到胶原蛋白,但是其分子量较高而人体较难消化吸收,原料所含各种杂质则导致纯度降低,因此其使用领域受到了限制。
目前已知的胶原蛋白有20多种,其中大部分是胶原蛋白1型,形态上则是以纤维相固态存在,具有3束多肽以氢键搓扭的结构,分子量大约为300kda。
胶原蛋白可以溶解到稀酸或稀碱后制成液态,浓度越高其黏度越高。
胶原蛋白适合生体组织并且是一种生物降解物质,因此作为组织修复材料、皮肤移植材料、骨移植材料,细胞培养等医疗用材料中的一个而广泛地应用。
另一方面,为了把提取自众多原料并制成液态的胶原蛋白清除异物和微生物后制备医疗用材料,通常会进行传统的过滤过程。
传统的过滤方式在垂直于滤膜的方向形成压力和流体流后过滤掉大于滤膜滤孔(pore)的物质而让小于该滤膜滤孔的物质通过。该过滤方法让过滤对象一次性地透过,没有透过的物质则积累在滤膜上,导致过滤量越多过滤效率越低,最后则发生滤膜堵塞的现象。因此传统过滤方式依赖于过滤对象的容量与膜面积,其能够过滤的浓度也较低。
鉴于该限制,为了过滤作为高分子蛋白质的胶原蛋白而需要制成低浓度的液态,尤其是进行用于清除微生物的细菌过滤时,为了透过具备0.22~0.45微米小滤孔的滤膜而需要制成大约5mg/ml以下的浓度。
至于把制成低浓度的胶原蛋白溶液浓缩成高浓度的方法,一般的蒸发浓缩方法可能会出现胶原蛋白热变性现象,需要较长的制备时间而难以适用,使用挥发性溶剂浓缩的方法则需要另外清除残留的溶剂而不适合作为医疗用材料的制备方法。
先前技术文献
(专利文献1)日本公开专利第2001-200000号揭示了海洋生物来源胶原蛋白的制备方法,其利用下列步骤制备浓缩的胶原蛋白:把海洋生物的皮肤组织清洗干净后利用有机酸提取胶原蛋白,让如此得到的溶液通过纯化膜清除杂质,让利用蛋白分解酶提取的溶液通过纯化膜的过滤工序;通过浓缩膜的浓缩工序;灭菌过滤工序。
(专利文献2)韩国公开专利第2014-0091435号揭示了胶原蛋白制备方法,该胶原蛋白制备方法包括下列步骤:利用切向流过滤装置进行浓缩;利用离心分离机浓缩上述浓缩后的胶原蛋白;利用冻干机浓缩上述浓缩后的胶原蛋白。
(专利文献3)美国专利第4894441号揭示了胶原蛋白制备方法,该胶原蛋白制备方法包括下列工序:利用有机酸从动物的皮肤提取生物组织;在上述提取物添加氯化钠提取胶原蛋白;tangentialfiltration工序。
(专利文献4)日本公开专利2011-201837揭示了胶原蛋白水解物的制备方法,其揭示了疏水性高分子和亲水性高分子的品牌水(brandwater),形成有管壁的多孔性中空丝膜。
(专利文献5)(国际专利文献5)揭示了具备三螺旋结构的蛋白质的制备方法,其包括利用错流过滤方法浓缩胶原蛋白后进行离心分离精炼胶原蛋白的过程。
技术实现要素:
解决的技术课题
本发明旨在解决上述现有技术的诸多问题,胶原蛋白是一种具有较低的抗原性并且能够进行生物降解的生物降解相容性蛋白质,为了获得该胶原蛋白而从各种动物的组织提取,不仅应用于医疗器材与医药品之类的医疗用材料,还可以作为化妆品、食品的原料广泛地使用。
为了把胶原蛋白作为医疗用材料使用,需要确保生物学上的安全性。尤其是,从动物的组织(tissue)提取胶原蛋白时,为了防止动物来源病毒的转移而需要清除病毒或灭活病毒,还要适当地清除微生物。
一般来说,病毒可以通过提高温度予以消灭或者利用具备纳米级滤孔(poresize)的过滤器予以过滤地清除病毒。但是胶原蛋白在37℃以上的高温变性而使得构成三螺旋束的结构分解成三个单束并且进行凝胶化失去胶原蛋白的基本特性,作为高达300纳米的高分子蛋白质,很难通过用于清除病毒的过滤器。
而且,广泛地用于胶原蛋白提取过程的酶或氯化钠等低分子物质必须被清除到适合用于医疗用途的程度。
一般来说,胶原蛋白作为医疗用材料以液态制剂使用时,为了延长胶原蛋白的残留时间或维持体积而要求30~60mg/ml的高浓度胶原蛋白,通过冻干制备固形制剂时也为了减少冻干机的容量与运转时间而要求高浓度的胶原蛋白。为了作为如前所述的医疗用材料满足消费者的要求,胶原蛋白需要制备成60mg/ml以上的高浓度。
而且,为了制备高浓度的液相形态医疗用胶原蛋白产品而使用胶原蛋白粉末的话,不可能在维持胶原蛋白的固有性质与结构地在粉末状态下灭菌,在重新溶解成液态后进行灭菌及浓缩的过程中需要无菌设备和较长时间。
解决课题的技术方案
把哺乳动物的组织以70%乙醇(ethylalcohol)处理24小时,以酸性溶液处理72小时以上地把病毒予以灭活,利用0.22微米滤孔的过滤器予以过滤,从而清除微生物而得以确保安全性。
通过利用胃蛋白酶的胶原蛋白提取、氯化钠、过滤器、切向流过滤装置、ph中和等制成高纯度胶原蛋白。
而且,通过利用切向流过滤、ph中和、离心分离的浓缩过程浓缩成120mg/ml的高浓度,将其均匀混合制成液态、海绵、粉末形态的各种产品。
如前文所述,把哺乳动物的组织予以病毒灭活并通过切向流过滤把之前工序所使用的酶、氯化钠之类的低分子物质清除后,利用0.22微米滤孔的过滤器予以过滤而制成了适合作为医疗用的无菌液态胶原蛋白。而且,通过切向流滤膜、ph中和、离心分离浓缩成120mg/ml的高浓度液态胶原蛋白而得以维持液态和无菌性地作为原料用于各种医疗用胶原蛋白产品。
下面结合附图详细说明实现该效果的本发明的优选实施例。
附图说明
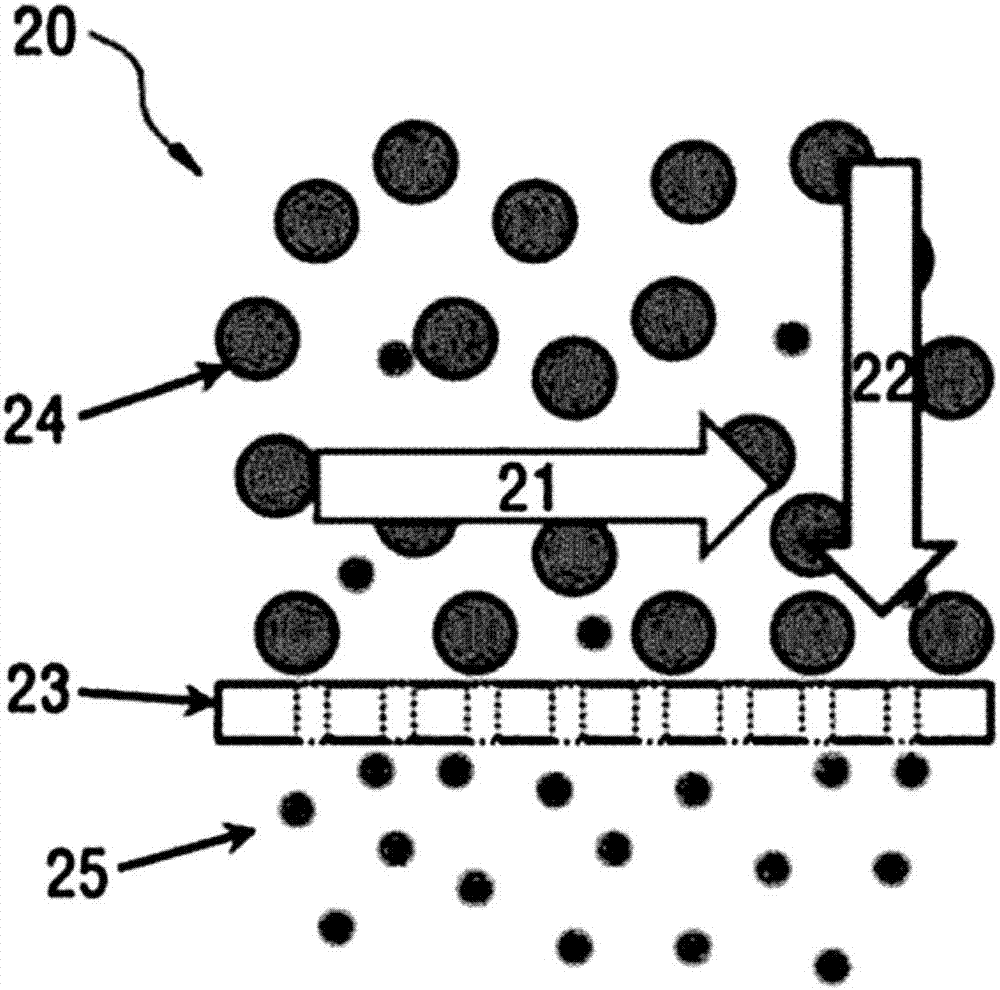
图1是说明本发明利用切向流过滤装置(tff)过滤胶原蛋白的方法的图形。
图2是说明本发明的切向流滤膜的图形。
图3是本发明的中和反应罐的结构图。
图4是混合器的结构图。
附图标记说明
10:切向流滤膜装置11:储存罐
12:泵13:切向流滤膜
14:阀门15:压力计
16:回收非透过物质17:废弃透过物质
18:纯化水
21:溶液流动方向22:压力方向
23:切向流滤膜24:非透过物质
25:透过物质31,a:垫圈(gasket)
32,b:缩紧装置33:ph滴定溶液投入口
34:ph电极c:旋转轴密封装置
d:ph电极
具体实施方式
本发明为了作为医疗用材料使用而把哺乳动物的组织作为原料确保生物学安全性地提取高纯度、高浓度的液态胶原蛋白。
首先,利用干净的水和酒精等物把哺乳动物的组织清洗干净后冷冻保管。此时,水以清除了微生物和粒子等的纯化水较为适合,酒精则为了消毒效果而使用70%乙醇较佳。
动物的组织在提取过程之前先进行下列前处理过程,亦即,利用粉碎机粉碎成细块后在70%乙醇沉积24小时。
把进行了前处理过程的动物的组织以纯化水漂洗后进行提取过程。
作为第一个提取过程的酶处理过程,在滴定成ph1.5~2.5的纯化水中放进组织与蛋白分解酶后搅拌并反应72小时以上。
此时,ph滴定时可以使用磷酸、盐酸等很多种酸性溶液,蛋白分解酶使用胃蛋白酶较佳,该胃蛋白酶不会让胶原蛋白的三螺旋结构损伤并且能清除对人体引起免疫反应的末端部分。
酶处理的ph低于1.5时,可能会对之后进行过滤工序时使用的过滤器的化学耐性不适合,超过ph2.5或者反应时间低于72小时的话,病毒灭活效果会降低。
通过在上述乙醇沉积72小时以上的前处理过程和在ph2.5以下进行酶处理72小时以上的过程把可能从动物组织混入的病毒予以灭活而得以确保生物学安全性。
作为第二个提取及纯化过程的盐处理过程中,在酶处理完毕的溶液添加氯化钠到成为0.5~0.9m浓度为止并且进行反应。各蛋白质具有在特定盐浓度下凝结的性质,该过程利用了胶原蛋白在上述盐浓度凝结后浮游的特性,其它没有凝结的杂质则予以废弃而得以提高胶原蛋白的纯度。
凝结的胶原蛋白则重新利用纯化水予以溶解以便能进行过滤工序。
作为第三个过程的纯化过程,首先利用2.0~0.5微米滤孔(poresize)的过滤器进行过滤,然后利用切向流过滤装置(tff:tangentialflowfiltration)清除溶液内胃蛋白酶、氯化钠之类的低分子物质。
此时,优选地,切向流过滤装置使用50kda~150kda的截留分子量(mwco)滤膜,这是为了,使用150kda以下的截留分子量滤膜而防止大约300kda的胶原蛋白的流失并且通过50kda以上的截留分子量(mwco)滤膜清除大约35kda的胃蛋白酶。
利用切向流过滤装置的过滤过程由储存罐(11)、泵(12)、滤膜(13)及压力计(15)和阀门(14)实现。利用泵把储存罐的溶液移送到滤膜,大于滤膜的滤孔的胶原蛋白无法透过并回收到储存罐,小于滤孔的杂质则透过滤孔清除。按照相当于通过滤膜滤孔清除的容量添加纯化水,反复该过程就能既确保储存罐内胶原蛋白溶液的流动性还提高纯度(图1、图2)。利用切向流过滤装置的纯化结果可以通过很多方法进行确认,其中,氯化钠的清除可以通过测量渗透压予以确认(请参阅实施例3)。
利用上述切向流过滤装置的过程除了纯化以外,还以浓缩目的使用。在杂质清除完毕的时刻不添加纯化水地反复进行过滤的话,就会通过滤孔清除水分而使得储存罐内胶原蛋白的含量增加。可以利用这一点把胶原蛋白的含量浓缩到10mg/ml,通过该工序得到的胶原蛋白可用于不要求高浓度的化妆品原料之类的领域。
但是鉴于浓度越高黏度就跟着越高的胶原蛋白特性,浓缩到10mg/ml以上时就会出现胶原蛋白积累到滤膜上的现象,胶原蛋白溶液的流动性大幅降低而导致获取率下降,需要较长的工序时间。为了制备医疗用胶原蛋白,需要浓缩成5mg/ml以下的浓度以获得可灭菌过滤的流动性和黏度。
利用切向流过滤装置的纯化及浓缩完毕的溶液则通过0.22微米滤孔的过滤器进行过滤后移送到中和反应罐。此时,灭菌过滤器和中和反应罐当然需要先进行灭菌,尤其是中和反应罐应该是能以适当的垫圈(31)、缩紧装置(32)等予以密封的结构,还需要配备ph滴定溶液投入口和用于测量ph的电极及溶液温度调节用衬套之类的设备(图3)。
通过灭菌过滤清除了微生物的胶原蛋白溶液则通过中和过程重新进行一次纯化及浓缩。中和过程添加氢氧化钠、盐酸之类的ph滴定溶液地把胶原蛋白溶液的ph调节成6.0~8.0并且把溶液温度调节成25~35℃而凝结胶原蛋白。
在上述中和过程脱离所提示的ph范围或溶液温度太低时无法充分地实现胶原蛋白的凝结,溶液温度太高时会发生热致变性而使得三螺旋结构被解开。
通过中和过程凝结胶原蛋白而得以在清除了未凝结的溶液后利用离心分离进行浓缩之前减少浓缩对象容量,能让水分与胶原蛋白轻易分离而得以利用较低的离心力在较短时间内实行浓缩,从而能够建立可利用相对较少的成本批量生产的设备。
把通过中和凝结的胶原蛋白放进可灭菌的离心分离容器后,利用离心分离机以4,000~6,000g的重力加速度浓缩5分钟。
施加低于上述离心力的离心力或缩短时间的话,会导致胶原蛋白的收获量减少或最终浓度降低的问题,施加更高的重力加速度和时间的话,则需要为此配备高性能高价离心分离机并且增加制备时间。
把经过了浓缩过程的胶原蛋白放进具备封闭结构的混合器(图4)后均匀地混合就能得到作为医疗用材料使用的高浓度胶原蛋白。此时,胶原蛋白的浓度可以根据拟适用的目的而添加清除了微生物及发热性物质的水进行调节,在上述条件下能够得到120mg/ml的高浓度胶原蛋白。
而且,在上述混合过程中把盐酸之类的酸性溶液作为ph滴定溶液添加而滴定成ph1.5~5.5后保管的话,就能以均质状态长时间保管。ph太低的话,之后为了制成医疗用产品而把ph滴定成中性时较为困难,ph高于5.5的话,胶原蛋白重新凝结而较难维持均匀浓度。
通过上述提取、纯化、浓缩及混合过程得到的胶原蛋白可以根据其使用用途而和水、等渗溶液、富含血小板血浆(prp)、透明质酸之类的混合溶剂混合及稀释后制成液态产品,把浓缩的胶原蛋白加以冻干后制成固形产品。
尤其是,液态产品可以在混合、充填及包装空间等最低程度的无尘室(cleanroom)设备内清除病毒、微生物等而确保了生物学安全性的状态并且维持该状态地制作产品。
实施例1
利用猪的皮肤组织制备及运用医疗用胶原蛋白
1)利用纯化水与酒精等把猪的皮肤组织清洗干净后,以-20℃以下予以冷冻保管。
2)细切猪的皮肤组织。
3)在70%乙醇沉积粉碎的皮肤组织24小时。
(病毒灭活工序第一阶段)
4)利用纯化水漂洗组织,倒入利用磷酸滴定成酸性(ph1.5~2.5)的纯化水后加入胃蛋白酶搅拌72小时以上地进行反应(病毒灭活工序第二阶段)。
此时,胃蛋白酶的量以皮肤组织重量的1/4~1/10较适合。
5)添加氯化钠到成为0.5~0.9m浓度浓度为止并加以搅拌地凝结胶原蛋白后,清除没有凝结的溶液。
6)利用滴定成ph1.5~4.0的水把凝结的胶原蛋白加以溶解后,利用2.0~0.5微米滤孔(poresize)的过滤器予以过滤。
7)为了让胶原蛋白适合作为医疗用使用而利用切向流过滤装置(tff:tangentialflowfiltration)清除溶液内胃蛋白酶之类的低分子物质与氯化钠。
此时,切向流过滤装置使用50kda~150kda的截留分子量(mwco)滤膜较佳,按照相当于通过滤膜滤孔流出的容量添加纯化水以便维持储存罐内胶原蛋白溶液的容量,从而确保流动性。
8)氯化钠、胃蛋白酶之类的低分子物质的清除完毕时,停止纯化水的供应并维持切向流过滤地进行浓缩。至于胶原蛋白的浓度,为了通过0.22微米滤孔的过滤器而把胶原蛋白的浓度调整到5mg/ml以下。
9)为了清除微生物而利用0.22微米滤孔的过滤器予以过滤。
10)把清除了微生物的溶液移送到灭菌后的中和罐。中和罐应该是能够灭菌并维持灭菌状态的密封结构,需要具备ph滴定溶液投入口和ph测量电极。
11)为了凝结胶原蛋白而利用盐酸(hcl)和氢氧化钠溶液(naoh)滴定到让ph近似于中性(ph6.0~8.0),把胶原蛋白溶液的温度调整到25~35℃,静置4小时~1日。
12)废弃没有凝结的溶液,把凝结的胶原蛋白层倒入离心分离容器后放进离心分离机后以4,000~6,000g的重力加速度进行离心分离地浓缩胶原蛋白。
13)在离心分离容器内清除水而和水分分离地浓缩的胶原蛋白则放进混合器后搅拌,就能得到大约120mg/ml浓度的胶原蛋白。
此时,和盐酸之类的酸性溶液混合而把ph调整到1.5~5.5的话,能以浓度均质状态进行保管。
14)凭借上述方法,胶原蛋白被制备成清除微生物、纯度高、维持了胶原蛋白性质的状态而适合作为医疗用使用,制备成120mg/ml的高浓度后可适用于各种产品。
作为一例,把上述胶原蛋白维持液态并且为了具备相同于人体内盐分的成分而混合了添加剂后,充填到载药注射器制成能够注入人体的形态的产品。
实施例2
病毒灭活验证
对于上述实施例1的制备过程中的病毒灭活过程,通过3次模拟实验验证了病毒灭活过程。
对于指示病毒,考虑基因型、脂质外皮的存在与否、抵抗程度后选择了pedv(porcineepidemicdiarrheavirus)、prv(porcinerotavirus)、ppv(porcineparvovirus)、pseudorabiesvirus。
把选定的4种病毒接种到粉碎的猪后,为了再现实际制备方法的前处理过程与酶处理过程,在70%乙醇反应24小时、在利用磷酸滴定成ph2.5的酸性溶液反应72小时。
对于再现了病毒灭活过程的样本,通过病毒定量分析比较了处理前与处理后。
在同一条件下进行3次模拟实验并且得到了相同的结果。一切病毒的检测值都在检测限度以下,各病毒灭活过程的logreductionfactor值被确认为超过了对病毒灭活有效的一般基准2logreductionfactor。而且各过程的pedv、prv、ppv、pseudorabiesvirus的logreductionfactor之和(maximumcumulativelogreductionfactor)分别为≥6.75、≥9.75、≥8.75、≥8.75,被评估为具备了强大的病毒灭活效果。
表1
实施例3
通过切向流过滤清除氯化钠
在上述实施例1进行酶处理、氯化钠处理并且利用2.0~0.5微米滤孔(poresize)的过滤器进行过滤后,利用100kda的截留分子量(mwco)滤膜进行了切向流过滤。
此时,按照相当于通过滤膜的滤孔清除的容量添加纯化水并且反复进行该过程就能确保储存罐内胶原蛋白溶液的流动性地清除氯化钠、胃蛋白酶之类的低分子物质,所添加的纯化水的总容量是初始胶原蛋白溶液容量的5倍。
反复进行上述切向流过滤过程3次后,把氯化钠选定为代表物质测量渗透压验证了低分子物质的清除结果。
其结果,清除比率分别为96.2%、96.1%、96.4%,平均清除比率为96.2%。凭此得知利用切向流过滤清除低分子物质是有效的,尤其是,氯化钠所呈现的31~33mosm渗透压低于血浆渗透压285mosm,因此得以在需要时和等渗溶液混合后作为医疗用材料使用。
表2
实施例4
各阶段的浓缩过程所致胶原蛋白浓度
按照上述实施例1的制备方法猪皮肤的量使用5kg、胃蛋白酶的量使用1kg,在切向流过滤阶段以相比于初始容量的1/2容量进行了浓缩时,分析了各阶段的胶原蛋白浓度。
从酶处理过程到利用2.0~0.5微米滤孔的过滤器进行的过滤过程为止的浓度按照各实例为1.6~2.4mg/ml,在切向流过滤过程清除低分子物质后浓缩成3.2~4.8mg/ml的浓度。
这是为了在切向流过滤后透过0.22微米滤孔的灭菌过滤过滤器,调节成2mg/ml以下的浓度时胶原蛋白溶液增加而使得中和反应罐的容量变大,在中和过程后利用离心分离进行浓缩时耗费较多时间,其结果导致成本提高。与此相反地,调节成5mg/ml以上的浓度时黏度上升而难以通过0.22微米滤孔的灭菌过滤器,使得灭菌过滤器过早堵塞而导致胶原蛋白流失并且需要使用大量过滤器。因此,把灭菌过滤之前的浓度调节到2~5mg/ml较佳。
确认了可以利用中和过程把没有凝结的水分初步清除而得以把胶原蛋白浓度从3.2~4.8mg/ml浓缩到5.6~6.7mg/ml。凭此,相比于中和过程之前的浓度大约浓缩1.4~1.8倍而得以在利用离心分离浓缩时减少初始容量,从而能够发挥出减少离心分离机容量和处理时间的产业用途上的优点。
把经过了最终中和过程后凝结的胶原蛋白溶液利用离心分离予以浓缩时,各实例能够得到114.6~122.3mg/ml的高浓度胶原蛋白,该结果不仅适合作为通常以30~60mg/ml浓度使用的液态医疗用胶原蛋白产品的原料使用,还能确保利用冻干制备固形制剂时减少冻干机的容量和运转时间的优点。
表3
*注)a:酶处理过程~过滤(2.0~0.5微米滤孔)过程
b:切向流过滤过程(清除低分子物质后浓缩过程)
c:中和处理过程(清除未凝结的溶液后)
d:利用离心分离的浓缩过程
本发明应理解为不限定于上述说明所涉及的特定形态,在权利要求书所定义的本发明的思想与范围内实现的一切变形物、等值物及替代物均应视为包含在本发明的范畴。
- 还没有人留言评论。精彩留言会获得点赞!