用于预防或治疗神经变性疾病的含有Ramalin的组合物的制作方法
本公开涉及治疗神经变性疾病的用途,其为ramalin的新用途且更具体地,本公开涉及预防或治疗神经变性疾病的组合物,其包含具有抑制炎性体和bace1的表达的活性的ramalin。
背景技术:
阿尔兹海默病(ad)为最常见的神经变性疾病,其引起痴呆且具有作为进行性神经变性疾病症状的神经元损失和认知障碍(donevetal.,jcellmolmed,13:4329-48,2009)。ad具有细胞外淀粉样-β(aβ)斑块和细胞内神经纤维缠结的神经病理学特征(querfurthetal.,nengljmed.362(4):329-44;laferlaetal.,biochemsoctrans.38(4):993-5)。淀粉样-β通过淀粉样-β前体蛋白(app)的连续分裂产生,后者经β-分泌酶1(bace1)和早老素/γ-分泌酶介导。淀粉样-β的产生和聚集在触发复杂的病理诱导中起重要作用,该诱导引起神经变性、神经纤维缠绕、炎症和神经元损失。
表现神经炎症的微神经胶质细胞的活化为在患有ad的患者脑中的另一病理特征(mcgeeretal.,neuroscilett,79:195-200,1987)。此外,微神经胶质细胞用作许多中枢神经系统(cns)疾病中的潜在致病源,包括慢性神经变性疾病诸如ad、帕金森病(pd)、人免疫缺陷病毒(hiv)痴呆和多发性硬化(blocketal.,natrevneurosci,8:57-69,2007)。活化的微神经胶质细胞和白细胞产生各种炎症介质,包括过敏毒素补体、细胞因子、趋化因子和前列腺素(gelderblometal.,stroke40(5):1849-57,2009;iadecolaetal.,natureneuroscience14(11):1363-1368,2011)。
针对外周组织中的炎性体复合物的研究涉及炎性细胞因子的产生、分泌以及凋亡性和焦亡性细胞死亡(lamkanfietal.,annurevcelldevbiol.28:137-61)。含有nacht、lrr和pyd域的蛋白1(nlrp1)以及含有nacht、lrr和pyd域的蛋白3(nlrp3)炎性体为细胞质聚合物复合物,其由以下构成:nlrp1/3受体、含有半胱天冬酶募集域(asc)的细胞凋亡相关斑点样蛋白、前半胱天冬酶-1、前半胱天冬酶-11(与人前半胱天冬酶-4或5具有同源性)和x连锁凋亡抑制剂(xiap)(boydenetal.,natgenet38(2):240-4,2006;martinonetal.,molcell10(2):417-26,2002)。前半胱天冬酶-1如下自动活化:待转化为裂解的半胱天冬酶-1并且形成nlrp1和nlrp3炎性体的nlrp1和nlrp3受体的活化和同寡聚化(lamkanfietal.,annurevcelldevbiol.28:137-61;martinonetal.,molcell10(2):417-26,2002)。aβ的长期累积促进ad中的微神经胶质细胞的活化(goldmannetal.,cellres.23:595-6)。il-1β水平的增加与aβ的累积相关(lucinetal.,neuron,64:110-22,2009)并且il-1β以针对半胱天冬酶-1的活化和分泌的无活性前体形式产生且半胱天冬酶-1的活性经炎性体调节。nlrp3炎性体检测炎症晶体和聚集的蛋白诸如aβ且与慢性炎性疾病相关(halleetal.,natimmunol9(8)857-65,2008;martinonetal.,annurevimmunol27:229-65,2009;henekaetal.,nature493(7434):674-8)。经活化nlrp炎性体诱导的炎症物质用于介导突触功能障碍、认知障碍、微神经胶质细胞的功能限制等。ad的进展可如下有效地阻碍:nlrp炎性体和炎性体衍生的在aβ介导的炎症反应中起重要作用的细胞因子的活化的抑制处理。
处于在人角质化细胞和成纤维细胞中几乎未显示出细胞毒性的浓度的ramalin具有抗氧化作用(paudeletal.,phytomedicine.18(14):1285-90)且已知作为抑制炎症反应的抗氧化剂。
本发明人在先前研究(韩国专利10-1025612)中由ramalinaterebrata即一种在南极洲乔治王岛野生的地衣分离出新化合物ramalin并且提供了ramalin的合成方法(韩国专利10-1182334)。此外,已经发现分离和合成的ramalin的预防或治疗炎症或免疫性疾病的效果(韩国专利10-1290745)以及分离和合成的ramalin的预防或治疗肝纤维化和肝硬化的效果(韩国专利10-1326256)。然而,尚不明确ramalin的预防或治疗神经变性疾病的效果。
因此,本发明人致力于开发用于治疗ad以及ad样疾病的有效策略且结果是证实了ramalin抑制bace1表达和炎症标志物诸如nlrp炎性体蛋白的表达,从而抑制淀粉样蛋白的产生且显著改善ad模型小鼠的认知功能并且完成了本发明。
技术实现要素:
本发明的目的提供了用于治疗或预防神经变性疾病的药物组合物,其包含作为活性成分的ramalin。
本发明的另一目的提供了用于预防或治疗神经变性疾病的食品组合物,其包含作为活性成分的ramalin。
发明详述
根据本发明的一方面,提供了用于治疗或预防神经变性疾病的药物组合物,其包含作为活性成分的由以下化学式i表示的ramalin。
[化学式i]
根据本发明的另一方面,提供了用于治疗或预防神经变性疾病的食品组合物,其包含作为活性成分的由所述化学式i表示的ramalin。
附图说明
图1a为ramalin的化学结构的示意图且图1b为用于测试在ramalin治疗后的行为功能的动物实验计划的示意图。
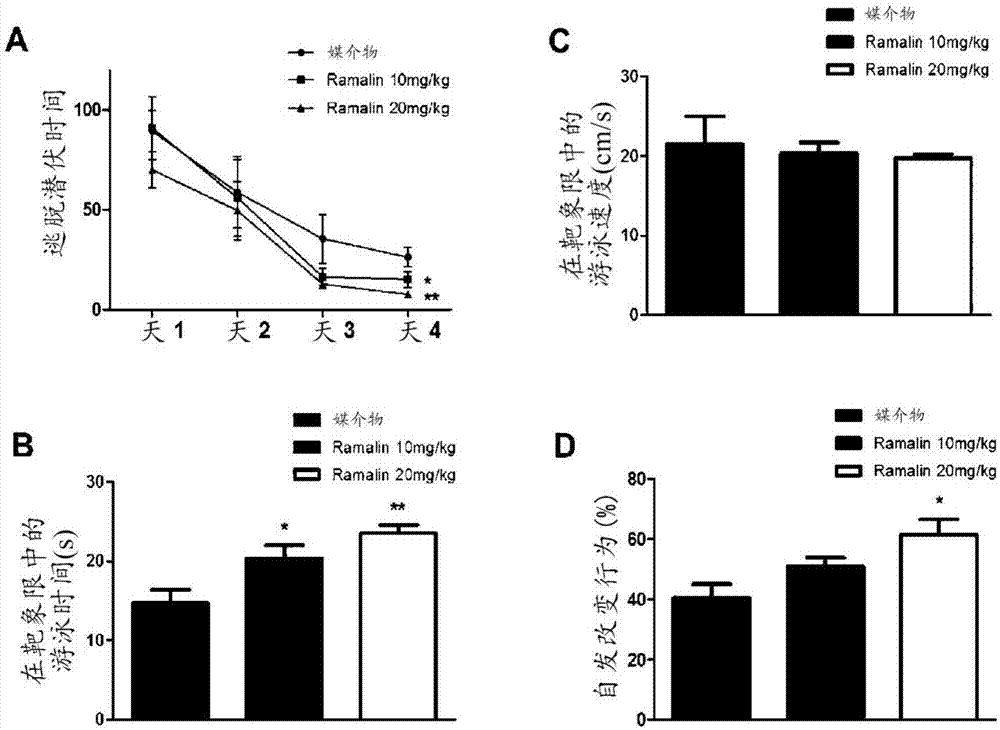
图2显示了给予ramalin的预防学习和记忆障碍的作用的结果,其通过靶向于app/ps1转化的小鼠,该小鼠为具有阿尔兹海默病的动物模型。图2a显示了给予ramalin达4周的实验组相比于对照组(媒介物)而言较快地发现在水面下的平台;图2b显示了在水迷宫测试开始后在第6天进行的探索测试的结果,ramalin具有改善痴呆动物模型的记忆保持能力的作用;图2c显示了通过测量实验动物组的游泳速度,实验组之间无差异;以及图2d显示了为了评价空间记忆能力,进行y迷宫测试且结果是在给予ramalin(20mg/kg)达4周的实验组中,自发改变行为得到了大幅增加。
图3显示了以下的结果:在app/ps1转化的小鼠中在给予ramalin后形成神经炎性斑块以及产生aβ得到显著减少,该小鼠为具有阿尔兹海默病的动物模型。图3a显示了由显微照相观察到在给予ramalin的动物中在皮质和海马中的aβ染色程度降低;图3b显示了通过图像分析量化证实了aβ老年斑块在皮质和海马中的数目也通过给予ramalin而减少;以及图3c显示了使用elisa测量水溶性aβ的结果证实了在给予ramalin的组中,aβ40和aβ42均减少。
图4显示了以下的结果:所证实的在给予ramalin后抑制app/ps1转化的小鼠(其为阿尔兹海默病动物模型)中bace1水平的结果是,ramalin具有降低脑中bace1的转录组和蛋白的水平的作用以及结果是,作为痴呆的致病因子的aβ的产生减少。图4a显示了通过使用针对bace1(其为动物皮质中的产生aβ的酶)的特异性抗体的免疫化学染色方法证实了在给予ramalin后,经给予ramalin减少了bace1的表达;图4b显示了通过使用针对bace1(其为动物海马中的产生aβ的酶)的特异性抗体的免疫化学染色方法证实了在给予ramalin后,经给予ramalin减少了bace1的表达;图4c显示了当通过免疫印迹方法测量蛋白的水平时证实了,在给予ramalin的动物的脑组织中bace1和c99(其为aβ前体以及bace1的底物)也得到减少;图4d显示了由免疫印迹方法测量的蛋白水平的统计值;以及图4e显示了经证实,bace1的转录组(mrna)在患有痴呆的动物脑组织中的表达通过给予ramalin而减少。
图5显示了证实以下的结果:在给予ramalin后抑制inos和cox-2在app/ps1转化的小鼠脑中的表达的作用,该小鼠为阿尔兹海默病动物模型。图5a显示了经证实,inos和cox-2在患有痴呆的动物脑组织中的蛋白水平通过给予ramalin而减少;以及图5b显示了由免疫印迹方法测量的蛋白水平的统计值。
图6显示了证实以下的结果:在给予ramalin后对在app/ps1转化的小鼠脑中的mapk信号传导途径蛋白的作用,该小鼠为阿尔兹海默病动物模型。图6a显示了磷酸化应激激酶p38、jnk和erk在患有痴呆的动物脑组织中的水平通过给予ramalin而降低;以及图6b显示了由免疫印迹方法测量的蛋白p38、jnk和erk的水平的统计值。
图7显示了证实以下的结果:在给予ramalin后对在app/ps1转化的小鼠脑中的炎性体蛋白的作用,该小鼠为阿尔兹海默病动物模型。图7a显示了炎性体组成蛋白nalp1、nalp3、半胱天冬酶-1、il-1β、tlr4和xiap在患有痴呆的动物脑组织中的水平通过给予ramalin而显著降低;以及图7b显示了由免疫印迹方法测量的蛋白nalp1、nalp3、半胱天冬酶-1、il-1β、tlr4和xiap的水平的统计值。
图8显示了证实以下的结果:对微神经胶质细胞中由lps诱导的炎症的作用。图8a显示了经证实,当炎症应答通过微神经胶质细胞用lps处理而诱导时,大幅提高的no通过ramalin的处理而被完全抑制;图8b显示了通过免疫印迹证实,微神经胶质细胞中经lps而提高的炎症信号传导的主要因子inos和cox-2的表达被ramalin完全抑制;图8c显示了由免疫印迹方法测量的inos水平的统计值;以及图8d显示了由免疫印迹方法测量的cox-2水平的统计值。
图9显示了证实以下的结果:ramalin对微神经胶质细胞中由lps诱导的nf-κb和mapk的活性的作用。图9a显示了经证实,微神经胶质细胞中由lps所诱导的nf-κb(磷酸化p65)通过ramalin的治疗而减少;图9b显示了微神经胶质细胞中由lps所诱导的nf-κb(磷酸化p65)的统计值;图9c显示了经证实,用lps处理的微神经胶质细胞中活化的应激激酶p38、jnk和erk通过ramalin的处理而被抑制;以及图9d显示了微神经胶质细胞中由lps所诱导的应激激酶的统计值。
图10显示了证实以下的结果:ramalin对微神经胶质细胞中由lps所诱导的炎性体、il-1β、tlr4和bace1的表达的作用。图10a显示了通过免疫印迹方法证实,微神经胶质细胞中由lps所提高的炎性体组成分子nalp1、nalp3和半胱天冬酶-1以及bace1(其为作为先天性免疫受体的tlr4和aβ的产生酶)的表达通过ramalin的处理而被抑制;以及图10b显示了由免疫印迹方法测量的炎性体组成分子和先天性免疫受体的水平的统计值。
具体实施方式
除非另有定义,否则本说明书中使用的所有技术和科学术语都具有与本领域的技术人员通常所理解的含义相同的含义。一般来说,本说明书中使用的命名法在本领域中是公知的并且是通常使用的。
在本发明中,鉴定了γ-谷氨酰基-n’-(2-羟基苯基)酰肼(ramalin)的新的学习和记忆缺损预防作用,而ramalin为由ramalinaterebrata即一种南极洲地衣分离的具有c11h16n3o4的分子式的化合物。
因此,本发明的一个方面涉及用于治疗或预防神经变性疾病的药物组合物,其包含作为活性成分的由以下化学式i表示的ramalin。
[化学式i]
在本发明中,神经变性疾病可选自阿尔兹海默病、帕金森病、卢格里克病、皮克病、克雅病、亨廷顿病和痴呆且优选阿尔兹海默病,但不限于此。
在本发明中,ramalin可抑制bace1的表达和nalp炎性体蛋白的表达。此外,ramalin可抑制inos、cox-2和mapk的炎症介质的信号传导途径蛋白的表达。
本发明的包含ramalin的组合物可根据一般方法进一步包含药用且适当的载体、赋形剂或稀释剂。可包含在包含所述化合物的组合物中的载体、赋形剂和稀释剂可为乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、木糖醇、赤藻糖醇、麦芽糖醇、淀粉、阿拉伯胶、藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟苯甲酯、羟苯丙酯、滑石、硬脂酸镁和矿物油。
本发明的包含ramalin的组合物可呈选自以下的任何一种制剂:粉剂、丸剂、颗粒、胶囊、混悬剂、溶液剂、乳剂、糖浆剂、无菌水溶液、非水溶液、混悬剂、冻干剂和栓剂。
在配制组合物时,制剂可如下制备:使用通常所使用的稀释剂或赋形剂诸如填充剂、膨胀剂、粘合剂、润湿剂、崩解剂和表面活性剂。用于口服给药的固体制剂包括片剂、丸剂、粉剂、颗粒、胶囊等且固体制剂可通过使所述化合物与至少一种赋形剂例如淀粉、碳酸钙、蔗糖或乳糖、明胶等混合来制备。此外,可使用除了简单赋形剂之外的润滑剂诸如硬脂酸镁和滑石。用于口服给药的液体制剂可包括混悬剂、溶液剂、乳剂、糖浆剂等且除了水和液体石蜡(其为通常使用的简单稀释剂)之外可包含各种赋形剂例如润湿剂、甜味剂、芳香剂、防腐剂等。用于肠胃外给药的制剂包括无菌水溶液、非水溶液、混悬剂、乳剂和冻干剂以及栓剂。对于非水溶液和混悬剂,可使用丙二醇、聚乙二醇、植物油诸如橄榄油、可注射酯诸如油酸乙酯等。对于栓剂,可使用混合脂肪酸甘油酯、聚乙二醇、吐温60、可可脂、月桂精黄油、甘油明胶等。
本发明化合物的优选剂量根据患者的状态和体重、疾病程度、药物形式以及给药途径和时期而变化,但可适当地由本领域技术人员选择。然而,对于优选的效果,本发明化合物可以0.001至100/kg/天、优选0.01至10/kg/天来给药。所述化合物可每天一次给药且每天多次口服给药。该剂量并不以任何方式限制本发明的范围。
本发明的另一方面涉及用于治疗或改善神经变性疾病的食品组合物,其包含作为活性成分的由以下化学式i表示的ramalin。
[化学式i]
本发明的食品组合物包括所有形式,包括功能性食品、营养补剂、保健食品和食品添加剂。保健功能性食品的类型可根据本领域已知的一般方法制备为各种形式。例如,对于保健食品,可制备并饮用呈茶、果汁和饮料形式的本发明的ramalin或可经制粒、包囊和粉末化来服用。此外,功能性食品可如下制备:将本发明的ramalin添加至饮料(包括酒精性饮料)、水果和它们的加工食品(例如水果罐头、瓶装食品、果酱、橘子酱等)、鱼类、肉类以及它们的加工食品(例如火腿、香肠、牛肉饼等)、面包和面条(例如乌冬面、荞麦面、拉面、意大利面、通心粉等)、果汁、各种饮料、饼干、太妃糖、乳制品(例如黄油、奶酪等)、食用植物油、人造黄油、植物蛋白、蒸煮食品、冷冻食品、各种调料(例如大豆酱、酱油、酱汁等)等。
此外,保健功能性食品包括作为食品组合物的各种形式诸如功能性食品、营养补剂、保健食品和食品添加剂且可根据本领域已知的一般方法以各种形式提供,例如通过以诸如茶、果汁和饮料形式制备上述ramalin或对所述ramalin制粒、包囊和粉末化或将该化合物或提取物添加至各种食品中,包括饮料、水果和它们的加工食品、鱼类、肉类和它们的加工食品、面包、面条、调料等。
实施例
以下将通过实施例更详细地描述本发明。然而,本发明不限于如下公开的示例性实施方案,而是可以各种形式来实施。描述以下示例性实施方案以使得本领域技术人员能够实现和实施本发明。
实施例1:分离/合成ramalin以及动物模型设计
在本发明的以下实施例中,通过使用甲醇由在2008年1月于乔治王岛的bartonpeninsula(s62°13.1,w58°47.0)采集的ramalinaterebrata进行分离的方法来分离(韩国专利10-1025612)和使用ramalin或合成和使用与天然的ramalin具有相同功效的稳定的ramalin(韩国专利10-1182334)(图1a)。
将c57bl/6j类的半缀合的转基因小鼠app/ps1(appswe/psen1de9)保持在12小时亮和12小时暗中,此时进行实验。将7月龄雌性app/ps1小鼠分为三组(对照、10mg/kgramalin和20mg/kgramalin),其中每个组中包括6只小鼠并且每日一次将ramalin口服给予至小鼠达38天。
在第31天至第35天进行morris水迷宫测试并且在第36天进行记忆保持测试以及在第38天进行y迷宫测试。在第40天,将小鼠处死,然后将脑组织保存在-70℃(图1b)。
实施例2:morris水迷宫测试
为了证实ramalin对app/ps1转基因小鼠的记忆改善作用,略微修改并进行已知且常规的morris方法。水浴具有环形,高度为35cm且直径为100cm并且加有无毒水溶性黑色染料且保持在20℃的水温。将水浴分为四部分且黑色平台(高度为10cm且直径为8cm)位于四部分之一的中间的表面以下约1cm。通过视频系统(ethovirionsystemnoldus,wageningen,netherlands)对开始在具有不同空间线索的水浴的平台中游泳的小鼠进行观察。当小鼠未找到平台达60秒时,每天两次给予水迷宫训练。每次试验在15分钟的中断时间后进行并且持续进行4天。对每只小鼠在每次试验所花费的时间进行测量以获得平均值。当小鼠找到平台时,小鼠停留10秒且当小鼠在120秒内未找到平台时,实验人员引导小鼠在平台上停留10秒。在第6天,将平台由水浴移去,然后进行60秒的探索测试。
在通过给予ramalin至app/ps1转基因小鼠达4周从而改善海马功能后,进行morris水迷宫测试并在测试过程中也给药ramalin达1周。结果是证实了在训练平台位置后,由于改善的记忆而缩短了到达平台的时间。在给予ramalin(10和20mg/kg)的组中,在第4天缩短了到达平台的时间(图2a)。此外,在最后一天移去平台后,当测量在靶象限内停留的时间时,所述时间随ramalin的浓度(10和20mg/kg)而增加(图2b)。在给予ramalin的组和对照组中,游泳速度无差异(图2c)。
实施例3:y迷宫测试
在y迷宫中,三个臂以y型延伸且每个臂以120°的角度定位,长度为40cm,高度为12cm且宽度为3cm。迷宫的底部和壁由不透明的深色聚乙烯塑料制成且记录了小鼠按顺序(即abcab等)首先位于一个臂上,然后通过该臂达8分钟。小鼠的移动由交叉次数表示且仅当小鼠连续地通过三个臂时,才将其定义为一次交叉(即abc、cab或bca,而不是bab)。通过完全除去气味来清洁迷宫的臂且最后给予ramalin(10和20mg/kg),然后测量1小时后ramalin对记忆损伤的抑制。交叉比如下定义:
%交叉=[(交叉次数)/(总体臂通过次数)]×100
结果是证实了在给予浓度为20mg/kg的ramalin的组中,记忆得到改善(图2d)。
实施例4:在app/ps1小鼠脑中的aβ产生和神经炎性斑块形成
为了研究ramalin对淀粉样蛋白在app/ps1小鼠脑中的累积的作用,分析了aβ40、aβ42和aβ斑块在给予ramalin的组以及对照组中的形成。通过对脑进行免疫染色证实了通过ramalin处理的aβ斑块累积。
将小鼠脑组织用4%多聚甲醛固定,用30%蔗糖在4℃冷冻48小时并切为45μm的厚度。通过使用抗aβ抗体(400:1,4g8,covance)的dab染色证实了斑块形成。结果是在给予ramalin的组的脑皮质和海马中,斑块形成显著减少(图3b)。
此外,通过固相夹心elisa系统(ibl,27713和27711)量化aβ。脑组织用含有1×蛋白酶混合物(calbiochem)的pbs匀化,在4℃和13,000rpm离心10分钟,每孔添加100μg标准aβ和样品并与aβ抗体在4℃进行o/n反应,然后与抗小鼠igg-hrp在室温反应1小时,洗涤,每孔添加100μl经稳定化的色原体,在室温避光反应30分钟,然后添加终止溶液并在450nm分析。结果是证实了在app/ps1小鼠脑组织中,aβ40、aβ42等由于ramalin处理而显著减少(图3c)。
实施例5:bace1表达在ramalin处理的app/ps1小鼠脑中的减少
为了研究ramalin对bace1在app/ps1小鼠脑中的表达的作用,通过免疫荧光染色和免疫印迹对给予ramalin的组和对照组中的bace1水平进行分析。此外,通过实时聚合酶链反应对bace1mrna水平进行分析。
免疫荧光染色方法与在实施例4中的方法相同并使用bace1抗体(400:1,r&d系统)进行分析。
为了进行免疫印迹,在app/ps1小鼠脑组织中,通过使用t-per(穿孔)提取缓冲液和完全迷你蛋白酶抑制剂片剂(roche)来提取蛋白。将提取的蛋白在8-17%sds-page上进行电泳,转移至0.45μmpvdf,然后使用bace1抗体(细胞信号传导)确认。
实时聚合酶链反应通过用ribospinrna纯化系统(geanall)提取总rna来进行且rt通过使用iscript系统cdna合成试剂盒(bio-rad)用1μgrna来进行。实时聚合酶链反应通过使用cfx96tm系统(bio-rad)和pcr扩增所用的sybrpremixextaqtmii(takarabioinc.)来进行且相对定量通过2-δδct方法进行。针对各个基因的引物如下。
bace1:正向5’-atgtggagatgaccgtaggc-3’(seqidno:1)
反向5’-tacacaccctttcggaggtc-3’(seqidno:2)
gapdh:正向5’-gacatcaagaaggtggtgaa-3’(seqidno:3)
反向5’-tgtcataccaggaaataggc-3’(seqidno:4)
bace1表达水平由针对gapdh表达水平的%表示。
结果是通过免疫荧光染色证实了在给予ramalin的组的脑皮质和海马中bace1免疫反应减少(图4a)。接下来,在ramalin处理的app/ps1小鼠脑中,测量bace1、c99和c83的蛋白表达。结果是证实了在用ramalin处理1个月的条件下bace1表达显著减少(图4d)。此外,通过实时聚合酶链反应分析证实了经ramalin处理bace1的mrna水平降低(图4e)。
实施例6:ramalin对app/ps1小鼠脑中的inos、cox-2、mapk和炎性体的治疗作用
ramalin是公知的抑制氧化氮的产生且增加神经保护的抗炎化合物。因此,通过氧化氮的产生在app/ps1小鼠ad模型中证实了ramalin的抗炎作用以及ramalin对神经炎症的作用。
结果是证实了通过ramalin的处理在app/ps1小鼠脑中inos和cox-2的表达被显著抑制(图5)。
此外,分析了通过ramalin的处理对促分裂原活化蛋白激酶(mapk)和nalp炎性体蛋白的表达的作用。经免疫印迹确认了p38、jnk、erk、nalp3、nalp1、半胱天冬酶1和xiap的蛋白表达。
结果是通过ramalin的处理p-p38、p-jnk、p-erk、nalp1、nalp3、前半胱天冬酶1、裂解的半胱天冬酶1和tlr4的表达减少,但t-p38、t-jnk、t-erk、pre-il-1β和xiap不具有大的差异(图6和7)。
实施例7:ramalin对由lps诱导的no、inos和cox-2的作用
在co2孵育器中在37℃将ht-22海马细胞和bv-2微神经胶质细胞用含10%fbs和1%pen/strep(gibco,usa)的dmem(hyclone,usa)孵育。将ramalin以0.1%(v/v)的浓度溶于蒸馏水中并使用且将所有实验中的细胞与每种浓度的ramalin孵育于具有或不具有lps(1μg/ml)的不含血清的dmem培养基中。
no测量通过在培养基中的griess反应进行且将bv-2微神经胶质细胞(在24孔板中2.5×105个细胞/孔)用ramalin预处理,然后用lps(1μg/ml)处理24小时,然后分析培养溶液。使每个样品的50μl培养溶液与等同水平的griess试剂[0.1%n-(1-萘基)-乙二胺二盐酸盐和含有1%磺胺的5%磷酸]混合并在96孔板中避光反应10分钟。经硝酸钠在培养溶液中的标准溶液对硝酸盐浓度进行分析并在540nm测量。
结果是在bv-2微神经胶质细胞中,经1μg/mllps处理的no产生为18.52μm并且经1μg/mlramalin处理的no产生降至15.17μm且经10μg/mlramalin处理的no产生降至5.64μm。此外,经100μg/mlramalin处理的no产生被显著抑制为0.53μm(图8a)。
在1μg/mllps处理后,相比于对照组,经免疫印迹分析的inos和cox-2蛋白水平增加约48%,但46.67%和55.33%的增加被10μg/mlramalin处理再次抑制。此外,inos和cox-2蛋白水平的126.3%和232%的显著增加被100μg/mlramalin处理抑制(图8c和8d)。
实施例8:ramalin对由lps和炎性体蛋白诱导的p38、jnk、erk和nf-κb的磷酸化的作用
如在图8所示,在bv-2微神经胶质细胞中,相比于对照组,p38、jnk、erkmapk和nf-κbp65以503.7%、99%、58%和89%的比率被1μg/mllps处理快速磷酸化。然而,nf-κb的磷酸化经10和100μg/ml的ramalin处理降至41.67%和131%且p38、jnk和erkmapk的磷酸化降低516.5%、116%和42%。此外,在lps处理的微神经胶质细胞中,增加的nf-κb(磷酸化的p65)经ramalin降低且在lps处理的微神经胶质细胞中,活化的应激激酶p38、jnk和erk经ramalin处理被抑制(图9)。
此外,在bv-2微神经胶质细胞中,证实炎性体组成分子nalp1、nalp3和半胱天冬酶-1以及bace1(其为作为先天性免疫受体的tlr4和aβ的产生酶)的由lps增加的表达经ramalin处理被显著抑制(图10)。
工业应用性
本发明的ramalin具有通过抑制含有nlrp炎性体蛋白和bace1的炎症因子的表达而改善认知能力的作用且因此用于预防或治疗记忆障碍和神经变性疾病。
尽管本发明的特定部分已经详细描述,但是对于本领域技术人员显而易见的是所述特定描述仅为优选的实施方案且不限制本发明的范围。因此,本发明的实质范围将由随附的权利要求及其等价形式来限定。
序列表txt文本
附上电子文本。
序列表
<110>韩国海洋研究院
<120>用于预防或治疗神经变性疾病的含有ramalin的组合物
<130>pf-b1870-cn
<140>pct/kr2014/010057
<141>2014-10-24
<160>4
<170>patentin版本3.2
<210>1
<211>20
<212>dna
<213>人工
<220>
<223>bace1-f
<400>1
atgtggagatgaccgtaggc20
<210>2
<211>20
<212>dna
<213>人工
<220>
<223>bace1-r
<400>2
tacacaccctttcggaggtc20
<210>3
<211>20
<212>dna
<213>人工
<220>
<223>gapdh-f
<400>3
gacatcaagaaggtggtgaa20
<210>4
<211>20
<212>dna
<213>人工
<220>
<223>gapdh-r
<400>4
tgtcataccaggaaataggc20
- 还没有人留言评论。精彩留言会获得点赞!