一种pH敏感型Fe3O4@LDH负载甲氨蝶呤的纳米药物颗粒、制备方法及其应用与流程
本发明涉及一种pH敏感型Fe3O4@LDH负载甲氨蝶呤的纳米药物颗粒、制备方法及其应用,属于纳米医药技术领域。
背景技术:
甲氨蝶呤(MTX)是众所周知的抗肿瘤药物之一,可治疗头颈部癌,乳腺癌,皮肤癌,肺癌等恶性肿瘤。遗憾的是,相比于流入率,MTX的血浆半衰期非常短且流出率高,治疗时需要使用高剂量的MTX。此外,施加到生物体上的药物剂量并没有完全达到肿瘤部位,而是遍布全身,对正常组织产生毒副作用,使其在临床应用上受到限制。将抗肿瘤药物通过纳米载体递送至病灶部位,根据外界环境的某种刺激敏感信号的性质、强弱等调整药物释放可达到局部病变局部治疗的目的,同时也将有效降低药物使用剂量、照射剂量和减轻药物的毒副作用,提高治疗增益比,减轻病人的痛苦和经济负担。
现有的MTX递送载体有多种,包括纳米颗粒,微球,脂质体,聚合物胶束和其他多颗粒系统。其中,纳米颗粒,特别是,磁性氧化铁(Fe3O4)纳米颗粒是一种很有前途的靶向特异性药物递送载体,基于磁靶向作用、肿瘤细胞组织的高通透性和滞留效应以及肿瘤细胞特殊的酸性微环境(内涵体:pH为5.0-5.5,溶酶体:pH为4.0-4.5),将负载的抗肿瘤药物释放。
近年来层状双金属氢氧化物纳米粒子由于其高的生物相容性,低细胞毒性等优点已被证实是有效的靶向特异性抗癌药物递送载体。具体地,据报道(Ufana Riaz and S.M. Ashraf.Double Layered Hydroxides as Potential Anti-Cancer Drug Delivery Agents. Mini-Reviews in Medicinal Chemistry,2013,13,522-529.),Mg-Al层状双金属氢氧化物 (Mg-Al LDH,以下简称LDH)由于其弱碱性和在酸性环境中缓慢降解能力从而比其它水滑石更有效,所产生的离子如镁离子,铝离子,或硝酸根离子可以通过离子通道离开细胞。因此,LDH能有效维持化学稳定性和生物降解性间的平衡,这恰恰满足了pH 敏感型药物释放的要求。遗憾的是,LDH虽然能够作为pH响应性药物载体,然而其实际靶向性能却很差,不能有效作用到病灶部位,缺乏识别病灶部位的能力。
技术实现要素:
针对现有技术中存在的不足,本发明的目的在于提供一种pH敏感型Fe3O4@LDH 负载甲氨蝶呤的纳米药物颗粒,纳米药物颗粒包括甲氨蝶呤和Fe3O4@LDH载体,其中 LDH包覆在Fe3O4纳米粒子表面,LDH的包覆量为5.3%~36.6%,甲氨蝶呤负载于LDH 的板层结构中,甲氨蝶呤的负载量为4%~15%。
本发明中所述的LDH除另有说明外,均指Mg-Al LDH。
所述的LDH的包覆量为Fe3O4@LDH载体中LDH与Fe3O4的质量比。
所述的甲氨蝶呤的负载量为纳米药物颗粒中甲氨蝶呤与Fe3O4@LDH载体的质量比。
本发明的另一目的在于提供一种pH敏感型Fe3O4@LDH负载甲氨蝶呤的纳米药物颗粒的制备方法,本发明通过调节铁源与LDH的比例,反应温度等因素,实现对目标产物结构的调控,改善材料生物相亲性及载药性能。
实现本发明目的的技术方案是:一种pH敏感型Fe3O4@LDH负载甲氨蝶呤的纳米药物颗粒的制备方法,首先采用自组装方式构建Fe3O4@LDH载体,再利用主体-客体交换技术将抗肿瘤药物甲氨蝶呤负载到载体上,具体步骤如下:
步骤1,将FeCl3·6H2O和醋酸钠溶于乙二醇中,超声搅拌分散均匀,然后加入LDH,超声搅拌使体系分散均匀;
步骤2,将步骤1得到的均一体系于190~200℃下反应8~10h;
步骤3,将步骤2得到的产物提纯洗涤、干燥后得到Fe3O4@LDH载体;
步骤4,将甲氨蝶呤与Fe3O4@LDH载体在水中超声分散均匀后,于55~65℃下避光反应完全;
步骤5,将步骤4得到的产物提纯洗涤、冷冻干燥后得到Fe3O4@LDH负载甲氨蝶呤的纳米药物颗粒。
步骤1中,所述的FeCl3·6H2O与LDH的质量比为1:2~6。
步骤1和步骤4中,所述的超声时间为5~20min。
步骤3中,所述的干燥为真空干燥,干燥温度为25~35℃。
步骤3和步骤5中,所述的提纯方法为磁倾析法。
步骤4中,甲氨蝶呤与Fe3O4@LDH载体的质量比为1~3:20。
本发明的再一目的为提供一种pH敏感型Fe3O4@LDH负载甲氨蝶呤的纳米药物颗粒在抗肿瘤药物递送中的应用。
与现有技术相比,本发明的优点是:
1、本发明的制备方法克服了现有技术操作复杂的缺点,将LDH直接加入到Fe3O4纳米粒子的制备体系中,在Fe3O4纳米粒子形成的同时LDH经过自组装的形式包覆至 Fe3O4纳米粒子的表面,生成Fe3O4@LDH载体,载体具有磁靶向作用的同时也具有很好的水溶性,并且LDH的包覆量可控。
2、本发明中的LDH特有的板层结构使得抗癌药物MTX能够通过主体-客体交换技术有效插入板层间,且充裕的板层空间能够有效提高载药量,负载率高达81.6%~99.2%。
3、Fe3O4@LDH-MTX纳米药物颗粒由于磁响应性Fe3O4纳米粒子的存在,可在外界磁场的引导下在病灶区域充分集结,并在肿瘤酸性环境刺激响应下促使LDH分解或产生离子交换作用而释放出MTX,使MTX持续在肿瘤组织累积,最大限度的降低毒副作用,提高疗效和生物利用度。
附图说明
图1为实施例1制备得到的Fe3O4@LDH载体的透射电镜图。
图2为实施例6中制备得到的Fe3O4@LDH-MTX在不同pH环境下的药物释放对比图。
图3为实施例7中Fe3O4@LDH、MTX及Fe3O4@LDH-MTX对人体乳腺癌细胞 MCF-7的细胞毒性评价结果图。
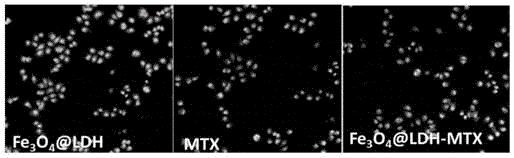
图4为实施例7中Fe3O4@LDH、MTX及Fe3O4@LDH-MTX对人体乳腺癌细胞 MCF-7的细胞毒性评价实际细胞活性图。
具体实施方式
下面结合实施例和附图对本发明作进一步详述。
实施例1:Fe3O4@LDH-MTX的制备
依次称取0.5g FeCl3·6H2O、3.0g醋酸钠,溶于40mL乙二醇中,超声搅拌20min 使体系分散均匀,然后向混合液中加入2.0g LDH,继续超声搅拌10min,之后将均一的混合液体转入聚四氟乙烯反应釜中,200℃反应10h。反应结束后倒出产物,磁倾析提取产物,用去离子水多次洗涤。将洗涤后的产物放入25℃的真空烘箱中烘干,得到干燥的粉末状Fe3O4@LDH载体。
依次称取50mg干燥的Fe3O4@LDH,2.5mg MTX,溶于20mL去离子水中,超声 5min使体系分散均匀。然后转入单口烧瓶中,55℃下避光反应3天。
反应结束后倒出产物,磁倾析提取产物,用去离子水多次洗涤。最后,经冷冻干燥后得到的粉末状Fe3O4@LDH负载甲氨蝶呤的纳米药物颗粒。
图1为制备得到的Fe3O4@LDH载体透射电镜图,通过图片可以看出Fe3O4纳米粒子表面均匀包覆一层LDH,且Fe3O4@LDH颗粒大小均一,分散性佳。
通过紫外分光光度法测得制备的Fe3O4@LDH-MTX的载药率为81.6%。载药率=(成功负载到载体上的MTX的量/总的MTX的量)×100%。
实施例2:Fe3O4@LDH-MTX的制备
依次称取0.5g FeCl3·6H2O、3.0g醋酸钠,溶于40mL乙二醇中,超声搅拌20min 使体系分散均匀,然后向混合液中加入2.0g LDH,继续超声搅拌10min。之后将均一的混合液体转入聚四氟乙烯反应釜中,200℃反应8h。反应结束后倒出产物,磁倾析提取产物,用去离子水多次洗涤。然后,将产物放入25℃的真空烘箱中烘干,得到干燥的粉末状Fe3O4@LDH载体。
依次称取50mg干燥的Fe3O4@LDH,3mg MTX,溶于20mL去离子水中,超声5min 使体系分散均匀。然后转入单口烧瓶中,55℃下避光反应3天。
反应结束后倒出产物,磁倾析提取产物,用去离子水多次洗涤。最后,经冷冻干燥后得到的粉末状Fe3O4@LDH负载甲氨蝶呤的纳米药物颗粒。
实施例3:Fe3O4@LDH-MTX的制备
依次称取0.5g FeCl3·6H2O、3.0g醋酸钠,溶于40mL乙二醇中,超声搅拌20min 使体系分散均匀。然后向混合液中加入2.0g LDH,继续超声搅拌10min。之后将均一的混合液体转入聚四氟乙烯反应釜中,190℃反应10h。反应结束后倒出产物,磁倾析提取产物,用去离子水多次洗涤。然后,将产品放入30℃的真空烘箱中烘干,得到干燥的粉末状Fe3O4@LDH载体。
依次称取50mg干燥的Fe3O4@LDH、5mg MTX,溶于20mL去离子水中,超声5min 使体系分散均匀。之后转入单口烧瓶中,65℃下避光反应3天。
反应结束后倒出产物,磁倾析提取产物,用去离子水多次洗涤。最后,经冷冻干燥后得到的粉末状Fe3O4@LDH负载甲氨蝶呤的纳米药物颗粒。
实施例4:Fe3O4@LDH-MTX的制备
依次称取0.5g FeCl3·6H2O,3.0g醋酸钠,量取40mL乙二醇,置于50mL烧杯中,超声搅拌20min使体系分散均匀。向上述混合液中加入称取好的1.0g LDH,继续超声搅拌10min。最后将均一的混合液体转入100mL聚四氟乙烯反应釜中,200℃反应10h。
反应结束后倒出产物,磁倾析提取产物,用去离子水多次洗涤。最后,将产品放入 30℃的真空烘箱中烘干,得到干燥的粉末状Fe3O4@LDH载体。
依次称取50mg干燥的Fe3O4@LDH、5.5mg MTX,溶于20mL去离子水中,超声 5min使体系分散均匀。之后转入单口烧瓶中,65℃下避光反应3天。
反应结束后倒出产物,磁倾析提取产物,用去离子水多次洗涤。最后,经冷冻干燥后得到的粉末状Fe3O4@LDH负载甲氨蝶呤的纳米药物颗粒。
通过紫外分光光度法测得制备的Fe3O4@LDH-MTX的载药率为99.2%。
实施例5:Fe3O4@LDH-MTX的制备
依次称取0.5g FeCl3·6H2O、3.0g醋酸钠,溶于40mL乙二醇中,超声搅拌20min 使体系分散均匀。然后向混合液中加入3.0g LDH,继续超声搅拌10min。之后将均一的混合液体转入聚四氟乙烯反应釜中,200℃反应10h。反应结束后倒出产物,磁倾析提取产物,用去离子水多次洗涤。然后,将产品放入35℃的真空烘箱中烘干,得到干燥的粉末状Fe3O4@LDH载体。
依次称取50mg干燥的Fe3O4@LDH、7.5mg MTX,溶于20mL去离子水中,超声 5min使体系分散均匀。然后转入单口烧瓶中,60℃下避光反应3天。
反应结束后倒出产物,磁倾析提取产物,用去离子水多次洗涤。之后,经冷冻干燥后得到的粉末状Fe3O4@LDH负载甲氨蝶呤的纳米药物颗粒。
通过紫外分光光度法测得制备的Fe3O4@LDH-MTX的载药率为91.78%。
实施例6:Fe3O4@LDH-MTX的释药性能
将实施例5制得的Fe3O4@LDH-MTX分别置于pH为3.5,5.0,7.4的磷酸盐缓冲液中,于37℃中恒温振荡,每隔一定时间取出3ml缓冲液,并同时补给等量的新鲜缓冲液。
Fe3O4@LDH-MTX在不同pH下的释药量经过紫外分光光度法测定,结果如图2所示,Fe3O4@LDH-MTX有着明显的药物缓释效果,并且在酸性条件下释药速率加快且释放量高,当pH=3.5时,48h内MTX的释放量达84.79%,表明Fe3O4@LDH-MTX对酸性的肿瘤组织有一定的靶向释药功能。
实施例7:Fe3O4@LDH-MTX的细胞毒性评价
采用WST-1法,将生长状态良好的人体乳腺癌细胞(MCF-7)接种于96孔板中, 37℃、5%CO2的恒温培养箱中培养24h后加入实施例5制备得到的、浓度为 20~120μg/mL的Fe3O4@LDH、MTX及Fe3O4@LDH-MTX样品,继续培养24h后每孔加入20μL WST-1溶液,恒温培养箱中放置4h,用酶标仪测定96孔板中各孔细胞液的吸光度(OD),细胞成活率按照以下公式算得:
细胞成活率=(OD样品/OD对照)×100%
OD样品:为加入各浓度样品的细胞液的吸光度
OD对照:为空白培养液的吸光度
每个样品设置3个平行样,细胞存活率如图3所示,Fe3O4@LDH载体对肿瘤细胞几乎没有毒副作用,且Fe3O4@LDH-MTX相比于MTX在对肿瘤细胞的抑制效果上有明显的增强。药物浓度为120μg/mL,温育时间为24h时,MCF-7的相对细胞存活率为 43.05%。图4为对应的细胞荧光图,绿色为活细胞,红色为死细胞。
- 还没有人留言评论。精彩留言会获得点赞!