使用针对CD28的域抗体治疗系统性红斑狼疮的方法与流程
本申请要求于2014年9月30日提交的美国临时申请序列号62/057,981的优先权,其全部内容通过引用并入本文。
技术领域:
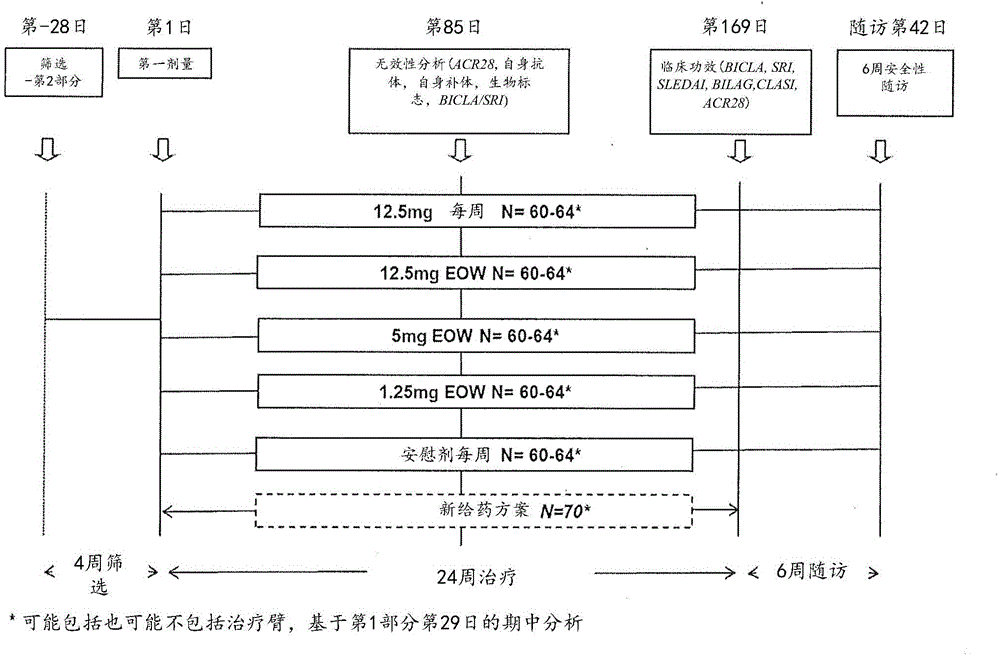
提供了使用特异性结合人CD28的域抗体治疗自身免疫疾病、例如系统性红斑狼疮的方法。序列表参考序列表以电子方式提交,并通过引用并入本文。背景系统性红斑狼疮(SLE)是一种慢性进行性自身免疫疾病,特征是多效性(pleiotropic)的器官/组织累及和临床表现。疾病的进展不时被复燃(flare)所打断,复燃根据其定义要求修改疗法。不受控制的SLE会导致终末器官损害,并增加发病率和死亡率。临床表现是多样化的,并且通常在单个患者中累及许多器官和组织。最常见的目标组织是皮肤(典型的脸颊斑或称蝴蝶斑)、关节和肾脏,但实际上任何器官和组织均可成为目标。自身抗体,例如抗双链脱氧核糖核酸(抗dsDNA)或抗核抗体(ANA),帮助了人们定义SLE的自身免疫性质。然而,这些自身抗体不是特异病征性的。SLE由于多效临床表现和特异性自身抗体的缺乏,是最典型的非器官特异性自身免疫疾病。美国风湿病学会(ACR)已经开发了一组11个因素的SLE诊断指南。这种诊断和监测疾病进展的固有复杂性妨碍了新治疗的验证。导致SLE的整个致病级联是复杂的,尚未完全定义,尽管其在临床上有多方面的表现。不过,现在已经普遍认可T细胞在SLE中具有关键作用。SLE以高反应性T细胞、自身抗体的过度产生、以及和抗原呈递细胞(APC)的超活化为特征。SLE患者中的自身抗体(特别是抗核抗体和抗dsDNA抗体)依赖于由共刺激分子和细胞因子所提供的T细胞辅助。除了提供B细胞辅助之外,T细胞可以直接浸润关节、皮肤、肾脏和大脑,通过细胞毒作用间接引起或通过巨噬细胞和嗜中性粒细胞的募集和活化间接引起损伤。来自SLE患者的淋巴细胞显示活化增加的迹象;例如,表达CD25的CD4+T细胞的百分比增加,CD19+B细胞上CD86的表达亦增加。增加的CD86表达被认为使(自身反应性)B细胞更易受T细胞辅助的影响,从而易化自身抗体产生。与此观察结果一致的是,活化的B细胞的数量和抗dsDNA抗体的水平随着疾病活动度(diseasedactivity)增加。此外,源自SLE患者的外周血单核细胞的外周血树突状细胞(DC)和DC显示出CD86的表达增加,并且SLE患者中CD86/CD80的比例高于健康供体。与CD86不同,在狼疮患者中CD4+和CD8+T细胞上的CD28表达似乎变化更大。无论CD28表达的水平如何,来自SLE患者的T细胞对抗CD28介导的活化似乎更易响应,并且与正常对照相比,具有活动性疾病的患者具有增加的CD28的基因表达。CTLA4(共抑制分子)在来自SLE患者的T细胞中也增加,但这似乎不支配异常T细胞活化。总之,这些数据表明CD28-CD86/CD80途径在SLE患者中观察到的缺陷性免疫应答中发挥中心作用。目前,SLE患者根据疾病的严重程度用抗疟药、CS例如口服泼尼松、和免疫抑制药物如MTX、AZA、霉酚酸酯和环磷酰胺治疗。尽管皮质类固醇和免疫抑制药物通常可有效地暂时控制复燃和疾病进展,但它们的降低的效力和严重的不良作用显著限制了它们的长期使用。这导致许多药物被超标签用于治疗狼疮患者。在过去五十年中,仅有一种用于SLE的新药(Belimumab)得到的批准,这突显了令人满意的治疗选项的缺乏。尽管Belimumab得到了批准,但SLE患者仍然具有非常大的医疗需求尚未得到满足,需要新的疗法以令人满意地治疗SLE。抑制CD28介导的T细胞活化可以抑制在自身免疫、移植排斥或变应性反应过程中发生的不希望的T细胞应答。例如,抑制CD28介导的T细胞活化可以延迟移植排斥,预防急性同种异体移植物排斥,诱导供体特异性耐受,并且阻止慢性同种异体移植物排斥的发生和中断其进展,以及预防移植物抗宿主病(GVH),即当移植的T细胞对宿主组织同种异体抗原产生激烈的免疫反应时(Salamaetal.(2001)J.Clin.Invest.108:943-48)。抑制CD28介导的T细胞活化不仅会通过消除通过CD28的活化信号传导而抑制免疫应答,也应该不会影响CD86和CD80与CTLA4的相互作用,从而保持CTLA4介导的T细胞应答的抑制。因此,抑制CD28介导的T细胞活化可用于预防自身免疫的诱导和减轻疮以及其它自身免疫性疾病的进展和/或严重度(Salomanetal.(2001)Ann.Rev.Immunol.19:225-252)。因此,本发明的目的是提供用于治疗患有SLE而不刺激CD28信号通路的受试者的改进方法。概要在某些实施方案中,本发明提供在患者中治疗免疫疾病的方法,包括对所述患者施用治疗有效量的包含可变域的抗CD28域抗体,其中所述可变域包含SEQIDNO:12的氨基酸序列(1h-239-891(D70C))或与SEQIDNO:12相差最多5个氨基酸,其中至少一个剂量的所述抗CD28域抗体以约1.25mg至约12.5mg的剂量施用。在具体实施方案中,免疫疾病是系统性红斑狼疮(SLE)。优选地,患者是人类患者。在某些方面,所述抗CD28域抗体以选自约1.25mg,约5mg,约12.5mg的剂量施用。例如,剂量为至少1.25mg或至少5mg。任选地,剂量为约1.25mg,约5mg或约12.5mg。任选地,剂量按每周或每两周施用。任选地,施用至少2个剂量,其中所述至少2个剂量相同或不同。例如,施用至少12个剂量。例如,施用至少24个剂量。在某些方面,所述抗CD28域抗体的可变域包含:(1)具有SEQIDNO:1的氨基酸序列的CDR1区;(2)具有SEQIDNO:2的氨基酸序列的CDR2区;和(3)具有SEQIDNO:3的氨基酸序列的CDR3区。举例说明,所述抗CD28域抗体包含SEQIDNO:12的氨基酸序列。任选地,所述抗CD28域抗体包含具有SEQIDNO:3的氨基酸序列的40kDa支化聚乙二醇。在某些具体实施方案中,所述抗CD28域抗体是BMS-931699。在某些方面,所述抗CD28域抗体是皮下施用的。例如,所述抗CD28域抗体配制在用于皮下施用的药物组合物中。此外,抗CD28域抗体是静脉内施用的。例如,所述抗CD28域抗体配制在用于静脉内施用的药物组合物中。在某些方面,本发明的方法还包括对患者施用免疫抑制剂/免疫调节剂和/或抗炎剂。任选地,免疫抑制剂/免疫调节剂和/或抗炎剂在所述抗CD28域抗体之前施用。任选地,免疫抑制剂/免疫调节剂和/或抗炎剂在所述抗CD28域抗体之后施用。任选地,免疫抑制剂/免疫调节剂和/或抗炎剂与所述抗CD28域抗体同时施用。包括拮抗CD28的方法,该方法包括向个体施用有效量的本文公开的抗CD28dAb。还包括拮抗CD28结合的方法,包括向个体施用有效量的本文公开的抗CD28dAb,其中所述抗CD28dAb拮抗个体中CD28与CD80和/或CD86的结合。还包括治疗、减轻或预防免疫疾病(例如自身免疫疾病或移植物相关疾病)的症状的方法,其包括将有效量的本文公开的抗CD28dAb施用于个体,所述个体具有免疫疾病或处于免疫疾病的风险中。包括治疗、减轻或预防免疫疾病的方法,包括向具有免疫疾病或处于免疫疾病的风险中的个体施用有效量的本文公开的抗CD28dAb。包括本文公开的抗CD28dAb供制备治疗或预防有需要的患者的免疫疾病的药物的用途。还包括本文公开的抗CD28dAb用于制备治疗或预防有需要的患者的免疫疾病的症状的药物的用途。本文还包括本文公开的抗CD28dAb用于制备药物的用途,所述药物用于减轻有需要的患者中的免疫疾病的至少一种症状。进一步提供了一种配制在用于皮下施用的药物组合物中的抗CD28域抗体。所述药物组合物可以进一步包含药学上可接受的载体。所述域抗体可以皮下施用。还提供一种用于在患者中治疗免疫疾病的试剂盒,该试剂盒包括:(a)一定剂量的域抗体,包括抗CD28域抗体,以及(b)在公开的方法中使用所述域抗体中的说明。附图说明图1显示了BMS-931699的FDA2期平行臂,随机,双盲,多中心国际研究的适应性设计示意图的第1部分。图2显示了BMS-931699的FDA2期平行臂,随机,双盲,多中心国际研究的适应性设计示意图的第2部分。图3显示了长期延长(LTE)设计示意图。图4显示了在稳定状态下12.5mg每周(QW),12.5mg每2周(QOW),5mg每2周(QOW)和1.25mg每2周(QOW)的BMS-931699的预期受体占据率。详细说明本公开提供了用于拮抗CD28活性的抗CD28域抗体和使用所述域抗体治疗免疫疾病,例如狼疮的方法。该域抗体可以与聚合物连接以改善药代动力学性质,例如稳定性和半衰期。本文包括用于将聚合物分子(例如,聚乙二醇;PEG)连接到蛋白质上、以调节该修饰的蛋白质的药代动力学性质的组合物和方法。例如,已经显示,蛋白质的PEG修饰可改变该蛋白质的体内循环半衰期、抗原性、溶解性和抗蛋白水解性(Abuchowskietal.(1977)J.Biol.Chem.,252:3578;Nuccietal.(1991)Adv.DrugDeliveryReviews6:133;Francisetal.,PharmaceuticalBiotechnologyVol.3(Borchardt,R.T.ed.);和StabilityofProteinPharmaceuticals:invivoPathwaysofDegradationandStrategiesforProteinStabilization1991pp235-263,Plenum,NY))。所公开的域抗体,包括BMS-931699(又称为lulizumab或1h-239-891(D70C),其型式中具有40kDa支化聚乙二醇),单价结合CD28,并抑制CD80和CD86与CD28——T淋巴细胞的关键共刺激受体——的相互作用。最终,与域抗体靶向CD28可以提供抑制导致系统性红斑狼疮(乃至其他移植物相关或自身免疫性疾病)的自身免疫过程的机会。这样的单价域抗体还可以避免使用能够二价或多价结合CD28的抗体时可能发生的不良作用。本文所述的域抗体也不阻断CD80和CD86与CTLA4的相互作用。本文所述的域抗体不与CTLA4交叉反应,因此不结合CTLA4和CD28上共有的结合CD80/86的基序。因而域抗体可以为自身免疫性疾病的患者提供改善的治疗益处并减少副作用。因此,域抗体提供了一种新治疗模式,这种模式对现有的患者而言是不可得的。考虑到所有常规治疗均失败的系统性红斑狼疮及自身免疫性疾病受试者缺乏治疗选项,这种具有独特的作用机制和已知的安全性特征的域抗体显示出有利的风险/效益概况。1.定义根据该详细描述,应用以下缩写和定义。必须注意,除非上下文另外明确要求,否则本文所使用的单数形式“一”,“一个”和“该”包括复数指示物。因此,例如,提及“一个抗体”包括多个这样的抗体,并且提及“剂量”包括提及一个或多个剂量及其为本领域技术人员已知的等同物,等等。除非另有定义,本文使用的所有技术和科学术语具有与本领域普通技术人员通常理解的相同的含义。除非另有说明,本文所述的所有范围包括具体的端点。以下提供以下术语。如本文中使用的,“固定剂量”是不管受试者体重如何施用的剂量。如本文中使用的,术语“人”当应用于域抗体或免疫球蛋白可变域时,是指该多肽具有来源于人免疫球蛋白的序列。当序列是:a)从人个体或从人个体的细胞或细胞系分离,b)从克隆的人抗体基因序列文库(或人抗体V域序列文库)分离;或c)当使用克隆的人抗体基因序列(或克隆的人V区序列(包括例如种系V基因区段))产生一种或多种多样化序列,然后从中选择结合所需靶抗原的序列时,序列是“来源于”人免疫球蛋白编码序列的。至少,人域抗体与天然存在的人免疫球蛋白可变域序列、例如,在Kabat(“SequencesofProteinsofImmunologicalInterest”,USDepartmentofHealthandHumanServices,1991)中公开的天然存在的人免疫球蛋白可变域序列具有至少70%相同、至少75%相同、至少80%相同、至少85%氨基酸同一性(包括例如87%,90%,93%,95%、97%,99%或更高的同一性)。如本文中使用的,术语“域”是指折叠的蛋白质结构,其独立于蛋白质的其余部分保留其三级结构。通常,域负责蛋白质的显著的(discrete)的功能性质,并且在许多情况下,可以添加域,去除域或将域转移至其他蛋白质,而不丧失蛋白质和/或域的其余部分的功能。“域抗体”是指折叠的多肽域,其包含作为免疫球蛋白可变域的特征的、且特异性地结合抗原(例如,解离常数为500nM或更低)的序列。因此,“域抗体”包括完整的抗体可变域以及修饰的可变域,例如其中一个或多个环已被不是抗体可变域特征的序列替代;或者已被截短或包含N-或C-末端延伸的抗体可变域,以及可变域的折叠片段,其保留500nM或更低(例如450nM或更低,400nM或更低,350nM或更低,300nM或更低,250nM或更低,200nM或更低,150nM或更低,100nM或更低)的解离常数,以及全长域的靶抗原特异性。在必要时,或在有任何疑问的情况下,Kabat等人提出的编号规则和边界(Kabatetal.(1991)SequencesofImmunologicalInterest,5thed.U.S.Dept.Health&HumanServices,Washington,D.C.)适用于本文中提到的免疫球蛋白可变和恒定域。“dAb”在本文中与“域抗体”可互换使用。本发明中使用的“域抗体”或“dAb”是指“抗CD28域抗体”。如本文中使用的,短语“作为免疫球蛋白可变域的特征的序列”是指与免疫球蛋白可变域序列中包含的序列有20个以上,25个以上,30个以上,35个以上,40个以上,45个以上,或乃至50个以上的连续氨基酸相同。与本文公开的序列相似或相同(例如,至少约70%的序列同一性)的序列也包括在本文中。如本文中使用的,术语“同一性”是指两个核苷酸或氨基酸序列在结构上彼此相似的程度。如本文中使用的,序列“相似性”衡量氨基酸序列在序列比对中的相应位置处共享相似的氨基酸残基的程度。若氨基酸的侧链是相似的,则氨基酸彼此相似。具体地,“相似性”包括彼此保守取代的氨基酸。“保守”取代是在BLOSUM62取代矩阵(HentikoffandHentikoff(1992)Proc.Natl.Acad.Sci.USA89:10915-10919)中具有正得分的取代。术语“序列A与序列Bn%相似”是指序列A和B之间的最佳全局比对的位置有n%是由相同的氨基酸或保守取代组成的。典型的保守取代是Met、Val、Leu和Ile之间的交换;Ser和Thr之间的交换;残基Asp、Glu和Asn之间的交换;残基Gln、Lys和Arg之间的交换;或芳族残基Phe和Tyr之间的交换。如本文中使用的,术语“表位”是指被免疫球蛋白VH/VL对常规结合的结构单元。表位定义了对抗体的最小结合位点,因此代表抗体特异性的靶点。在域抗体的情况下,表位表示由域抗体在分离状态下结合的结构单元。也就是说,结合位点由单独一个免疫球蛋白可变域提供。表位可以是线性的或构象性的,并且可以小至三个氨基酸。如本文中使用的,“CD28活性”是涉及或缘于CD80、CD86和/或另一配体与CD28的结合的活性,包括但不限于CD28介导的细胞信号传导的活化。CD28活性还包括T细胞增殖的诱导和T细胞对细胞因子例如白细胞介素2(IL-2)的分泌的诱导。如本文中使用的,术语“基本上不激动”是指给定的作用剂,例如域抗体,不实质活化一种或多种CD28活性,如术语“活化”在本文中定义的。具体而言,“基本上不激动”的作用剂是指作用剂不活化超过20%的被CD80和/或CD86与CD28结合所活化的活性,在一方面,该试剂不活化超过约10%,8%,5%,3%或2%或更小的被CD80和/或CD86与CD28结合活化的活性,包括零活化。作为非限制性实例,本文所述的基本上不激动CD28活性的域抗体不激动CD28活性超过抗CD28mAb9.3(Gibson,etal.(1996)JBC,271:7079-7083)在其它方面相同的测定条件下对CD28活性的激动获得的活性的5%。如本文中使用的,术语“抑制”是指给定的可测量活性(例如,结合活性)相对于参照减少至少10%。当期望抑制时,这种抑制是至少约20%,30%,40%,50%,60%,70%,80%,90%或更高,乃至且包括100%,即给定活性的完全抑制或缺无。可以如本文的工作实施例中所述地那样测量CD28与CD80或CD86结合的抑制。如本文中使用的,术语“基本上抑制”是指相对于参照,给定的可测量活性(例如,CD28与CD80或CD86的结合)降低至少50%。例如,“基本上抑制”是指给定的可测量活性相对于参照降低至少约50%,55%,60%,65%,70%,75%,80%,85%,90%,95%,乃至且包括100%。如本文中使用的,“抑制结合”,就结合CD28的域抗体的结合,或CD80与CD28的结合,或CD86与CD28的结合而言,是指相对于参考的结合降低至少10%。“抑制结合”是指结合减少至少约20%,30%,40%,50%,60%,70%,80%,90%或更多,乃至且包括100%。如本文中使用的,术语“活化”是指给定的可测量活性相对于参照增加至少5%,例如至少10%,25%,50%,75%,或甚至100%或更多。如本文中使用的,术语“单价”意指给定的域抗体仅可以结合其靶标的单个分子。天然存在的抗体通常是二价的,因为它们具有两个功能性抗原结合环,每个结合环包含一个VH和一个VL域。当空间位阻不成问题时,二价抗体可以结合相同抗原的两个分别的分子。相比之下,“单价”抗体具有仅结合一个这样的抗原分子的能力。如该术语在本文中使用的,“单价”抗体还可以包含一个以上的抗原结合位点,例如两个抗原结合位点,但是结合位点必须是针对不同的抗原,使得抗体一次只能结合一个CD28分子。单价抗体的抗原结合域可包含一个VH和一个VL域,但在一个方面中,仅包括一个单一的免疫球蛋白可变域,即,一个VH域或一个VL域,其具有结合CD28的能力而不需要对应的VL或VH域。单价抗体缺乏交联单种抗原的分子的能力。如本文中所使用的,术语“VH域”和“VL域”是指由Kabat等人(Kabatetal.(1991)SequencesofImmunologicalInterest,5thed.U.S.Dept.Health&HumanServices,Washington,D.C.)定义的免疫球蛋白可变区,上述文献通过引用并入本文。如本文中使用的,“连接”是指聚合物部分(例如PEG)与域抗体的氨基酸残基的连接。PEG聚合物与域抗体(例如域抗体)的氨基酸残基的连接被称为“PEG化”,并且可以使用几个PEG附接部分来实现,包括但不限于N-羟基琥珀酰亚胺(NHS)活性酯,琥珀酰亚胺基丙酸酯(SPA),马来酰亚胺(MAL),乙烯基砜(VS)或硫醇。PEG聚合物或其它聚合物可以在预定位置与域抗体连接,或者可以随机地连接于域抗体分子。PEG聚合物可以在预定位置与域抗体连接。PEG聚合物可以与域抗体中的任何残基连接,然而,优选地,聚合物连接到赖氨酸或半胱氨酸,赖氨酸或半胱氨酸天然存在于域抗体中或已经工程构建到域抗体中,例如通过将域抗体中天然存在的残基诱变为半胱氨酸或赖氨酸。PEG连接也可以通过连接到域抗体的肽接头来介导。也就是说,PEG部分可以连接到与域抗体融合的肽接头,其中接头提供用于PEG连接的位点,例如游离半胱氨酸或赖氨酸。如本文中使用的,“连接”还可以指两个或更多个域抗体(例如dAb单体)缔合以形成二聚体,三聚体,四聚体或其它多聚体。域抗体单体可以通过本领域已知的几种方法连接以形成多聚体,包括但不限于多个域抗体单体作为融合蛋白表达、两个或多个单体通过单体之间的肽接头的连接,或通过在翻译后化学连接各单体,其中各单体直接彼此连接,或藉由二硫键通过接头连接,或通过连接于二,三或多价连接部分(例如,多臂PEG)而连接。虽然本文具体考虑了dAb多聚体,例如在双特异性或多特异性域抗体构建体的语境中,但需要强调的是,对于任何给定的域抗体构建体,构建体应当仅能够结合一个分子的CD28,构建体应当仅具有一个CD28结合元件,而不应当交联CD28。如本文中使用的,“聚合物”是指由重复单体单元组成的大分子,并且可以指合成或天然存在的聚合物,例如任选取代的直链或支化聚亚烷基,聚亚烯基或聚氧化烯聚合物或支化或非支化多糖。本文所用的“聚合物”特别指任选取代或支化的聚(乙二醇)、聚(丙二醇)或聚(乙烯醇)及其衍生物。本文所用的“PEG”或“PEG聚合物”是指聚乙二醇,更具体地可以指PEG的衍生化形式,包括但不限于PEG的N-羟基琥珀酰亚胺(NHS)活性酯,例如琥珀酰亚胺丙酸酯,苯并三唑活性酯,用马来酰亚胺、乙烯基砜或硫醇团衍生的PEG。例如,PEG制剂可以包括PEG-O-CH2CH2CH2-CO2-NHS;PEG-O-CH2-NHS;PEG-O-CH2CH2-CO2-NHS;PEG-S-CH2CH2-CO-NHS;PEG-O2CNH-CH(R)-CO2-NHS;PEG-NHCO-CH2CH2-CO-NHS;和PEG-O-CH2-CO2-NHS;其中R是(CH2)4)NHCO2(mPEG))。本文所述的PEG聚合物可以是直链分子,或可以是支化的,其中多个PEG部分存在于单一聚合物中。PEG或另一种作用剂(例如HSA)与本文所述的域抗体在示例性实施方案中的连接不会削弱多肽特异性结合CD28的能力。也就是说,相对于非PEG连接的对应物,PEG连接的域抗体将保留其结合活性。如本文中使用的,“保留活性”是指PEG连接的域抗体的活性水平为非PEG连接的域抗体的活性水平的至少10%,包括包含相同的一个或多个抗原结合域的非PEG连接的域抗体活性的至少约20%,30%,40%,50%,60%,70%,80%乃至90%,包括高达约95%,98%和高达100%。更具体地,PEG-连接的域抗体与非PEG连接的域抗体相比的活性应当基于摩尔确定;即在每个试验中应当使用等摩尔数的PEG-连接的域抗体和非-PEG-连接的域抗体。在确定特定的PEG连接的域抗体是否“保留活性”时,可以将PEG连接的域抗体的活性与在不存在PEG的情况下相同域抗体的活性进行比较。如本文中所使用的,术语“IC50”是指将给定的活性抑制约50%所需要的抑制剂的浓度。IC50是这样测量的:在不同量的抑制剂(例如,域抗体)的存在下,测定给定的活性,例如与CD80或CD86的CD28的结合,并将抑制剂浓度对靶定的活性作图。本文通过实施例所述的方法测量CD28与CD80或CD86的结合。或者,可以使用表面等离子体共振(SPR)。如本文所使用的,术语“EC50”是指化合物或域抗体引发受试者中的响应的浓度,其中所述响应是基线和最大响应之间一半。受试者对化合物或域抗体的基线与最大响应可以通过本领域已知的任何技术确定。如本文中使用的,术语“与域抗体融合”通常是指多肽通过使用重组DNA技术与给定抗体融合,尽管可以在蛋白质水平上发生化学的融合。因此,与另一种多肽(例如另一种具有不同结合特异性的抗体)“融合”的抗体在自然界中是不存在的,是通过重组手段产生的。术语“与域抗体融合”还包括多肽通过例如二硫键或其它化学联接而与给定的域抗体连接,其中在自然界中该融合多肽不被发现与所述域抗体融合。将某一多肽融合到另一多肽(例如抗体)的重组和化学方法是本领域熟知的。如本文所使用的,术语“Fc域”是指包含CH2和CH3恒定域的恒定区抗体序列,所述CH2和CH3恒定域如Kabat等人(同上)所述界定。重链多肽的Fc部分具有自缔合的能力,这种功能可促进二价抗体形成。术语“缺乏Fc域”意指给定的域抗体缺少免疫球蛋白Fc域(此类域根据Kabatetal.,1991,SequencesofImmunologicalInterest,5thed.U.S.Dept.Health&HumanServices,Washington,D.C.定义)中至少如下所述的部分:该部分足以介导含有所述Fc的域抗体的二聚化。测量含有Fc的域抗体的二聚化,例如通过色谱法或通过表面等离子体共振。缺乏Fc区域抗体的Fc避免血小板的相互作用,从而避免诱导血小板的聚集。如本文中使用的,术语“通用框架”是指这样的单一抗体框架序列,其对应于如Kabat(Kabatetal.(1991)SequencesofImmunologicalInterest,5thed.U.S.Dept.Health&HumanServices,Washington,D.C.)所定义的抗体中序列上保守的区域、或者对应于由ChothiaandLesk,(1987)J.Mol.Biol.196:910-917所定义的人种系免疫球蛋白库或结构。本文包括单个框架或一套这种框架的应用,已经发现此类应用容许通过仅在高变区中的变化而衍生出几乎任何结合特异性。术语“约”将是本领域的普通技术人员能够理解的,并且会因其使用的上下文中而在某种程度上有所变化。一般情况下,“约”涵盖参考值的±10%的值的范围。2.抗CD28域抗体本发明涉及特异性结合并抑制人CD28的域抗体(“抗CD28域抗体”),其在涉及CD28途径的疾病的治疗中有用。因此,提供在需要这样治疗的患者中治疗免疫疾病的方法,包括向患者施用治疗有效量的抗CD28域抗体。提供单价结合CD28的域抗体。不希望受任何特定理论的束缚,相信对CD28的单价结合可消除像现有技术的抗体那样交联细胞表面受体的可能性。因此,在一个方面中,本文公开的域抗体不仅抑制或拮抗CD80或CD86对CD28的结合,而且基本上不激动CD28活性。在一个方面,所述结合单价CD28的抗体是人类域抗体。人类域抗体可以施用给人类患者,同时很大程度上避免其它物种,例如小鼠的抗体的施用经常引起的抗抗体免疫应答。虽然鼠抗体可以通过嫁接人恒定域到鼠抗原结合域上而“人源化”,如本文所公开的人抗体的产生无需对鼠抗体序列的费力且耗时的遗传操作。在某些实施方案中,域抗体可包括以下的CDR的一个或多个:CDR1:RASRPIWPFLE(SEQIDNO:1)CDR2:FTSRLRH(SEQIDNO:2)CDR3:LQNVANPAT(SEQIDNO:3)在一个实施方案中,所述抗CD28域抗体具有与SEQIDNO:1至少70%,75%,80%,85%,90%,95%,96%,97%,98%或99%相同的CDR1序列。在另一个实施方案中,CDR1与SEQIDNO:1相差最多5个氨基酸(例如,相差5,4,3,2,1或0个氨基酸)。在一个实施方案中,所述抗CD28域抗体具有与SEQIDNO:2至少70%,75%,80%,85%,90%,95%,96%,97%,98%或99%相同的CDR2序列。在另一个实施方案中,CDR2与SEQIDNO:2相差最多5个氨基酸(例如,相差5,4,3,2,1或0个氨基酸)。在一个实施方案中,所述抗CD28域抗体具有与SEQIDNO:3至少70%,75%,80%,85%,90%,95%,96%,97%,98%或99%相同的CDR3序列。在另一个实施方案中,CDR3与SEQIDNO:3相差最多5个氨基酸(例如,相差5,4,3,2,1或0个氨基酸)。在某些实施方案中,所述抗CD28域抗体包含与选自SEQIDNO:4-15的氨基酸序列至少70%,75%,80%,85%,90%,95%,96%,97%,98%或99%相同的氨基酸序列。在另一个实施方案中,抗CD28域抗体与选定的氨基酸序列相差最多5个氨基酸。例如,该域抗体与SEQIDNO:12相差最多5个氨基酸(例如,相差5,4,3,2,1或0个氨基酸)。在某些实施方案中,所述抗CD28域抗体包含选自SEQIDNO:4-15的氨基酸序列。在一个具体的实施方案中,抗CD28域抗体包含SEQIDNO:12的氨基酸序列。下面提供了抗CD28域抗体的某些示例性序列。h-239-891(SEQIDNO:4):DIQMTQSPSSLSASVGDRVTITCRASRPIWPFLEWYQQKPGKAPKLLIYFTSRLRHGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCLQNVANPATFSQGTKVEIKR1h-239-891(Q3C)(SEQIDNO:5):DICMTQSPSSLSASVGDRVTITCRASRPIWPFLEWYQQKPGKAPKLLIYFTSRLRHGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCLQNVANPATFSQGTKVEIKR1h-239-891(S9C)(SEQIDNO:6):DIQMTQSPCSLSASVGDRVTITCRASRPIWPFLEWYQQKPGKAPKLLIYFTSRLRHGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCLQNVANPATFSQGTKVEIKR1h-239-891(R18C)(SEQIDNO:7):DIQMTQSPSSLSASVGDCVTITCRASRPIWPFLEWYQQKPGKAPKLLIYFTSRLRHGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCLQNVANPATFSQGTKVEIKR1h-239-891(G41C)(SEQIDNO:8):DIQMTQSPSSLSASVGDRVTITCRASRPIWPFLEWYQQKPCKAPKLLIYFTSRLRHGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCLQNVANPATFSQGTKVEIKR1h-239-891(K42C)(SEQIDNO:9):DIQMTQSPSSLSASVGDRVTITCRASRPIWPFLEWYQQKPGCAPKLLIYFTSRLRHGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCLQNVANPATFSQGTKVEIKR1h-239-891(K45C)(SEQIDNO:10):DIQMTQSPSSLSASVGDRVTITCRASRPIWPFLEWYQQKPGKAPCLLIYFTSRLRHGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCLQNVANPATFSQGTKVEIKR1h-239-891(S60C)(SEQIDNO:11):DIQMTQSPSSLSASVGDRVTITCRASRPIWPFLEWYQQKPGKAPKLLIYFTSRLRHGVPCRFSGSGSGTDFTLTISSLQPEDFATYYCLQNVANPATFSQGTKVEIKR1h-239-891(D70C)(SEQIDNO:12):DIQMTQSPSSLSASVGDRVTITCRASRPIWPFLEWYQQKPGKAPKLLIYFTSRLRHGVPSRFSGSGSGTCFTLTISSLQPEDFATYYCLQNVANPATFSQGTKVEIKR1h-239-891(T74C)(SEQIDNO:13):DIQMTQSPSSLSASVGDRVTITCRASRPIWPFLEWYQQKPGKAPKLLIYFTSRLRHGVPSRFSGSGSGTDFTLCISSLQPEDFATYYCLQNVANPATFSQGTKVEIKR1h-239-891(Q79C)(SEQIDNO:14):DIQMTQSPSSLSASVGDRVTITCRASRPIWPFLEWYQQKPGKAPKLLIYFTSRLRHGVPSRFSGSGSGTDFTLTISSLCPEDFATYYCLQNVANPATFSQGTKVEIKR1h-239-891(K103C)(SEQIDNO:15):DIQMTQSPSSLSASVGDRVTITCRASRPIWPFLEWYQQKPGKAPKLLIYFTSRLRHGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCLQNVANPATFSQGTCVEIKR在某些具体实施方案中,抗CD28域抗体可以包含H-239-891(D70C)(SEQIDNO:543)。抗CD28域抗体可包含40kDa支化的聚乙二醇。抗CD28域抗体可以是BMS-931699。例如,BMS-931699是T细胞增殖和细胞因子产生的强力抑制剂,其EC50分别为35±14ng/mL和25±6ng/mL。BMS-908613-P40B(BMS-931699的猕猴替代品)在抑制CD80-和CD86驱动的T细胞增殖上等效。重要的是,用BMS-931699没有观察到激动剂或共激动剂活性,如由T细胞增殖或细胞因子释放所确定的。在一个实施方案中,所述域抗体与CD28的结合基本上不激动CD28活性。具体地,所述dAb不激动与T细胞受体信号传导联合的CD28信号传导。在另一个实施方案中,所述域抗体抑制CD28对CD80的结合。在另一个实施方案中,所述域抗体抑制CD28对CD80的结合,而基本上不激动CD28的信号传导。在另一个实施方案中,所述域抗体抑制CD28对CD86的结合。在另一个实施方案中,所述域抗体抑制CD28对CD86的结合,而基本上不激动CD28的信号传导。在一个方面中,所述dAb基本上不诱导与T细胞受体信号传导联合的T细胞的增殖。在另一个方面,所述dAb基本上不诱导与T细胞受体信号传导联合的T细胞细胞因子分泌。在一个实施方案中,细胞因子是选自下组中的至少一种细胞因子:GM-CSF,IL-2,IL-3,IL-4,IL-5,IL-6,IL-10,IL-12IL-13,IL-15,IL-17,IL-21,IL-22,IL-24,TGFβ,TNF-α,TNF-β,IFN-α,IFN-β,IFN-γ。在一个方面中,因为人抗体当施用人类受试者以治疗或预防疾病时将避免发生对该抗体的免疫反应,所述域抗体是这样的人域抗体,其单价地结合CD28,并且在一个示例性实施方案中,基本上不激动CD28活性。在一个实施方案中,所述域抗体与人CD28相互作用的Kd通过表面等离子体共振测量为50nM至1pM(包括端值)。例如,对人CD28的Kd可以是25nM至20pM,10nM至20pM,5nm至20pM,1nM至20pM,0.5nM至20pM,0.1nM至20pM,0.1nM至50pM,75pM至20pM,或甚至50pM至20pM。在一个实施方案中,对人CD28的Kd为约50pM。在一个实施方案中,域抗体以50nM或更低的EC50抑制CD80与CD28的结合。在一个实施方案中,域抗体以50nM或更低的EC50抑制CD86与CD28的结合。在另一个实施方案中,域抗体对CD28具有结合特异性,Koff速率常数为1×10-3s-1或更小,1×10-4s-1或更小,1×10-5s-1或更小,或1×10-6s-1或更小,如通过表面等离子体共振测定的。在一个实施方案中,域抗体在标准测定中以50nM或更小的EC50中和CD28。在另一个实施方案中,域抗体包含结合CD28的单个免疫球蛋白可变域。在一个实施方案中,单个免疫球蛋白可变域是VH或VL域。在另一个实施方案中,域抗体包含两个可变域(例如一个VH域和一个VL域)的同源多聚体或异源多聚体,但其中一个可变域具有不需要相应的VL或VH域而结合CD28的能力。也就是说,dAb可独立于额外的VH或VL域结合抗原。这些实施方案中的可变域可以包含三个互补决定区(CDR)。在另一个实施方案中,域抗体不含Fc域。Fc域的界限在Kabat等人(1991,SequencesofImmunologicalInterest,第5版,U.S.Dept.Health&HumanServices,Washington,D.C;通过引用并入本文)中列出。或者,Fc域由CH2-CH3区组成,任选包括与CH2连接的铰链区。在一个方面中,域抗体包含通用框架。在这个方面中,域抗体可以包含一个以上的框架区,所述框架区包含与由人种系抗体基因区段编码的相应框架(FW)区的氨基酸序列相同的氨基酸序列,或者,相对于由人种系抗体基因区段编码的所述相应框架区的氨基酸序列,所述一个以上的框架区的氨基酸序列总共包含最多5个,例如1、2、3、4或5个氨基酸差异。在一个实施方案中,dAb包含的FW1,FW2,FW3和FW4的氨基酸序列对应于人抗体(例如人种系抗体)的FW1,FW2,FW3和FW4。在另一个实施方案中,域抗体的FW1,FW2,FW3和FW4的氨基酸序列中的一些或全部与由人种系抗体基因区段编码的相应框架区的氨基酸序列相同。例如,FW2可以与人抗体的FW2相同。在另一个实施方案中,FW1,FW2,FW3和FW4的氨基酸序列相对于由所述人种系抗体基因区段编码的相应框架区的氨基酸序列总共包含最多10个氨基酸差异。在上述的另一个实施方案中,人种系抗体基因区段可以选自DP47、DP45、DP48和DPK9。在一个实施方案中,通用框架包含选自DP47、DP45和DP38的VH框架,和/或VL框架是DPK9。在一个方面,域抗体被型式化以增加其体内半衰期。特别地,域抗体相对于相同的无型式域抗体具有增加的体内t-α或t-β半衰期。在一个实施方案中,当与在其它相同条件下测定的未修饰的蛋白质相比时,域抗体组合物的tα半衰期增加10%或更多。在另一个实施方案中,域抗体组合物的tα-半衰期增加50%或更多。在另一个实施方案中,域抗体组合物的tα-半衰期增加2X或更多。在另一个实施方案中,域抗体组合物的tα-半衰期增加5X或更多,例如10X,15X,20X,25X,30X,40X,50X或更多。在另一个实施方案中,域抗体组合物的tα-半衰期增加100X,200X,300X,400X,500X或更多。在另一个实施方案中,域抗体具有0.25至6小时(包括端值)的tα半衰期。在另一个实施方案中,tα半衰期在30分钟至12小时的范围内(包括端值)。在另一个实施方案中,域抗体的tα半衰期在1至6小时的范围内。在另一个实施方案中,当与在其它相同条件下测定的未修饰的蛋白质相比时,域抗体的tβ半衰期增加10%或更多。在另一个实施方案中,域抗体的tβ半衰期增加50%或更多。在另一个实施方案中,抗体域抗体的tβ半衰期增加2X或更多。在另一个实施方案中,域抗体的tβ半衰期增加5X或更多,例如10X,15X,20X,25X,30X,40X或更多。在另一个实施方案中,域抗体的tβ半衰期增加50X或更多。在另一个实施方案中,域抗体具有1小时至744小时(包括端值)的tβ半衰期。在另一个实施方案中,tβ半衰期在12至48小时的范围内(包括端值)。在另一个实施方案中,tβ半衰期在12至26小时的范围内(包括端值)。在另一个实施方案中,tβ半衰期为约336小时。除了上述标准之外或替代上述标准,提供了含域抗体的组合物,其包含具有在1mg·min/ml或更大范围内的AUC值(曲线下面积)的配体。在一个实施方案中,该范围的下限为5、10、15、20、30、100、200或300mg·min/ml。并且/或者,配体或组合物具有在高达600mg·min/ml范围内的AUC。在一个实施方案中,该范围的上限为500、400、300、200、150、100、75或50mg·min/ml。有利地,配体的AUC在选自下组的范围内:15至150mg·min/ml;15至100mg·min/ml;15至75mg·min/ml;和15至50mg·min/ml。在另一个实施方案中,型式化包括dAb的PEG化。在一个实施方案中,PEG是共价连接的。在另一个实施方案中,PEG在半胱氨酸或赖氨酸残基处与域抗体连接。在另一个实施方案中,PEG连接的域抗体具有至少24kD的流体动力学尺寸。在另一个实施方案中,总PEG大小为20至60kD,包括端值。在另一个实施方案中,PEG连接的域抗体具有至少200kD的流体动力学尺寸。在另一个实施方案中,相对于缺少连接的聚乙二醇的相同多肽组合物,PEG连接的域抗体具有增加的体内半衰期。在另一个实施方案中,域抗体组合物的tα半衰期增加10%或更多。在另一个实施方案中,域抗体组合物的tα半衰期增加50%或更多。在另一个实施方案中,域抗体组合物的tα半衰期增加2X或更多。在另一个实施方案中,域抗体组合物的tα-半衰期增加5X或更多,例如10X,15X,20X,25X,30X,40X,50X或更多。在另一个实施方案中,域抗体组合物的tα-半衰期增加100X,200X,300X,400X,500X或更多。在另一个实施方案中,PEG连接的域抗体具有0.25至6小时(包括端值)的tα半衰期。在另一个实施方案中,tα半衰期在30分钟至12小时的范围内(包括端值)。在另一个实施方案中,域抗体的tα半衰期在1至6小时的范围内。在另一个实施方案中,PEG-连接的域抗体的tβ半衰期增加10%或更多。在另一个实施方案中,PEG-连接的域抗体的tβ半衰期增加50%或更多。在另一个实施方案中,PEG连接的域抗体的tβ半衰期增加2X或更多。在另一个实施方案中,PEG-连接的域抗体的tβ半衰期增加5X或更多,例如10X,15X,20X,25X,30X,40X或更多。在另一个实施方案中,PEG连接的域抗体的tβ半衰期增加50倍或更多。在另一个实施方案中,PEG连接的域抗体具有1至170小时(包括端值)的t半衰期。在另一个实施方案中,tβ半衰期在12至48小时的范围内(包括端值)。在另一个实施方案中,tβ半衰期在12至26小时的范围内(包括端值)。在另一个实施方案中,PEG连接的域抗体具有在1mg.min/ml或更多的范围内的AUC值(曲线下面积)。在一个实施方案中,该范围的下限为约5,10,15,20,30,100,200或300mg·min/ml。并且/或者,配体或组合物具有在最高高达约600mg·min/ml范围内的AUC。在一个实施方案中,该范围的上限为约500,400,300,200,150,100,75或50mg·min/ml。有利地,配体将具有选自以下的范围内的AUC:约15至150mg·min/ml,约15至100mg·min/ml,约15至75mg·min/ml,约15至50mg·min/ml。dAb可以以约100nM,约50nM,约1nM,约500pM,约100pM,约50pM,约10pM,约5pM或约1pM的EC50抑制CD28与CD80和/或CD86的结合。例如,域抗体抑制CD28与CD80的结合的EC50在1pM至1.5μM的范围内;抑制CD28与CD80结合的EC50。EC50可以在1pM至1μM,1pM至900nM,1pM至800nM,1pM至700nM,1pM至600nM,1pM至500nM,1pM至400nM1pM至300nM,1pM至200nM,1pM至100nM,1pM至50nM,1pM至10nM,1pM至1nM,1pM至500pM,1pM至100pM,1pM至50pM,1pM至10pM,或1pM至5pM的范围内。其它可接受的范围包括例如50pM至1μM,100pM至500nM,125pM至250nM,150pM至200nM,150pM至100nM,和200pM至50nM。在另一个实施方案中,域抗体抑制CD28与CD86的结合,其EC50在1pM至1.5μM的范围内(包括端值);抑制CD28与CD86结合的EC50。EC50可以在1pM至1μM,1pM至900nM,1pM至800nM,1pM至700nM,1pM至600nM,1pM至500nM,1pM至400nM,1pM至300nM,1pM至200nM,1pM至100nM,1pM至50nM,1pM至10nM,1pM至1nM,1pM至500pM,1pM至100pM,1pM至100nM,1pM至50pM,1pM至10pM,或1pM至5pM的范围内。其它可接受的范围包括例如50pM至1μM、100pM至500nM、125pM至250nM、150pM至200nM、150pM至100nM和200pM至50nM。域抗体可以包含一个或多个框架区,其包含与由人种系抗体基因区段编码的相应框架区的氨基酸序列相同的氨基酸序列,或者一个或多个所述框架区的氨基酸序列相对于由人种系抗体基因区段编码的所述相应框架区的氨基酸序列总共包含至多5个氨基酸差异。在一个实施方案中,域抗体的FW1、FW2、FW3和FW4的氨基酸序列与由人种系抗体基因区段编码的相应框架区的氨基酸序列相同,或者FW1、FW2、FW3和FW4相对于由所述人种系抗体基因区段编码的相应框架区的氨基酸序列总共包含至多10个氨基酸差异。在一个实施方案中,域抗体的FW1、FW2和FW3的氨基酸序列与由人种系抗体基因区段编码的相应框架区的氨基酸序列相同。人种系抗体基因区段可以选自DP47,DP45,DP48和DPK9。3.域抗体的应用如本文所述的域抗体可用于拮抗CD28的活性。因此,如本文所述的域抗体可用于治疗患有完全由或部分由CD28活性介导的状况、疾病或病症的患者。例如,如本文所述的域抗体可用于治疗或预防涉及CD28介导的途径的不适当激活的疾病或病症,例如系统性红斑狼疮(SLE)。如本文所用,当涉及疾病的症状时,“治疗”,“减少”,“预防”或“减轻”是指基于临床可测量的参数,症状减少至少10%,或临床上接受的疾病或症状严重程度量表上至少的一个点。如本文所用的,术语“系统性红斑狼疮的症状”是指SLE的本领域技术人员已知的任何临床相关症状,包括但不限于BICLA(基于BILAG的复合红斑狼疮评估),SRI(系统性红斑狼疮响应者指数)。非限制性实例包括IgG自身抗体(例如针对核抗原例如染色质、snRNP(特别是U1,Sm,Ro/SSA和La/SSB)、磷脂和细胞表面分子的IgG自身抗体),溶血性贫血,血小板减少症,白细胞减少,肾小球肾炎,血管炎,关节炎和浆膜炎)。患者的此类症状的减少是与用安慰剂治疗的患者相比临床可测量参数的至少10%的减少,或临床上接受的疾病严重程度量表上至少一个点的减少。在一个方面,自身免疫性疾病常常涉及CD28途径的不适当调节或活性。向患有这种疾病(包括自身免疫疾病)的个体施用本文所述的域抗体可以减少该疾病的一种或多种症状。本文所述的域抗体可以用于治疗的疾病的非限制性实例包括但不限于艾迪生病,变态反应,强直性脊柱炎,哮喘,动脉粥样硬化,耳的自身免疫性疾病,眼的自身免疫性疾病,自身免疫性萎缩性胃炎,自身免疫性肝炎,自身免疫性溶血性贫血,自身免疫性腮腺炎,原发性胆汁性肝硬化,良性淋巴细胞性脉管炎,结肠炎,冠心病,克罗恩病,糖尿病(I型),糖尿病,包括1型和/或2型糖尿病,附睾炎,肾小球肾炎,古德帕斯彻综合征,格雷夫斯病,吉兰巴雷综合征,桥本氏病,溶血性贫血,特发性血小板减少性紫癜,炎性肠病(IBD),对重组药物产品(例如血友病中的因子VII)的免疫应答,系统性红斑狼疮,狼疮肾炎,男性不育症,混合性结缔组织病,多发性硬化,重症肌无力,原发性粘液性水肿,天疱疮,恶性贫血,多肌炎,银屑病,银屑病关节炎,风湿热,类风湿性关节炎,结节病,硬皮病,干燥综合征,脊椎关节病,交感性眼炎、淋巴细胞淋巴瘤,T细胞急性淋巴母细胞白血病,睾丸偏心T细胞淋巴瘤,甲状腺炎,移植排斥,溃疡性结肠炎,自身免疫性葡萄膜炎和血管炎。自身免疫介导的状况包括但不限于其中受影响的组织是初级靶标,并且在一些情况下是次级靶标的状况。这样的状况包括但不限于AIDS,特应性变态反应,支气管哮喘,湿疹,麻风,精神分裂症,遗传性抑郁症,组织和器官移植,慢性疲劳综合征,阿尔茨海默病,帕金森病,心肌梗塞,癫痫,Arthus现象,过敏反应,酒精和药物成瘾。本文描述的域抗体还可以用于治疗移植物相关疾病,如移植物抗宿主病(GVHD)、急性移植排斥和慢性移植排斥。在某些实施方案中,本发明提供了治疗患者的免疫疾病的方法,包括向患者施用治疗有效量的抗CD28域抗体。为了举例说明,免疫性疾病可以是系统性红斑狼疮。与接受安慰剂的患者相比,接受抗CD28域抗体的患者可具有减少的SLE症状。例如,与接受安慰剂的患者相比,接受抗CD28域抗体的患者可具有更低水平的C3、C4、抗dsDNA和/或抗ANA。例如,与接受安慰剂的患者相比,接受抗CD28域抗体的患者可具有减少的关节炎症状。例如,与接受安慰剂的患者相比,接受抗CD28域抗体的患者可具有减少的炎症性皮肤病症状。所述治疗还可包括施用免疫抑制剂/免疫调节剂和/或抗炎剂。治疗可以与免疫抑制剂/免疫调节剂和/或抗炎剂联合施用。此类额外的免疫抑制/免疫调节和/或抗炎剂或疗法可以包括钙调神经磷酸酶抑制剂,环孢菌素,环磷酰胺(cytoxan),泼尼松,硫唑嘌呤,甲氨蝶呤,皮质类固醇,非甾体抗炎药/Cox-2抑制剂,羟氯喹,柳氮磺吡啶,金盐,依那西普,英夫利昔单抗,阿那白滞素,咪唑立宾,霉酚酸,霉酚酸酯,干扰素β-1a,干扰素β-1b,乙酸格拉默,盐酸米托蒽醌和/或其它生物制剂如抗TNF。域抗体还可以与一种或多种下列试剂组合施用以调节免疫应答:CTLA4,可溶性gp39(也称为CD40配体(CD40L)、CD154、T-BAM、TRAP),可溶性CD29,可溶性CD40,可溶性CD80,可溶性CD86,可溶性CD56,可溶性Thy-1,可溶性CD3,可溶性TCR,可溶性VLA-4,可溶性VCAM-1,可溶性LECAM-1,可溶性ELAM-1,可溶性CD44,与gp39反应的抗体,与CD40反应的抗体,与B7反应的抗体,与CD28反应的抗体,与LFA-1反应的抗体,与LFA-2反应的抗体,与IL-2反应的抗体,与IL-12反应的抗体,与IFN-γ反应的抗体,与CD2反应的抗体,与CD48反应的抗体,与任何ICAM(例如ICAM-2)反应的抗体,与CTLA4反应的抗体,与Thy-1反应的抗体,与CD56反应的抗体,与CD3反应的抗体,与CD29反应的抗体,与TCR反应的抗体,与VLA-4反应的抗体,与VCAM-1反应的抗体,与LECAM-1反应的抗体,与ELAM-1反应的抗体,与CD44反应的抗体,针对白细胞受体,例如MHC,CD2,CD3,CD4,CD11a/CD18,CD7,CD25,CD27,B7,CD40,CD45,CD58,CD137,ICOS,CD150(SLAM),OX40,4-1BB或其配体的单克隆抗体。当本发明的域抗体与另一免疫抑制剂/免疫调节剂或抗炎剂或治疗(例如如上所述)组合施用时,可同时或按顺序进行施用。当dAb与另一种药剂(例如上文指定的药剂)同时施用时,dAb和该药剂可在同一药物组合物中施用。所述治疗可产生至少一种可通过选自以下的生物标志物测量的治疗效应:T细胞上的CD28受体占据率,C3、C4、抗dsDNA、抗ANA、抗Ro自身抗体、抗La自身抗体、抗RNP自身抗体,抗-Sm自身抗体,抗APL自身抗体,CRP,总IgG,总IgM,全血中的RNA转录物,尿中的NGAL,尿中的TWEAK,尿中的MCP-1,尿中的IL-1,总可溶性CD28,T细胞活化,白细胞表面CD4,白细胞表面CD8,白细胞表面CD28,白细胞表面CD57和白细胞细胞内粒酶B,血清IL-6,血清IL-18,血清TNF-α,血清α-干扰素、血清BLyS(BAFF),CD154,sCD28和微泡(microvessicles)。4.药物组合物,剂量和施用本文所述的抗CD28域抗体可以掺入适合于施用于受试者的药物组合物中。通常,药物组合物包含域抗体和药学上可接受的载体。如本文所用,“药学上可接受的载体”包括任何生理上相容的溶剂、分散介质、包衣,抗细菌剂和抗真菌剂,等渗剂和吸收延迟剂等。术语“药学上可接受的载体”排除包含牛或马血清的组织培养基。药学上可接受的载体的实例包括水,盐水,磷酸盐缓冲盐水,葡萄糖,甘油,乙醇等中的一种或多种,以及它们的组合。在许多情况下,优选在组合物中包含等渗剂,例如糖,多元醇如甘露醇,山梨醇或氯化钠。药学上可接受的物质包括少量辅助物质,例如润湿剂或乳化剂,防腐剂或缓冲剂,其增强域抗体的保存期限或有效性。如本文描述的组合物可以是各种形式。这些包括,例如,液体、半固体和固体剂型,例如液体溶液(例如,可注射和可输注溶液),分散体或悬浮液,粉剂,脂质体和栓剂。优选的形式取决于意图的施用和治疗应用方式。典型的优选组合物是可注射或可输注的溶液,例如与那些用于以其他抗体被动免疫接种人的组合物的形式。施用的一种模式是肠胃外(例如,静脉内、皮下、腹膜内、肌内)。治疗组合物通常必须在制造和贮存的条件下是无菌和稳定的。组合物可以配制成溶液,微乳剂,分散体,脂质体或适合于高药物浓度的其他有序结构。无菌可注射溶液可以通过在合适的溶剂中将所需量的活性化合物与一种上述列举的成分或上述列举成分的组合(根据需要)合并,随后过滤灭菌来制备。一般地,分散体通过将活性化合物掺入的无菌溶媒中来制备,其中所述无菌溶媒含有基本分散介质和来自上述列举者的所需其它成分。对于制备无菌注射溶液用的无菌粉末,制备方法包括真空干燥和冷冻干燥,从预先无菌过滤的溶液产生活性成分加上任何其他需要的成分的粉末。溶液的适当流动性可以被保持,例如,通过使用包衣如卵磷脂,通过维持所需的颗粒大小(在分散体的情况下)和通过使用表面活性剂。本文所述的域抗体可通过多种本领域已知的方法给药,尽管用于许多治疗应用。所述多肽可以通过静脉内(IV)、肌内(IM)或皮下(SC)注射给药。如熟练的技术人员会理解的,施用途径和/或模式将根据所期望的结果而变化。在某些实施方案中,活性化合物可以与会保护该化合物免于快速释放的载体一起制备,如控释制剂,包括植入物,和微囊化递送系统。域抗体非常适合于配制成延长释放制剂,这部分是因为它们的尺寸小,每剂的摩尔数可以显著高于例如全尺寸的抗体的剂量。可以使用可生物降解的、生物相容的聚合物,如乙烯乙酸乙烯酯,聚酸酐,聚乙醇酸,胶原,聚原酸酯,和聚乳酸。注射组合物的延长吸收可通过在组合物中加入延迟吸收的作用剂,例如单硬脂酸盐和明胶来实现。许多用于制备这样的制剂的方法已获得专利或者是本领域技术人员所公知的。参见,例如,SustainedandControlledReleaseDrugDeliverySystems,J.R.Robinson,ed.,MarcelDekker,Inc.,NewYork,1978。其他可适用于多肽试剂(例如本文中公开的单价域抗体)的受控或延长释放的方法在例如美国专利号6,306,406和6,346,274,以及,例如美国专利公开号US20020182254和US20020051808中有描述,所有文献均通过提述并入本文用于所有目的。例如,所述域抗体可配制在用于皮下施用的药物组合物中,该组合物可以包括药学上可接受的载体。该药物组合物可以进一步包含在20mM磷酸盐,pH值5.9中的12.5mg/mLBMS-931699,含用5%(重量/体积)山梨糖醇。组合物中还可以掺入其他的活性化合物。在某些实施方案中,域抗体与一种或多种另外的治疗剂共配制和/或共施用。例如,域抗体可以与一种或多种结合其他靶标的另外的抗体(例如,结合其他细胞因子或结合细胞表面分子的抗体)共配制和/或共施用,或者与一种或更多的细胞因子共配制和/或共施用。这样的组合疗法可利用所施用的治疗剂的较低剂量,从而避免可能的与各种单一疗法相关的毒性或并发症。本文所公开的药物组合物可包括域抗体的“治疗有效量”或“预防有效量”。“治疗有效量”是指在必要的剂量数和时程条件下有效实现期望的治疗结果的量。域抗体的治疗有效量可根据例如个体的疾病状态、年龄、性别和体重以及域抗体在个体中引起所需反应的能力等因素而变化。治疗有效量也是这样的量,在该量下治疗有益效果超过抗体或抗体部分的任何毒性或有害作用。“预防有效量”是指在必要的剂量数和时程条件下有效达到所需的预防结果的量。通常,因为预防剂量在疾病之前或疾病的早期阶段用于受试者,故预防有效量将小于治疗有效量。对剂量方案可以加以调整以提供最佳所需应答(例如,治疗或预防应答)。例如,可以进行单次推注,可以经过一段时间施用几个分份剂量,或者可以视治疗情况的紧急程度的要求按比例减少或增加剂量。有利的是,为了便于给药和剂量的均一,将肠胃外组合物配制成单位剂型。本文使用的“单位剂型”是指物理上独立的单位,适合作为单一剂量用于待治疗的哺乳动物受试者;每个单位含有计算为产生所需治疗效果的预定量的活性化合物以及所需的药物载体。治疗或预防有效量的域抗体的一个非限制性范围为0.1-20mg/kg,在一个方面,为1-10mg/kg。例如,域抗体可以以约1.25mg至约12.5mg的剂量施用;即剂量可以为至少1.25mg,至少5mg,至少12.5mg,约1.25mg,约5mg,或约12.5mg。可以皮下施用1.25mg至约12.5mgmg的域抗体。剂量可以按照固定的或变化的时间表施用。例如,剂量可以每周或每两周施用。所述剂量可以根据设定的治疗方案施用,例如每两周一次持续24周(共12个剂量)或每周一次持续24周(共24个剂量)。应注意,剂量值可能取决于要缓解的病症的类型和严重性而变化。应进一步理解,对于任何特定受试者,应根据个体需要和主治医生的专业判断随时间调整具体剂量方案。本文所述的域抗体治疗的功效由本领域技术人员基于所治疗的疾病状态或病症的一种或多种症状或指标的改善来判断。在一个以上临床指标中至少10%的改善(增加或减少,取决于所测量的指标)被认为是“有效治疗”,但更大的改善亦包括在内,例如约20%,30%,40%50%,75%,90%或甚至100%,或者根据所测量的指示物,超过100%(例如,两倍,三倍,十倍等,直到并包括达到无疾病状态。指标可以是物理测量,例如酶、细胞因子、生长因子或代谢物水平,细胞生长或细胞死亡的速率,或异常细胞的存在或量。还可以测量,例如,疾病或病症的症状复燃(flare-up)之间的时间量的差异(例如对于缓解中或复发中的疾病,如多发性硬化而言)。或者,可以依赖于非物理测量,例如报告的疼痛或不适的减轻或其他疾病状态的指标来衡量治疗的有效性。在进行非物理测量时,可以使用各种临床可接受的量表或指数,例如克罗恩病活动指数或CDAI(Best等(1976)Gastroenterology70:439),其将物理指标(例如作为血细胞比容和液态或极软粪便的量)以及其他患者报告的因素(例如腹部疼痛或抽搐的严重程度和一般健康)相结合来指定疾病得分。如该术语在本文中所使用的,如果相对于在未用本文所述的组合物处理的相似个体(人或动物模型)中的相应症状,一种或多种症状的发作被延迟或者严重程度减少至少10%,或者被消除,则使用本文所述的组合物进行的“预防”是“有效的”。尽管本文所述的域抗体结合人CD28,但如果在动物模型系统中评价其效果,该多肽必须与动物模型系统中的一种或多种抗原交叉反应,在一个方面,以高亲和力交叉反应。本领域技术人员可以容易地确定对于给定的动物模型系统和给定的域抗体是否满足该条件。如果满足该条件,可以通过在模拟疾病状态的条件下将域抗体施用于动物模型,并监测该疾病状态的一个或多个指标是否有至少10%改善,来检查域抗体的功效。实施例实施例1:PEG化的1h-239-891(D70C)在食蟹猴中的药代动力学在食蟹猴中进行研究以评价用30kDa线性PEG(P30L)或40kDa支化PEG(P40B)聚乙二醇化的1h-239-891(D70C)以用0.05mg/kg和5mg/kg的单次静脉内(IV)给药,或以0.05、0.5、5mg/kg(mpk)的皮下(SC)给药后的药代动力学。表1和2分别总结了1h-239-891(D70C)-P30L和-P40B的IV和SCPK参数。对于P30L和P40BPEG型式均观察到非线性药代动力学。P30L和P40B的终末半衰期(T1/2)分别为1.6和2.5天。在0.05mg/kg的P30L、以及0.05和5mg/kg的P40B的SC给药后,1h-239-891(D70C)的吸收几乎完全(生物利用度F>90%),但5mg/kg的P30L下降到70%。稳态分布体积(Vss)在两种PEG型式之间是相当的。然而,P40B的系统清除率(CL)是30L的系统清除率(CL)的三分之一,这大体上解释了观察到的这两种型式之间AUC和T1/2的差异。例如,在0.05mg/kg下,由于终末期的药物浓度低于定量水平(LLQ),无法精确地测定T1/2。表1:1h-239-891(D70C)的PK参数-P30L*由于终末期的药物浓度低于LLQ,无法准确确定表2:1h-239-891(D70C)的PK参数-P40B*由于终末期的药物浓度低于LLQ,无法准确确定实施例2:BMS-931699替代药理学使用替代性的识别小鼠CD28的CD28dAb,其具有类似于BMS-931699的效力,来评价在小鼠功效模型中CD28直接抑制的影响。在一个小鼠KLH抗体应答模型中,BMS1m-74-14982-P40B(BMS-931699的小鼠替代物)在小鼠中在0.1mg/kg完全阻抑了IgG滴度,其中体内EC50为18ng/mL。最大功效需要剂量后24小时~100%的CD28受体占据率(RO)。在相同的模型中,mCTLA4Ig在3mg/kg完全抑制了IgG反应,体内EC50为1656ng/mL。在NZB/NZWF1狼疮模型中在疾病发作后(治疗模式)用BMS1m-74-14982-P40B治疗,可有效减少蛋白尿、血清自身抗体滴度、局部细胞因子基因表达、以及肾小球肾炎/免疫复合物沉积。大多数终点在0.5mg/kg剂量受到完全影响,而存活和抗dsDNA则需要更高的浓度,分别为2mg/kg和8mg/kg。总的来看,体外和体内研究提供了dAb技术的概念验证,也为CD28dAb在临床上对自身免疫性疾病的有效性提供了信心。支持BMS-931699临床开发的非临床安全性评估包括:1)在猴中使用BMS-908613-P40B进行的单剂量PK/PD研究,以支持最小预期生物效应水平(MABEL)剂量理论;2)在小鼠中使用BMS1m-74-14982-S60C-P40B进行的单剂量探索性毒性研究,以评估啮齿动物模型中CD28拮抗作用的潜在毒性;3)BMS-931699在食蟹猴中的GLP1个月和6个月重复剂量毒性枢纽性研究;4)对人T细胞的潜在BMS-931699相关效应(细胞因子释放、T细胞活化/增殖)的探索性体外研究;和5)良好实验室操作(GLP)人组织交叉反应性研究,以证明靶点分布并提示任何潜在的非预期的表位结合。选择食蟹猴作为毒理学物种,因为BMS-931699可与猕猴CD28相当地结合,在猴中具有药理活性,并且不与啮齿动物CD28交叉反应。已经在体内用BMS-908613-P40B(TDAR的抑制)和用BMS-931699(各种淋巴结中皮质淋巴细胞的减少,反映生发中心活性的减少)证明了对食蟹猴的预期PD作用。在体外,BMS-931699和BMS-908613-P40B在体外混合淋巴细胞反应(MLR)测定中显示相似的与人CD28结合的亲和力和相似的效力。使用BMS-931699的啮齿动物替代物——BMS1m-74-14982-S60C-P40B来评估小鼠中的潜在毒性可能性。在小鼠的单剂量探索性毒性研究中,BMS1m-74-14982-S60C-P40B在高达18mg/kg(AUC≤5184μg·h/mL)的SC剂量没有任何相关的不良药物相关所见(adversedrug-relatedfindings)。在猴的单剂量探索性PK/PD研究中,BMS-908613-P40B在高达5mg/kg(AUC≤6793μg·h/mL)的SC剂量没有任何相关的不良药物相关所见,包括任何对血浆细胞因子的效应。剂量≥0.5mg/kg时的BMS-908613-P40B相关效应仅限于当给药24小时后施用KLH时,可逆且剂量依赖地阻抑针对KLH的初级TADR——这是预期之内的药理学效应。在食蟹猴中的一项具有8周恢复期的5周间歇剂量毒性研究中,BMS-931699的高达15mg/kg的IV剂量(从0时至168小时的联合性别平均AUC[AUC(0-168h)]≤16,700μg·hr/mL)或3.5mg/kg的SC剂量(平均AUC≤3520μg·hr/mL),临床上耐受性良好。值得注意的是,在所有剂量(在第22天平均值[AUC(0-168h)]≥1860μg·h/mL)的BMS-931699相关效应包括外周血调节性T淋巴细胞(Treg)的非不良性减少,淋巴结中的皮质淋巴细胞的最小到适度减少,以及各种组织中的与炎症或坏死性改变或器官功能改变无关的最小至轻微的巨噬细胞和/或上皮细胞空泡化。淋巴结中Treg和皮层淋巴细胞的减少是预期的药理作用,而在多种组织中的空泡化归因于BMS-931699的PEG部分。在8周恢复期后,除了脉络丛上皮和垂体中的空泡化之外,所有BMS-931699相关效应显示部分到完全消退。基于严重性低且没有相关的炎症或退行性变化,认为未观察到不良反应的水平(NOAEL)是15mg/kg/周IV(第22日的平均AUC[0-168h]为15,200μg·h/mL)和3.5mg/kg/周SC(第22天日的平均AUC[0-168h]为3330μg·h/mL)。在具有6个月恢复期的6个月间歇性剂量毒性研究中,当BMS-931699作为10mg/kg的每周SC剂量(AUC[[0-168h]12,100μg·h/mL)施用时,BMS-931699在食蟹猴中临床上良好耐受≤6个月。所有剂量下的主要BMS-931699相关所见是外周血Treg、B淋巴细胞、血清IgG和淋巴结或脾中的皮质淋巴细胞的药理学介导的减少。由于Treg的变化是最小的、可逆的,并且不与任何其他关联性不良结果相关,因此不将Treg的变化视为不良。在≥1mg/kg/周(AUC[0-168h]1,350μg·h/mL)下的其他非不良显微镜检查所见包括巨噬细胞和/或上皮细胞在几种组织(脑的脉络丛、肾脏、腋窝淋巴结、和注射部位),以及肾间质的厚度增加。在≥3.5mg/kg/周(4,450μg·h/mL的AUC[0-168h])下,注意到垂体中巨噬细胞的PEG相关的空泡化以及皮下注射部位的炎症和出血的发生率和严重程度增加。其他在10mg/kg/周的所见包括在下颌和肠系膜淋巴结、脑的周室器、膀胱、卵巢、子宫以及脾中的巨噬细胞的PEG相关空泡化。所有上述所见均显示出可逆性(部分或完全)的证据,但肾间质的厚度增加和垂体、脑的周室器、膀胱和子宫中巨噬细胞的空泡化除外。这些所见均不伴有退行性或炎症性改变,被认为非不良性。在1mg/kg/周的1名雌性中观察到淋巴瘤,其被认为是继发于潜伏感染LCV的食蟹猴中BMS-931699诱导的免疫抑制;基于该所见,在本研究中未确定NOAEL。在单剂量探索性PK和PD研究、以及重复剂量猴毒性研究中,有低发生率的免疫原性出现。此外,抗药物抗体(ADA)的存在未影响猴中BMS-931669的PK、PD或毒性动力学。在猴子的5周或6个月研究中,使用大于或等于人类推荐量的BMS-931699浓度和注射速率,在BMS-931699IV或SC注射部位没有观察到不良刺激或局部不耐受。在一种体外测定系统中,将纯化的人T细胞与BMS-931699或超激动性抗CD28单克隆抗体(mAb)TGN5.11A1一起温育,以监测对T淋巴细胞活化、增殖和细胞因子释放的潜在效应。结果没有BMS-931699相关的影响,而TGN5.11A1诱导了细胞因子释放和细胞激活二者。在使用23种人组织的综合组的GLP组织交叉反应性研究中,BMS-931699的结合在大多数人组织中限于单核细胞。由于CD28主要由T细胞表达,全组人组织中的血淋巴细胞和单核细胞均被染色是预期的反应性。总体而言,BMS-931699已经展现了可接受的药理学、非临床PK、PD和毒理学性质,支持继续进行临床开发。作为在猴中的枢纽性GLP重复剂量毒性研究的一部分,评估了IV和/或SC施用BMS-931699对心血管、中枢/外周神经和/或呼吸系统的潜在影响。在猴子中5次每周IV/SC剂量、或6个月的每周IV剂量的BMS-931699之后,下述各项的临床评估无所见:认为与BMS-931699相关的物理、神经学和眼科检查的结果;体温;心率;定性和定量心电图评估;呼吸速率;肺声音和粘膜颜色的评价;和动脉血氧饱和度测定。实施例3:临床前代谢和药代动力学分别在小鼠和食蟹猴中评价BMS1m-74-14982-S60C-P40Br和BMS-908613-P40Br的PK。在静脉内(IV)施用(小鼠中为0.2mg/kg;猴中为0.05和5mg/kg)后,循环中的BMS-1m74-14982-S60C-P40B和BMS-908613-P40B浓度显示双指数下降。小鼠中BMS1m-74-14982-S60C-P40B和BMS-908613-P40B的稳态分布体积(Vss)为(0.13L/kg),大于小鼠中报告的血浆体积,表明药物大部分驻留在细胞外空间。然而,在猴中,BMS-908613-P40B的Vss(0.053L/kg)与报告的血浆体积相似,表明非常有限的血管外分布。小鼠中BMS-1m74-14982-S60C-P40B的血清清除率和猴中BMS-908613-P40B的血浆清除率分别为3.9mL/h/kg和0.82至1.1mL/h/kg。IV施用后的表观消除半衰期(T-HALF)在小鼠中为27小时,在猴中为50至71小时。在单次SC施用(小鼠中为0.2mg/kg;猴中为0.05、0.5和5mg/kg)后,BMS-1m74-14982-S60C-P40B和BMS-908613-P40B被良好地吸收,生物利用度为78%(小鼠)和96至111%(猴)。峰值血浆或血清浓度(Tmax)的时间通常为约24小时(范围=8至36小时)。在SCPK研究(DS09012)中,BMS-908613-P40B在雌性猴中表现出超过剂量比例的暴露增加(在0.05、0.5和5mg/kg,峰值血浆浓度[Cmax]分别为0.335、5.0、和61.9μg/mL,并且从时间零到无穷大的浓度-时间曲线下的面积[AUC(INF)]值分别为43.4、642和6790μg*h/mL)。在随后的猴SCPK/PD研究(DS09013)中,其中猴用卵白蛋白和KLH免疫,在雄性中观察到0.05和5mg/kg之间的线性PK,但是,和研究DS09012中一样,雌性中暴露有超比例增加的趋势,而雄性中没有。在对小鼠腹膜内施用(0.08、0.4和2mg/kg)后,BMS1m74-14982-S60C-P40Br显示出大致与剂量成比例的暴露增加。Tmax为4-9小时。实施例4:首次人体研究:临床药理学与安全BMS-931699的早期临床研究计划包括首次人体(FIH)单递增剂量(SAD)研究(第1部分)以及新抗原免疫SAD研究(第2部分),随后是多递增剂量(MAD)研究。总共156名受试者参加了FIHSAD研究IM128001,包括第1部分中(单递增剂量研究)的108名受试者和SAD第2部分(KLH免疫)中的48名受试者。共有108名受试者接受活性研究药物,48名接受安慰剂。总地来说,BMS-931699在高达100mgIV的单次剂量后是安全的和良好耐受的。没有死亡。没有报告生命体征、身体所见或ECG的临床上相关的变化。在单剂量的BMS-931699之后没有观察到促炎细胞因子的临床上有意义的变化,证实了在人类中缺乏CD28受体激动活性。报道了两例严重不良事件(SAE),但两者均被认为与研究药物无关。这些包括一起急性肾功能衰竭事件和一起阑尾炎事件。在7名受试者中发生急性输注反应;这些事件中3例导致在输注完成之前停止研究药物。所有急性输注反应的强度缓和。在研究药物治疗组和安慰剂组中均报道了孤立的无症状丙氨酸转氨酶(ALT)增加,没有受试者符合Hy's标准。最常见的不良反应(AE)包括头痛,感觉热,口咽疼痛,背痛,瘙痒和上呼吸道感染。在用SC剂量的BMS-931699(6.25mg每隔一周[EOW]、12.5mg每周[QW]或37.5mgQW)或安慰剂(3:1随机化)中治疗5周的24名受试者(3个群组的8名受试者)中进行MAD研究IM128003。如SAD研究中所报道的一样,来自MAD研究的初步结果显示没有CD28激动活性的证据,CD28激动活性由临床上显著的细胞因子释放和/或淋巴细胞变化所定义。在BMS-931699治疗的健康受试者群组(5/18;27.8%)中观察到感染,但在暴露和感染率之间没有观察到相关性。总共,在5名受试者中报道了6起感染,其中4名受试者中的5起感染被认为是相关事件。一名以12.5mg每周方案给药的受试者经历了2次感染发作:在研究的第40天口腔疱疹,7天后发生上呼吸道感染,两起事件的严重性均被界定为轻度。一名以12.5mg每周方案给药的受试者在研究第69天呈现疖(严重性为轻度)。一名以37.5mg每周给药的受试者在第89天呈现中等严重性的扁桃体脓肿,需要抗生素治疗(500mg阿莫西林每日三次[TID],持续10天。一名受试者在每周施用37.5mgBMS-931699后在第81天具有轻度病毒感染,这被认为是不相关的。一名受试者在每2周施用6.25mg后具有严重蜂窝织炎的SAE。该受试者在第49天因其右手第三指根部皮肤损伤后发生蜂窝织炎而要求住院治疗。当住院时,该患者接受IV抗生素治疗,并且手术引流病灶。该SAE在右手的创伤性皮肤损伤之后发生,造成了皮肤完整性的破坏而有助于蜂窝织炎的发展。然而,不能排除BMS-931699可能使受试者对随后的感染更敏感。因此,该SAE被认为可能与研究药物有关。BMS-931699的药代动力学IM128001的药代动力学总结:单递增剂量研究SAD研究IM128001评价在0.01mg至100mg(0.01、0.05、0.25、3、9、25、50和100mg)的剂量范围内在30分钟IV输注后的BMS-931699,以及在9、25、50mg剂量SC给药后的BMS-931699。BMS-931699在单次IV和SC施用后表现出线性PK。IV和SC施用的BMS-931699的Cmax和AUC(INF)在3mg至100mg的范围内与剂量成比例地增加。在健康受试者中,BMS-931699的AUC和Cmax值在3mg至100mg的单剂量IV和9mg至50mg的单剂量SC之后以剂量成比例的方式增加。平均总身体清除率(CLT)、Vz和Vss分别在0.42-0.59L/min、3.4-5.1L、和3.2-4.5L的范围内,并且在单次IV施用后的所有剂量组中相对一致。平均表观总身体清除率(CLT)/F和Vz/F分别在0.59-0.70L/min和6.0-7.3L的范围内,并且在单次SC施用后的所有剂量组中相对一致。在健康受试者中单剂量或多剂量后BMS-931699的T-HALF类似(单剂量为4至5.5天,多剂量为6至7天)。SC施用后的BMS-931699相对AUC(INF)的生物利用度为68.2%。IM128003的药代动力学汇总:多剂量递增研究MAD研究IM128003在三个治疗组中评价BMS-931699:每隔一周6.25mg(3剂),每周12.5mg(5剂)和每周37.5mg(5剂)。在每隔一周和每周SC施用后,BMS-931699的药代动力学在每隔一周6.25mg至每周37.5mg的范围内是线性的。对于6.25mgEOW,12.5mgQW和37.5mgQW,AUC的累积指数的几何平均值分别为1.3、2.4和3。在多次剂量的BMS-931699之后,观察到中值T-HALF为6至7天。平均CL/F(0.345至0.46L/min)与在SAD研究中观察到的一致。MAD中报道的T-HALF与SAD研究相比稍长的原因可能是由于在MAD研究中在末期有更多可测量的浓度数据可用来估计BMS-931699的T-HALF。实施例5:2期临床试验剂量选择理论在一项2期剂量范围研究中,选择四种BMS-931699治疗用于人的初步评估,包括每隔一周1.25mg、每隔一周5mg、每隔一周12.5mg和每周12.5mg。这些给药方案是基于PK/PD关系选择的,使用在匙孔血蓝蛋白(KLH)-抗原攻击后的受体占据率(RO)和IgG抑制作为SLE患者中免疫抑制活性和临床疗效的预测标志。使用基于人MAD数据的受体占据率的PK/PD模型进行模拟,以鉴定出将提供宽范围的受体占据率从而跨越PK-受体占据率曲线的给药方案。这些模拟预测,每隔一周1.25mg,每隔一周5mg,每隔一周12.5mg和每周12.5mg方案在大多数患者的整个给药间隔分别提供大约≥40%,≥70%,≥80%,≥90%的受体占据率(图4)。与每隔一周1.25mg和每隔一周5mg的方案相关的受体占据率的分布落在PK-受体占据率曲线的陡峭部分,而每隔一周和每周方案的12.5mg落在最大值高原部分。临床前猴数据提示,最大免疫抑制(如KLH-抗原攻击后IgG抑制测量的)需要≥80%的受体占用率持续2周,并且当受体水平降低到80%以下时,免疫抑制活性减弱,抗KLH抗体形成上升。单递增剂量(SAD)研究的结果证实了这一假设。在达到约80%受体占据率时,全部治疗组中均观察到近最大IgG抑制。值得注意的是,在最低KLH处理组(9mg)中,当%RO下降到80%以下时,随后有IgG形成的回弹。因此认为引发免疫抑制活性需要高水平的靶点作用,例如80%受体占据率或更大。从6个月的猴研究中测试的最低剂量来看,预期每隔一周给药方案的1.25mg的最低建议剂量的相关暴露非常低(在正常健康志愿者的MAD研究中测试的最低剂量低5倍),具有大的预计安全范围(50X)。每隔一周1.25mg的预测受体占据率分布预期对于整个治疗群体而言会降至低于80%,而对于大多数人类受试者,预期该剂量维持受体占据率高于40%。基于上述80%受体占据率和KLH抑制之间的相关性的发现,预期每隔一周5mg的方案在约50%的患者中会引发≥80%的受体占据率,从而提供一些免疫抑制活性,进而诱导一些临床响应,虽然不是最佳的。此外,从6个月猴毒理学研究中测试的最低剂量看,该给药方案的相关暴露(AUC(TAU))相当低,具有大的预计安全范围(12.7X)。更高的每隔一周和每周12.5mg的剂量预期对于整个治疗群体会提供>80%和>90%的受体占据率,并且预期会引起接近最大的免疫抑制活性,可能导致接近最大的有效响应。与6个月猴研究中测试的最低剂量相比,与这2种方案相关的暴露低得多(5.1X和2.5X)。前述四种剂量的预计暴露处于健康人类受试者的MAD研究中测试的暴露范围内。该POC研究中的最高剂量仍将是MAD研究中的最高剂量的三分之一。实施例6:研究设计和持续时间进行具有自适应设计的2期平行臂随机双盲多中心国际研究。该研究包括一个短期时段,具有两个部分:第1部分(图1)和第2部分(图2);以及一个长期延伸(LTE)时段(图3)。第1部分重点评估安全性和受体占有率。第1部分限于安全性/RO期中分析(IA)中包括的30至50名患者(约6-10名患者/臂)。每个臂的6至10位患者完成28天(4周)的治疗。这些患者在安全性/ROIA之外继续接受研究治疗,治疗进行最长达24周,并且在治疗完成后再追踪6周。共有最多达50名随机受试者接受治疗6个月。如果安全性/ROIA分析表明应该放弃一个或多个臂,则治疗可能会更短。一旦累积安全性概况被认为是可接受的,并且有每群组6-10名受试者给药>28天的受体占有率数据可用,则开启第2部分。将大约300名受试者随机分入本研究部分(根据期中无效性分析的结果,随机分入第2部分的患者数量可能增加)。所有受试者接受筛选评价以确定适格性,并允许在施用其第一剂研究药物之前28天内进行泼尼松(或泼尼松等效物)的剂量下降滴定。剂量可以如下调适:·安全性和受体占据率(RO)期中分析:当每臂约6至10名受试者已达到研究第29天(4周治疗的)时,执行安全性和受体占据率分析。基于该分析的结果,可以调节臂剂量或完全放弃。·当每个臂约30名受试者已达到研究第85天(治疗12周或中止)时,进行无效性期中分析以及根据BICLA响应、SLE应答者指数响应、ACR28和一些SLE生物标志(例如自身抗体,补体水平等)的剂量调适,同时可能进行探索性暴露反应分析。分析由一个非盲的主持者团队(Sponsorteam)进行,而在站点和受试者级别上保持盲目。基于结果,可以修改剂量水平和样本量。·进行中的安全性评估由一个独立的数据监察委员会(DMC)和内部非盲安全监控团队来实施。两个实体可就基于安全性的观察结果,就研究行为和剂量调整给主持者提供建议。长期延伸(LTE)时段是可选的,并且包括已经完成第169天(第24周)治疗并同意参与的合格受试者。这个研究期间仍然是盲目的,但不再有安慰剂臂。合格的受试者保持在其原分配的剂量臂上,除非他们在短期时段是在安慰剂臂上。在第169天(24周)将安慰剂臂重新随机分入现有的活性臂之一。安慰剂受试者的再随机分配通过IVRS进行,并且只有未盲的药剂师/药物制备者知道新的随机化臂。LTE对研究团队和研究人员而言仍然是盲目的。研究的大致持续时间是:短期时段中28天的筛选(4周),168天(24周)的治疗、和42天(6周)的安全随访,总共约238天(34周)。如果受试者适格并且选择继续进入LTE,则在短期时段完成之后完成42天随访,受试者直接进入LTE。如果受试者选择不进入LTE,则在治疗结束42天后完成随访。在撰写本文时,长期延伸时段没有确定的结束日期,然而,上述LTE规定可能基于正在进行的卢立单抗(lulizumab)开发程序的结果进一步调整。在LTE期间中断治疗的受试者在接受其最后一剂研究药物后约6周完成随访。在第1部分或第2部分中随机分配的受试者接受治疗长达24周,并进行相同的程序并遵循相同的访视计划。实施例7:总体风险/效益评估本实施例总结BMS-931699治疗的潜在风险和在临床研究中要求注意的事项。此评估是基于在迄今为止BMS-931699的非临床数据和临床经验,如前述实施例中阐明的。阻断CD28的功能预期会调节免疫应答。免疫应答的调节可能导致易感染。在非临床研究中,没有BMS-913699治疗导致了细菌或病毒感染的证据。迄今为止,已在健康受试者中施用了单一剂量和重复剂量的BMS-931699。基于来自食蟹猴中单一和重复剂量IV和SC非临床毒理学研究的研究结果和来自研究IM128001和IM128003,BMS-931699的临床数据,已经证明安全性可接受,支持继续开发。每周最高建议剂量12.5mg的预期稳定状态下的暴露[AUC(TAU)]比在猴中的6个月毒性研究中的最低测试剂量1mg/kg/周(在此剂量下观察到最小至中度的巨噬细胞空泡化)低约2.5X。该2期研究中的最高剂量是MAD研究中最高剂量的三分之一。在2期的第1部分中全程进行高强度的安全监控,允许及早检测任何安全信号。实施例8:剂量调适如上所述,2期研究以4个方案开始:每隔一周1.25mg,每隔一周5mg,每隔一周12.5mg和每周12.5mg。实施安全性/受体占据率期中分析以确保暴露和受体占据率观察结果接近原始预测。在研究的第1部分中当每个治疗臂至少6名患者达到研究第29天时进行安全性和受体占据率的期中分析(IA)。确认受体占据率观察结果接近最初的预测,并且BMS-931699在SLE患者中得到良好耐受。其余的患者参加研究。基于该期中分析的结果,可以中断最初包括在第1部分中的给药方案和/或可以根据下面概述的标准添加新的给药方案。当根据IA已就要继续进行的给药方案作出决定之后,开启该研究的第2部分的入选工作:安全性安全性分析侧重于所有不良事件(AE),严重AE、和预先确定的特殊关注事件(例如感染AE)的发生率和严重性,和DMC要求的任何其他安全性分析。DMC与非盲内部安全监测团队可能联合要求停止一个或多个剂量,如果满足停止标准或出现其他临床监察员(MedicalMonitor)和/或DMC认为足够值得担忧的安全信号。非盲安全监测小组不参与定期研究活动。受体占据率计算每个治疗臂第29天的中值受体占据率。·如果任何剂量的中值受体占据率<20%,主持者考虑放弃该剂量。·如果所有剂量的中值受体占据率>90%,主持者考虑在研究的第2部分添加或替换一个剂量,以确保有足够的药效学范围(剂量不超过每周12.5mg)。如果受体占据率结果落入上述的参数之外,则考虑减少剂量和/或降低给药频率。该调整出于安全原因进行,或当SLE患者中观察到预料之外的受体占据率概貌时进行。调整剂量和/或频率的决定由临床团队对数据进行审查后作出。受试者不改变剂量。如果臂被修改或删除,随机分配到该臂中的受试者中止。在研究的第2部分,当每个臂30名患者(包括来自第1部分的患者)已完成至少85天治疗期或中止时,进行无效性和剂量调适期中分析。可能由于缺乏疗效而放弃一个或多个治疗臂,或者可以添加治疗臂用于探索次优剂量。可以与该期中分析并行地进行功效和安全性的暴露-响应分析,以帮助为这一附加的较低治疗臂选择剂量。长期延伸时段有期中分析以便于剂量调适。如果鉴定了显著安全问题,一个或多个剂量臂可能被放弃。如果因安全原因放弃一个或多个剂量臂,所有目前接受该一个或多个剂量的受试者停止接受研究药物。实施例9:纳入标准满足系统性红斑狼疮分类的美国风湿病学标准的18至70岁的男性或女性(未在哺乳或怀孕)是适格的(表3)。该分类基于11个标准。为了在临床研究中鉴别患者的目的,如果某人在任何观察间隔期间存在11个标准中的任何4个或更多个,无论是连续(顺序)地或同时(一致)地存在,则该人被认为具有系统性红斑狼疮(SLE)。在第1天给药之前必须满足四个标准才能进入研究。然而,4个标准可能在研究进入时不存在,而是在疾病过程中的某个时间已发生并被记录:表3:1982年修订的系统性红斑狼疮分类标准此外:·受试者在≥1:80的筛选时具有升高的抗核抗体,由中心实验室通过免疫荧光测定测得,和/或由中心实验室测定具有高于正常水平的阳性抗dsDNA和/或抗Sm。(如果中心实验室结果为阴性,并且在现场记录到阳性结果,则允许重复一次中心实验室的值)。·受试者在筛选时也具有系统性红斑狼疮疾病活动指数2000(SLEDAI-2K)评分≥6以适格。分数中至少4分可归因于临床标准,包括以下临床参数中的至少一个:关节炎、皮疹、肌炎、粘膜溃疡、胸膜炎、心包炎、血管炎,且排除来自狼疮性头痛和器质性脑综合征的分数。·在第1天,受试者具有≥4的SLEDAI-2K得分,包括来自以下临床组分中的至少一种的分数:关节炎,皮疹,肌炎,粘膜溃疡,胸膜炎,心包炎,血管炎和发热,且排除需要实验室结果的参数(血尿,尿脓,尿结石,蛋白尿,阳性抗dsDNA,减少的补体,血小板减少和白细胞减少)。排除来自狼疮性头痛和器质性脑综合征的分数。·受试者具有至少一种下列SLE表现,如经修改用于本研究的不列颠群岛狼疮评估组(BILAG)2004标准所定义的:o(1)在皮肤粘膜身体系统中BILAGA或B评分o(2)在肌肉骨骼系统中BILAGA或B评分,由于如下定义的活动性多关节炎:·(a)“BILAGA”:严重关节炎(BILAG#41),在≥2个关节中观察到活动性滑膜炎,伴有明显的运动功能范围丧失,并且显著阻碍日常生活的基本活动,在过去4周内已累积存在数日,包括在筛选访视时。基本ADL定义为需要辅助或辅助装置的以下活动(至少一个必须存在并且在源中记录):离床活动、如厕、梳洗包括洗浴、穿衣、自行进食(对高达10mg/天的类固醇,抗疟药,NSAID无响应)。■(b)“BILAGB”:中度关节炎或腱炎或腱鞘炎(BILAG#42)定义为≥1个关节(观察或通过历史)的腱炎/腱鞘炎或活动性滑膜炎,部分丧失功能运动范围,导致部分丧失功能活动度,表现在对工具性ADL(例如烹饪、驾驶、使用电话或计算机、购物、清洁等)的影响,这在过去4周中的数日中存在,且在筛选时存在。o(3)如果由于关节炎在肌粘膜身体系统或肌肉骨骼身体系统中仅存在一个“B”而无“A”得分,则其他身体系统中必须存在至少一个B,以得到总共2“B”BILAG身体系统得分。除非不耐受,受试者必须当前接受至少一种以下类固醇节用药物至少12周,并且在签署同意书之前接受至少56天(8周)的稳定剂量:硫唑嘌呤(AZA)、氯喹、羟氯喹、甲氨蝶呤(MTX)、来氟米特、霉酚酸酯/霉酚酸。受试者在整个研究中必须保持稳定的剂量。不需要泼尼松(或泼尼松等效物);然而,如果受试者正在服用泼尼松(或泼尼松等效物),则在筛选时剂量不能超过30mg/日受试者方可合格,并且必须在第1天(随机化)之前稳定在最大10mg/日至少5日时间。任何其他免疫抑制或生物药物在进入研究之前需要冲洗期。如果受试者接受非甾体抗炎药(NSAID)(包括市售的COX-2抑制剂),则剂量必须在第1日的第一剂研究药物(随机化)之前稳定14天,并且受试者在研究全程中必须保持相同剂量。注意:若访视时评估BILAG、SLEDAI2K、关节计数、皮肤红斑狼疮疾病面积和严重程度指数(CLASI)和MDGA,则访视前NSAIDS应停药至少12小时。在研究药物施用开始前24小时内,育龄女性患者具有阴性的血清或尿妊娠试验(最小灵敏度25IU/L或等同单位的人绒毛膜促性腺激素)。女性患者不在哺乳。育龄女性患者必须在研究药物治疗持续时间内、加上治疗完成后总共65天[5个研究药物的半衰期(7天)再加30天(排卵周期持续时间)]内使用避孕。与育龄女性患者性活跃的男性必须在治疗持续时间内加治疗完成后共125天时间内[5个研究药物的半衰期(7天)加90天(精子周转持续时间)使用避孕。无精子症的男性和持续没有异性性活动的育龄女性可以免于避孕要求。然而他们仍然必须接受怀孕测试。实施例10:排除标准下列受试者不纳入第二阶段的研究:a)具有药物诱发性SLE,而不是“特发性”SLE的受试者。b)具有其他自身免疫性疾病[例如类风湿关节炎(RA),多发性硬化症(MS)]的受试者。(1型糖尿病,甲状腺自身免疫病和继发性干燥综合征的受试者是适格的)。c)其SLE或SLE样综合征的唯一或主要特征是原发性抗磷脂抗体综合征的受试者被排除在外。但是,具有继发性抗磷脂综合征患者被包括在研究中,除非他们在签署同意书之前一年内发生了严重的血栓性成事件(例如肺栓塞、中风、或深静脉血栓形成)。慢性香豆或依诺肝素用药的患者可以纳入研究。具有下述医学状况、伴发病和病史的受试者不纳入第二阶段的研究:a)在研究药物施用(第1天)的6周内进行过任何大手术的受试者或计划在研究过程中进行的任何非急需(elective)手术。b)具有结核病(TB)的任何历史或风险的受试者,特别是具有以下的受试者:(1)活动性TB的当前临床、放射照相、或实验室证据。(2)过去3年内活动性结核病的病史,除非根据当前的世界卫生组织指南,有记录表明先前的抗结核治疗在持续时间和类型上是合适的。(3)潜伏性TB,定义为在没有临床表现的情况下的阳性定量淋巴结(QFG)或其他诊断测试,除非受试者已经接受至少1个月的异烟肼或当地卫生当局指南推荐的其他试剂治疗,并且干扰素γ释放测定(IGRA)测试,例如QFG或T-Spot,在第1天之前为阴性。(4)在筛选时或在第1天之前3个月内的阳性QFG测试(或其他诊断测试)是可接受的,只要到第1天为止有记录阴性结果。c)具有活动性或不稳定性的狼疮神经精神病学表现的受试者,包括但不限于由BILAG“A”标准定义的任何状况,但多发性单精症和多发性神经病除外,此二者是允许的。d)具有活动性、重度的狼疮性肾炎(WHOIII、IV类),需要或可能需要用细胞毒剂或高剂量皮质类固醇治疗的受试者。患有在先的、受控的肾病,具有高达3g/天的残留蛋白尿或3mg/mg或339mg/mmol的尿蛋白/肌酐比的受试者是允许的。e)患过在筛选前小于2个月消退的带状疱疹的受试者。f)在潜在筛选时具有活动性或潜伏的细菌或病毒感染的证据(由研究者评估)的受试者,包括具有人免疫缺陷病毒(HIV)感染(由HIV-1,-2抗体阳性定义)的证据的受试者。g)目前在服用羟氯喹或氯喹,在筛选6个月内具有视网膜病的证据或在筛选前一年内没有进行眼科评估且不进行该检查,或在参与研究期间不愿意或不能进行常规眼科检查的受试者。h)研究者认为其在研究期间很可能需要额外的全身性糖皮质激素治疗的伴发病(例如哮喘)是排除性的。然而,用吸入性皮质类固醇治疗哮喘的治疗是允许。i)乳腺癌筛查疑似恶性肿瘤,在附加的临床、实验室或其他诊断评价后不能合理地排除恶性肿瘤的可能性的女性受试者。j)在过去五年内具有癌症病史的受试者(除了通过局部切除术治愈的非黑素瘤皮肤细胞癌之外)。现有的非黑素瘤皮肤细胞癌必须在随机化(第1天治疗)之前去除。经过确定性手术介入治疗的原位癌是允许的。k)具有任何急性和/或慢性严重细菌或病毒感染(例如肺炎、肾脏感染和鼻窦炎)的受试者。在第1天(随机化)之前,必须在医疗图表中有消退的记录。g)在研究药物施用的4周内(对于仅血浆,2周内)向血库或在临床研究中(筛选访视除外)捐献血液。h)在研究药物施用的4周内输血。i)不能进行静脉穿刺和/或耐受静脉通路的受试者。j)具有任何显著的药物变应反应(例如过敏反应或肝毒性)的受试者。k)研究者确定的任何其他可靠的医疗、精神病学和/或社会原因。具有以下医学状况、伴发病和病史的受试者不纳入2期研究:a)器官功能障碍,或身体检查、生命体征、ECG或临床实验室检查中任何临床上显著偏离正常,超出与目标人群相符的范围的证据。b)乙型肝炎表面抗原阳性。c)丙型肝炎抗体阳性,具有阳性重组免疫印迹测定(RIBA)或聚合酶链式反应(PCR)。d)白细胞(WBC)<1,200/mm3(1.2×109/L)。e)血小板<50,000/mm3(50×109/L)。f)血红蛋白<8g/dL或<7g/dL,如果由于与SLE相关的溶血性贫血。g)蛋白尿>3.0g/天(3000mg/天)或相当水平的蛋白尿,如通过蛋白质/肌酸酐比率(3mg/mg或339mg/mmol)评估的。h)血清肌酐>2.0mg/dL。i)定义为红细胞(RBC)柱的活动性尿沉渣。j)血清丙氨酸转氨酶(ALT)>2x正常上限(ULN),除非根据研究者的判断是明显与狼疮有关的。k)血清天冬氨酸转氨酶(AST)>2xULN,除非根据研究者的判断是明显与狼疮有关的。l)非法滥用药物的尿液筛查阳性,但如这些药物是由主治医师处方的(必须记录在案)的则除外,且在该国家或地区内并不非法的其他药物除外m)任何其他根据研究人员的意见可能使参与本研究的受试者处于不可接受的风险的实验室检查结果。在研究药物施用之前服用的、在研究中禁用和/或限制性药物描述如下:1)先前暴露于BMS-931699。2)在研究药物给药前1周内使用任何其他药物,包括非处方药物和草药制剂,除了那些由BMS临床监察员审查通过的药物。3)在研究全程内禁止使用环磷酰胺,任何静脉内、任何关节内或生物制剂。4)对于发生中性粒细胞减少(绝对嗜中性粒细胞计数<1.3×103/μL)的受试者,应当中断霉酚酸酯/霉酚酸或根据包装说明书减少剂量。5)在筛选30天内接受过任何活疫苗的受试者。(此外,在最后一次剂量后的2个月内不应使用活疫苗,而任何其他灭活疫苗如破伤风等,如果在治疗期间使用,应根据当地指南使用)。6)计划或预期在研究过程中进行非急需性手术的受试者。在研究期间不施用伴随药物(处方药,非处方药或草药),除非研究者开具这些药物以治疗特定临床事件。实施例11:BMS-931699或安慰剂的施用取决于剂量组,每周一次以溶液形式皮下(SC)单次注射施用BMS-931699或外观相似的安慰剂。临床标签反映产品名称为“BMS-931699-01”以与小瓶上的产品描述相关联。BMS-931699-01注射液的组成为:含5%(w/v)山梨醇的20mM磷酸盐,pH5.9中的12.5mg/mLBMS-931699。BMS-931699-01注射剂包装在具有13mm开口、1块标签牌、开放标签的3cc小瓶中。BMS-931699-1注射液呈现澄清至微乳白色,无色至浅黄色的溶液。BMS-931699-01注射液冷藏在2-8℃(36-46°F)。下表4表示每个剂量组的每剂的总剂量和小瓶数。表4:治疗施用治疗每日总剂量配方力量小瓶数11.25mgSCEOW12.5mg/mL125mgSCEOW12.5mg/mL1312.5mgSCEOW12.5mg/mL1412.5mgSC每周12.5mg/mL15安慰剂安慰剂生理盐水(NSS)对于皮下(SC)给药,对于12.5mg的剂量不需要稀释药物产品溶液(12.5mg/mL)。然而,5mg和1.25mg的剂量需要稀释。使用21号,1.5英寸(3.8cm)无菌针从小瓶中抽取该产品,使用27号,0.5英寸(1.3cm)无菌针用于SC给药。使用适当尺寸的常规的市售聚碳酸酯注射器用于抽取和施用。在抽取产品到适当大小的注射器中后,在4小时内施用。如果不立即给药,填充好的注射器避光保持在2°-8℃(36°-46°F)备用。用于BMS-931699注射的安慰剂是生理盐水溶液,其以与针对BMS-931699注射描述的类似的方式施用。研究人员将剂量施用给受试者。在第1天,将受试者以1:1:1:1:1随机化方案随机分配至表4中的给药组之一。在第1天的早上,每个受试者接受单一SC剂量的BMS-931699或安慰剂。主要注射点是上臂之一。然而,其他注射点也是可接受的。目前没有已知的与BMS-931699相关的食物和流体摄入的限制。要求每名随机化的受试者每周都到诊所/研究中心接受给药。这确保双盲的维持,无论给药方案如何不同。随机分配到每周皮下注射安慰剂或BMS-931699的受试者按照时间表每周给药,而随机化分配到每隔一周的臂之一的受试者一周接受皮下注射BMS-931699、下一周接受皮下注射安慰剂,如此交替。实施例12:生物标志在研究中纳入药效学、靶点作用和疾病相关的生物标志测定,以指导剂量选择、监测功效,以及可能地预测治疗响应。抽取血液和尿液用于测量BMS-931699的靶点作用和药效学效应的标志,包括CD28受体占据率、C3、C4和自身抗体。研究中纳入靶点作用,如通过T细胞上的CD28受体占据率所评估的,以指导3期研究的剂量选择、监测功效并且可能地预测治疗反应。表征BMS-931699的浓度水平与CD28受体占据率之间的关系。其他生物标志包括:其他细胞因子和趋化因子、抗双链脱氧核糖核酸(抗dsDNA)、抗核抗体(抗ANA)、抗-Ro(也称为抗SSA、抗SSA/RO或抗Ro/SSA)自身抗体、抗狼疮(抗-La)(也称为抗Sjggren综合征B型抗原(抗SS-B))自身抗体、抗核糖核蛋白(抗RNP)自身抗体、抗Sm核抗原自身抗体、抗APL自身抗体和其他自身抗体。C反应蛋白(CRP)、总免疫球蛋白G(IgG)、总免疫球蛋白M(IgM),全血中的RNA转录物,尿中的蛋白质(NGAL,TWEAK,MCP-1,IL-18,IL-1)、总可溶性CD28、T细胞活化、外周血单个核细胞(PMBC)和全血中的白细胞表型(表面CD4、表面CD8、表面CD28、表面CD57、和细胞内颗粒酶B)、可溶性炎症介质(血清IL-6、IL-18、TNF-α、α-干扰素、BLyS(BAFF),CD154、sCD28和其他可溶性受体,微囊泡)也可以用作生物标志。与SLE相关的一些药效学终点表征如下:基于血液的(RNA)评估在指定的时间收集全血核糖核酸(RNA)样品到PAX基因管中。这些样品提供广泛的基因组概貌,用以寻找与炎症和/或自身免疫途径相关的新的药效学和功效生物标志。此外,使用这些样品在基线搜索可预测BMS-931699治疗的受试者的功效的基因表达。白细胞表型分型收集外周血用于通过流式细胞术免疫表型分型。可以表征T细胞的活化和亚群。标志可以包括,但不限于,表面CD4、CD8、CD28、CD57和细胞内颗粒酶B的组合。可以分析其它外周细胞,包括B细胞、单核细胞/巨噬细胞、树突细胞和NK细胞。尿生物标志收集尿液并分析SLE和其它炎性病症的标志。分析样品的炎症标记物(包括但不限于IL-18,IL-1,NGAL,uTWEAK,MCP-1)的蛋白质组概貌。进行探索性分析以鉴定生物标志,用以监测肾脏受累的患者的PD和对治疗的响应。外周血清和血浆生物标志收集血清和血浆用于测量与炎症、SLE或共刺激阻断相关的可溶性炎症介质(包括但不限于血清IL-6、IL-18、TNF-α、α-干扰素、BLyS(BAFF)、CD154、sCD28和其他可溶性受体,微囊泡)。进行探索性分析以鉴定SLE的生物标志,并监测PD和BMS-931699对炎症途径的影响。结果研究评估受试者完成慢性疾病治疗疲劳功能评估(FACIT-F)、FDA短表36调查问卷(SF-36)、和受试者的疾病活动全面评估(PGA)。这些页面是本研究中的源文档。所有结果研究评估应在预定的到场访视施用研究药物之前完成。探索性功效结果量度健康相关的生活质量SF-36用于度量健康相关的生活质量。计算个体子量表得分和两个总结得分:(1)身体成分汇总(physicalcomponentsummary,PCS)包括身体功能、角色-身体、身体疼痛和一般健康;(2)心理成分汇总(MCS),包括活力、社会功能、角色情感和心理健康。SF-36是一种广泛认可的工具,FDA认可其为一种经过验证的用于测量多种疾病状态下健康相关的生活质量的手段。疲劳疲劳由FACIT-F评估。FACIT-F是一种以疲劳为重点的与健康相关的生活质量问卷。FACIT-F包括以下组成部分:身体健康,社会/家庭福利,情绪健康,功能健康和其他关心的问题。已经参考其具体实施例具体示出和描述了本文所阐述的公开内容。本领域技术人员将理解,在不脱离所附权利要求所涵盖的范围的情况下,可以在形式和细节上进行各种改变。序列表<110>百时美施贵宝公司<120>使用针对CD28的域抗体治疗系统性红斑狼疮的方法<130>12394-WO-PCT<150>62/057981<151>2014-09-30<160>15<170>PatentInversion3.5<210>1<211>11<212>PRT<213>人工序列<220><223>SyntheticPeptide<400>1ArgAlaSerArgProIleTrpProPheLeuGlu1510<210>2<211>7<212>PRT<213>人工序列<220><223>合成肽<400>2PheThrSerArgLeuArgHis15<210>3<211>9<212>PRT<213>人工序列<220><223>合成肽<400>3LeuGlnAsnValAlaAsnProAlaThr15<210>4<211>108<212>PRT<213>人工序列<220><223>合成肽<400>4AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerArgProIleTrpProPhe202530LeuGluTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrPheThrSerArgLeuArgHisGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysLeuGlnAsnValAlaAsnProAla859095ThrPheSerGlnGlyThrLysValGluIleLysArg100105<210>5<211>108<212>PRT<213>人工序列<220><223>合成肽<400>5AspIleCysMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerArgProIleTrpProPhe202530LeuGluTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrPheThrSerArgLeuArgHisGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysLeuGlnAsnValAlaAsnProAla859095ThrPheSerGlnGlyThrLysValGluIleLysArg100105<210>6<211>108<212>PRT<213>人工序列<220><223>合成肽<400>6AspIleGlnMetThrGlnSerProCysSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerArgProIleTrpProPhe202530LeuGluTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrPheThrSerArgLeuArgHisGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysLeuGlnAsnValAlaAsnProAla859095ThrPheSerGlnGlyThrLysValGluIleLysArg100105<210>7<211>108<212>PRT<213>人工序列<220><223>合成肽<400>7AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspCysValThrIleThrCysArgAlaSerArgProIleTrpProPhe202530LeuGluTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrPheThrSerArgLeuArgHisGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysLeuGlnAsnValAlaAsnProAla859095ThrPheSerGlnGlyThrLysValGluIleLysArg100105<210>8<211>108<212>PRT<213>人工序列<220><223>合成肽<400>8AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerArgProIleTrpProPhe202530LeuGluTrpTyrGlnGlnLysProCysLysAlaProLysLeuLeuIle354045TyrPheThrSerArgLeuArgHisGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysLeuGlnAsnValAlaAsnProAla859095ThrPheSerGlnGlyThrLysValGluIleLysArg100105<210>9<211>108<212>PRT<213>人工序列<220><223>合成肽<400>9AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerArgProIleTrpProPhe202530LeuGluTrpTyrGlnGlnLysProGlyCysAlaProLysLeuLeuIle354045TyrPheThrSerArgLeuArgHisGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysLeuGlnAsnValAlaAsnProAla859095ThrPheSerGlnGlyThrLysValGluIleLysArg100105<210>10<211>108<212>PRT<213>人工序列<220><223>合成肽<400>10AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerArgProIleTrpProPhe202530LeuGluTrpTyrGlnGlnLysProGlyLysAlaProCysLeuLeuIle354045TyrPheThrSerArgLeuArgHisGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysLeuGlnAsnValAlaAsnProAla859095ThrPheSerGlnGlyThrLysValGluIleLysArg100105<210>11<211>108<212>PRT<213>人工序列<220><223>合成肽<400>11AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerArgProIleTrpProPhe202530LeuGluTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrPheThrSerArgLeuArgHisGlyValProCysArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysLeuGlnAsnValAlaAsnProAla859095ThrPheSerGlnGlyThrLysValGluIleLysArg100105<210>12<211>108<212>PRT<213>人工序列<220><223>合成肽<400>12AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerArgProIleTrpProPhe202530LeuGluTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrPheThrSerArgLeuArgHisGlyValProSerArgPheSerGly505560SerGlySerGlyThrCysPheThrLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysLeuGlnAsnValAlaAsnProAla859095ThrPheSerGlnGlyThrLysValGluIleLysArg100105<210>13<211>108<212>PRT<213>人工序列<220><223>合成肽<400>13AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerArgProIleTrpProPhe202530LeuGluTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrPheThrSerArgLeuArgHisGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuCysIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysLeuGlnAsnValAlaAsnProAla859095ThrPheSerGlnGlyThrLysValGluIleLysArg100105<210>14<211>108<212>PRT<213>人工序列<220><223>合成肽<400>14AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerArgProIleTrpProPhe202530LeuGluTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrPheThrSerArgLeuArgHisGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuCysPro65707580GluAspPheAlaThrTyrTyrCysLeuGlnAsnValAlaAsnProAla859095ThrPheSerGlnGlyThrLysValGluIleLysArg100105<210>15<211>108<212>PRT<213>人工序列<220><223>合成肽<400>15AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerArgProIleTrpProPhe202530LeuGluTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrPheThrSerArgLeuArgHisGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysLeuGlnAsnValAlaAsnProAla859095ThrPheSerGlnGlyThrCysValGluIleLysArg100105当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1