使用液体潴留的预测因子治疗CKD的方法与流程
现有技术
本申请要求2014年11月7日提交的美国临时申请no.62/077,108的优先权,其全文经此引用并入本文。
领域
本公开大体上涉及基于液体潴留的预测因子治疗慢性肾病(ckd)的方法。本公开还涉及基于液体潴留的预测因子治疗糖尿病肾病的方法。
背景
多于25%的糖尿病具有一定程度的蛋白尿,这造成慢性肾病的进展。目前,尽管开发出抑制肾素-血管紧张素轴系统(raas)并减慢肾病进展的药剂,但仍然存在降低蛋白尿和进一步减慢疾病进展的明显未满足的医疗需求。对于接受有效剂量的raas抑制剂如血管紧张素转化酶抑制剂(acei)或血管紧张素受体阻断剂(arbs)的患者,如通过尿白蛋白/肌酐比值(uacr)的降低测得的蛋白尿的降低与“严重后果(hardoutcome)”肾事件,如血清肌酐倍增、终末期肾病(esrd)时间和死亡的发生率的降低相关联。
尽管临床研究已表明内皮素受体拮抗剂(etras)可降低患有肾病的高血压患者的血压,但etras以及eta和etb受体之一或两者的拮抗剂已知造成液体潴留。液体潴留是与之前研究的etras相关的常见副作用。对于一些之前研究的etras观察到的水肿率导致停止针对蛋白尿或其它疾病状态研发这些etras。因此,在使用etras时以在限制外周性水肿和液体潴留的发生率的同时降低尿蛋白排泄量的方式寻求所需肾保护作用和临床安全性之间的平衡。
例如,针对顽固性高血压的治疗研究etra达卢生坦(darusentan)。weber(weber,m.等人,lancet,374:1423-31(2009))在全世界多地进行的关键双盲研究招收379名收缩压高于140mmhg的个体,他们接受全剂量的至少三种降血压药,包括利尿剂。患者被随机分配接受安慰剂或达卢生坦(50mg、100或300mg),每天摄入一次。该研究中的几乎所有患者都接受一种形式的raas抑制剂,几乎四分之三接受钙-通道阻断剂,大约三分之二接受β-阻断剂,99%的患者接受全剂量的这些药物。此外,几乎所有患者接受某一形式的利尿疗法,其中使用利尿剂的患者大部分(83%)接受每天25mg剂量的氢氯噻嗪。
在治疗14周后,达卢生坦的加入与分别约10mmhg和5mmhg的与安慰剂治疗相比收缩和舒张临床坐位血压的非剂量依赖性下降相关联。在该研究中在27%的使用达卢生坦的患者和14%的使用安慰剂的患者中报道了水肿和/或液体潴留。尽管在联合达卢生坦治疗组中只有四名患者(2%)由于液体潴留或外周性水肿不得不中止参与该研究,五名摄入达卢生坦的患者发生心脏相关的严重不良事件(两名患者具有心肌梗死,一名患者具有心房颤动和两名患者具有突发充血性心力衰竭)。在安慰剂组中发生一例猝死事件。
在研究使用另一etra,阿伏生坦(avosentan)降低糖尿病患者的蛋白尿的试验中观察到类似的并发症。具体而言,mann等人(mannj.等人,j.am.soc.,nephrolo.21:527-535(2010))在多中心、多民族双盲安慰剂对照试验中研究了阿伏生坦对显性糖尿病肾病的进展的影响。在这一研究中,随机分配1392名患有2型糖尿病的参与者以接受阿伏生坦(25或50mg)或安慰剂。所有患者继续用ace抑制剂或arb药剂治疗。在中位数为4个月的随访后,使用阿伏生坦的过多心血管事件导致该研究提前终止。尽管阿伏生坦显著降低uacr(中位数下降阿伏生坦25mg为44%,阿伏生坦50mg为49%的,与此相比安慰剂仅为9.7%),但阿伏生坦发生显著增加的归因于不良事件的试验用药终止(阿伏生坦25mg为19.69%,阿伏生坦50mg为18.2%,与此相比安慰剂仅为1.5%)。造成阿伏生坦的研究中断的不良事件主要与液体过剩和充血性心力衰竭相关。安慰剂有12例死亡,阿伏生坦25mg有21例死亡,阿伏生坦50mg有17例死亡。
波生坦(bosentan)治疗与在enable和reach-1试验中在前4-8周内充血性心力衰竭(chf)的早期恶化相关联,这被认为是液体潴留的后果。在earth和heat-chf试验中,达卢生坦在以较高剂量给药时倾向于使chf恶化。
静脉替唑生坦(tezosentan)在大于1mg/hr的剂量下降低急性chf患者的尿排出量,由此限制临床疗效。
安立生坦(ambrisentan)(1-10mg/天)与水肿(25%发生率)相关联。
司他生坦(sitaxsentan)在较高剂量下显著造成水肿;而较低剂量(每日100或300mg)具有较低的造成水肿的倾向。
阿曲生坦(atrasentan)是之前研究用于治疗前列腺癌的强效选择性etra。在详细评估临床前结果后,阿曲生坦被评估用于治疗残留蛋白尿。关键目标是平衡全身效应,这会造成显著不可接受的副作用,如水肿,和对尿白蛋白肌酐比值(uacr)的疗效影响。随后,在具有与糖尿病肾病相关的残留蛋白尿的患者中研究阿曲生坦。
在未接受肾素-血管紧张素系统(rsa)抑制剂的11名患有1型糖尿病和蛋白尿的受试者中的双盲安慰剂对照二期交叉研究(在本文中被称作研究m96-499)中,阿曲生坦每日5mg(qd)导致尿白蛋白排泄减少65%。平均动脉血压(bp)也降低,但在bp变化和蛋白尿降低之间只有弱相关性。在阿曲生坦组中最常发生的治疗紧急不良事件是外周性水肿(64%)、肺水肿(18%)、鼻炎(36%)和头痛(18%),而在安慰剂组中没有外周性水肿,但有鼻炎(11%)和头痛(56%)的报道。
由于在肿瘤学程序和研究m96-499中观察到液体潴留和外周性水肿,考虑使用低于2.5mg的剂量以限制水肿率。在尝试限制液体潴留和水肿的同时,基于受体结合数据评估后续研究的剂量。
在2a期的双盲、随机化、安慰剂对照研究(在本文中称作m10-815)中,给予接受稳定剂量的ras抑制剂的患有2型糖尿病和蛋白尿的受试者0.25、0.75或1.75mgqd的阿曲生坦hcl8周。尽管该研究的结果证实对于摄入0.75mgqd(42%下降,1侧p=0.023)和1.75mgqd(35%下降,1侧p=0.073)的受试者平均uacr从基线下降,但与安慰剂中仅9%相比,许多受试者发生轻度至中度外周性水肿--在0.75mgqd阿曲生坦剂量组中18%和在1.75mgqd阿曲生坦剂量组中46%。接受0.25mgqd的受试者只有14%发生轻度至中度外周性水肿,但与接受安慰剂的受试者(11%下降)相比,这些受试者具有21%(p=0.291)的不显著平均uacr下降。此外,0.75mg组中的一名具有易患心力衰竭倾向的受试者经受急性心力衰竭事件并退出该研究。
因此,以降低水肿风险的方式给予etras的方法会提供显著益处。
概述
本文中公开的临床分析显示,估算肾小球滤过率(egfr)、血压、糖化血红蛋白浓度(hba1c)和稳态模型评估法(homa-结果(product))是由etra给药造成的液体潴留的有用预测因子。
本公开提出用etra如阿曲生坦或另一选择性eta受体拮抗剂治疗慢性肾病的方法,所述方法包括测量患有慢性肾病的对象的egfr、血压、hba1c或homa-结果的一个或多个;基于测量结果确定如果给予所述对象etra的液体潴留风险;和如果风险在可接受的水平则给予所述对象etra。
另外,本公开提出用etra如阿曲生坦或另一作为选择性eta受体拮抗剂的etra治疗糖尿病肾病的方法,所述方法包括测量患有糖尿病肾病的对象的egfr、血压、hba1c或homa-结果的一个或多个;基于测量结果确定如果给予所述对象etra的液体潴留风险;和如果风险在可接受的水平则给予所述对象etra。
本公开还提出用内皮素受体拮抗剂(etra)治疗慢性肾病、糖尿病肾病或两者的方法,包括给予需要治疗慢性肾病、糖尿病肾病或两者的对象ras抑制剂;测量对象的egfr、血压、hba1c或homa-结果的一个或多个;基于测量结果确定如果除ras抑制剂外还给予所述对象etra的液体潴留风险;和如果风险在可接受的水平则给予所述对象etra。在一些实施方案中,在所述测量步骤之前已给予所述对象ras抑制剂至少四周,和/或在所述测量步骤之前已给予所述对象最大容许标示日剂量(mtldd)的ras抑制剂至少四周。上述方法还可进一步包括基于所述测量步骤调节已给予所述对象的利尿剂的量或频率和基于所述测量步骤和利尿剂的调节而确定给予所述对象etra的风险的步骤。
在上述方法中,所述风险是给予所述对象etra两周后的液体潴留风险。在一些实施方案中,液体潴留风险是给予所述对象etra两周后对象具有大于或等于2公斤的体重增加的风险,和/或给予所述对象etra两周后对象具有大于或等于1.3g/dl的血红蛋白降低的风险。
在上述方法中,etra可以是选择性eta受体拮抗剂,如阿曲生坦或其可药用盐。
可接受的风险可以由临床医师根据对象的治疗需求权衡液体潴留风险而确定。可以手动或自动确定风险水平,如利用使用egfr、血压、hba1c和/或homa-结果作为输入计算液体潴留风险水平的算法。可以基于一个参数或基于参数的组合确定风险水平。例如,可以基于egfr、血压、hba1c或homa-结果的两个或更多个,或基于egfr、hba1c或两者确定风险水平。
在一些实施方案中,上述方法进一步包括获得来自对象的生物样品(例如尿或血液)并使用该生物样品测量参数之一(例如egfr或hba1c)。在一些实施方案中,将测量结果与egfr、血压、hba1c或homa-结果的预定值相比较,这些预定值与液体潴留的可接受风险相关联。预定值可以是可接受的风险水平值、不可接受的风险水平值或两者。
在一些实施方案中,当临床医师基于egfr、血压、hba1c或homa-结果的测量结果确定液体潴留风险不可接受时,不给予etra疗法。在一些实施方案中,如果液体潴留风险相对较高,临床医师可以调节给予对象的疗法以使不可接受的液体潴留风险变成可接受的风险,如通过给予利尿剂、增加对象已摄取的利尿剂的剂量(如量或频率)或改变对象摄取的利尿剂。
附图简述
图1描绘经12周的阿曲生坦或安慰剂给药uacr、体重、血红蛋白和血细胞比容与基线相比的变化。
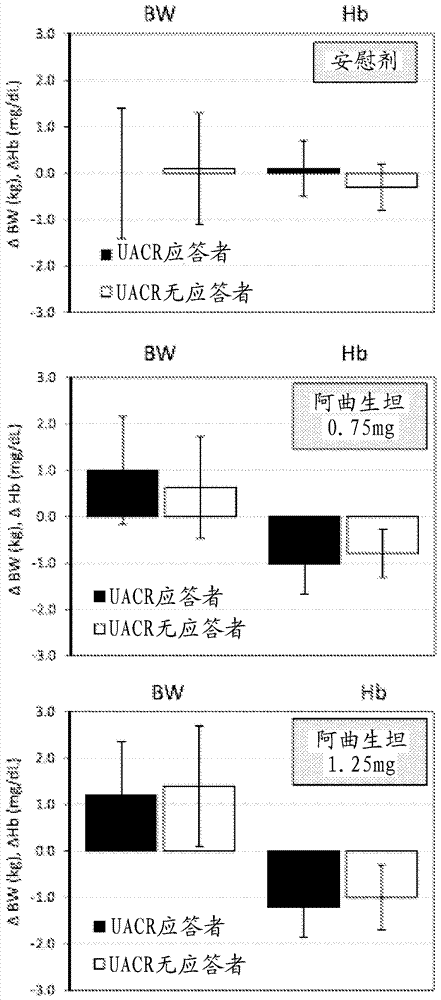
图2基于对象是否表现出大于30%的uacr应答描绘体重、血红蛋白和血细胞比容的变化。
详述
这一节中和本文的整个公开内容中所用的节标题无意构成限制。
除非上下文清楚地另行规定,本文所用的单数形式“一(a、an)”和“该(the)”包括复数指示对象。关于本文中的数值范围的描述,明确考虑它们之间的具有相同精度的各中间值。例如,对于范围6-9,除6和9外还考虑数值7和8,对于范围6.0-7.0,明确考虑数值6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9和7.0。
本文所用的术语“约”与术语“大约”同义使用。直观地说,术语“约”的使用是指数值略微偏离所列数值,即+或-10%。引用术语“约”和“大约”的权利要求的范围因此包括这样的剂量。
术语“给予(administer,administering,administered)”或“给药(administration)”是指向对象或患者提供药物(如阿曲生坦或其可药用盐)的任何方式。可以通过本领域技术人员已知的任何手段实现给药途径。这样的手段包括,但不限于,口服、含服(buccal)、静脉、皮下、肌内、透皮、吸入等。
术语“阿曲生坦”是指具有下示结构的(2r,3r,4s)-4-(1,3-苯并二氧杂环戊烯-5-基)-1-[2-(二丁基氨基)-2-氧代乙基]-2-(4-甲氧基苯基)吡咯烷-3-甲酸:
及其盐,如阿曲生坦的hcl盐。制备阿曲生坦的方法例如描述于美国专利nos.6,380,241、6,946,481、7,365,093、5,731,434、5,622,971、6,462,194、5,767,144、6,162,927和7,208,517,它们的内容经此引用并入本文。使用血管紧张素转化酶(ace)抑制剂和血管紧张素受体阻断剂(arbs)的etras治疗方案公开于美国专利nos.8,623,819和8,865,650,它们经此引用并入本文。
活性剂的“有效量”或“治疗有效量”是指无毒但足以提供所需效果的活性剂的量。“有效”的活性剂的量随对象而变,取决于个体的年龄和一般状况、特定的一种或多种活性剂等。因此,并非总是可以指定确切的“有效量”。但是,本领域普通技术人员可以使用常规实验确定任何个例中的适当“有效量”。
如在“可药用赋形剂”或“可药用添加剂”的描述中的“可药用”是指不是生物学上或其它方面不合意的材料,即,该材料可并入给予患者的药物组合物中而不造成任何不合意的生物效应。
术语“对象”是指动物。在一个方面中,该动物是哺乳动物,包括人类或非人类。术语患者和对象在本文中可互换使用。
术语“治疗(treating,treatment)”是指降低症状的严重程度和/或频率、消除症状和/或基本成因、防止出现症状和/或它们的基本成因,以及改善或补救损伤。因此,例如,“治疗”患者涉及预防易感个体中的特定障碍或不良生理事件以及通过抑制障碍或疾病或使其消退而治疗有临床症状的个体。
进行二期2b、多中心、前瞻性、随机化、双盲、安慰剂对照、12周研究以评估阿曲生坦与安慰剂相比在降低残留蛋白尿方面的效力和安全性。以0.75mgqd和1.25mgqd的剂量研究阿曲生坦。研究方法相同,但分地点(nct01356849在美国、加拿大和台湾;nct10424319在日本)。另外的临床细节可见于kohan,de等人,“predictorsofatrasentan-associatedfluidretentionandchangeinalbuminuriainpatientswithdiabeticnephropathy”,clinjamsocnephrol,2015年9月,10:1568-1574,其全文经此引用并入本文。
体重变化和血红蛋白变化的观察可用作液体潴留变化的替代指标。
安慰剂和阿曲生坦0.75和1.25mg/d组(arms)之间的人口学参数类似(表1)。在该表内使用下列缩写:bnp=b型利钠肽;dbp=舒张压;egfr=估算肾小球滤过率;hba1c=糖化血红蛋白;ras=肾素-血管紧张素系统;sbp=收缩压;uacr=尿白蛋白/肌酐比值。表1部分复制自dezeeuwd等人,theendothelinantagonistatrasentanlowersresidualalbuminuriainpatientswithtype2diabeticnephropathy.jamsocnephrol25:1083-1093,2014,其全文经此引用并入本文。除非另行规定,表1中的数值是平均值±标准偏差。
表1
表2描绘随时间经过测量/计算参数的变化。
表2
表2显示在治疗2周后体重增加大约1公斤,与此相比,安慰剂组降低大约1公斤。尽管在阿曲生坦治疗组中在30天恢复期间体重下降1-2公斤,但安慰剂组中体重不变。血红蛋白(hb)在两个阿曲生坦组中在2周治疗后都降低大约1g/dl,并且这些降低在整个治疗期持续。hb到治疗停止后30天标准化,表明由血液稀释造成阿曲生坦相关的hb降低。尽管接受阿曲生坦的患者体重增加,在b-利钠肽(bnp)中没有观察到显著变化。在整个研究中治疗组间的利尿剂剂量变化类似(安慰剂、0.75mg/天和1.25mg/天组分别为4%、5%和8%)。
表3显示在阿曲生坦治疗两周后体重和血红蛋白变化的潜在独立基线预测因子的列表。
表3
表3中所用的缩写包括bp=血压;egfr=估算肾小球滤过率;hba1c=糖化血红蛋白;homa=稳态模型评估法。在初始后向选择模型中包括下列协变量:治疗分配(treatmentassignment)、年龄、性别、体重、hb、egfr、蛋白尿、收缩压(bp)、egfr、对数变换稳态代谢评估法(homa)结果、对数变换b-型利钠肽(bnp)、噻嗪类和袢利尿药使用。收缩压和阿曲生坦剂量分别不包括在体重和血红蛋白的最终逻辑回归模型中。
表3证实在阿曲生坦治疗2周后的体重增加的基线预测因子包括0.75或1.25mg/天的阿曲生坦剂量vs安慰剂、较低egfr、较高糖化血红蛋白(hba1c)、较高收缩压和较低homa结果。基线egfr每低10ml/min,体重高0.2(0.1-0.3)kg。hba1c每低一个百分比,体重增加0.2(0.1-0.4)kg。基线收缩压每低10mmhg,体重高0.1(0.0-0.3)kg。预测大于或等于2公斤体重增加的因子的逻辑回归分析(分布的上四分位数)显示大于或等于2公斤体重增加的让步比(odds)在阿曲生坦0.75和1.25mg/天组中分别是3.0(1.0-8.5)和6.6(2.3-18.6)倍(图1,板块a)。逻辑回归中的决定因子类似于线性回归模型中的那些。
表3还公开了在阿曲生坦治疗2周后的hb变化的基线预测因子包括0.75或1.25mg/天的阿曲生坦剂量vs安慰剂、egfr、hb和体重。预测大于或等于1.3g/dl的hb下降的因子的逻辑回归分析(联合阿曲生坦0.75和1.25mg/天组的分布的上四分位数)显示阿曲生坦1.25mg/天vs安慰剂的让步比增加到5.6(2.5-12.7)倍(但0.75mg/天组没有显著相关性)和基线egfr每低10ml/min,0.6(0.2-0.9)倍的让步比。还观察到与基线体重和hb的小但显著的相关性。基线bnp与体重或hb的变化没有关联。
基于这一分析,可以基于测量egfr、血压、hba1c或homa-结果的一个或多个预测如果给予对象etra,如阿曲生坦的液体潴留风险。临床医师可以在开出或给予etra之前使用该测量结果确定特定对象的液体潴留风险是否可接受。
表4显示在安慰剂或阿曲生坦治疗2周后血红蛋白和体重变化与尿白蛋白/肌酐比值变化之间的相关性。
表4
阿曲生坦剂量和egfr是第2周血红蛋白变化的预测因子。此外,基线血红蛋白和体重预测第2周血红蛋白变化。
在第2周体重和血红蛋白变化与蛋白尿变化之间观察到弱相关性。r2值在0.005至0.07之间,表明只有0.5%至7%的蛋白尿应答变异性通过体重变化解释。在uacr变化和体重变化之间没有检测到相关性。在摄取安慰剂或阿曲生坦0.75或1.25mg/天的对象中在第2周在uacr变化和体重变化之间没有看出相关性。r2值显示4%至6.9%的蛋白尿应答变异性通过hb的应答解释。
在用阿曲生坦治疗2周后在uacr应答者(uacr降低>30%)和无应答者(uacr降低<30%)之间比较体重或hb变化。在接受任一阿曲生坦剂量的对象中,在uacr应答者和无应答者之间在体重或血红蛋白变化中没有检测到差异(见图2)。
这些数据一起显示在2型糖尿病肾病患者中通过初始egfr、血压和血糖控制预测阿曲生坦诱发的液体潴留。uacr降低不是液体潴留的预测因子。因此,那些基线测量结果是液体潴留的预测因子是令人惊讶的和不可预测的。此外,对阿曲生坦治疗观察到的液体潴留与观察到的蛋白尿降低效果无显著相关。
- 还没有人留言评论。精彩留言会获得点赞!