一种适用于动脉血管的具有锥度的生物可降解血管支架的制作方法
本发明属于植入人体的医疗器械领域,具体涉及一种适用于动脉血管的具有锥度的生物可降解血管支架。
背景技术:
闭塞性下肢动脉硬化症和糖尿病下肢动脉闭塞症是最常见外周血管疾病之一,70岁以上的人群发病率在10%-20%以上。目前,髂动脉及股浅动脉腔内治疗已日益成熟,股动脉-膝关节以上腘动脉自体血管搭桥术仍然是股浅动脉长段闭塞疾病治疗的金标准,而以新型载药球囊和载药金属支架为代表的腔内技术则成为了血管外科技术革命的焦点,在中短段狭窄或闭塞性病变中获得了不劣于传统搭桥手术的疗效,并以其微创、安全的优势成为了大部分股浅动脉病变患者的首选治疗方案。
腘动脉为股动脉在内收肌管出口的延续,位置较深,邻贴股骨腘面及膝关节囊后部,沿半腱肌外缘向外斜行,至股骨髁问窝水平居膝后中部,而后垂直向下达腘肌下缘,分为胫前动脉和胫后动脉。腘动脉可分为三段,内收肌管出口腘动脉起始点至髌骨上缘平面为P1段,髌骨上缘平面至胫骨内外侧髁连线平面为P2段,胫骨内外侧髁连线平面以下至分出胫前动脉处终点为P3段。
腘动脉病变、尤其是髌骨下缘以下的腘动脉P2、P3段的病变,无论是跨膝关节的自体血管搭桥术,或者球囊/支架腔内成形术,其治疗效果仍然远远逊色于股浅动脉病变。究其原因,其一是腘动脉走行于人体膝关节后面,在膝关节屈曲-伸直运动中,腘动脉存在多种弯曲形态,而据研究显示,在超过75%的情况下,膝关节屈曲运动中腘动脉弯曲的拐点均位于P2段;而且,由于P2段腘动脉游离度最大,而P3段则因为肌肉的存在而游离最小,在动脉弯曲出现拐点的同时还有有动脉的短缩、扭曲等存在。因此,跨膝关节放置的血管支架承受了与其他解剖部位完全不同的弯曲、拉伸、扭转应力,急性血栓形成、支架断裂等严重并发症发生率高。
腘动脉自身的解剖特点更加凸显了传统外周血管支架的劣势。传统外周血管支架总体呈等直径的圆柱性,而动脉血管则是呈自近心端至远心端直径逐渐减少的趋势。在主动脉、髂动脉、股浅动漫等走行较长的动脉血管,由于动脉血管走行较长,相对而言局部动脉直径的改变不大,加之动脉血管自身的弹性和可塑性,等直径的传统外周血管支架能基本满足这些血管的需要。腘动脉延续至较为粗大的股浅动脉,跨膝关节后至腘肌水平迅速分为胫前动脉及胫后动脉,血管直径变化明显。
技术实现要素:
本发明提供了基于动脉解剖生理特点的一款适用于动脉血管的具有锥度的生物可降解血管支架。
腘动脉自收肌腱裂孔始、至胫前动脉分出处止,其全长为20.2±2.6cm,自收肌腱裂孔至股骨髁下缘水平长度为14.0±2.1cm,而自股骨髁下缘水平至胫前动脉分出处长度为6.2±0.8cm;而直径变化极为迅速,距收肌腱裂孔5cm处腘动脉直径为10.5±2.2mm,到股骨髁下缘水平腘动脉直径迅速减为8.7±1.6mm,而到胫前动脉分出处腘动脉直径仅4.7±0.1mm。因此,一个常规直径为60mm-150mm的等直径传统外周血管支架难以适应腘动脉的生理解剖。
本发明提供的适用于动脉血管的具有锥度的生物可降解血管支架,其特征在于:所述生物可降解血管支架包括由镁合金或镁制成的本体、由聚乳酸-聚三亚甲基碳酸酯共聚物、聚丙交酯-乙交酯聚合物或环己六醇六磷酸酯制成的覆盖本体表面的保护涂层和由药物制成的覆盖保护涂层表面的药物涂层;所述本体为中空圆台型,高度为40-120mm,一个底面的直径为4.0-6.0mm,另一个底面的直径为3.0-5.0mm,两个底面的直径差为0.5-1.5mm;所述动脉血管为腘动脉血管,收肌腱裂孔至腘肌下缘的血管、中远段股浅动脉血管、胫前动脉血管、胫后动脉血管、腓动脉中靠近腘动脉端的三分之一长度的血管。
所述适用于动脉血管的具有锥度的生物可降解血管支架,所述本体的高度具体可为100mm,一个底面的直径具体可为5.0mm,另一个底面的直径具体可为4.0mm,两个底面的直径差具体可为1.0mm。
经过预实验,本发明的发明人发现,符合中国人临床需要的腘动脉血管支架应该长度为40-120mm,直径长径范围为4.0、4.5、5.0、5.5、6.0mm,直径短径范围为3.0、3.5、4.0、4.5、5.0mm,长径和短径的差距在0.5、1.0或者1.5mm,以适应腘动脉上宽下窄的解剖特点,提高腘动脉支架的顺应性。
镁是人体内第二重要的阳离子,含量仅次于钾,其在人体正常新陈代谢过程中不可或缺。镁离子在细胞外液的浓度波动于0.7-1.05mmol/L之间,由肾脏和小肠保持其浓度稳定。然而,由于镁的化学性质极为活泼(-2.36VSCE),并且在腐蚀介质中产生的氧化膜疏松多孔(PBR=0.8),镁及镁合金耐蚀性能较差,尤其是在含有Cl-离子的人体生理环境中更是如此。这一问题长久以来一直被认为是镁及镁合金的缺点,也成为限制其作为植入物在生物医学应用的最主要原因。本发明的发明人克服本领域工作人员的技术偏见,进行逆向思维,利用镁及镁合金耐蚀性能差的特点,将它们作为生 物可降解材料应用到临床医学领域。镁合金具有优异的性能:质轻(密度仅为铝合金的2/3,钢的1/4);比强度和比刚度都高于铝合金和钢;优良的尺寸稳定性与良好的能量吸震性;高达85%以上的废料回收利用率;机械加工容易、焊接性能良好。
进一步的,本发明的发明人提供的适用于动脉血管的具有锥度的生物可降解血管支架,其形状特征、力学特征及化学性质阐述如下:
一、形状特征
本发明所述的适用于动脉血管的具有锥度的生物可降解血管支架的本体为中空、圆台型,高度为40-120mm,一个底面的直径为4.0-6.0mm,另一个底面的直径为3.0-5.0mm,两个底面的直径差为0.5-1.5mm。
二、径向支撑力
腘动脉走行P3段较固定,在膝关节活动时受到较大的径向支撑力,因此要求植入人体前支架的径向支撑力大于等于15牛顿,且在溶解时间窗(溶解时间窗的定义即血管支架能有效支撑动脉壁弹性回缩的时间)内径向支撑力保持在12牛顿以上。
三、溶解时间窗
如前述,腘动脉成形手术的主要目标是为进展为严重肢体缺血(静息痛、溃疡不愈、坏疽)的患者提供及时的血运重建,避免截肢、促进溃疡愈合、争取通过运动锻炼建立侧枝的时间,因此,保持中短期(6个月左右)的通畅对于腘动脉动脉至关重要,而相对而言中远期的通畅与否对于患者预后关系较小。而且膝关节的屈曲-伸直运动导致膝关节背面的动脉内血管支架承受了巨大的横向屈曲及轴向剪切力,反复的屈曲-伸直更可能导致长期留存的血管支架的金属疲劳,诱发支架断裂、变形,继发急性的动脉血栓形成和远端肢体的急性缺血,严重者需要截肢治疗。本发明的发明人进行预实验后发现腘动脉血管支架留存的最佳时间为6个月,因此将血管支架的溶解时间窗设定为150-210天,优选165-195天。
四、最大溶解时间
最大溶解时间的定义为:血管支架自植入人体时刻起至支架完全溶解(肉眼)的时间。由于镁合金的特性,一旦开始自身腐蚀溶解过程后,其溶解时间是相当快的。而对于生物可降解支架,在最佳治疗窗口后,溶解时间的加快可以减少支架因缓慢溶解断裂成小的碎片掉落导致远端小动脉栓塞的可能。本发明的发明人进行预实验后,将血管支架的最大溶解时间设定为300-420天,优选330-390天。
五、顺应性
血管支架顺应性是指在弯曲作用力下血管支架变形最大处支架腔面积与伸直形 态同一位置子支架腔面积的比值,支架变形可同时用角度α。在变形角度变大的情况下,顺应性越高,代表支架的管腔丢失面积越小。本发明要求血管支架在变形30°时支架顺应性为不低于90%,变形60°时支架顺应性不低于75%,变形90°时支架顺应性不低于50%,变形120°时支架顺应性不低于30%。
所述镁合金为如下(1)至(8)中的任意一种:
(1)由93.3-94.7质量份镁、4.5-5.5质量份锌和0.8-1.2质量份锰组成的镁合金;
(2)由92.1-93.9质量份镁、4.5-5.5质量份锌、0.8-1.2质量份锰和0.8-1.2质量份钙组成的镁合金;
(3)由94质量份镁、5质量份锌和1质量份锰组成的镁合金;
(4)由93.3质量份镁、5.5质量份锌和1.2质量份锰组成的镁合金;
(5)由94.7质量份镁、4.5质量份锌和0.8质量份锰组成的镁合金;
(6)由93质量份镁、5质量份锌、1质量份锰和1质量份钙组成的镁合金;
(7)由92.1质量份镁、5.5质量份锌、1.2质量份锰和1.2质量份钙组成的镁合金;
(8)由93.9质量份镁、4.5质量份锌、0.8质量份锰和0.8质量份钙组成的镁合金。
所述本体由金属丝组成的,呈镂空网状。
所述镂空网状的形态为:部分金属丝呈若干环形波浪状,每个波浪的波峰或波谷与相邻的波浪的波峰或波谷通过金属丝连接。
所述金属丝的直径为0.5-1.5mm,优选为1.0mm。
所述支架的本体的制作工艺包括但不限于机械加工或激光雕刻支撑。
所述保护涂层的厚度为0.01-1mm,优选为0.1mm。
所述保护涂层的制作工艺可为如下任一工艺或如下工艺中一种或几种的组合:超声喷涂、激光镂空、浸涂、喷涂、热喷涂、静电涂敷、溶胶凝胶和超临界液态涂覆工艺。
所述聚乳酸-聚三亚甲基碳酸酯共聚物具体可为PLA30-PTMC70。PLA30-PTMC70的重均分子量具体可为39000,数均分子量具体可为17730。
所述聚丙交酯-乙交酯聚合物具体可为LA85-GA15。LA85-GA15的重均分子量具体可为144700,数均分子量具体可为73100。
所述药物涂层的厚度为0.01-1mm,优选为0.1mm。
所述药物涂层中的药物具体可为局部作用的药物。所述药物涂层中的药物可为抗内膜增生药物和/或抗血栓形成的药物。所述抗内膜增生药物包括但不限于如下药物:雷帕霉素(Rapamycin)、与雷帕霉素结构相似和/或作用机理相同和/或受体相同的药物、紫杉醇(Paclitaxel)、与紫杉醇结果相似和/或作用机理相同的药物。所述抗血栓形成的药物可为抗凝和/或抗血小板药物。所述抗凝和/或抗血小板药物包括但不限于如下药物:Xa因子抑制剂及凝血酶原抑制剂、糖蛋白GPⅡh/Ⅲa复合物抑制剂、水蛭素类药物。所述Xa因子抑制剂及凝血酶原抑制剂包括但不限于肝素(Heparin)、利伐沙班(rivaroxaban)。所述糖蛋白GPⅡh/Ⅲa复合物抑制剂包括但不限于氯吡格雷(clopidogrel)。所述水蛭素类药物包括但不限于比伐卢定(bivalirudin)。
所述药物涂层的制作工艺可为如下任一工艺或如下工艺中一种或几种的组合:超声喷涂、激光镂空、浸涂、喷涂、热喷涂、静电涂敷、溶胶凝胶和超临界液态涂覆工艺。
生物可降解材料的引入能极大的减轻因金属支架永久留存血管内而带来的一些列迟发并发症的风险。但是,由于支架支撑力随着溶解而迅速消失,血管平滑肌层的迁移和增殖随之增加,支架放置部位长期将面临新生内膜增生、管腔丢失和再狭窄的风险。局部作用的抑制内膜增生药物被证明可以有效降低术后再狭窄的发生率,降低病变部位需要再次血运重建的风险。局部作用的药物都需要一定的运送载体到达病变部位。生物可降解支架是比球囊和传统金属支架更好的载药载体。药物球囊面临的最大问题是由于球囊作用于病变部位的时间有限,为了达到一定的血药浓度,必须要求较高的载药密度,而过高的载药密度以及相对较低的有效利用率会引起全身药物浓度的瞬时血药峰值,存在全身脏器损害和迟发性肿瘤发生的风险。药物金属支架虽然具有充分的药物施放时间、较高的药物利用度和相对稳定的局部药物浓度,但一旦药物释放完毕后,药物支架即转变成传统的金属支架,同样具有传统金属支架的各种问题。负载药物的生物可降解支架则兼得了药物球囊无异物留存、药物支架稳定而高效的局部药物作用浓度,从而可以发挥更好的抗内膜增生作用。
本发明公开了一种主要适用于动脉血管的具有锥度的生物可降解血管支架,以特有的性质、力学特征及溶解行为适应了腘动脉的管腔直径的变化、运动生理特点以及下肢动脉硬化闭塞症患者腘动脉病变的血运重建要求。所述生物可降解血管支架在降解前能有效提供径向支撑力用于短期改善及维持远端肢体血运,避免截肢、促进溃疡愈合及争取功能锻炼时间;特有的圆台型设计契合人类腘动脉管腔直径自粗变细的特点;而在生物可降解血管支架降解后避免了因腘动脉长期屈曲-伸直运动导致支架变 形、支架断裂、血栓形成等远期并发症;该生物可降解血管支架外涂的药物涂层较传统药物球囊或药物金属支架更有利于发挥药物局部作用。
本发明提供的具有锥度的生物可降解血管支架由医生按照血管支架的常规使用方法使用即可。
本发明将引领国内医用耗材的革命性创新,为患者带来福音,并具有极高的科学意义和潜在经济效益。
附图说明
图1为支架本体的纵切剖视图。
图2为镁离子浓度和雷帕霉素浓度的结果(生物可降解血管支架Ⅰ)。
图3为镁离子浓度和雷帕霉素浓度的结果(生物可降解血管支架Ⅳ)。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
模拟血液的组成:NaCl 8.00g/L、KCl 0.40g/L、CaCl2 0.14g/L、NaHCO3 0.35g/L、MgSO4·7H2O 0.20g/L、Na2HPO4·12H2O 0.12g/L、KH2PO4 0.06g/L,余量为水。
人主动脉血管平滑肌细胞(HA-VSMC):CRL-1999TM。
检测镁离子浓度的方法:使用络合滴定法测定镁离子浓度(国标中文标准:无机化工产品中镁含量测定的通用方法络合滴定法;国标标准号:GB/T 21525-2008)。
雷帕霉素浓度:使用目前国内通用的高效液相光谱法测定雷帕霉素浓度(见刘忠,赵丽丽,孙钦美,唐云峰,高效液相色谱法测定雷帕霉素,生物加工过程[J],2013。11(5):71-73)。色谱条件:色谱柱Zorbax Eclipse XDB-C8(4.6mm X 150mm,3.5微米)反相柱。流动相:体积(乙腈):体积(水)=51:49。流速1.0mL/min。紫外检测波长278nm。柱温55摄氏度。使用雷帕霉素标准品配制不同浓度的雷帕霉素乙腈溶液,在上述色谱条件下进样,记录色谱图,以峰面积对浓度进行线性回归,建立标准品色谱曲线。
实施例中的聚乳酸-聚三亚甲基碳酸酯共聚物指的是PLA30-PTMC70,重均分子量为39000,数均分子量为17730。
实施例中的聚丙交酯-乙交酯聚合物指的是LA85-GA15,重均分子量为144700,数均分子量为73100。
实施例1、预实验
分别采用各种不同材质制备支架本体(具体材质见表1)。
支架本体的纵切剖视图见图1。支架本体的形状为中空圆台型,高度为100mm,一个底面的直径为5.0mm,另一个底面的直径为4.0mm,两个底面的直径差为1.0mm。支架本体由直径为1.0mm的金属丝组成的,呈镂空网状(镂空网状的形态为:部分金属丝呈若干环形波浪状,每个波浪的波峰与相邻的波浪的波峰通过金属丝连接)。
表1
在本体Ⅰ表面喷涂聚乳酸-聚三亚甲基碳酸酯共聚物(聚乳酸-聚三亚甲基碳酸酯共聚物形成保护涂层,保护涂层的厚度为0.1mm),形成中间支架Ⅰ。
在本体Ⅱ表面喷涂聚丙交酯-乙交酯聚合物(聚丙交酯-乙交酯聚合物形成保护涂层,保护涂层的厚度为0.1mm),形成中间支架Ⅱ。
在本体Ⅲ表面喷涂环己六醇六磷酸酯(环己六醇六磷酸酯形成保护涂层,保护涂层的厚度为0.1mm),形成中间支架Ⅲ。
在本体Ⅳ表面喷涂聚乳酸-聚三亚甲基碳酸酯共聚物(聚乳酸-聚三亚甲基碳酸酯共聚物形成保护涂层,保护涂层的厚度为0.1mm),形成中间支架Ⅳ。
在本体Ⅴ表面喷涂聚丙交酯-乙交酯聚合物(聚丙交酯-乙交酯聚合物形成保护涂层,保护涂层的厚度为0.1mm),形成中间支架Ⅴ。
在本体Ⅵ表面喷涂环己六醇六磷酸酯(环己六醇六磷酸酯形成保护涂层,保护涂层的厚度为0.1mm),形成中间支架Ⅵ。
通过力学试验检测各个中间支架的径向支撑力。中间支架Ⅰ的径向支撑力为17.39牛顿,中间支架Ⅱ的径向支撑力为16.87牛顿,中间支架Ⅲ的径向支撑力为16.58 牛顿,中间支架Ⅳ的径向支撑力为18.86牛顿,中间支架Ⅴ的径向支撑力为16.99牛顿,中间支架Ⅵ的径向支撑力为17.34牛顿。
将各个中间支架在模拟血液中浸泡(环境条件:37℃、3%CO2、湿度99%),中间支架Ⅰ径向支撑力降低至12牛顿的时间为176天,中间支架Ⅱ径向支撑力降低至12牛顿的时间为172天,中间支架Ⅲ径向支撑力降低至12牛顿的时间为169天,中间支架Ⅳ径向支撑力降低至12牛顿的时间为180天,中间支架Ⅴ径向支撑力降低至12牛顿的时间为182天,中间支架Ⅵ径向支撑力降低至12牛顿的时间为185天。
将各个中间支架在模拟血液中浸泡(环境条件:37℃、3%CO2、湿度99%),中间支架Ⅰ的最大溶解时间为355天,中间支架Ⅱ的最大溶解时间为348天,中间支架Ⅲ的最大溶解时间为353天,中间支架Ⅳ的最大溶解时间为360天,中间支架Ⅴ的最大溶解时间为372天,中间支架Ⅵ的最大溶解时间为387天。
实施例2、生物可降解血管支架的制备
生物可降解血管支架包括本体(本体Ⅳ或本体Ⅰ)、由聚乳酸-聚三亚甲基碳酸酯共聚物制成的覆盖本体表面的保护涂层和由雷帕霉素制成的覆盖保护涂层表面的药物涂层。本体呈中空圆台型,高度为100mm,一个底面的直径为5.0mm,另一个底面的直径为4.0mm,两个底面的直径差为1.0mm。本体由直径为1.0mm的金属丝组成的,呈镂空网状(镂空网状的形态为:部分金属丝呈若干环形波浪状,每个波浪的波峰与相邻的波浪的波峰通过金属丝连接)。保护涂层厚度为0.1mm。药物涂层厚度为0.1mm。
本体Ⅰ的材质即为实施例1中的表1中的本体Ⅰ的材质。
本体Ⅳ的材质即为实施例1中的表1中的本体Ⅳ的材质。
采用本体Ⅰ时,生物可降解血管支架命名为生物可降解血管支架Ⅰ。
采用本体Ⅳ时,生物可降解血管支架命名为生物可降解血管支架Ⅳ。
实施例3、生物可降解血管支架的性能
一、径向支撑力
通过力学试验检测实施例2制备的生物可降解血管支架的径向支撑力。生物可降解血管支架Ⅰ的径向支撑力为17.39牛顿,生物可降解血管支架Ⅳ的径向支撑力为18.86牛顿。
二、溶解时间窗
将实施例2制备的生物可降解血管支架在模拟血液中浸泡(环境条件:37℃、3%CO2、湿度99%),生物可降解血管支架Ⅰ径向支撑力降低至12牛顿的时间为176天,生物可降解血管支架Ⅳ径向支撑力降低至12牛顿的时间为180天。
三、最大溶解时间
将实施例2制备的生物可降解血管支架在模拟血液中浸泡(环境条件:37℃、3%CO2、湿度99%),生物可降解血管支架Ⅰ的最大溶解时间为355天,生物可降解血管支架Ⅳ的最大溶解时间为360天。
四、顺应性
检测实施例2制备的生物可降解血管支架的顺应性。生物可降解血管支架Ⅰ,在变形30°时支架顺应性为92%,变形60°时支架顺应性为76%,变形90°时支架顺应性为51%,变形120°时支架顺应性为31%。生物可降解血管支架Ⅳ,在变形30°时支架顺应性为93%,变形60°时支架顺应性为77%,变形90°时支架顺应性为52%,变形120°时支架顺应性为33%。
五、降解情况
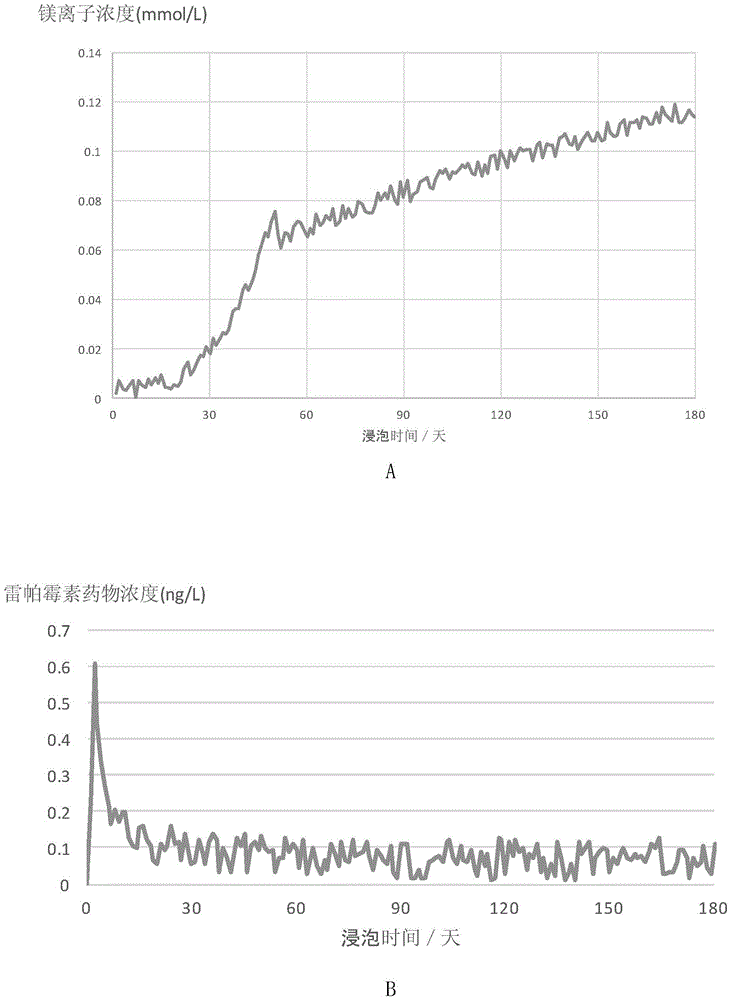
将实施例2制备的生物可降解血管支架在模拟血液中浸泡(环境条件:37℃、3%CO2、湿度99%),每天取液体样本,检测液相样本中的镁离子浓度和雷帕霉素浓度。生物可降解血管支架Ⅰ的结果见图2,A为镁离子浓度结果,B为雷帕霉素浓度的结果。生物可降解血管支架Ⅳ的结果见图3,A为镁离子浓度结果,B为雷帕霉素浓度的结果。
六、对血管平滑肌的作用效果
待测溶液分别为步骤四中第1天、第7天、第30天、第90天和第180天取的液体样本。
1、取人主动脉血管平滑肌细胞,用胰酶消化,然后用含20%胎牛血清的DMEM培养基悬浮,得到(5-10)×104个细胞/ml的细胞悬液。
2、取96孔板,每孔加入100μl步骤1得到的细胞悬液,然后培养至细胞单层铺满孔底。
3、完成步骤2后,取所述96孔板,吸弃上清液,每孔加入100μl待测溶液,然后培养36小时。设置用等体积模拟血液代替待测溶液的阴性对照。
4、完成步骤3后,取所述96孔板,每孔加入10μl MTT溶液(5mg/ml,即0.5%MTT),继续培养4h。
5、完成步骤4后,吸弃上清液,每孔加入150μl二甲基亚砜使结晶物充分溶解,在酶联免疫检测仪OD490nm处测量各孔的吸光值。
上述步骤中,细胞培养条件为:5%CO2,37℃。
细胞增殖率=试验组的吸光度/阴性对照的吸光度×100%。
每种待测溶液设置5个重复处理,结果取平均值。
结果见表2。生物可降解血管支架的降解液抑制了人主动脉血管平滑肌细胞的增殖,也就是说其实现了抗内膜增生的效果。
表2
- 还没有人留言评论。精彩留言会获得点赞!