改进的经导管主动脉瓣植入规划的方法和系统与流程
本发明涉及经导管主动脉瓣植入(TAVI)规划,且更特别地,涉及产生用于规划TAVI过程的主动脉瓣的个性化3D打印解剖模型。
经导管主动脉瓣植入(TAVI)正成为照料遭受严重的主动脉瓣狭窄的、不可手术且高风险患者的标准选择。TAVI是最低程度侵入性的心脏介入,其中主动脉瓣植入经由导管通过患者的血管被递送到患者体内。由于在TAVI过程中没有对受影响解剖结构的直接查看或者访问,所以精确的术前规划对于成功的结果是至关重要的。计算机断层成像(CT)已经被建立作为针对TAVI过程的术前规划的最佳标准成像模态。标准的临床测量结果(例如环直径和铰链环(hinge-annulus)平面间距)可以基于得出的几何模型来估计,并且在做出临床决定期间被使用。做出临床决定的一个重要方面是选择正确的植入设备和设备尺寸。因为在市场上可以获得许多不同的设备,并且每种设备具有不同的尺寸,所以对于患者来说存在大量的选项。另外,由于主动脉瓣中的钙,为了选择正确的植入设备,仅评估患者的主动脉瓣的几何特性可能是不够的。
技术实现要素:
本发明提供了用于经导管主动脉瓣植入(TAVI)规划的方法和系统。本发明的实施例提供了一种从手术医学图像数据提取包括钙的主动脉瓣的几何模型的自动化框架,该几何模型能够使用3D单一材料或多材料打印机来打印以产生患者的主动脉瓣的物理3D模型。最终打印的3D模型可以使用两种不同材料来产生,该两种不同材料表示狭窄患者的瓣膜内的两种主要组织,主动脉组织(较软的组织)和钙(较硬的组织)。本发明的实施例允许在最少或没有用户交互的情况中从医学图像(例如CT图像)进行到3D打印模型的无缝且快速的工作流程。基于患者的主动脉瓣的打印的3D模型,可以实施针对TAVI过程的实践(hands-on)术前规划,包括尝试不同类型的植入设备和针对每种类型植入设备的不同尺寸。
在本发明的一个实施例中,根据患者的医学图像数据估计心脏瓣膜的解剖表面模型。在医学图像数据中分割心脏瓣膜内的钙化病变。产生心脏瓣膜和钙化病变的组合的体积模型。使用3D打印机产生心脏瓣膜和钙化病变的3D打印模型。在本发明的一个实施例中,一种用于心脏瓣膜介入规划的方法包括:
从患者的医学图像数据估计心脏瓣膜的解剖表面模型;
分割医学图像数据中心脏瓣膜内的钙化病变;
产生心脏瓣膜和钙化病变的组合体积模型;以及
使用3D打印机产生心脏瓣膜和钙化病变的3D打印模型。
其中使用3D打印机产生心脏瓣膜和钙化病变的3D打印模型包括:
使用针对心脏瓣膜组织的第一材料和针对钙化病变的第二材料产生心脏瓣膜和钙化病变的3D打印模型。
其中第二材料具有大于第一材料的硬度。
其中第一材料具有与心脏瓣膜组织的硬度特性的标准值相等的硬度特性,并且第二材料具有与钙化病变的硬度特性的标准值相等的硬度特性。
其中从患者的医学图像数据估计心脏瓣膜的解剖表面模型包括:
在医学图像数据中检测心脏瓣膜的生理模型的全局位置(global location);
基于检测到的全局位置在医学图像数据中检测心脏瓣膜的解剖界标;以及
基于检测到的解剖界标将心脏瓣膜的表面模型适配到医学图像数据。
其中从患者的医学图像数据估计心脏瓣膜的解剖表面模型进一步包括:
使用已训练的边界检测器细化心脏瓣膜的表面模型。
其中所述心脏瓣膜是主动脉瓣,且基于检测到的全局位置在医学图像数据中检测心脏瓣膜的解剖界标包括:
基于检测到的全局位置在约束的医学图像数据的区域中检测主动脉瓣的连合处界标、铰链界标、小叶尖界标、和口(ostia)界标。
其中基于检测到的解剖界标将心脏瓣膜的表面模型适配到医学图像数据包括:
基于检测到的连合处界标、铰链界标、小叶尖界标、和口界标将主动脉根和主动脉瓣小叶的表面模型适配到医学图像数据。
其中分割医学图像数据中心脏瓣膜内的钙化病变包括:
基于心脏瓣膜的估计的解剖表面模型限定医学图像数据中的心脏瓣膜的感兴趣区域;以及
分割医学图像数据中心脏瓣膜的感兴趣区域内的钙化病变。
其中分割医学图像数据中心脏瓣膜的感兴趣区域内的钙化病变包括:
检测心脏瓣膜的感兴趣区域中的具有大于钙阈值的强度值的体素。
其中分割医学图像数据中心脏瓣膜的感兴趣区域内的钙化病变进一步包括:
基于医学图像数据的心脏瓣膜的感兴趣区域中的强度柱状图确定钙阈值。
其中基于医学图像数据的心脏瓣膜的感兴趣区域中的强度柱状图确定钙阈值包括:
确定医学图像数据的心脏瓣膜的感兴趣区域中的强度柱状图;以及
使用已训练的回归函数基于医学图像数据的心脏瓣膜的感兴趣区域中的强度柱状图计算钙阈值。
其中基于医学图像数据的心脏瓣膜的感兴趣区域中的强度柱状图确定钙阈值包括:
确定医学图像数据的心脏瓣膜的感兴趣区域中的强度柱状图;
基于医学图像数据的心脏瓣膜的感兴趣区域中的强度柱状图在训练图像的数据库中识别多个最近邻训练图像;以及
计算与所述多个最近邻训练图像相关联的钙阈值的平均值。
其中产生心脏瓣膜和钙化病变的组合体积模型包括:
将分割的钙化病变映射到心脏瓣膜的解剖表面模型;以及
将心脏瓣膜的解剖表面模型拉伸到预定厚度。
其中将心脏瓣膜的解剖表面模型拉伸到预定厚度包括:
在心脏瓣膜的解剖表面模型上的多个点的每个点处,在与心脏瓣膜的解剖表面模型垂直的方向上拉伸心脏瓣膜的解剖表面模型。
其中所述心脏瓣膜是主动脉瓣,并且将心脏瓣膜的解剖表面模型拉伸到预定厚度包括:
在主动脉根表面上将心脏瓣膜的解剖表面模型拉伸到第一预定厚度,和在主动脉瓣小叶表面上将心脏瓣膜的解剖表面模型拉伸到第二预定厚度。
其中将心脏瓣膜的解剖表面模型拉伸到预定厚度包括:
将心脏瓣膜的解剖表面模型拉伸到如下之一:与心脏瓣膜相关联的标准厚度值或与3D打印机相关联的最小厚度等级。
其中所述心脏瓣膜是主动脉瓣,并且将心脏瓣膜的解剖表面模型拉伸到预定厚度包括:
如果与主动脉根相关联的标准厚度大于或等于与3D打印机相关联的最小厚度等级,则将心脏瓣膜的解剖表面模型的主动脉根表面拉伸到与主动脉根相关联的标准厚度;
如果与主动脉根相关联的标准厚度小于与3D打印机相关联的最小厚度等级,则将心脏瓣膜的解剖表面模型的主动脉根表面拉伸到与3D打印机相关联的最小厚度等级;
如果与主动脉瓣小叶相关联的标准厚度大于或等于与3D打印机相关联的最小厚度等级,则将心脏瓣膜的解剖表面模型的主动脉瓣小叶表面拉伸到与主动脉瓣小叶相关联的标准厚度;以及
如果与主动脉瓣小叶相关联的标准厚度小于与3D打印机相关联的最小厚度等级,则将心脏瓣膜的解剖表面模型的主动脉瓣小叶表面拉伸到与3D打印机相关联的最小厚度等级。
其中将心脏瓣膜的解剖表面模型拉伸到预定厚度进一步包括:
将分割的钙化病变中的至少一个扩展到与3D打印机相关联的最小厚度等级。
其中使用3D打印机产生心脏瓣膜和钙化病变的3D打印模型包括:
使用3D打印机打印心脏瓣膜和钙化病变的组合体积模型的物理3D模型。
用于心脏瓣膜介入规划的方法进一步包括:
将多个不同植入设备类型和植入设备尺寸放置到心脏瓣膜和钙化病变的3D打印模型中以选择用于心脏瓣膜介入过程的针对患者的植入设备类型和尺寸。
在本发明的另一实施例中,一种用于心脏瓣膜介入规划的装置,包括:
处理器;
存储计算机程序指令的存储器,当计算机程序指令被所述处理器执行时使得所述处理器实施包括如下各项的操作:
从患者的医学图像数据估计心脏瓣膜的解剖表面模型,
分割医学图像数据中心脏瓣膜内的钙化病变,以及
产生心脏瓣膜和钙化病变的组合体积模型;以及
3D打印机,用于产生心脏瓣膜和钙化病变的3D打印模型。
其中所述3D打印机包括:
多材料3D打印机,用于使用针对心脏瓣膜组织的第一材料和针对钙化病变的第二材料产生心脏瓣膜和钙化病变的3D打印模型。
其中第二材料具有大于第一材料的硬度。
其中第一材料具有与心脏瓣膜组织的硬度特性的标准值相等的硬度特性,并且第二材料具有与钙化病变的硬度特性的标准值相等的硬度特性。
其中从患者的医学图像数据估计心脏瓣膜的解剖表面模型包括:
在医学图像数据中检测心脏瓣膜的生理模型的全局位置;
基于检测到的全局位置在医学图像数据中检测心脏瓣膜的解剖界标;以及
基于检测到的解剖界标将心脏瓣膜的表面模型适配到医学图像数据。
其中分割医学图像数据中心脏瓣膜内的钙化病变包括:
基于心脏瓣膜的估计的解剖表面模型限定医学图像数据中的心脏瓣膜的感兴趣区域;以及
分割医学图像数据中心脏瓣膜的感兴趣区域内的钙化病变。
其中分割医学图像数据中心脏瓣膜的感兴趣区域内的钙化病变包括:
检测心脏瓣膜的感兴趣区域中的具有大于钙阈值的强度值的体素。
其中分割医学图像数据中心脏瓣膜的感兴趣区域内的钙化病变进一步包括:
基于医学图像数据的心脏瓣膜的感兴趣区域中的强度柱状图确定钙阈值。
其中产生心脏瓣膜和钙化病变的组合体积模型包括:
将分割的钙化病变映射到心脏瓣膜的解剖表面模型;以及
将心脏瓣膜的解剖表面模型拉伸到预定厚度。
其中将心脏瓣膜的解剖表面模型拉伸到预定厚度包括:
在心脏瓣膜的解剖表面模型上的多个点的每个点处,在与心脏瓣膜的解剖表面模型垂直的方向上拉伸心脏瓣膜的解剖表面模型。
其中将心脏瓣膜的解剖表面模型拉伸到预定厚度包括:
将心脏瓣膜的解剖表面模型拉伸到如下之一:与心脏瓣膜相关联的标准厚度值或与3D打印机相关联的最小厚度等级。
其中所述3D打印机通过使用所述3D打印机打印心脏瓣膜和钙化病变的组合体积模型的物理3D模型来产生心脏瓣膜和钙化病变的3D打印模型。
在本发明的再另一实施例中,一种非临时性计算机可读介质,存储用于心脏瓣膜介入规划的计算机程序指令,所述计算机程序指令当被处理器执行时使得处理器实施包括以下各项的操作:
从患者的医学图像数据估计心脏瓣膜的解剖表面模型;
分割医学图像数据中心脏瓣膜内的钙化病变;
产生心脏瓣膜和钙化病变的组合体积模型;以及
控制3D打印机产生心脏瓣膜和钙化病变的3D打印模型。
其中控制3D打印机产生心脏瓣膜和钙化病变的3D打印模型包括:
控制3D打印机使用针对心脏瓣膜组织的第一材料和针对钙化病变的第二材料产生心脏瓣膜和钙化病变的3D打印模型。
其中第二材料具有大于第一材料的硬度。
其中第一材料具有与心脏瓣膜组织的硬度特性的标准值相等的硬度特性,并且第二材料具有与钙化病变的硬度特性的标准值相等的硬度特性。
其中从患者的医学图像数据估计心脏瓣膜的解剖表面模型包括:
在医学图像数据中检测心脏瓣膜的生理模型的全局位置;
基于检测到的全局位置在医学图像数据中检测心脏瓣膜的解剖界标;以及
基于检测到的解剖界标将心脏瓣膜的表面模型适配到医学图像数据。
其中分割医学图像数据中心脏瓣膜内的钙化病变包括:
基于心脏瓣膜的估计的解剖表面模型限定医学图像数据中的心脏瓣膜的感兴趣区域;以及
分割医学图像数据中心脏瓣膜的感兴趣区域内的钙化病变。
其中分割医学图像数据中心脏瓣膜的感兴趣区域内的钙化病变包括:
检测心脏瓣膜的感兴趣区域中的具有大于钙阈值的强度值的体素。
其中分割医学图像数据中心脏瓣膜的感兴趣区域内的钙化病变进一步包括:
基于医学图像数据的心脏瓣膜的感兴趣区域中的强度柱状图确定钙阈值。
其中产生心脏瓣膜和钙化病变的组合体积模型包括:
将分割的钙化病变映射到心脏瓣膜的解剖表面模型;以及
将心脏瓣膜的解剖表面模型拉伸到预定厚度。
其中将心脏瓣膜的解剖表面模型拉伸到预定厚度包括:
在心脏瓣膜的解剖表面模型上的多个点的每个点处,在与心脏瓣膜的解剖表面模型垂直的方向上拉伸心脏瓣膜的解剖表面模型。
其中将心脏瓣膜的解剖表面模型拉伸到预定厚度包括:
将心脏瓣膜的解剖表面模型拉伸到如下之一:与心脏瓣膜相关联的标准厚度值或与3D打印机相关联的最小厚度等级。
其中控制3D打印机产生心脏瓣膜和钙化病变的3D打印模型包括:
控制所述3D打印机打印心脏瓣膜和钙化病变的组合体积模型的物理3D模型。
通过参考以下详细描述和附图,本发明的这些和其他益处对于本领域普通技术人员来说将是显而易见的。
附图说明
图1图示了根据本发明的实施例的经导管主动脉瓣植入(TAVI)规划的方法;
图2图示了图1的方法的步骤的示例性结果;
图3图示了根据本发明的实施例的主动脉瓣的生理模型;
图4图示了根据本发明的实施例的用于分割CT体积内的主动脉瓣表面模型的解剖表面模型的方法;
图5图示了根据CT体积估计的主动脉瓣的示例性解剖表面模型;
图6图示了在主动脉瓣中分割钙化病变的示例性结果;
图7图示了主动脉瓣和钙化病变的示例性组合体积模型;
图8图示了主动脉瓣和钙化病变的示例性3D打印模型;
图9图示了使用图1的方法产生的主动脉瓣的3D打印模型的另外示例;和图10是能够实施本发明的装置的高级别框图。
具体实施方式
本发明涉及经导管主动脉瓣植入(TAVI)规划。本发明的实施例在本文中被描述,以给出对TAVI规划方法的视觉理解。数字图像经常由一个或多个对象(或形状)的数字表示组成。对象的数字表示在本文中经常在识别和操纵所述对象方面被描述。这样的操纵是在计算机系统的存储器或其他电路/硬件中完成的虚拟操纵。因此,应该理解的是,本发明的实施例可以使用计算机系统内存储的数据在计算机系统内被实施。
本发明的实施例提供了一种从手术医学图像数据提取包括钙的主动脉瓣的几何模型的自动化框架,该几何模型能够使用3D单一材料或多材料打印机来打印以产生患者的主动脉瓣的物理3D模型。最终打印的3D模型可以使用两种不同材料来产生,该两种不同材料表示狭窄患者的瓣膜内的两种主要组织,主动脉组织(较软的组织)和钙(较硬的组织)。本发明的实施例允许在最少或没有用户交互的情况中从医学图像(例如CT图像)进行到3D打印模型的无缝且快速的工作流程。基于患者的主动脉瓣的打印的3D模型,可以实施针对TAVI过程的实践术前规划,包括尝试不同类型的植入设备和针对每种类型植入设备的不同尺寸。这允许用户评估与仅基于标准临床测量结果选择设备尺寸相比使设备尺寸过大或尺寸不足对特定患者的影响。患者的主动脉瓣的3D打印模型可以对临床决定做出有重要意义,特别是在复杂解剖畸形的情况中(例如小的环但是大的扩张的主动脉瓣根),在该情况中标准临床测量结果可能不足以用于选择最好的植入设备和最好的植入设备尺寸。通过产生患者主动脉瓣的3D打印模型,其中钙和正常组织被利用具有不同材料硬度的单独材料打印,3D打印模型可以有效地被用于评估患者特有几何结构对具体设备扩张的影响。另外,可以使用打印的3D模型来容易地评估从设备到冠状动脉口的距离。
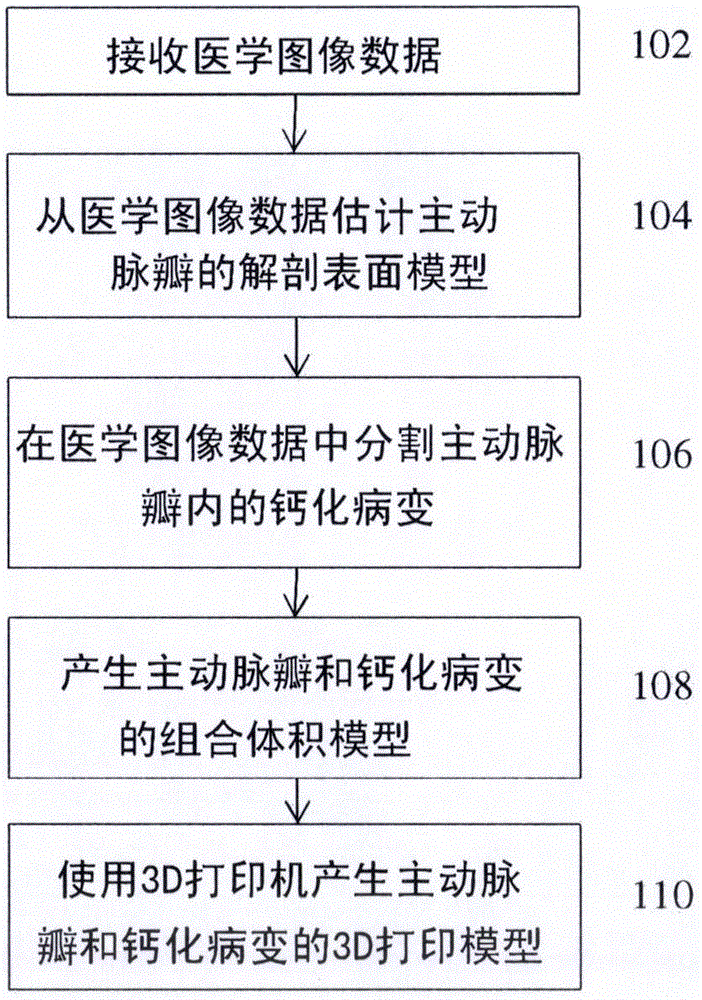
图1图示了根据本发明的实施例根据本发明的实施例的经导管主动脉瓣植入(TAVI)规划的方法。图1的方法将患者的医学图像数据变换成患者的主动脉瓣的患者特有的打印的3D模型。图1的方法提供了患者的主动脉瓣根、三个小叶(leaflet)和钙化病变的解剖建模。图2图示了图1的方法的步骤的示例性结果。参考图1,在步骤102,接收患者的医学图像数据。医学图像数据可以为包括至少患者的心脏区域的术前3D体积。根据有利的实施方式,医学图像数据可以为3D计算机断层成像(CT)体积,但是本发明不限于此,且其他成像模态,例如磁共振成像(MRI)、超声、DynaCT等也可以被使用。医学图像数据可以直接从图像获取设备(例如CT扫描仪、MR扫描仪等)接收,或可以通过经由网络加载或接收先前存储的患者的医学图像数据来接收。图2的图像202示出了患者心脏区域的CT体积。
在步骤104,患者的主动脉瓣的解剖表面模型从患者的医学图像数据分割出来。在有利的实施例中,根据患者的医学图像数据估计主动脉瓣的患者特有模型的表面几何结构,主动脉瓣包括主动脉瓣根、三个主动脉瓣小叶和左心室流出道。图2的图像204图示了从CT体积202提取的示例性主动脉瓣表面模型。为了估计主动脉瓣的患者特有表面几何结构,能够捕捉复杂形态和病理变化的主动脉瓣的生理模型与医学图像数据(例如CT体积)适配。图3图示了根据本发明的实施例的主动脉瓣的生理模型300。在示例性实施方式中,主动脉瓣模型300可以根据11个界标(3个连合处、3个铰链、3个小叶尖和2个口)和四个表面结构(主动脉根、N小叶、L小叶和R小叶)来构建。主动脉根表面结构受铰链和连合处平面约束,且每个小叶表面结构跨越在两个连合处和一个铰链之间。左心室流出道位于主动脉根的底部表面处。为了有效地处理解剖复杂性,模型表示和对应的参数化被分级地构建,并且包括:全局仿射模型;表示解剖界标的非刚性界标模型m;以及包括主动脉根和三个小叶的主动脉瓣的全表面模型M。生理主动脉瓣模型300的患者特有参数可以鲁棒机器学习算法从3D体积(例如CT体积)来估计,所述鲁棒机器学习算法使用边缘空间学习(MSL)框架内的分级方法。
3D体积中主动脉瓣模型的全局位置利用三维笛卡尔空间内的相似变换进行参数化:
其中(cx,cy,cz)、和(sx,sy,sz)分别是位置、取向和尺度参数。该位置由主动脉瓣的重心给出,而尺度参数被选择为使得主动脉瓣的整个解剖结构被包括在与仿射参数化对应的边界框内。长轴的取向由到主动脉-连合平面的法向矢量来限定,而短轴取向为从重心指向LR-连合处。主动脉瓣模型的下一复杂性等级可以由11个解剖界标来建模:R-、N-和L-铰链,和LR-、RN-、NL-连合处,R-、N-和L-小叶尖,和R-和L-口。主动脉瓣模型的最高抽象层对主动脉根、和N-、L-和R-小叶的3D表面进行建模。主动脉根表面由管状网格表示,管状网格与主动脉圆周方向u和向上方向v对齐。每一个小叶表面被表示为固定到附件冠(attachment crown)上的根的抛物面,附件冠由铰链和连合处勾画外形,其中其余的自由边缘由对应的小叶尖点约束。
为了将效率最大化和遵照分级模型限定,患者特有主动脉瓣模型可以使用估计算法在患者的医学图像数据中被估计,该估计算法是基于鲁棒学习方法并且包括全局定位阶段、解剖界标估计阶段和表面模型适配阶段。图4图示了根据本发明的实施例的在CT体积中估计患者特有的主动脉瓣解剖表面模型的方法。图4的方法可以被用于图1的实施步骤104。虽然图4的方法描述了在CT体积中估计患者特有解剖表面模型,但应该理解的是,图4的方法也可以类似地应用到其他类型的体积医学图像数据。
参见图3,在步骤402,在CT体积中检测主动脉瓣模型的全局位置。全局位置由3D仿射参数(cx,cy,cz,αx,αy,αz,sx,sy,sz)表示。这些参数限定了与CT体积中主动脉瓣模型的全局位置对应的边界框,并且通过使用边缘空间学习(MSL)框架训练的组合的解剖结构检测器限定。通过在如下具有递增维数的子空间中进行操作,MSL提供了用于学习高维模型和快速在线搜索的高效技术:
∑1=(cx,cy,cz)
由此,MSL的目的不是直接在全相似变换空间中学习分类器,而是在一系列边缘空间中递增地学习分类器。随着维数增加,有效的空间区域变得更受限于先前的边缘空间分类器。3D对象检测(全局位置估计)被分成三个步骤:对象位置估计、位置取向估计和位置-取向-尺度估计。单独的分类器基于有注解的训练数据针对这些步骤中的每一个被训练。每个分类器可以基于有注解的训练数据的集合,使用与Haar和/或可控特征结合的概率提升树(PBT)来被训练。这产生了估计的仿射变换(位置、取向和尺度),该估计的仿射变换限定表示CT体积中主动脉瓣模型的全局位置的边界框。MSL在美国专利No.7,916,919中被更详细地描述,该专利于2011年3月29日发布并且名称为“System and Method for Segmenting Chambers of a Heart in a Three Dimensional Image”,其通过参考并入本文。在示例性实施方式中,主动脉瓣模型的全局位置估计可以在3mm分辨率上被实施。
在步骤404,基于检测到的主动脉瓣模型的全局位置,在3D CT体积中检测解剖界标。特别地,受全局位置Θ约束,11个主动脉瓣界标m1......m11使用相应的已训练的界标检测器在CT体积中被检测到。针对11个主动脉瓣界标(3个连合处,3个铰链,3个小叶尖和2个口)中的每一个训练独立的界标检测器。每个界标检测器可以使用Haar特征基于有注解的训练数据作为PBT分类器被训练。在有利的实施例中,用于训练每个界标检测器的正和负训练样本仅从训练图像的检测到的全局位置区域提取。已训练的界标检测器在由检测到的全局位置Θ约束的CT体积的更小子空间内搜索相应的界标:
p(mi|I(t))=p(mi|Θ(t),I(t))i=1......11 (2)
因为搜索空间被约束到与检测到的全局位置对应的边界框,界标检测可以在比全局定位更精细的分辨率上实施。例如,界标检测可以在1mm各向同性分辨率上实施。在这种情况下,界标检测器也在更精细的分辨率被训练。
在步骤406,主动脉瓣的表面模型被适配到CT体积。具体来说,包括主动脉根表面、3个小叶表面和左心室流出道的表面模型基于检测到的解剖界标被适配到CT体积。在可能的实施例中,主动脉瓣的表面模型可以使用非严格(non-rigid)MSL框架来估计,其中搜索空间由从训练数据集合中的真实网孔(ground truth mesh)学习得到的主动脉瓣表面模型的统计形状模型的多个模式限定。可以使用主成分分析(PCA)从训练数据产生统计形状模型,以便表示训练数据中真实主动脉瓣网孔中的变化。在可能的实施方式中,主动脉瓣表面模型的搜索空间可以由从训练数据计算得到的统计形状模型的前三个模式(c1,c2,c3)来限定。c1,c2,c3中的每一个假设(即统计形状空间中的每个样本点)对应于非严格(rigid)形状。为了学习统计形状模型的哪些系数与CT体积中的主动脉瓣的形状最合适对应,来自c1,c2,c3的每个样本均被用于产生主动脉瓣的非严格形状,使用检测到的全局位置Θ把该非严格形状投射到图像空间。这产生主动脉瓣表面模型的假设集合。已训练的分类器被用于从表面模型假设集合中选择最合适假设作为主动脉瓣表面模型。该分类器可以为提升分类器,其基于训练数据中的真实主动脉根表面模型和围绕表面模型假设的非严格形状点提取的可控特征被训练。因此,对于被投射到CT体积内检测到的全局位置的每个表面模型假设,可控特征在围绕每个模型点的附近区域中被提取,并且假设的概率分数由已训练的分类器基于提取的可控特征来确定。具有最高概率分数的表面模型假设被选作主动脉瓣表面模型。在另一可能的实施例中,主动脉瓣表面模型可以通过基于检测到的解剖界标点计算变换(例如薄板样条(TPS)变换)来与CT体积适配,该变换将生理主动脉瓣模型中的每个点映射到CT体积中的对应位置。
在步骤408,主动脉瓣表面模型的形状使用已训练的边界检测器被局部细化。已训练的边界检测器可以基于训练数据使用PBT分类器和可控特征进行训练。主动脉瓣表面模型的边界通过在主动脉瓣表面模型上的每个点的附近区域中局部地应用已训练的分类器来细化,以在法向方向上搜索具有最高概率分数的点。图5图示了从CT体积估计的主动脉瓣的示例性解剖表面模型。如图5中所示,图像500、510和520分别示出了从CT体积估计的主动脉瓣的患者特有解剖表面模型的顶视图、仰视图和侧视图。解剖表面模型包括主动脉根502、小叶504和左心室流出道506的患者特有表面几何结构。
回到图1,在步骤106,在患者的医学图像数据中估计主动脉瓣内的钙化病变。3D医学图像体积的感兴趣区域(ROI)基于主动脉瓣的估计的患者特有表面模型来限定。具体来说,由估计的主动脉瓣表面模型的边界限定的体积区域可以被裁剪,以在3D医学图像体积中限定ROI以用于分割钙化病变。钙化病变在3D医学图像体积的限定的ROI中被分割。分割的钙化病变可以被映射到主动脉瓣的患者特有表面模型。图2的图像206示出了由分割钙化病变产生的钙模型和主动脉瓣的示例。在有利的实施例中,强度阈值化被用于分割主动脉瓣ROI内的钙化病变。异常的瓣膜ROI中每个体素的强度(亨斯菲尔德单位(Hounsfield units))被与钙阈值比较,并且如果体素的强度被确定为大于钙阈值,则该体素被确定为钙化病变体素。对于无对照CT体积(即当没有对照试剂被注入患者体内时获取的CT体积)来说,预定的钙阈值可以用于强度阈值化,因为钙化病变将显现为比主动脉瓣组织显著地更亮。对于有对照CT体积(即当对照试剂被注入患者体内时获取的CT体积)来说,预定的钙阈值可能不准确。
在有利的实施例中,可以使用基于机器学习的方法针对每个医学图像体积自动地确定钙阈值。该技术可以确定有对照和无对照CT体积的钙阈值,以及其他类型成像模态的钙阈值。对于多个训练图像数据集合(例如CT体积)中的每一个来说,相应钙阈值被手工设置并且表示强度分布的柱状图被识别。在可能的实施例中,回归函数在离线训练阶段基于训练数据被训练,以基于主动脉瓣ROI内的柱状图特征计算钙阈值。例如,回归函数可以使用随机森林(Random Forests)进行训练以学习训练图像内的柱状图特征和训练图像的钙阈值之间的关系。对于患者的当前医学图像数据来说,表示主动脉瓣ROI内的强度分布的柱状图被确定,并且回归函数基于主动脉瓣ROI内的柱状图特征计算钙阈值。在另一可能的实施例中,k最近邻算法(K-nearst neighbor algorithm)可以被用于确定钙阈值。这种情况下,针对当前图像确定表示主动脉瓣ROI内的强度分布的柱状图,并且k最近邻算法被用于比较针对当前图像的主动脉瓣ROI内的柱状图和数据库中训练图像的柱状图,以便在训练图像中找到当前图像的k个(例如3个)最近邻训练图像。然后针对当前图像的钙阈值可基于k个最近邻训练图像来确定。例如,k个最近邻训练图像的钙阈值的平均值可以被用作当前图像的钙阈值。
图6图示了分割主动脉瓣内钙化病变的示例性结果。如图6中所示,图像600、610和620分别示出了具有分割的钙化病变602的主动脉瓣的患者特有解剖表面模型的顶视图、仰视图和侧视图。
回到图1,在步骤108,产生主动脉瓣和钙化病变的组合体积模型。主动脉瓣的估计的患者特有表面模型提供了主动脉瓣的3D边界,但是其是没有厚度的平面模型。主动脉瓣和钙化病变的体积组合模型通过使主动脉瓣的表面模型沿着其法向拉伸并且在最终的体积模型中包括分割的钙化病变来产生。具体来说,在主动脉瓣的表面模型上的每个点处,模型在与该点处的表面垂直的方向上被拉伸至特定厚度。模型可以被拉伸到主动脉瓣根和主动脉瓣小叶的预定厚度。在示例性实施方式中,来自文献的标准数值可以被用于主动脉瓣根和主动脉瓣小叶的厚度。组合体积模型中的主动脉瓣根和主动脉瓣小叶可以被设置为具有不同厚度。在另一可能的实施方式中,组合体积模型的一个或多个部分的厚度可以基于用于打印主动脉瓣的3D模型的3D打印机的打印机设定来确定。例如,主动脉瓣根和/或主动脉瓣小叶的厚度可以被设置为与3D打印机能够打印的最小厚度对应的预定值(例如8mm)。在一个实施例中,使用标准厚度值确定主动脉根和瓣小叶的相应厚度。如果确定的主动脉根或瓣小叶的厚度小于3D打印机的最小厚度等级,则该厚度被增加到3D打印机的最小厚度等级。因为钙化病变在3D体积中被分割,所以厚度与每个被分割的钙化病变相关联。如果特定钙化病变的厚度(在任意方向)小于3D打印机的最小厚度等级,则钙化病变可以扩展到符合最小厚度等级。
图7图示了主动脉瓣和钙化病变的示例性组合体积模型。如图7中所示,图像700、710和720分别示出了主动脉瓣和钙化病变的组合体积模型的顶视图、仰视图和侧视图。
回到图1,在步骤110,使用3D打印机产生主动脉瓣和钙化病变的3D打印模型。3D打印模型是患者的主动脉瓣和钙化病变的患者特有物理3D模型,其使用3D打印机打印。一旦产生具有满足3D打印机的最小厚度等级的厚度的主动脉瓣和钙化病变的组合体积模型,主动脉瓣和钙化病变的组合体积模型就可以由3D打印机打印,从而产生主动脉瓣和钙化病变的物理3D打印模型。图1的图像210示出了主动脉瓣和钙化病变的示例性3D打印模型。3D打印机可以为单一材料3D打印机或多材料3D打印机。在使用单一材料3D打印机的情况下,3D打印模型可以使用柔性材料来打印,该柔性材料具有与主动脉瓣组织类似的柔性。在有利的实施例中,多材料3D打印机被用于产生3D打印模型,并且不同材料被用于主动脉瓣组织和钙化病变。具体来说,具有更大柔性的第一材料被用于主动脉瓣组织并且较硬的第二材料被用于钙化病变,以表示不同类型组织的真实组织特性。第一材料可以为具有与主动脉瓣组织的硬度特性的标准值相等或类似的硬度特性(例如杨氏模量)的材料,且第二材料可以为具有与钙化物质的硬度特性的标准值相等或类似的硬度特性的材料。如果主动脉瓣的硬度的患者特有测量值是可获得的,则第一材料可以被选择作为具有与患者的主动脉瓣的患者特有硬度测量值类似的硬度特性的材料。
图8图示了主动脉瓣和钙化病变的示例性3D打印模型。如图8中所示,图像800、810和820分别示出了主动脉瓣和钙化病变的患者特有3D打印模型的顶视图、仰视图和侧视图。
如以上所述,在图1的方法中,3D打印模型基于从3D医学图像体积估计的主动脉瓣的解剖表面模型和在3D医学图像体积中分割的钙化病变而产生。在各个实施例中,3D医学图像体积可以在主动脉瓣打开时被获取,以产生打开的主动脉瓣的3D打印模型,或者3D医学图像体积可以在主动脉瓣关闭时被获取,以产生关闭的主动脉瓣的3D打印模型。还可能的是,通过针对在心动周期期间的不同时间获取的各个3D体积重复图1的方法来产生多个3D打印模型。例如,医学图像数据可以包括在心动周期期间获取的4D(3D+时间)图像序列(例如4D CT图像序列),其中该序列的每一帧是3D体积。可以针对4D图像序列的各个帧重复图1的方法以产生处于打开位置和关闭位置的主动脉瓣和钙化病变的3D打印图像。例如,在心脏收缩期间获取的第一帧可以用于产生处于打开位置的主动脉瓣的3D打印模型,且心脏舒张期间获取的第二帧可以用于产生处于关闭位置的主动脉瓣的3D打印模型。
最终的3D打印模型可以用于针对TAVI规划的实践方法。不同的植入设备、设备类型和设备尺寸可以被放置在3D打印模型中以评估植入尺寸过大和尺寸不足的影响。另外,如上所述,钙化病变可以使用比主动脉瓣组织更硬的材料打印,以便类似钙化病变的真实组织特性,并且因此可以研究钙化病变对植入设备的最终扩张的影响。例如,钙化病变可以引起瓣膜的扩张不足,这能够引起脊椎旁渗漏和其他问题。本文描述的工作流程能够对于具有异常瓣膜形状(例如小的环但是大的扩张的主动脉瓣根)的患者来说特别有益于评估在TAVI过程之前特定的设备对患者的影响。除了规划TAVI过程,主动脉瓣和钙化病变的3D打印模型也可以用于训练。例如,3D打印模型可以用于训练操作特别是针对具有异常瓣膜形状的患者的植入的医师。3D打印模型也可以用于新的植入设备的设备测试。例如,新的植入设备可以被放置在3D打印模型内以便测试新的植入设备的各个特性,例如耐用性、功能性等。另外,主动脉瓣和钙化病变的3D打印模型可以用于构建和测试与3D打印模型的患者特有几何结构适配的个性化的植入设备。
图9图示了使用图1的方法产生的主动脉瓣的3D打印模型的另外的实施例。如图9中所示,行900示出了第一患者的主动脉瓣和钙化病变的患者特有3D打印模型的各个视图,行910示出了第二患者的主动脉瓣和钙化病变的患者特有3D打印模型的各个视图,并且行920示出了第三患者的主动脉瓣和钙化病变的患者特有3D打印模型的各个视图。
如上所述,图1的方法产生用于TAVI过程的患者特有规划的主动脉瓣和钙化病变的3D打印模型。然而,本发明不限于主动脉瓣和TAVI规划,并且图1的方法可以类似地应用于任何其他心脏瓣膜(例如肺动脉瓣、二尖瓣和三尖瓣)以产生用于心脏瓣膜介入的患者特有规划的心脏瓣膜的3D打印模型。
图10是能够实施本发明的装置的高级别框图。以上描述的用于规划心脏瓣膜介入的方法(例如TAVI)可以使用众所周知的计算机处理器、存储器单元、存储设备、计算机软件和其他部件在计算机1002上结合3D打印机1030被实施。计算机1002包含处理器1004,处理器1004通过执行限定这种操作的计算机程序指令来控制计算机1002的整个操作。计算机程序指令可以被存储在存储设备1012(例如磁盘)中,并且当期望执行计算机程序指令时被加载到存储器1010中。因此,图1和4的方法的步骤可以通过存储在存储器1010和/或存储装置1012中的计算机程序指令来限定,并且由执行计算机程序指令的处理器1004来控制。
图像获取设备1020(例如CT扫描仪)可以被连接到计算机1002,以将图像数据输入到计算机1002。可以将图像获取设备1020和计算机1002实施为一个设备。也可能的是,图像获取设备1020和计算机1002通过网络无线地通信。在可能的实施例中,计算机1002可以相对于图像获取设备1020被遥远地定位,并可以作为基于服务器或云的服务的一部分实施这些方法步骤。
3D打印机1030可以连接到计算机1002以打印主动脉瓣或其他心脏瓣膜的3D模型。3D打印机1030可以为单一材料3D打印机或多材料3D打印机。3D打印机1030可以利用任何类型的3D打印技术,包括但不限于立体平版印刷、熔融沉积成型、选择性激光烧结、选择性激光熔化、电子束熔化或层叠对象制造。3D打印机1030可以通过有线连接连接到计算机1002或3D打印机1030和计算机1002可以通过网络无线通信。在一个实施例中,3D打印机1030可以定位在计算机1002和图像获取设备1020附近,使得图1的方法的从图像获取到产生3D打印模型的所有方法步骤可以在本地实施。在另一实施例中,3D打印机1030和计算机1002可以相对于图像获取设备1020遥远地定位,并且图1的方法步骤可以作为基于服务器或云的服务的一部分被实施,其中物理3D打印模型一旦它被产生就被发送到客户或用户。在再另一实施例中,3D打印机1030可以相对于计算机1002和图像获取设备1020遥远地被定位,使得估计主动脉瓣的解剖表面模型、分割钙化病变和产生主动脉瓣和钙化病变的组合体积模型的方法步骤由计算机1002在本地实施,并且3D打印模型的打印由3D打印机1030作为基于服务器或云的服务的一部分被实施。
计算机1002还包括一个或多个网络接口1006,用于经由网络与其他设备通信。计算机1002还包括实现用户与计算机1002的交互的其他输入/输出设备1008(例如显示器、键盘、鼠标、扬声器、按钮等)。本领域技术人员将意识到,实际计算机的实施可能还包含其他部件,并且图10是出于说明目的的这种计算机的一些部件的高级别表示。
前面的详细描述要被理解为在每个方面都是说明性的和示例性的,而不是限制性的,并且本文公开的本发明的范围并不从详细描述来确定,而是从如根据由专利法允许的完整的宽度来解释的权利要求来确定。要理解的是,本文示出和描述的实施例仅说明本发明的原理,并且本领域技术人员在不偏离本发明的范围和精神的情况下可以实施各种修改。本领域技术人员在不偏离本发明的范围和精神的情况下可以实施各种其他特征组合。
- 还没有人留言评论。精彩留言会获得点赞!