一种黄蜀葵花醇提取物的应用的制作方法
本发明涉及一种黄蜀葵花醇提取物的应用,具体涉及黄蜀葵花醇提取物在保护和促进成纤维细胞生长方面的新用途,尤其涉及制备创伤愈合药物中的应用。
(二)
背景技术:
各种创伤均会造成不同程度的细胞变性、坏死和组织缺损,必须通过细胞增生和细胞间基质的形成来进行组织修复。成纤维细胞(fibroblast)是疏松结缔组织的主要细胞成分,是创伤修复过程中最主要的功能细胞,在细胞因子等因素的调控下,成纤维细胞发生增殖、迁移,并合成、分泌胶原和细胞外基质成分以及胶原酶等,参与肉芽组织形成、创口收缩、疤痕形成及组织重建的过程,保护和促进成纤维细胞生长是加速伤口愈合的基础与关键。同时成纤维细胞数量的增多有助于伤口愈合过程中毛囊的形成,进而降低皮肤愈合后落下疤痕的几率(Driskell R R,Lichtenberger B M,Hoste E,et al.Distinct fibroblast lineages determine dermal architecture in skin development and repair[J].Nature,2013,504(7479):277-281.)。
黄蜀葵(Abelmoschl manihot L medic)花为锦葵科植物黄蜀葵的干燥花。性味甘寒滑,无毒,具有清利湿热,消炎解毒之功效,内服主治五淋,水肿;外用治疗痈疽肿毒,烫伤,其花蕾在一些地方作为蔬菜食用,安全无毒。黄蜀葵花在我国分布广泛、资源丰富,种植容易,价廉。但目前除了黄葵胶囊,已成为治疗慢性肾小球肾炎、蛋白尿的药物外,黄蜀葵花的产品研发仍屈指可数。从历史典籍的记载和现代临床实践看,深化基础研究,扩大黄蜀葵花适应证,具有良好前景。目前有关黄蜀葵花的研究发现其具有抗感染作用、对心脑缺血性损伤的保护作用、抑制乙肝病毒作用、抗炎作用等。但黄蜀葵花的其它作用还需进一步研究和探索,还未见黄蜀葵花醇提取物对能保护和促进成纤维细胞生长方面的报道。
(三)
技术实现要素:
本发明目的是提供一种黄蜀葵花醇提取物的新用途,即在保护和促进成纤维细胞生长的新用途以及制备创伤愈合药物中的应用。
本发明采用的技术方案是:
本发明提供一种黄蜀葵花醇提取物在制备促成纤维细胞生长试剂中的应用。
进一步,所述促成纤维细胞生长试剂为创伤愈合药物。
进一步,所述黄蜀葵花醇提取物为干燥黄蜀葵花粉末,以乙醇水溶液回流提取、浓缩后得到的提取物。
进一步,所述黄蜀葵花醇提取物按如下方法制备:称取干燥黄蜀葵花,粉碎,过50目筛,获得粉末,加入体积浓度80%乙醇水溶液,加热回流提取3次,每次2h,过滤,合并滤液,减压回收乙醇,获得浸膏,即为黄蜀葵花醇提取物;所述乙醇水溶液体积用量以粉末质量计为10ml/g。
进一步,所述试剂中黄蜀葵花醇提取物终浓度为100~1000μg/ml。
进一步,所述试剂中黄蜀葵花醇提取物终浓度为100~500μg/ml。
进一步,所述创伤愈合药物包括黄蜀葵花醇提取物和药用可接受的载体。
进一步,所述创伤愈合药物为口服剂、外用剂、注射剂或复方制剂。
进一步,所述创伤愈合药物中黄蜀葵花醇提取物有效浓度为100~1000μg/ml,优选500μg/ml。
本发明黄蜀葵花醇提取物能够非常显著地促进成纤维细胞增殖。黄蜀葵花醇提取物各个浓度均能明显地促进成纤维细胞增殖,提高细胞活力,500μg/ml作用最显著,使细胞活力增加了42.8%;此外,当浓度达到1000μg/ml时,细胞活力虽不再增加,但仍在正常水平之上且与正常组有极显著差异(p<0.001),由此可以看出,黄蜀葵花醇提取物有极明显的生物活性且对细胞几乎无毒性,它对创口愈合的促进作用与其促成纤维细胞增殖作用密切相关。
在成功建立H2O2诱导NIH-3T3细胞损伤模型的基础上,研究黄蜀葵花醇提取物抗成纤维细胞氧化损伤的作用。结果显示,黄蜀葵花醇提取物浓度100~1000μg/ml能显著减轻过氧化损伤,提高受损细胞活力,减少细胞內酶LDH释放。其中500μg/ml的黄蜀葵花醇提取物抗氧化损伤效果最理想。
机械划痕实验结果表明,黄蜀葵花醇提物各个浓度均能不同程度地促进成纤维细胞迁移,加快划痕愈合,其中500μg/ml组细胞迁移速度最快。可以认为黄蜀葵花醇提取物通过促进成纤维细胞迁移来加快创面愈合。
与现有技术相比,本发明的有益效果主要体现在:
(1)本发明对黄蜀葵花醇提取物发掘了新的医疗用途,开拓了一个新的应用领域。
(2)本发明首次提出并证明黄蜀葵花醇提取物的保护和促进成纤维细胞生长作用,效果显著,预示着很好的药用前景。
(3)本发明的黄蜀葵花醇提取物原料来源丰富、价廉,制备方法简单、成本低,可制成各种口服剂型,使用方便。
(4)本发明的黄蜀葵花醇提取物具有显著的促进创口愈合作用,毒副作用小。
(四)附图说明
图1是黄蜀葵花醇提取物(HSK)对成纤维细胞增殖活性的影响;
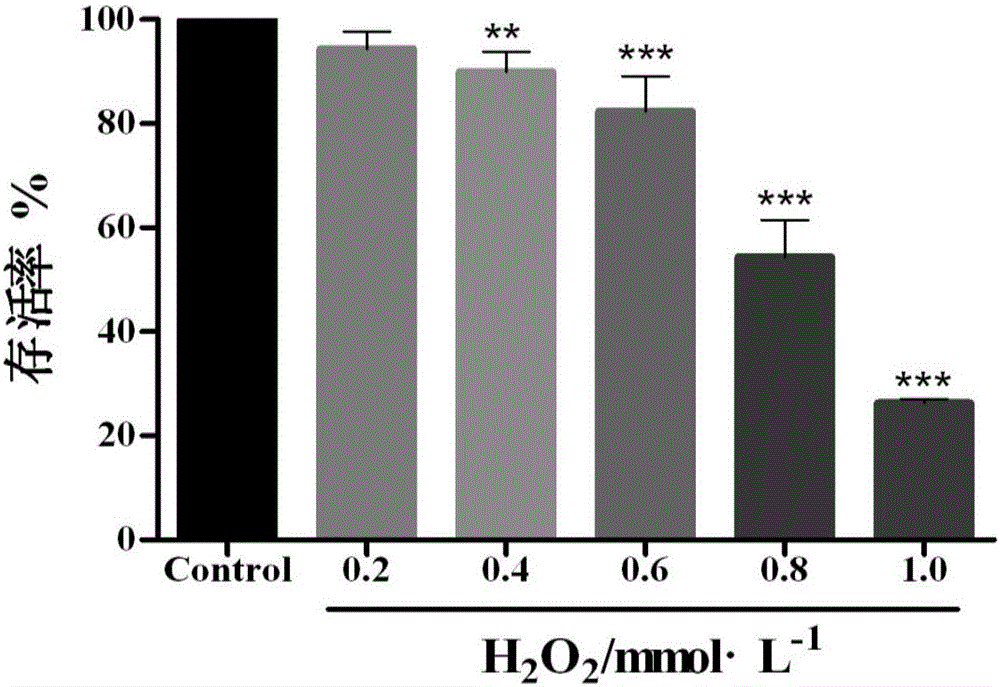
图2是不同浓度H2O2对细胞存活率的影响;
图3是不同浓度黄蜀葵花醇提取物抗NIH-3T3细胞氧化损伤作用;
图4是不同浓度黄蜀葵花醇提取物对细胞上清液中LDH活性的影响;
图5是黄蜀葵花醇提取物对0.2mmol/L H2O2连续损伤下NIH-3T3细胞的保护作用;
图6是黄蜀葵花醇提取物对0.8mmol/L H2O2连续损伤下NIH-3T3细胞的保护作用;
图7是不同浓度黄蜀葵花醇提取物对细胞迁移率的影响;
图8是不同时间点的NIH-3T3细胞迁移率比较图。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1 黄蜀葵花醇提取物(HSK)
称取干燥黄蜀葵花(购自安徽亳州中药材市场),粉碎,过50目筛,获得粉末50g,加入体积浓度80%乙醇水溶液500ml,加热回流提取3次,每次2h,过滤,合并滤液,减压回收乙醇,获得浸膏,即为黄蜀葵花醇提取物6.65g。
按浸膏得率%=浸膏重量/原料重量×100%计算,可得浸膏得率为13.3%,其浓度为含生药7.52g/g浸膏。
实施例2 细胞增殖实验
实验原理:设置不同终浓度的黄蜀葵花醇提取物组,分别作用于细胞,MTT法测定细胞活力,观察黄蜀葵花醇提取物对NIH-3T3细胞增殖活性的影响。
实验方法:取生长状态良好、处于对数期的NIH-3T3细胞,以1.0×104个/孔接种于96孔培养板,37℃、5%CO2孵育24h。随机分成对照组和实验组(组1-组5),每组6个复孔。吸弃上清液,对照组加入DMEM完全培养液(购自上海吉诺医药生物技术有限公司),实验组加入不同终浓度的黄蜀葵花醇提取物(组1-组5生药量分别为10、50、100、500、1000μg/ml),每孔100μl,继续培养24h后,每孔加入20μl MTT(5mg/ml,购自Sigma),孵育4h,弃上清,加入150μl DMSO完全培养液完全溶解后,置于酶标仪上490nm处测定各组吸光度,比较黄蜀葵花醇提取物对成纤维细胞增殖能力的影响。各组实验均重复3次。结果见图1所示。由图1可知,以正常组细胞活力为100%基础,观察黄蜀葵花醇提取物作用24h时细胞的增殖情况,可见在一定浓度范围内,细胞活力随黄蜀葵花醇提取物浓度的增大而升高,当黄蜀葵花醇提取物浓度达到500μg/ml时,细胞活力值最大,比正常组提高了42.8%;进一步升高浓度,细胞活力反而下降,但仍在基础活力之上。本实验结果证明:(1)黄蜀葵花醇提取物能够有效地促进成纤维细胞增殖,且500μg/ml是其促增殖作用的最佳浓度;(2)黄蜀葵花醇提取物无细胞毒性,即使高浓度(1000μg/ml)仍然促进细胞增殖。本实验结果为局部应用黄蜀葵花醇提取物提供了治疗浓度参考依据(100~500μg/ml)。
实施例3 H2O2诱导NIH-3T3细胞损伤模型的建立
实验原理:设置不同浓度的H2O2损伤NIH-3T3细胞,通过MTT法测定细胞活力摸索H2O2诱导NIH-3T3细胞损伤的最佳条件。
实验方法:将处于对数期生长的NIH-3T3细胞,按1.0×104个/孔的密度接种于96孔板,37℃、5%CO2培养箱中孵育24h。实验分对照组和实验组(组1-组5)。对照组弃上清后直接加入100μl含体积浓度10%FBS的DMEM完全培养液。实验组弃上清液后,每组分别加入不同浓度的H2O2,用DMEM完全培养液补足至每孔100μl体积,使H2O2的终浓度分别为0.2、0.4、0.6、0.8和1.0mmol/L,放回培养箱中培养24h。用MTT法测定各组细胞活力,计算细胞存活率,选择最适浓度作为下一步实验的损伤条件。各组实验均重复3次。实验结果如图2。由图2可知,H2O2对NIH-3T3细胞的损伤效果呈剂量依赖关系。H2O2浓度越大,细胞活力越低,损伤越重;但是低浓度(0.2~0.6mmol/L)的H2O2对细胞的损伤作用较弱,0.6mmol/L H2O2损伤24h后细胞活力仍在80%以上;当H2O2浓度过高(≥1.0mmol/L)时,大部分细胞已经死亡,细胞存活率仅为正常细胞的20%左右,损伤过重;而当H2O2浓度为0.8mmol/L时,细胞的存活率为正常组细胞的58.09%,符合实验要求,故选择0.8mmol/L的H2O2损伤24h为造模条件。
实施例4 抗H2O2所致NIH-3T3细胞损伤实验
实验原理:设置5个的黄蜀葵花醇提取物浓度组,测定损伤后的细胞活力和上清液LDH含量,评价黄蜀葵花醇提取物抗H2O2诱导的NIH-3T3细胞损伤作用,同时建立不同处理组细胞的生长曲线,观察黄蜀葵花醇提取物对细胞持续性损伤的作用。
实验方法:
①MTT法检测HSK对H2O2损伤的NIH-3T3细胞的作用
将细胞随机分为对照组、模型组和实验组(组1-组5),共7组,每组6个复孔。对照组加DMEM完全培养液100μl/孔,模型组和实验组用含终浓度0.8mmol/L H2O2的DMEM完全培养液100μl损伤(方法同实施例3)后,再分别加入实施例1制备的黄蜀葵花醇提取物至生药量终浓度分别为10、50、100、500、1000μg/ml,置于CO2培养箱中继续培养24h。以MTT法在490nm波长处测定各组OD值,计算细胞存活率,评价黄蜀葵花醇提取物抗NIH-3T3细胞氧化损伤的能力。各组实验均重复3次。结果见图3所示。
由图3可知,黄蜀葵花醇提取物具有良好的抗NIH-3T3细胞氧化损伤作用,其中100~1000μg/ml浓度的黄蜀葵花醇提取物抗损伤效果显著,能明显提高NIH-3T3细胞的存活率。且当浓度为500μg/ml时,抗损伤能力最强,细胞存活率比模型组提高了19.6%。综上所述,黄蜀葵花醇提取物具有明显的抗H2O2诱导的成纤维细胞损伤作用。
②黄蜀葵花醇提取物对细胞上清液中LDH含量的影响
取上述实验处理后各孔细胞上清液,采用乳酸脱氢酶测定试剂盒(LDH,批号20140718,购自南京建成生物工程研究所)按以下步骤测定LDH含量(按试剂盒说明书操作):
(1)试剂及配制:
试剂一:基质缓冲液,5ml×1瓶,4℃保存;
试剂二:辅酶Ⅰ,粉剂×1支,-20℃冷冻保存;用时每支粉剂加1.3ml双蒸水溶解,分装冷冻保存(防止反复冻融);
试剂三:2,4-二硝基苯肼,5ml×1瓶,4℃避光保存;
试剂四:4mol/L NaOH,5ml×1瓶,4℃保存;用时用双蒸水稀释10倍;
试剂五:2μmol/ml丙酮酸标准液,1ml×1支;用时用双蒸水稀释10倍。
(2)测定步骤如表1:
表1 LDH含量测定方法
混匀,室温放置5min,于波长450nm处,酶标仪测定吸光度。
按以下公式计算细胞上清液中的LDH含量,结果见图4所示:
由图4可知,细胞氧化损伤后LDH释放量大大增加,而经不同浓度的黄蜀葵花醇提取物处理后,细胞外LDH活力明显下降,其中高浓度黄蜀葵花醇提取物(100~1000μg/ml)效果尤为突出,500和1000μg/ml组LDH活性与正常组无显著性差异,而黄蜀葵花醇提取物终浓度为500μg/ml时效果最佳。说明黄蜀葵花醇提取物能够有效降低细胞的氧化损伤程度,维持细胞膜完整性,减少细胞内酶溢出,抑制细胞死亡。
③绘制生长曲线研究黄蜀葵花醇提取物对细胞持续性损伤的作用
(1)将生长状态良好、处于对数期的NIH-3T3细胞,按5.0×103个/孔接种于96孔板中,于37℃、5%CO2条件下培养,待细胞贴壁伸展后立即开始实验,将实验细胞随机分为7组,即:正常对照组、H2O2损伤组和实验组(即黄蜀葵花醇提取物保护组,设置5个浓度)。正常对照组和H2O2损伤组分别加入DMEM完全培养液100μl。实验组分别加入加入DMEM完全培养液100μl并加入实施例1制备的黄蜀葵花醇提取物至生药量终浓度分别为10、50、100、500、1000μg/ml,37℃、5%CO2培养箱中孵育24h后,弃上清液,对照组加DMEM完全培养液,损伤组和实验组分别加入含终浓度0.2mmol/L H2O2的DMEM完全培养液,每孔100μl。换液后开始计时,分别于第0、6、12、24、36、48、60、72h各取6孔,以MTT法测定细胞活力,绘制细胞生长曲线,结果见图5所示。
(2)同样将细胞随机分成7组进行实验,方法及步骤同(1),但损伤组和实验组分别加入终浓度0.8mmol/L的H2O2,同样方法分别测定0、6、12、24、36、48、60、72h的细胞活力,绘制生长曲线,结果见图6所示。
由图5和图6可知,正常组细胞生长曲线呈“S”型,损伤组细胞活力明显下降,黄蜀葵花醇提取物在一定程度上减少H2O2对细胞的氧化损伤。当0.2mmol/L H2O2连续损伤数小时后,NIH-3T3细胞生长被抑制,生长曲线持续、缓慢线性下降;黄蜀葵花醇提取物保护组细胞活力较损伤模型组有极显著提高(p<0.001),细胞仍保持一定的增殖能力,表明黄蜀葵花醇提取物能够有效抗成纤维细胞氧化损伤,促进细胞增殖。但是,当0.8mmol/L H2O2连续损伤时,黄蜀葵花醇提取物仅在24、36h能明显降低细胞损伤(p<0.001),保持一定的细胞活力;当细胞持续损伤48h之后,黄蜀葵花醇提取物保护组细胞活力与损伤组无异,说明黄蜀葵花醇提取物对成纤维细胞持续性严重损伤无保护作用。
实施例5 划痕实验
实验原理:建立成纤维细胞机械划痕损伤模型,检测细胞移动性,观察黄蜀葵花醇提取物对机械划痕损伤后细胞迁移率的影响。
实验方法:取生长状态良好、处于对数期的NIH-3T3细胞,按5.0×104个/孔接种于24孔板。待其生长至接近90%融合时,用20μl无菌枪头沿孔中央垂直直线划痕,PBS洗涤2~3次,除去划痕边缘脱落细胞,随机分为对照组和3个实验组,每组6个复孔。对照组加DMEM完全培养液,实验组分别加入含不同生药量终浓度黄蜀葵花醇提取物(100、500、1000μg/ml,实施例1制备)的DMEM完全培养液,每孔400μl,37℃、5%CO2培养箱中培养。分别于划痕后0、6、12、24、36、48h用倒置显微镜观察拍照,每孔选择3个视野,并计算细胞迁移率,按迁移率%=(0h划痕面积-t h划痕面积)/0h划痕面积×100%,考察药物对机械损伤后NIH-3T3细胞迁移率的影响。实验结果如图7~图8所示。
由图7和图8可知,机械性划痕损伤后,可见划痕周围出现空白条状区域,划痕两侧边缘整齐,周围细胞的胞体、突起结构均消失。划痕一定时间后,细胞开始向空白区域迁移,黄蜀葵花醇提取物实验组迁移速度明显加快,在划痕后12、24h,黄蜀葵花醇提取物实验组与正常组相比,明显可见更多细胞向空白划痕区域移动,划痕区相对宽度和划痕面积明显减小。综合分析可以看出,黄蜀葵花醇提取物能明显促进成纤维细胞迁移,其中500μg/ml组细胞迁移速度最快。
实施例6 黄蜀葵花醇提取物(HSK)对烫伤小鼠创面愈合情况的影响
1.实验动物分组及给药
将50只小鼠随机分成5组,即模型组、阳性对照组和HSK(30、60、120mg/cm2)组,每组10只,雌雄各半。各组小鼠分别脱毛,于24h后再分别用烫伤仪(2号烫头,面积3.0cm2)造小鼠背部深Ⅱ度烫伤模型,造模后1h开始给药,模型组创面不作任何处理,对照组外用湿润烧伤膏(MEBO)100mg/cm2,HSK组分别给予不同剂量的实施例1制备的黄蜀葵花醇提取物(30、60、120mg/cm2),采用湿润疗法连续给药,第1周外涂药物,每4~6h换药一次,每天4次,每次换药前用温水清洗创面,除去残留药物;第2~3周,皮肤开始再生修复,每6~8h换药一次,每天3次;3周之后直到愈合,每天早晚各给药一次,各阶段均暴露创面给药,使药物均匀覆盖创面为宜且给药厚度小于1mm。
2.创面愈合率及愈合时间的测定
分别于造模后1h和7、14、21d四个时间点,测量每只小鼠的创面直径,计算创面面积,并以烫伤后1h的创面面积作为烫伤面积,分别计算创面愈合率,并且观察记录每组小鼠创面完全愈合的时间,比较HSK在烫伤创面愈合过程中的影响。按以下公式计算创面愈合率:
创面愈合率%=(烫伤面积-创面面积)/烫伤面积×100%。
3.结果
3.1创面愈合率情况
深Ⅱ度烫伤后,表皮坏死、皮肤正常功能受损,需借助创面周围的正常细胞进行增殖和修复,一般无感染情况下4周左右创面即可愈合。从7、14、21d的创面愈合率结果(表2)可以看出,HSK和阳性对照药MEBO均能不同程度地促进创面愈合,其中HSK高剂量组效果最显著(p<0.001),21d时的创面愈合率已高达95%以上,比模型组提高了将近20%。与模型组(Model)比较,MEBO组和各剂量的HSK组不同时间点的愈合率均显著提高(p<0.05);与阳性对照组(MEBO)比较,HSK低、中剂量组各时间点的愈合率虽有差距,但高剂量HSK组与MEBO组无显著性差异(p>0.05)。由此可知,HSK能够显著性促进创面愈合,是有效的促进烫伤修复的药物。
表2 药物对小鼠烫伤创面愈合率的影响(Mean±SD,n=10)
与模型组(model)比较,*p<0.05,**p<0.01,***p<0.001
3.2创面完全愈合时间
各实验组小鼠创面完全愈合时间结果如表3。从实验结果可知,HSK能明显缩短创面愈合时间,且呈剂量依赖关系。高剂量HSK效果最佳,与MEBO相当,其创面愈合时间比模型组加快了一周左右。综合创面愈合率及愈合时间分析,HSK能显著提高创面愈合速度,缩短愈合时间,促进烫伤愈合。
表3 药物对小鼠创面完全愈合时间的影响(Mean±SD,n=10)
与模型组(Model)比较,*p<0.05,***p<0.001
4.结论
通过对小鼠深Ⅱ度烫伤创面的愈合率、愈合时间等最为直观的愈合指标的测定发现,HSK能显著提高创面愈合率、减少创面完全愈合所需的时间;其中高剂量的HSK效果最显著,与阳性对照药相当,均表现出较好的促进烫伤创面愈合效果。
- 还没有人留言评论。精彩留言会获得点赞!