一种载喜树碱类抗肿瘤药物脂质体、制备方法及其应用与流程
本发明涉及一种载喜树碱类抗肿瘤药物脂质体,该载药脂质体的制备方法,及其在肿瘤治疗中的应用。
背景技术:
伊立替康(CPT-11)是喜树碱的半合成衍生物,被批准用于多种癌症疾病的治疗,CPT-11以拓扑异构酶为靶向部位,与抑制拓扑异构酶I-DNA复合物结合,从而阻止断裂单链的再连接,使DNA双链结构解旋而发挥抗肿瘤作用。但水溶性CPT-11进入体内后存在不稳定、消除快、血药浓度维持时间短等缺陷;此外,CPT-11在体内转化成具有抗癌作用的活性成分7-乙基-10-羟基喜树碱(SN38)需要羧酸酯酶的酶解,但转化率不到8%,导致生物利用率极低。同时鉴于SN38的体外活性高于CPT-11活性的100~1000倍。因此,直接利用SN38分子,避开对CPT-11进行酶解从而释放SN38的途径,可望有效提高药物的抗肿瘤效果。但是SN38的水溶性很差,且不溶于药剂学上可以接受的溶剂(如吐温或者聚氧乙烯蓖麻油),因此无法直接用于临床注射。
现有技术制备的喜树碱或其衍生物制剂,在临床使用中存在半衰期短、生物利用度低并且毒副作用明显等缺点。为了解决上述技术缺陷,人们采用脂质体包封喜树碱及其衍生物,提高药物的溶解性,增强药物的靶向性,提高生物利用度以及降低毒副作用。
脂质体最初由英国研究者Bangham和Standish等作为生物膜模型提出。Bangham将磷脂分散在水中进行电镜观察时发现,磷脂分散在水中自然形成多层囊泡,每一层均为脂质的双分子层,囊泡中间和各层之间被水相隔开。后来,将这种由磷脂双分子层组成,内部为水相的、具有类似生物膜结构的双分子小囊称为脂质体。20世纪70年代初,英国Gregoriadis和Rymen等根据脂质体的特点,提出将脂质体作为药物载体的可能性,并用脂质体β-半乳糖苷酶载体治疗累积疾病,研究发现药物经脂质体包封后,药物动力学和药物在体内的分布发生了很大的变化,药物在体内的半衰期大大延长,药物的毒副作用也得到明显的改善(Gregoriadis G,Ryman BE.Liposomes as carriers of enzymes or drugs:a new approach to the treatment of storage diseases.Journal of Biochemistry.1972,129:123-132)。此后,人们开始广泛运用脂质体包裹药物。阿霉素脂质体(Doxil)是第一个抗肿瘤药物脂质体,于1995年在美国获得FDA批准。研究表明,Doxil能显著延长阿霉素在体内的循环时间,盐酸阿霉素普通注射液的半衰期为10.4h,而经PEG修饰的阿霉素脂质体Doxil的半衰期延长至84h,且明显降低了阿霉素对心脏的毒副作用(K.Maruyama,Intracellular targeting delivery of liposomal drugs to solid tumors based on EPR effects,Advanced drug delivery reviews,2011,63,161-169.)。
ZL95190971.1公开了一种脂质体前体和高效包载力脂质体的制备方法、装置及应用,该法通过一层或多层形成脂类化合物的薄层溶解在至少一种有机溶剂中形成具有高效包载力的脂质体,但该法要求被包封的药物具有良好的亲水性或亲脂性,应用范围有限。
我们前期的实验中显示,SN38由于其独特的化学结构,与脂质体并不相容,从而导致SN38无法导入脂质体的药物输送体系和较低的包封率,或存在药物在体内快速释放的问题。针对现有喜树碱脂质体技术存在的问题,本发明目的在于提供一种亲脂性喜树碱药物前体用于构建载药脂质体体系,提高喜树碱药物的临床应用范围和应用价值。
技术实现要素:
本发明的第一目的在于提供一种载喜树碱类抗肿瘤药物脂质体,从而进一步提高喜树碱药物制剂的疗效,推广喜树碱在肿瘤治疗中的应用。
为实现第一目的,本发明采用如下技术方案:
一种载喜树碱类抗肿瘤药物脂质体,由脂质体双分子层和喜树碱类抗肿瘤药物组成;所述脂质体双分子层由磷脂、胆固醇和PEG修饰物制成。各组分重量百分比如下:喜树碱类抗肿瘤药物0.01~20%,磷脂30~70%,胆固醇0.05~30%,PEG修饰物0.1~20%。
一种载喜树碱类抗肿瘤药物脂质体的制备方法,主要包括:磷脂、胆固醇、PEG修饰物以一定摩尔比溶解在乙醇中,将抗肿瘤药物(溶于二甲基亚砜)滴入上述乙醇溶液中,将得到的混合溶液注入水中,高速离心收集,得到负载抗肿瘤药物的脂质体。
所述磷脂选自卵磷脂(蛋黄卵磷脂、大豆卵磷脂)、脑磷脂、磷脂酰甘油、磷酯酰丝氨酸、鞘磷脂、二棕榈酰磷脂酰胆碱(DPPC)、二棕榈酰磷脂乙醇胺(DPPE)、二硬脂酰磷脂酰胆碱(DSPC)中的一种或多种组成的混合物。优选为卵磷脂,进一步优选为蛋黄卵磷脂。
所述PEG修饰物选自PEG-磷脂酰乙醇胺、mPEG-磷脂酰乙醇胺、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(DSPE-PEG)、二硬脂酰基磷脂酰乙醇胺-甲氧基聚乙二醇(DSPE-mPEG)中一种或多种的混合物。优选为DSPE-PEG,进一步优选为DSPE-PEG2000和DSPE-mPEG2000。
所述的喜树碱类抗肿瘤药物是由7-乙基-10-羟基喜树碱通过酯键与不饱和脂肪酸连接形成的药物前体。作为优选,所述的不饱和脂肪酸为全反式维甲酸(RA)、二十二碳六烯酸(DHA)、亚麻酸(LNA)或亚油酸(LA),进一步优选为亚油酸。
本发明提供了一种载喜树碱类抗肿瘤药物脂质体的制备方法,首先采用不饱和脂肪酸对喜树碱药物进行分子改性,赋予药物的亲脂性,再采用脂质体载体负载该抗肿瘤药物前体,使用本发明方法制备的抗肿瘤药物脂质体药物包封率高达80%。
该制备方法包括以下具体步骤:
第一步:对喜树碱衍生物7-乙基-10-羟基喜树碱(SN38)进行分子改性,偶联不饱和脂肪酸,赋予药物分子亲脂性。而亲脂性SN38衍生物能够在体内释放具有抗癌活性的SN38分子;
第二步:构建可负载第一步SN38前药的脂质体,由脂质体双分子层和SN38组成,所述的脂质体双分子层包含磷脂、胆固醇和PEG修饰物。
本发明还提供了一种载喜树碱类抗肿瘤药物脂质体在制备抗癌药物中的应用。本发明的载喜树碱类抗肿瘤药物脂质体,在体外释放中表现持续缓慢的释放,且有效延长药物在体内的循环时间、增加药物的靶向性。
附图说明
图1为实施例5得到的载药脂质体的电镜和粒径图;
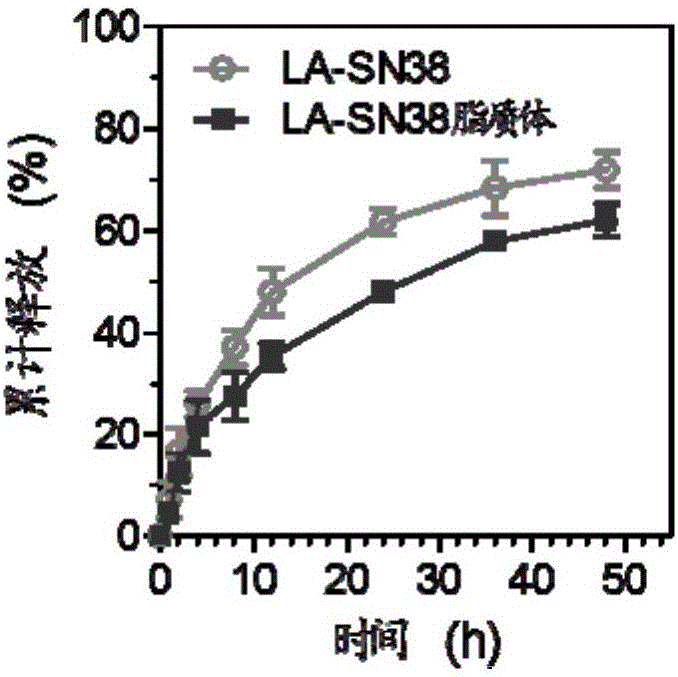
图2为测试例1中载药脂质体体外释放曲线;
图3为测试例3中载药脂质体的药物动力学曲线;
图4为测试例4中载药脂质体的肿瘤靶向性;
图5为测试例5中载药脂质体体内抑制肿瘤增长的效果图;
图6为测试例5中载药脂质体对裸鼠体重的变化的影响。
图中,SN38表示7-乙基-10-羟基喜树碱,LA表示亚油酸,RA表示全反式维甲酸,LNA表示亚麻酸,DHA表示二十二碳六烯酸,LA-SN38表示亚油酸与SN38偶联物,LNA-SN38表示亚麻酸与SN38偶联物,RA-SN38表示全反式维甲酸与SN38偶联物,DHA-SN38表示DHA与SN38偶联物。
具体实施方式
下面结合附图和具体实施方式对本发明作进一步详细说明,但本发明并不受其限制。
实施例1
亚油酸-SN38(LA-SN38)合成方法参考申请人前期专利“7-乙基-10-羟基喜树碱药物前体及其制备方法和应用”,专利申请号为201410295432.X。
实施例2
RA-SN38合成方法参考申请人前期专利“一种全反式维甲酸-喜树碱类抗癌药物偶联物及其制备方法和应用”,专利申请号或专利号为201410692682.7。
实施例3
亚麻酸-SN38合成方法参考申请人前期专利“7-乙基-10-羟基喜树碱药物前体及其制备方法和应用”,专利申请号为201410295432.X。
实施例4
DHA-SN38合成方法参考申请人前期专利,专利申请号为201410295432.X。
实施例5
实施例1中抗肿瘤药物前体脂质体的制备方法如下:
蛋白卵磷脂(7.2mg)、胆固醇(1.9mg)、DSPE-PEG2000(0.9mg)溶于900μL乙醇溶剂中,将实施例1中制备得到的抗肿瘤药物前体LA-SN38(10mg/mL溶于DMSO)取100μL滴入上述乙醇溶液中,再将得到的混合溶液注入水中,高速离心收集,得到负载抗肿瘤药物的脂质体。电镜下观察到纳米粒呈较好的圆形,大小均匀(144±18nm),采用动态光散射法测定纳米粒粒径大小在152nm,与电镜结果保持较好的一致性(如图1)。
采用高效液相色谱(HPLC)测定脂质体中抗肿瘤药物的浓度,计算得到该制备方法中脂质体载药率7.1%,包封率83.4%。
实施例6
实施例2中抗肿瘤药物前体脂质体的制备方法如下:
大豆卵磷脂(5.3mg)、胆固醇(3.2mg)、DSPE-mPEG2000(1.5mg)溶于900μL乙醇溶剂中,将实施例2中制备得到的抗肿瘤药物前体RA-SN38(10mg/mL溶于DMSO)取100μL滴入上述乙醇溶液中,再将将得到的混合溶液注入水中,高速离心收集,得到负载抗肿瘤药物的脂质体。
以下通过测试例进一步阐明本发明所述脂质体对肿瘤的治疗效果:
测试例1 抗肿瘤药物脂质体体外释放实验
将实施例5制备的载药脂质体置于分子量为14kDa的透析袋中,释放条件为pH 7.4的磷酸缓冲液(含0.2%的吐温80),37℃,转速为100r/min的环境中,不同时间点取出外界磷酸缓冲液,用HPLC测得SN38含量,从而得到脂质体中药物的体外释放情况。由图2可看出,与LA-SN38自由药物相比,由于疏水性脂质双分子层的保护作用,药物从脂质体中释放速度较慢,24h仅释放48%的药量。脂质体的这种缓慢的持续释放有利于药物在体内的长时间循环,有望提高药物疗效。
测试例2
考察实施例5中抗肿瘤药物脂质体对肿瘤细胞增殖的抑制作用,具体方法如下:
取对数生长期细胞,接种于96孔培养板(1×104个细胞/孔)。放入在37℃细胞培养箱中恒温培养48h后,加入实施例5中抗肿瘤药物脂质体,每种药每个浓度4个重复值,加完药后将96孔细胞板放入细胞培养箱中培养72h后,在96孔板的每孔内加入30μL的四甲基偶氮唑蓝(MTT,5mg/mL),继续放入细胞培养箱中培养4h后,吸弃培养基,每孔加入100μL二甲亚砜,用酶标仪检测492nm处的吸光值。计算细胞存活率,绘制出细胞存活曲线,得到药物对细胞生长的IC50(半数抑制浓度)。抗肿瘤药物脂质体对各种肿瘤细胞的体外毒性结果见表1。
表1实施例5中抗肿瘤药物脂质体对肿瘤细胞的IC50
表1结果显示,与实施例5中抗肿瘤药物脂质体共培养48h后,对实验的四种肿瘤细胞(HCT-116、HT-29、BEL-7402和Huh-7)的存活率都有一定的影响。具体作用体现在:实施例5中制备的抗肿瘤药物脂质体对BEL-7402、HT-29、Huh-7和HCT-116细胞的IC50值分别是CPT-11(临床抗肿瘤用药)组的4.2、9.4、11.2和18.7倍。载药脂质体纳米粒在体外显示较好的抑制肿瘤细胞增殖的能力。
测试例3 载药脂质体的药物动力学评价
SD大鼠(250±20g),2组,每组4只,实施例5中制备的LA-SN38脂质体单次静脉用药(SN38等同剂量8mg/kg)。分别在用药后5min、15min、30min、1h、2h、4h、8h和24h后取血(0.5mL),4000rpm离心10min。采用HPLC检测血液中的药物含量。不同时间血液中的药物含量如图3所示。与自由LA-SN38相比,LA-SN38脂质体在体内具有更长的循环时间,更有利于药物发挥长时间药效。
测试例4 载药脂质体的肿瘤靶向性评价
Balb/c荷瘤裸鼠(瘤体体积500mm3左右),静脉注射200μL由DiR标记的载药脂质体(实施例5中制备)。采用活体成像技术观察药物在小鼠体内的实时分布,并取出裸鼠的脏器组织和瘤体,对其荧光强度进行定量分析。实验结果如图4所示,用药后6h和24h,肿瘤组织中的荧光强度与其他正常组织(心、肝、脾、肺、肾)相比,显著性增强,显示了载药脂质体较强的肿瘤靶向性。
测试例5 载药脂质体的体内抗肿瘤药效评价
Balb/c裸鼠移植肿瘤2周后,分成4组:生理盐水、伊立替康、实施例1制备的LA-SN38、实施例5制备的载药脂质体LA-SN38脂质体组,每组7只。每隔三天一次尾静脉给药,总共4次。以第一次给药为0天,每隔三天测量瘤体体积变化进行结果统计。对皮下肝癌瘤的药效评价结果见图5。由图可知,实施例5中制备的LA-SN38脂质体组,相对于临床伊立替康对抑制肿瘤生长具非常显著的效果,且优于由实例1中LA-SN38制备纳米药物。用药后,各组裸鼠体重变化趋势保持一致(图6)。体内试验进一步证实,本发明中制备的载药脂质体具有较强的抑制肿瘤增长的能力,并且对用药动物无明显毒副作用。
- 还没有人留言评论。精彩留言会获得点赞!