一种共装载化疗药物和放疗药物的蛋白及其应用的制作方法
本发明涉及医药技术领域,尤其涉及一种共装载化疗药物和放疗药物的蛋白及其应用。
背景技术:
癌症是21世纪威胁人类健康的几种重大恶性疾病之一。虽然从上世纪50年代起,数十年中大量的人力、物力、财力被投入到癌症的预防和治疗中,但在这方面人类所取得的进展依然十分有限。
手术、放疗和化疗一起并称癌症的三大治疗手段。化疗是化学药物治疗的简称,通过使用化学治疗药物杀灭癌细胞达到治疗目的。化疗是一种全身治疗的手段,无论采用什么途径给药(口服、静脉和体腔给药等),化疗药物都会随着血液循环遍布全身的绝大部分器官和组织。因此,对一些有全身播撒倾向的肿瘤及已经转移的中晚期肿瘤,化疗都是主要的治疗手段。放射治疗,包括内放疗和外放疗,是利用各种不同能量的射线照射肿瘤,以抑制和杀灭癌细胞。其中内放疗是利用放射性同位素产生的α、β、γ射线。大约70%的癌症患者在治疗癌症的过程中需要用放射治疗,约有40%的癌症可以用放疗根治。将放疗与化疗联合治疗能够有效的提高治疗效果。但是传统化疗和内放疗在肿瘤富集率低,肿瘤耐药性强,治疗副作用大。近年来,随着纳米医学的发展,利用多功能的纳米载体可显著地增强化疗小分子和放疗核素在肿瘤的富集,进而增强肿瘤治疗的效果。但是肿瘤乏氧微环境导致肿瘤对放疗和化疗都表现出抗性,改善肿瘤的乏氧微环境对于提高疗效有重要的意义。
但是现有的一些纳米载体生物相容性差,会长期的滞留在生物体内,而且材料的制备过程复杂,成本高,这些都限制了进一步的应用。采用一种简单的方法合成纳米材料共负载放疗药物和化疗药物用于肿瘤的联合治疗与显像还未曾报道过。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种共装载化疗药物和放疗药物的蛋白及其应用,共装载化疗药物和放疗药物后其效果显著优于单独装载放疗药物或单独装载放疗药物。
本发明提供了一种共装载化疗药物和放疗药物的蛋白。
本发明以蛋白为载体,将放疗药物和化疗药物共同装载在蛋白上,从而使得制得的产品能够可实现放疗和化疗的联合治疗,且可用于肿瘤的成像。由于蛋白在血液中大量存在,具有良好的生物相容性,从而使得本发明制得的装载有放疗、化疗药物的蛋白能够在生物体内具有良好的分散性,进而提高肿瘤的防治和/或成像效果。
本发明提供的共装载化疗药物和放疗药物的蛋白中蛋白为白蛋白;化疗药物为紫杉醇;放疗药物为I-131。
白蛋白(又称清蛋白,albumin,Alb),为含585个氨基酸残基的单链多肽,分子量为67kDa,分子中含17个二硫键,不含有糖的组分。白蛋白是血浆中含量最多的蛋白质,占血浆总蛋白的40%~60%。紫杉醇(Paclitaxel,PTX)分子量为854Da,分子式为C47H51NO14,是一种经典的小分子化疗药物,在临床中已经有广泛的应用。I-131或记为131I、碘-131,是一种常用的放疗核素,尤其对甲状腺疾病有良好的治疗效果。
本发明以白蛋白HSA为基底,通过疏水作用力吸附小分子化疗药物紫杉醇,并将I-131标记在蛋白的酪氨酸上,从而得到本发明提供的共装载化疗药物和放疗药物的蛋白,标记为131I-HSA-PTX。
本发明提供的共装载化疗药物和放疗药物的蛋白中蛋白与化疗药物的摩尔比为1:5。
本发明提供的共装载化疗药物和放疗药物的蛋白中蛋白与I-131的摩尔比可任意调控。
本发明实施例中,共装载紫杉醇和I-131的白蛋白中紫杉醇与白蛋白的摩尔比为1:5。
本发明对I-131与白蛋白的比例不作限定,其可任意调控。本发明实施例中,共装载紫杉醇和I-131的白蛋白中I-131与白蛋白的比例为200μCi:3mg。
本发明提供的共装载化疗药物和放疗药物的蛋白的制备方法,包括:化疗药物装载至蛋白后,装载放疗药物;或者,放疗药物装载至蛋白后,装载化疗药物。
在本发明中,装载所述化疗药物的溶剂为乙醇,所述装载的条件为搅拌。
在本发明中,装载所述放疗药物的溶液为水,催化剂为氯胺T;所述装载的条件为震荡。
在一些具体实施例中,本发明提供的共装载化疗药物和放疗药物的蛋白的制备方法为:将放疗核素I-131标记到白蛋白上,然后加入溶在乙醇中的化疗药物PTX,搅拌过夜,离心去除沉淀,材料分散在上清中。
在此实施例中,I-131的来源为Na131I,Na131I与HSA的比例为100μCi:2mg。
HSA水溶液中HSA的浓度为2mg/mL。
装载I-131的催化剂为氯胺T,氯胺T与HSA的质量比为0.3:2。
氯胺T溶解于PB缓冲液,浓度为10mg/mL。
将Na131I、HSA水溶液、氯胺T溶液混合后进行I-131的装载。
装载I-131的条件为震荡,时间为20min,反应温度为室温。
为了去除未反应的Na131I和氯胺T,装载I-131后,还包括超滤步骤。所述超滤采用10kDa超滤管。
装载I-131后,获得131I标记的HSA,记做131I-HSA。
在131I-HSA上装载PTX,PTX溶于乙醇,浓度为20mg/mL。
为了使所得产物中HSA与PTX的物质的量比为1∶5,装载PTX时,PTX与HSA的质量比为1:10。
将经过超滤的131I-HSA溶液与PTX乙醇溶液混合,进行PTX装载。
装载PTX的条件为搅拌,时间为8h~12h,反应温度为室温。
搅拌后,经离心去除沉淀,产物131I-HSA-PTX分散在上清液中。
离心的条件为14800转/分钟,5分钟。
另一实施例中的制备方法为,本发明提供的共装载化疗药物和放疗药物的蛋白的制备方法为:将PTX溶在乙醇中,加入到白蛋白水溶液中,搅拌过夜,离心去除沉淀,中间体分散在上清中。然后,将放疗核素I-131标记到中间体上,得到最终材料。
在此实施例中,为了使所得产物中HSA与PTX的物质的量比为1:5,装载PTX时,PTX与HSA的质量比为1:13。
将HSA水溶液与PTX乙醇溶液混合,进行PTX装载。
PTX的乙醇溶液中,PTX的浓度为20mg/mL。
HSA水溶液中HSA的浓度为2mg/ml。
装载PTX的条件为搅拌,时间为8h~12h,反应温度为室温。
搅拌后,经离心去除沉淀,产物HSA-PTX分散在上清液中。
离心的条件为14800转/分钟,5分钟。
I-131的来源为Na131I,Na131I与HSA的比例为100μCi:2mg。
装载I-131的催化剂为氯胺T,氯胺T与HSA的质量比为0.3:2。
氯胺T溶解于PB缓冲液,浓度为10mg/mL。
将Na131I、含有HSA-PTX的上清液、氯胺T溶液混合后进行I-131的装载。
装载I-131的条件为震荡,时间为20min,反应温度为室温。
为了去除未反应的Na131I和氯胺T,装载I-131后,还包括超滤步骤。所述超滤采用10kDa超滤管。
装载I-131后,获得131I标记的HSA,记做131I-HSA。
在131I-HSA上装载PTX,
本发明提供的共装载化疗药物和放疗药物的蛋白在制备肿瘤成像剂中的应用。
本发明提供的共装载化疗药物和放疗药物的蛋白,其中放疗药物发射的射线可用于肿瘤的显像。本发明实验表明,以I-131为放疗药物,以PTX为化疗药物,以白蛋白为载体,所获得的131I-HSA-PTX注射入模型小鼠体内,经CT成像和伽马成像的图像合并后的图像,表明伽马射线的位置主要集中在肿瘤部位,其成像的清晰程度要显著优于游离I-131或131I-HSA。说明,本发明提供的131I-HSA-PTX能够能够在肿瘤的部位具有很高的富集,负载PTX没有影响I-131的成像效果,反而对成像效果起到了正面的影响。
本发明提供的共装载化疗药物和放疗药物的蛋白在制备抑制肿瘤生长的药物中的应用。
放疗核素I-131不仅可以实现肿瘤显像,而且可以实现肿瘤治疗;小分子 药物PTX不仅是化疗药物,杀伤癌细胞,而且可以提高肿瘤氧含量。根据现有技术,131I-HSA、或HSA-PTX联合使用的效果与使用131I-HSA-PTX的效果相比,131I-HSA-PTX对肿瘤细胞的杀伤能力比将单独的HSA-PTX和131I-HSA联合的效果更加显著(p<0.05)。
本发明提供的共装载化疗药物和放疗药物的蛋白在制备检测肿瘤和/或治疗肿瘤的产品中的应用。
本发明所提供的共装载化疗药物和放疗药物的蛋白能够用于肿瘤的检测或治疗。以I-131为放疗药物,以PTX为化疗药物,以白蛋白为载体,所获得的131I-HSA-PTX能够对多种肿瘤起到良好的治疗和检测作用。本发明实施例中,131I-HSA-PTX对乳腺癌(乳腺癌细胞4T1)起到良好的抑制作用,其能够在肿瘤部位良好的富集。在此实施例中,肿瘤为乳腺癌。
本发明还提供了检测肿瘤和/或治疗肿瘤的方法,该方法的包括使用本发明提供的共装载化疗药物和放疗药物的蛋白。
检测肿瘤的方法为,给予本发明提供的共装载化疗药物和放疗药物的蛋白后,进行伽马成像。
治疗肿瘤的方法为:给予本发明提供的共装载化疗药物和放疗药物的蛋白。
本发明提供了共装载化疗药物和放疗药物的蛋白,一些实施例中,在白蛋白上装载I-131和PTX。本发明提供的共装载化疗药物和放疗药物的蛋白具有良好的水溶性和生物相容性,能够实现化疗与放疗的联合治疗,有效降低能有效的降低肿瘤组织的间压,改善肿瘤的乏氧,提高材料在肿瘤的均相分布,进而提高放疗的治疗效果。且其制备方法非常简单。
附图说明
图1合成装载着化疗药物和放疗核素的蛋白131I-HSA-PTX的示意图,其中,图1-a示实施例1的合成路径,图1-b示实施例2的合成路径;
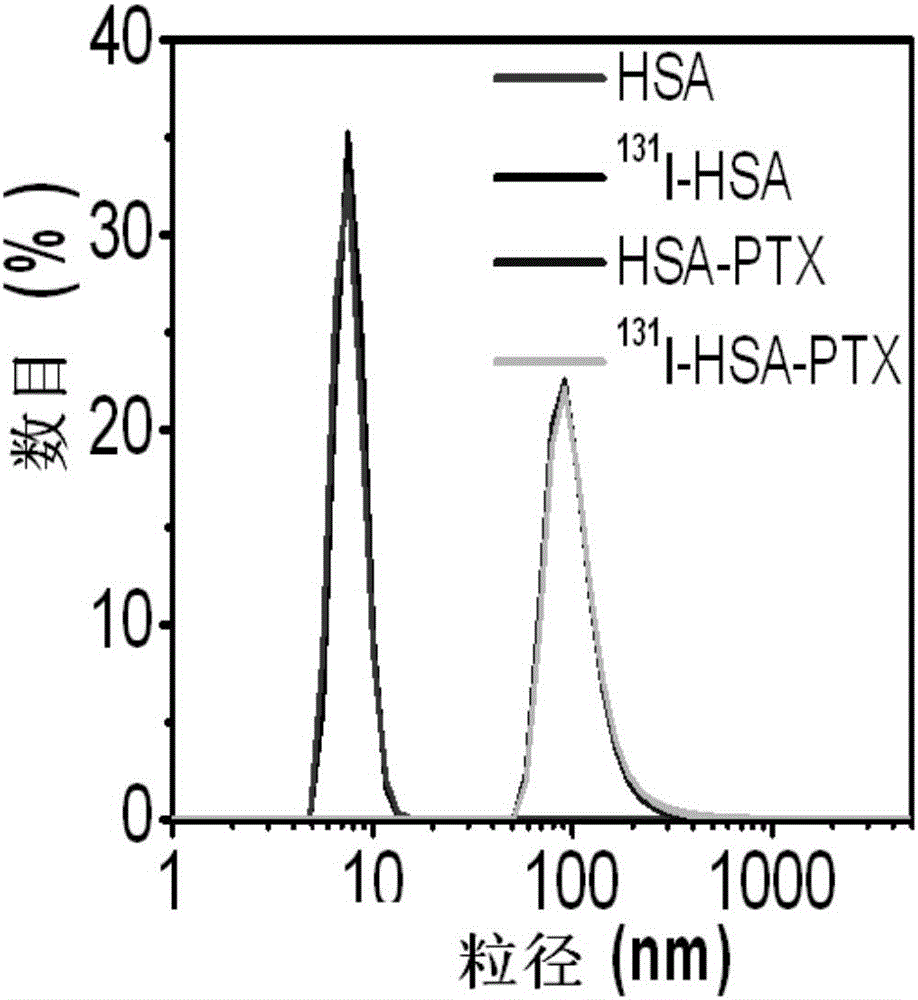
图2示HSA、131I-HSA、HSA-PTX和131I-HSA-PTX水合粒径分布;
图3示4T1细胞分别与荧光标记的HSA-PTX和HSA孵育的荧光共聚焦照片;其中,图3-a示激光共聚焦证明荧光标记的HSA和HSA-PTX的细胞内吞;图3-b示流式细胞仪证明荧光标记的HSA和HSA-PTX的细胞内吞; 图3-c示流式细胞仪测试荧光标记的HSA和HSA-PTX细胞内吞的荧光强度;
图4示131I-HSA-PTX、131I-HSA和HSA-PTX在细胞水平的治疗,其中,**示与131I-HSA效果相比具有极显著性差异,p<0.01;***示与HSA-PTX效果相比具有极显著性差异,p<0.001,p值以ANOVA计算;
图5示131I-HSA-PTX、131I-HSA和HSA-PTX通过尾静脉注射到小鼠体内不同时间点的伽马成像;
图6示131I-HSA-PTX通过尾静脉注射到小鼠体内在不同时间点时在各个组织的分布;
图7示尾静脉注射HSA-PTX后,小鼠肿瘤在不同时间点的光声成像;其中,图7-a示肿瘤在尾静脉注射HSA-PTX后不同时间点的光声成像血氧饱和度;图7-b示不同帧数下肿瘤血氧饱和度;图7-c示不同时间点时肿瘤血氧饱和度;
图8示小鼠分别尾静脉注射HSA-PTX和HSA24小时后肿瘤免疫荧光;其中,图8-a小鼠尾静脉注射HSA和HSA-PTX后乏氧免疫荧光切片;图8-b小鼠尾静脉注射HSA和HSA-PTX后乏氧诱导因子-1α免疫荧光切片;图8-c小鼠尾静脉注射HSA和HSA-PTX后乏氧免疫荧光;图8-d小鼠尾静脉注射HSA和HSA-PTX后乏氧诱导因子-1α免疫荧光;
图9示活体肿瘤联合治疗实验结果图;图9-a示联合治疗肿瘤生长曲线;图9-b示在各种处理19天后老鼠肿瘤的体积,Predicted additive effect是计算出的预计肿瘤单独放疗和单独化疗联合治疗(131I-HSA+HSA-PTX)的效果;*示具有显著性差异,p<0.05;**示具有极显著性差异,p<0.01;***示具有极显著性差异,p<0.001,p值以ANOVA计算;
图10示老鼠经过各种处理后,肿瘤组织切片H&E和TUNEL染色。
具体实施方式
本发明提供了一种共装载化疗药物和放疗药物的蛋白及其应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改 动或适当变更与组合,来实现和应用本发明技术。
为肿瘤(tumour)是指机体在各种致瘤因子作用下,局部组织细胞增生所形成的新生物(neogrowth)。肿瘤的分类通常以组织发生为依据,每一类别又按其分化成熟程度及其对机体影响的不同而分为良性和恶性两大类。常见的肿瘤发生于:直肠、结肠、乳腺、子宫、胃、肝、肺、骨、头颈等。
化疗药物,主要指化学药物,其能作用在肿瘤细胞生长繁殖的不同环节上,抑制或杀死肿瘤细胞,是目前治疗肿瘤的主要手段之一。
放疗药物主要为放射性核素,利用放射性核素产生的α、β、γ射线和各类X射线治疗机或加速器产生的X射线、电子束、中子束、质子束及其他粒子束等照射患处杀死癌细胞。
肿瘤成像是指通过探测放射性的方法来观察放射性同位素在人体脏器内的分布,以诊断脏器是否存在病变和确定病变所在的位置。
本发明采用的试剂、动物、细胞皆为普通市售品,皆可于市场购得。
下面结合实施例,进一步阐述本发明:
实施例1制备共装载化疗和放疗药物的蛋白131I-HSA-PTX
制备过程如图1-a所示,以白蛋白HSA为基底,通过转载化疗药物和放疗核素。
取100μCi的Na131I,加入1ml的2mg/ml的HSA水溶液,再加入30μL的10mg/ml的氯胺T溶液(溶在PB缓冲液中),震荡摇匀20分钟,用10kDa的超滤管超滤,去除未反应的Na131I和氯胺T,得到131I标记的HSA溶液。然后加入13μL的20mg/ml的PTX(溶在乙醇中)(PTX的加入量会改变纳米颗粒的尺寸,PTX的量越多,纳米颗粒粒径越大),搅拌过夜,14800转/分钟离心5分钟去除沉淀,产物131I-HSA-PTX分散在上清中
实施例2制备共装载化疗和放疗药物的蛋白131I-HSA-PTX
制备过程如图1-b所示,以白蛋白HSA为基底,通过转载化疗药物和放疗核素。
将13ul的20mg/ml的PTX(溶在乙醇中),加入1ml的2mg/ml的HSA水溶液,搅拌过夜,14800转/分钟离心5分钟去除沉淀,中间体HSA-PTX分 散在上清中。然后在上清中加入100uCi的Na131I和30ul的10mg/ml的氯胺T溶液(溶在PB缓冲液中),震荡摇匀20分钟,用10KDa的超滤管超滤,去除未反应的Na131I和氯胺T,得到最终产物131I-HSA-PTX。
实施例3 131I-HSA-PTX的表征
对实施例1或2制得的131I-HSA-PTX进行表征,实施例1或2所得 131I-HSA-PTX的激光动态光散射结果如图2所示,原始的HSA和放射性标记的HSA的水合半径约为8nm,放射性标记没有改变HSA的尺寸;中间体HSA-PTX和最终产物131I-HSA-PTX的水合半径都约为110nm,放射性标记没有改变材料尺寸和PTX的装载。
实施例4材料的细胞内吞
将荧光标记的HSA和HSA-PTX分别与4T1细胞孵育6小时,用PBS洗去游离的材料,细胞固定、DAPI染色,激光共聚焦显微镜观察细胞对材料的内吞。然后用用流式细胞仪进一步定量的测试细胞对材料的内吞。
结果如图3所示,细胞中明显的红色荧光表明材料被细胞内吞,且未进入细胞核。流式细胞仪数据进一步证明了细胞对材料的内吞。
实施例5 131I-HSA-PTX在细胞水平治疗
将不同浓度的131I-HSA-PTX、131I-HSA和HSA-PTX与4T1细胞孵育72小时后测试MTT。
其中,131I-HSA-PTX的浓度依次为0、6.25μCi/mL 131I和0.15μg/mL PTX、12.5μCi/mL 131I和0.31μg/mL PTX、25μCi/mL 131I和0.62μg/mL PTX、50μCi/mL 131I和1.25μg/mL PTX、100μCi/mL 131I和2.5μg/mL PTX、200μCi/mL 131I和5μg/mL PTX;
131I-HSA中131I的浓度依次为0、6.25μCi/mL、12.5μCi/mL、25μCi/mL、50μCi/mL、100μCi/mL、200μCi/mL;
HSA-PTX中PTX的浓度为0、0.15μg/mL、0.31μg/mL、0.62μg/mL、1.25μg/mL、2.5μg/mL、5μg/mL。
结果如图4所示,数据表明131I-HSA-PTX的细胞活性明显低于其他对照 组,表明131I-HSA-PTX有较强的放疗与化疗联合治疗效果。其效果显著优于 131I-HSA(p<0.001)或HSA-PTX(p<0.01)。
实施例6 131I-HSA-PTX通过尾静脉注射到活体内的伽马成像实验
随机选择背部带有4T1肿瘤的裸鼠进行成像试验。
将游离的131I(131I 200μCi)、131I-HSA(131I 200μCi)和131I-HSA-PTX(131I200μCi,PTX 9mg/kg)通过尾静脉注射到小鼠体内,在小动物伽马成像系统上进行在不同的时间点进行实时采集图片,观察肿瘤部位的富集量。
结果如图5所示,随着时间的推移,游离的131I被很快从膀胱代谢出去,在肿瘤区域没有明显的富集;131I-HSA和131I-HSA-PTX在肿瘤区域的伽马射线信号逐渐增强,其它组织的伽马射线信号逐渐变弱,表明131I-HSA和 131I-HSA-PTX逐渐被分解和代谢。图5是将小鼠的CT成像和伽马成像的图像合并后的图像,表明伽马射线的位置主要集中在肿瘤部位。图5的结果表明, 131I-HSA-PTX的成像效果显著优于131I-HSA或游离131I。
实施例7 131I-HSA-PTX在生物体内的分布实验
随机选择背部带有4T1肿瘤的裸鼠进行成像试验。
将131I-HSA-PTX通过尾静脉注射到小鼠体内(剂量为131I 200μCi,PTX 9mg/kg),24或72小时后,实验小鼠牺牲,取出重要的器官称重后置于伽马计数器中。
结果如图6所示,131I-HSA-PTX在肿瘤组织有较高富集。在72小时后,富集在其他组织和器官的材料含量变得很低,被逐渐的分解和代谢;但是在肿瘤组织中仍然具有较高的富集。
实施例8HSA-PTX在活体水平上改善肿瘤乏氧
首先利用光声成像直接测试HSA-PTX对肿瘤氧含量的影响,含量取1只背部带有4T1肿瘤的小鼠从尾静脉注射HSA-PTX(PTX 9mg/kg),分别在0,12,24和48小时测试肿瘤区域的血氧饱和度。结果如图7所示,注射HSA-PTX后小鼠肿瘤部位的血氧饱和度明显升高,48小时后血氧饱和度仍处于较高水平,表明HSA-PTX可持续的提高肿瘤组织的氧含量。
然后通过免疫荧光染色说明HSA-PTX改善小鼠肿瘤乏氧。选取两只背部带有4T1肿瘤的小鼠分布从尾静脉注射HSA-PTX和HSA,在22.5小时时注射60mg/kg的哌莫硝唑,24小时后取小鼠的肿瘤,冷冻切片,进行光声成像测定肿瘤血氧饱和度(图7)及免疫荧光法测定乏氧与乏氧诱导因子-1α表达情况(图8)。结果表明,相对注射HSA,小鼠注射HSA-PTX后肿瘤的乏氧区域明显减少。乏氧诱导因子-1α表达水平如图7-b所示,也明显降低。对注射131I-HSA-PTX后肿瘤乏氧与乏氧诱导因子-1α表达情况进行检测,其结果与HSA-PTX相似,无显著性差异(p>0.05)。
实施例9HSA-PTX在活体水平上肿瘤治疗
选取20只背部带有4T1肿瘤的裸鼠,随机分为四组,每组五只,分别每间隔三天尾静脉注射生理盐水,HSA-PTX(PTX 9mg/kg),131I-HAS(131I 200μCi)和131I-HSA-PTX(131I 200μCi,PTX 9mg/kg),共注射四次。肿瘤生长曲线结果如图9~10所示,对比HSA-PTX和131I-HSA组,131I-HSA-PTX更加显著地抑制了肿瘤的生长;而且通过计算发现,131I-HSA-PTX比将单独的HSA-PTX和131I-HSA联合的效果更加显著。在四次注射治疗后,将肿瘤组织取下。通过H&E染色和TUNEL染色发现,经过131I-HSA-PTX处理,大部分肿瘤细胞已经死亡。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!