一种肝靶向载铂纳米前药的结构及其制备方法与流程
本发明涉及一种肝靶向载铂纳米前药及其制备方法,该方法制备的纳米粒子适用于肝癌治疗,属于生物医药技术领域。
背景技术:
:
根据2014年世界卫生组织(World Health Organization,WHO)发布的《世界癌症报告》显示,在全球各类恶性肿瘤中,肝癌的死亡数高居世界第二位,而其中来自我国的肝癌发病和死亡数就占到全球一半以上(OrganizationWH.World Cancer Report 2014.)。在我国,肝癌是死亡率最高的恶性肿瘤。它具有早期诊断困难,恶性度高,侵袭性强,患者生存期短的特点。目前,化疗是除手术外最主要的肝癌干预手段。常见的用于肝癌的化疗药物包括5-氟嘧啶、顺铂、紫杉醇、阿霉素等。这些药物本身毒性很大,使用时多具有较大的副作用和较低的生物利用率等缺陷,限制了其进一步的应用和发展。
研究发现,纳米粒子是一种有效的药物载体。它可以通过共价或非共价键的方式负载药物,使得载药量明显提高,同时100-200nm的纳米粒子对于肿瘤组织具有被动靶向作用(Passive targeting),可通过肿瘤高通透和滞留效应(EPR效应)优先在肿瘤组织富集,这样就可以增大肿瘤组织的药物浓度,减小药物在其他脏器及血液中的分布,提高药物利用率(Pérez-Herrero E,Fernández-Medarde A.Advanced targeted therapies in cancer:Drug nanocarriers,the future of chemotherapy.European Journal of Pharmaceutics&Biopharmaceutics.2015;93:52-79.)。基于此,研究人员开发了多种纳米药物传递体系。如景遐斌教授课题组用聚乙二醇-聚己内酯-聚赖氨酸(PEG-b-PCL-b-PLL)三嵌段共聚物包载铂类药物和紫杉醇,通过亲疏水性自组装为纳米粒子,实现了双重给药效果(Xiao H,Qi R,Liu S,Hu X,Duan T,Zheng Y,et al.Biodegradable polymer-cisplatin(IV)conjugate as a pro-drug ofcisplatin(II).Biomaterials.Biomaterials.2011;32:7732-9.)。梁兴杰教授课题组用谷胱甘肽稳定的纳米金负载铂类药物的同时连接RGD肽,实现肿瘤靶向给药(KumarA,Huo S,Zhang X,Liu J,Tan A,Li S,et al.Neuropilin-1-Targeted Gold Nanoparticles Enhance Therapeutic Efficacy of Platinum(IV)Drug for Prostate Cancer Treatment.ACS nano.2014;8:4205-20.)。尽管基于纳米粒子传递体系的研究多种多样,然而应用到体内的效果却不尽理想。研究人员认为,纳米粒子药物传递体系在体内必须经过多个阶段,如血液循环、肿瘤富集、细胞摄取、药物胞内释放等(Samir M,Joerg L.Materials for drug delivery:innovative solutions to address complex biological hurdles.Advanced Materials.2012;24:3717-23.)。一个优良的纳米粒子药物传递体系只有在以上多个步骤中都具有良好性质,即血液循环稳定性,通过EPR效应在肿瘤区域富集,良好的细胞摄取能力,以及良好的胞内药物释放能力,才能最终在体内发挥理想的性能。目前,纳米粒子的聚集-分散、电荷翻转、外层塌缩或脱落等策略都可以满足以上所述的条件。然而具备这些特点的纳米粒子体系往往都具有复杂的结构和较高的制备难度,限制了其进一步的动物实验乃至临床应用。
顺铂自上世纪60年代被发现具有抗癌活性以来,就获得迅速的发展。自1978年顺铂上市以来,已发展出多代基于经典顺式结构的铂类金属抗肿瘤药物。铂类药物是一种细胞周期非特异性抗癌药物,对包括肝癌在内的多种常见恶性肿瘤都有很好的杀伤效果,是目前临床上使用最广的化疗药物之一(World Health Organization.International Clinical Trials Registry Platform(ICTRP).http://www.who.int/ictrp/en/2015.)。然而它的稳定性很差,经静脉注射后容易与血液中的血红蛋白结合,引发一系列副作用的同时还降低了药效。由于不具有肿瘤靶向性,铂类药物的全身分布会对胃肠道、肾、耳、神经等产生损害,引发患者的强烈不适(FloreaAM,Büsselberg D.Cisplatin as an Anti-Tumor Drug:Cellular Mechanisms ofActivity,Drug Resistance and Induced Side Effects.Cancers.2011;3:1351-71)。因此,如何提高铂类药物的抗肿瘤活性,降低其毒副作用,提高血液稳定性和治疗效果,使其得到高效广泛的应用便成了当下该领域的研究热点。
研究表明,Pt(II)对癌细胞的毒性较大,做化疗药物使用时患者的副反应较强烈,使化疗效果大打折扣。Pt(IV)化合物可以作为顺铂Pt(II)的前药。相对于Pt(II)而言,Pt(IV)的毒性及与血清白蛋白的结合能力均较低,它可以在还原性物质(如谷胱甘肽)作用下还原为Pt(II),由此可降低化疗的毒副作用,提高疗效。
综上所述,如何构建一种简单有效适用于体内的纳米粒子体系,降低Pt(II)的毒副作用的同时增加在肿瘤的富集量,提高疗效,是本发明致力解决的问题。
技术实现要素:
本发明目的是解决如何提高铂类药物的抗肿瘤活性,降低其毒副作用,提高血液稳定性和治疗效果,更加方便其应用于临床治疗问题,现有的高效载药体系都具有结构复杂,制备困难的特点,如具有电荷反转功能的碳量子点载药体系,极大限制了其应用,难以实现临床治疗。本发明设计并提供一种可以治疗肝癌的载铂类纳米前药及其制备方法,制备出结构简单、疗效显著的载铂药物纳米粒子。
本发明技术方案
一种用于肝癌治疗的肝靶向载铂纳米前药,该纳米前药的结构为海藻酸钠同时修饰甘草次酸及四价铂化合物,记为ALG@GA,Pt(IV);其中,纳米前药的粒径为160-200nm,海藻酸钠上修饰的两种物质甘草次酸及四价铂化合物的摩尔比(GA-NH2:PtCl2(OH)2(NH3)2)范围为1:8至2:1。Pt(IV)化合物与海藻酸钠单体摩尔比(PtCl2(OH)2(NH3)2:ALG-TBA)范围为1:8到2:1。
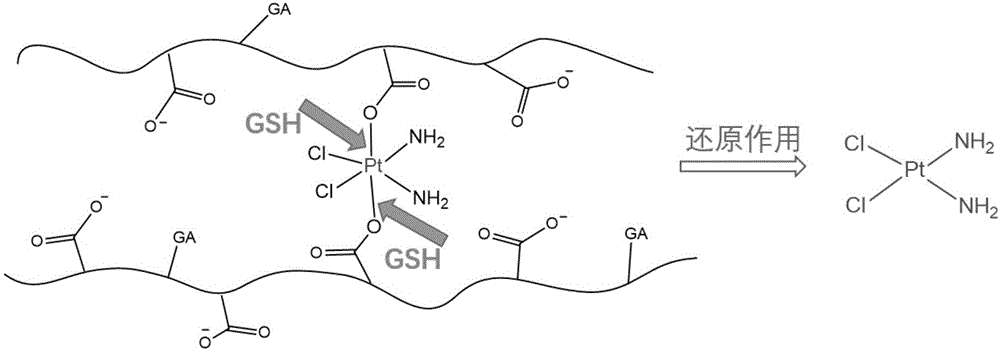
本发明在具有良好生物相容性的天然多糖——海藻酸钠上修饰具有肝癌细胞靶向能力的甘草次酸GA和四价铂化合物Pt(IV)药物,通过简单的化学反应连接顺铂前药Pt(IV)化合物和甘草次酸(ALG@Pt,GA),结构式见附图1。利用亲疏水性自组装为纳米粒子,获得了适宜体内给药的载铂类药物纳米粒子。海藻酸钠糖环中丰富的羧基不仅提供了所需要的反应位点,而且负电的特性可有效防止对蛋白以及细胞的非特异性吸附,具有良好的血液稳定性;GA具有明显的肝细胞靶向性,可以显著加强肝癌细胞对药物的摄取能力;Pt(IV)药物细胞毒性弱,与血清白蛋白结合力低,毒副作用小,在还原性物质如谷胱甘肽(在癌细胞中含量较高)的作用下,铂氧键断裂,形成Pt(II)化合物,细胞毒性随之增强,见附图2。纳米前药的粒径在200纳米以内,可通过EPR效应实现被动靶向。本发明中的纳米粒子综合了以上化合物的优势,细胞实验表明,该纳米粒子随着使用浓度的增高,对肝癌细胞的杀伤能力明显增强。释药曲线表明该纳米粒子具有一定的缓慢释放铂类药物的效果。
一种用于肝癌治疗的肝靶向载铂纳米前药的制备方法,具体步骤如下:
第一,四丁基铵海藻酸盐(ALG-TBA)制备:HCl水溶液(0.6M,30mL)加入到乙醇(30mL)中得到混合溶液,ALG-Na(2.0g)加入到上述混合溶液中,在4℃搅拌过夜;抽滤得到ALG-H,依次用乙醇,丙酮洗涤,在40℃真空干燥过夜;将干燥后的海藻酸分散在100mL蒸馏水中,在搅拌条件下逐滴滴加四丁基铵碱(TBAOH)到聚合物完全溶解,调节pH为7.0-10.0,透析,冻干得到白色的ALG-TBA。
第二,顺铂前体药物二氯·二(氢氧根)·二氨合铂(IV)(cis,trans,cis-[PtCl2(OH)2(NH3)2])制备:干燥的顺铂cis-[PtCl2(NH3)2](0.20g,6.6*10-4mol)分散在5ml水中,加入10倍过量的H2O2(30%w/v,7.0mL,6.6*10-3mol),50℃下搅拌1h后降温结晶,过滤后得到淡黄色透明固体PtCl2(OH)2(NH3)2。
第三,乙二胺修饰甘草次酸(GA-NH2)的制备:将DCC(5.3g,25.6mmol)和HOBt(3.4g,25.6mmol)溶于二氯甲烷中,室温下搅拌30min。向溶液中加入甘草次酸(10.0g,21.3mmol)搅拌20min。之后加入乙二胺(2.3mL,21.3mmol),室温搅拌12h。反应液旋转蒸发除去溶剂后使用色谱柱(VCH2Cl2:VMeOH:VNH3H2O=15:1:1)提纯,之后将产物溶解于乙酸乙酯中,0℃下静置2h,过滤,滤液蒸干、真空干燥后得到白色粉末状产物GA-NH2。
以上三步为相互独立的步骤,可以分别同时进行,其先后顺序也可以互换而对本发明方法没有任何影响。
第四,改性甘草次酸和二氯·二(氢氧根)·二氨合铂(IV)修饰的海藻酸钠制备:ALG-TBA(0.1g,0.24mmol)溶于DMF中,加入CMPI(61.2mg,0.24mmol)在氮气条件冰水浴中活化1h,常温下加入GA-NH2(30.8mg,0.06mmol)和PtCl2(OH)2(NH3)2(40mg,0.12mmol),搅拌2d。
第五,肝靶向载铂纳米前药的制备:第四步制备的ALG@GA,Pt(IV)反应液与丙酮混合,混合液以恒定速率滴入蒸馏水中,搅拌过夜后,放入透析袋中透析4天,每8h换一次水。得到纳米粒子(ALG@GA,Pt(IV))。通过电感耦合等离子体质谱(ICP-MS)测试其载铂量。
第六,肝靶向载铂纳米前药浓缩液的制备:通过离心的方法对第五步得到的ALG@GA,Pt(IV)进行离心处理,离心转速25000转/分钟,时间为1h,得到了适合用于小鼠实验的肝靶向载铂纳米前药浓缩液,通过电感耦合等离子体质谱(ICP-MS)测试其载铂量。
本发明的优点和有益效果:
本发明通过合理设计,向海藻酸钠上修饰具有肝癌细胞靶向能力的甘草次酸和顺铂前药,利用亲疏水性自组装为肝靶向载铂纳米前药。本发明通过ICP测定不同时间段药物浓度得到该肝靶向载铂纳米前药的药物释放曲线,证明了该纳米前药在没有还原性物质存在下,3天时间仅释放少量药物(<10%);而在还原性物质存在下可以持续释放较多的药物(3天内释药70%以上),具有缓释作用。本发明通过MTT细胞毒性实验证明了该肝靶向载铂纳米前药对肝癌细胞HepG2具有较强的毒性,且细胞毒性具有浓度依赖性。本发明肝靶向载铂纳米前药结构简单,制备容易。可以显著提高铂类药物的杀伤作用,具有在胞内还原性物质作用下释放药物的特征,并且可以缓释药物。本发明可能用于治疗肝癌,在生物医学领域有很好的应用前景。
附图说明
图1是肝靶向载铂纳米前药高聚物结构式;
图2是肝靶向载铂纳米前药与还原性物质作用示意图;
图3是肝靶向载铂纳米前药溶液DLS表征粒径图;
图4是肝靶向载铂纳米前药浓缩液DLS表征粒径图;
图5是肝靶向载铂纳米前药药物释放曲线;
图6是不同GA:Pt(IV)投料比纳米前药对细胞毒性的影响;
图7是肝靶向载铂纳米前药MTT实验结果。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
实施例1:用于肝癌治疗的肝靶向载铂纳米前药的制备:
1)四丁基铵海藻酸盐(ALG-TBA)制备:HCl水溶液(0.6M,30mL)加入到乙醇(30mL)中,ALG-Na(2.0g)加入到混合溶液中,在4℃搅拌过夜;抽滤得到ALG-H,依次用乙醇,丙酮洗涤,在40℃真空干燥过夜;将干燥后的海藻酸分散在100mL蒸馏水中,在搅拌条件下逐滴滴加四丁基铵碱(TBAOH)到聚合物完全溶解,调节pH为7.0-10.0,透析,冻干得到白色的ALG-TBA。
2)顺铂前体药物二氯·二(氢氧根)·二氨合铂(IV)(cis,trans,cis-[PtCl2(OH)2(NH3)2])制备方法:干燥的顺铂cis-[PtCl2(NH3)2](0.20g,6.6*10-4mol)分散在5ml水中,加入10倍过量的H2O2(30%w/v,7.0mL,6.6*10-3mol),50℃下搅拌1h后降温结晶,过滤后得到黄色透明化合物PtCl2(OH)2(NH3)2。电喷雾电离质谱(ESI-MS):333(M-H+)表征合成成功。
3)乙二胺修饰甘草次酸(GA-NH2)的制备方法:将DCC(5.3g,25.6mmol)和HOBt(3.4g,25.6mmol)溶于二氯甲烷中,室温下搅拌30min。向溶液中加入甘草次酸(10.0g,21.3mmol)搅拌20min。之后加入乙二胺(2.3mL,21.3mmol),室温搅拌12h。反应液旋转蒸发除去溶剂后使用色谱柱(VCH2Cl2:VMeOH:VNH3H2O=15:1:1)提纯,之后将产物溶解于乙酸乙酯中,0℃下静置2h,过滤,滤液蒸干、真空干燥后得到白色粉末状产物GA-NH2。电喷雾电离质谱(ESI-MS):513.8(M+H+)表征合成成功。
4)改性甘草次酸二氯·二(氢氧根)·二氨合铂(IV)修饰的海藻酸钠(GA:Pt(IV):ALG-TBA=1:2:4)制备方法:ALG-TBA(0.1g)溶于DMF中,加入CMPI(61.2mg,0.24mmol)在氮气条件冰水浴中活化1h,常温下加入GA-NH2(30.8mg,0.06mmol)和PtCl2(OH)2(NH3)2(40mg,0.12mmol),搅拌2d。
5)改性甘草次酸二氯·二(氢氧根)·二氨合铂(IV)修饰的海藻酸钠(GA:Pt(IV):ALG-TBA=1:2:1、GA:Pt(IV):ALG-TBA=1:2:2、GA:Pt(IV):ALG-TBA=1:2:8、GA:Pt(IV):ALG-TBA=1:2:16)制备方法:同步骤4。
6)改性甘草次酸二氯·二(氢氧根)·二氨合铂(IV)修饰的海藻酸钠(GA:Pt(IV):ALG-TBA=2:1:2、GA:Pt(IV):ALG-TBA=1:1:2、GA:Pt(IV):ALG-TBA=1:4:8、GA:Pt(IV):ALG-TBA=1:8:16)制备方法:同步骤4。
7)纳米粒子的制备方法:ALG@GA,Pt(IV)反应液与丙酮体积比为1:1混合,混合液以恒定速率滴入蒸馏水中,搅拌过夜后,放入透析袋中透析4天,每8h换一次水。得到纳米粒子——载铂纳米前药(ALG@GA,Pt(IV))。用电感耦合等离子体质谱(ICP-MS)测试其载铂量,不同Pt(IV):ALG-TBA投料比对纳米粒子载铂量的影响如表1所示,根据表1结果,当Pt(IV):ALG-TBA=1:2时,继续增加Pt(IV)投料,载铂量无显著提高。用DLS表征其粒径,其中(GA:Pt(IV):ALG-TBA=1:2:4)粒径约为160nm,见附图3。
表1不同Pt(IV):ALG-TBA投料比的纳米粒子载铂量
实施例2:用于肝癌治疗的肝靶向载铂纳米前药浓缩稳定性考察:
肝靶向载铂纳米前药浓缩液的制备:通过离心的方法对实施例1中第7步得到的ALG@GA,Pt(IV)(GA:Pt(IV):ALG-TBA=1:2:4)纳米粒子进行离心处理,离心转速25000转/分钟,时间为1h,弃去上清液后,得到了具备小鼠实验能力的载铂类药物纳米粒子浓缩液,其中铂元素浓度为140ug/ml。超声分散摇匀浓缩液,粒径为160nm,用DLS表征,见附图4。证明该纳米粒子具有良好的浓缩稳定性。
实施例3:用于肝癌治疗的肝靶向载铂纳米前药释药曲线的测定:
分别取1ml肝靶向载铂纳米前药溶液加入70ml含0mM谷胱甘肽(GSH)和10mM GSH的PBS缓冲溶液中,再固定的时间点取出2ml溶液,用ICP测定其浓度,得到药物在不同还原环境下的释放曲线,见附图5。在还原物质存在下药物释放明显增多且存在缓释作用。
实施例4:用于肝癌治疗的肝靶向载铂纳米前药MTT实验:
1)处于正常状态的HepG2人类肝癌细胞种植在96孔板中,每孔12000细胞,置于培养箱预先培养24h后细胞给药(材料GA:Pt(IV)投料比为1:8至2:1),给药浓度均为20ug/ml,给药后继续培养24h后加MTT,过4h后要用酶标仪检测细胞存活率(520nm)。结果显示,实验组GA:Pt(IV)=1:2细胞毒性最高,效果最好。见附图6。
2)处于正常状态的HepG2人类肝癌细胞种植在96孔板中,每孔12000细胞,置于培养箱预先培养24h后细胞给药(材料GA:Pt(IV):ALG-TBA=1:2:4),给药浓度分别为1、5、10、15、20、25、30ug/ml,给药后继续培养24h后加MTT,过4h后要用酶标仪检测细胞存活率(520nm)。结果显示,随着给药浓度的提升,细胞毒性明显增强。见附图7。
- 还没有人留言评论。精彩留言会获得点赞!