一种淫羊藿总黄酮酶解产物及其制备方法和应用与流程
本发明涉及一种淫羊藿总黄酮酶解产物,该产物是将淫羊藿总黄酮通过固定化蜗牛酶酶解产生的。本发明还涉及该酶解产物的制备方法和在抗肿瘤方面的应用,属于医药技术领域。
背景技术:
淫羊藿作为传统的补肾中药,在民间沿用已有千年历史,具有补肾阳,强筋骨、祛风湿的作用,临床常用于治疗阳痿遗精,筋骨萎软,风湿痹痛等症。
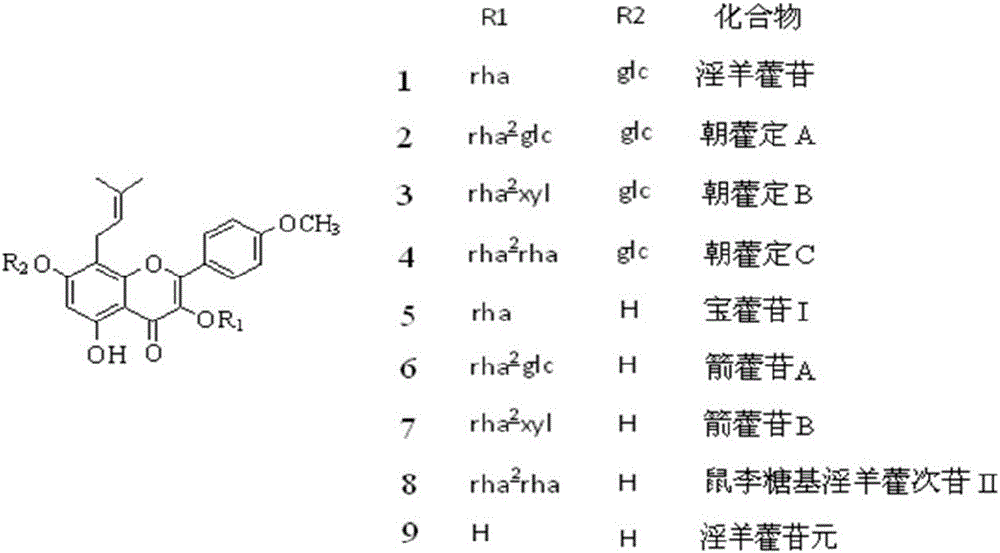
淫羊藿主要含有黄酮类成分,主要有淫羊藿苷、朝藿定A、朝藿定B,朝藿定C和宝藿苷I等黄酮苷(结构见图1)。现代药理研究表明,淫羊藿黄酮苷具有很好的生物活性,除具有抗骨质疏松活性外,还具有很好的抗肿瘤作用。文献报道淫羊藿黄酮类成分对呼吸道系统肺癌肿瘤、对消化系统肝癌和胃癌、对血液系统白血病细胞具有一定的杀伤能力,能够控制肿瘤细胞的生长,促使肿瘤细胞的死亡,抑制肿瘤血管形成、并可以有效地调节机体内特异、非特异的免疫细胞,抑制肿瘤细胞的免疫逃逸,从而起到抗肿瘤作用。
本课题组前期研究表明,口服淫羊藿黄酮苷,原型吸收较少,需要经过肠道酶肠道菌的水解,以次级苷或苷元的形式被吸收而发挥疗效。因此在体外寻找将淫羊藿黄酮苷适宜酶解的方法,获得活性较高且易于吸收的次级苷,对进一步研发具有较好抗肿瘤作用的新药应用于临床具有重要意义。目前,已有较多关于体外酶解淫羊藿黄酮原型苷的研究,但这些方法多是利用游离酶酶解淫羊藿苷,如利用β-葡萄糖苷酶、纤维素酶、蜗牛酶或曲霉属霉菌产生的诱导酶转化淫羊藿苷的研究。但游离酶对反应体系的微环境十分敏感,任何pH、温度的改变均会使其活性受到影响,并且难于循环使用、花费代价高,不利于大规模工业生产。由于淫羊藿中除了含有淫羊藿苷成分外,还含有另外三种含量较多的黄酮类成分:朝藿定A、朝藿定B和朝藿定C。因此,单纯从淫羊藿药材中提取淫羊藿苷再进行酶解,不仅需要繁琐的分离提纯步骤,而淫羊藿药材中的有效成分不能充分利用,不利于中药资源的合理化应用。
技术实现要素:
本发明的目的之一是提供一种淫羊藿总黄酮酶解产物,该产物是将淫羊藿总黄酮通过固定化蜗牛酶酶解产生的,该酶解产物具有比淫羊藿总黄酮原型及游离酶酶解产物更好的抗肿瘤活性,且具有较好的口服吸收性,提高了对淫羊藿有效成分的利用率,实现了药材资源的综合利用,并且产物制备所用的固定化酶能够循环使用,可节约资源,实现绿色生产。
针对上述发明目的,本发明提供以下技术方案:
一种淫羊藿总黄酮酶解产物,所述酶解产物通过固定化蜗牛酶酶解淫羊藿总黄酮获取,所述蜗牛酶由氨基介孔硅固定。
其中,所述淫羊藿总黄酮的制备方式为:将淫羊藿用6~40(m/v)倍量40%~90%乙醇采用热回流提取后浓缩,经大孔吸附树脂法进一步纯化,得到质量含量不低于60%的淫羊藿总黄酮。其中,淫羊藿总黄酮中淫羊藿苷、朝藿定A、朝藿定B、朝藿定C和宝藿苷Ⅰ的总质量含量不低于30%(HPLC测得)。
一种优选的氨基介孔硅的制备方法为:将二氧化硅浸入溶有3-氨丙基三乙氧基硅烷的甲苯中,磁力搅拌800r·min-1,在90℃高温下,反应12h;取出反应物,在甲苯中超声洗涤10min,在60℃下真空干燥2h。
进一步的,所述蜗牛酶的固定方法为:将蜗牛酶和氨基介孔硅载体置于pH 5.0磷酸缓冲盐溶液中反应,室温下磁力搅拌反应;之后蒸馏水洗涤后干燥保存。
其中,所述蜗牛酶与氨基介孔硅载体用量为质量比1:1~1:4,优选1:1。蜗牛酶与氨基介孔硅的结合效率在质量比1:1~1:4间递增,质量比1:4时蜗牛酶与介孔硅的结合效率达到最大,可达到90%以上,但考虑制备成本,最终选择蜗牛酶与介孔硅的质量比为1:1,既减少了介孔硅载体的用量,也可保持有效的结合效率,在此条件下,蜗牛酶与氨基介孔硅的结合效率可达到89.63%。
进一步的,酶解条件优选为:氨基介孔硅固定化蜗牛酶和淫羊藿总黄酮加入含有40%体积分数DMSO的缓冲盐溶液中,缓冲盐溶液pH 5.0,氨基介孔硅固定化蜗牛酶和淫羊藿总黄酮质量比为1:1,在50℃温度条件下反应,反应2h。
本发明所述酶解产物中几乎没有淫羊藿苷元,其酶解产物主要由箭藿苷A;箭藿苷B;鼠李糖基淫羊藿次苷II;宝藿苷I组成;其组成比例约为箭藿苷A:箭藿苷B:鼠李糖基淫羊藿次苷II:宝藿苷I为1.5:2.0:1.0:5.8。
本发明的第二目的在于提供一种淫羊藿总黄酮酶解方法,具体技术方案为,采用固定化蜗牛酶酶解淫羊藿总黄酮,其中所述蜗牛酶的固定载体选用氨基介孔硅。
采用本发明所述的固定化蜗牛酶方法酶解淫羊藿总黄酮,蜗牛酶和载体的结合效率高,反应的适宜pH范围增宽,对反应温度也具有更好的适应性,稳定性好,并且酶解转化率高。
此外,本发明进一步要求保护上述淫羊藿总黄酮酶解产物在制备抗肿瘤药物中的应用。
本发明所述的固定化蜗牛酶对淫羊藿总黄酮酶解产物,比淫羊藿总黄酮原型及游离酶酶解产物具有更好的抗肿瘤活性,且具有较好的口服吸收性。
采用本发明所述氨基介孔硅固定化蜗牛酶方法酶解淫羊藿总黄酮,固定化酶不仅保留了游离酶的优点,还具有易于与底物分离,便于回收重复再利用,适宜的反应条件范围宽,可降低生产成本、适宜工业化生产等优势。并且蜗牛酶和氨基介孔硅载体的结合效率高,稳定性好,并且酶解转化率高。另外,本发明还实现了对淫羊藿中除淫羊藿苷以外的黄酮类成分的有效利用,提取淫羊藿中的总黄酮成分进行酶解,提高了淫羊藿药材有效成分利用率,实现了药材资源的综合利用。更重要的是,淫羊藿总黄酮经氨基介孔硅固定蜗牛酶酶解产物比原型化合物及经游离酶酶解的产物具有更好的抗肿瘤活性,以此为原料研发抗肿瘤新药具有较好的临床应用价值。
附图说明
图1为淫羊藿总黄酮所含主要黄酮及酶解产物的化学结构示意图;
图2为氨基介孔硅固定化蜗牛酶的SEM表征示意图(放大倍数为8.1mm×50.0k);
图3为氨基介孔硅固定化蜗牛酶相对酶活和转化率随温度变化示意图;其中,A为相对酶活,B为转化率,(n=3,*P<0.05,**P<0.01);
图4为氨基介孔硅固定化蜗牛酶相对酶活和转化效率随贮藏时间变化示意图;其中A为相对酶活;B为转化率(n=3);
图5为氨基介孔硅固定化蜗牛酶酶解淫羊藿总黄酮最适反应条件考察示意图;其中,A为以酶活为指标的最适反应pH;B为以转化率为指标的最适反应pH;C为以酶活为指标的最适反应温度;D为以转化率为指标的最适反应温度;E为以酶活为指标的最适酶与底物质量比;F为以转化率为指标的最适酶与底物质量比;
图6为淫羊藿总黄酮及其酶解产物的HPLC图谱;其中,A为混合对照品溶液;B为淫羊藿总黄酮酶解产物,其中1为游离蜗牛酶酶解总黄酮产物,2为氨基介孔硅固定化蜗牛酶酶解总黄酮产物;a.朝藿定A;b.朝藿定B;c.朝藿定C;d.淫羊藿苷;e.箭藿苷A;f.箭藿苷B;g.鼠李糖基淫羊藿次苷II;h.宝藿苷I;i.淫羊藿苷元;
图7为淫羊藿总黄酮及其固定化酶酶解产物对A549、HepG2、MCF-7、Hela细胞作用48h的抑制率比较示意图;其中,A为A549细胞;B为HepG2细胞;C为MCF-7细胞;D为Hela细胞;(n=6,*P<0.05,**P<0.01);
图8为游离酶和固定化酶酶解淫羊藿总黄酮的产物对A549、HepG2、MCF-7、Hela细胞作用48h的抑制率比较示意图;其中,A为MCF-7细胞;B为Hela细胞;C为HepG2细胞;D为A549细胞;(n=6,*P<0.05,**P<0.01)。
具体实施方式
下面结合实例对本发明作进一步详细说明,但本发明的范围并不受这些实例的任何限制。
本发明实施例中所选用的水解酶信息:蜗牛酶(>300U/mg,上海源叶生物科技有限公司),除特殊说明外,本发明所用的各种原料/制剂均为市售的已知产品。
实施例1
本实施例提供一种采用本发明方法酶解淫羊藿总黄酮的优选方式,对本发明酶解方法做进一步具体描述。
1.淫羊藿总黄酮的制备
将淫羊藿用6~40(m/v)倍量40%~90%乙醇采用热回流提取后浓缩,经大孔吸附树脂法进一步纯化,得到质量含量不低于60%的淫羊藿总黄酮。
淫羊藿总黄酮主要成分为淫羊藿苷、朝藿定A、朝藿定B、朝藿定C和宝藿苷I,并且淫羊藿苷、朝藿定A、朝藿定B、朝藿定C和宝藿苷I总质量含量不低于30%。
2.氨基介孔硅载体的制备及表征
将二氧化硅浸入溶有3-氨丙基三乙氧基硅烷(C=50mM)的甲苯中,磁力搅拌800r·min-1,在90℃高温下,反应12h。取出反应物,在甲苯中,超声洗涤10min,在60℃下,真空干燥2h,即得氨基介孔硅样品,于4℃冰箱中保存备用。
采用Hitachi S-3400扫描电子显微镜(SEM)观察氨基介孔硅固定化酶的表面结构。取氨基介孔硅样品粉末用固体导电胶带固定,镀金后,工作电压15kV,于真空条件下进行表征,见图2。制备所得的氨基介孔硅肉眼观察,外观为白色均一粉末。(SEM)观察制备的氨基介孔硅外观圆整,表面具有较多的空隙结构,氨基介孔硅的多孔结构孔径较为均一,利于提高酶的固定效率。
3.氨基介孔硅固定化蜗牛酶的制备
按照1:1的质量比称取蜗牛酶与氨基介孔硅载体适量置于锥形瓶中,于pH 5.0磷酸缓冲盐溶液中反应,室温下磁力搅拌500r·min-1,反应10h。然后蒸馏水洗涤3~5次,于37℃条件下真空干燥,即得氨基介孔硅固定化蜗牛酶,置于4℃冰箱中保存备用。
4.氨基介孔硅固定化蜗牛酶酶学性质的测定
(1)氨基介孔硅固定化蜗牛酶热稳定性的测定
称取适量游离及氨基介孔硅固定化蜗牛酶置于不同温度(50、60、70、80、90、100℃)条件下放置1h后,然后在温度为50℃和pH为5.0的条件下,底物浓度0.5mg·mL-1,酶与底物质量比均为1:1,酶解淫羊藿总黄酮,反应1h后取样,加入甲醇终止反应,HPLC测定,结果见图3。氨基介孔硅固定化酶的酶活均高于游离酶,在极端温度条件下,二者有显著性差异,氨基介孔硅固定化蜗牛酶的热稳定性高于游离蜗牛酶。
(2)氨基介孔硅固定化蜗牛酶重复利用性的测定
称取适量氨基介孔硅固定化蜗牛酶在温度为50℃和pH为5.0的条件下,底物浓度0.5mg·mL-1,酶与底物质量比均为1:1,酶解淫羊藿总黄酮,反应1h后取样,加入甲醇终止反应,HPLC测定。将上述氨基介孔硅固定化蜗牛酶从酶解体系中分离,蒸馏水充分洗涤3次后,在相同的条件下反应,HPLC测定,重复上述步骤,考察使用次数对氨基介孔硅固定化蜗牛酶酶活的影响。在重复利用氨基介孔硅固定化蜗牛酶5次后,其酶活力依旧可保持在60%以上;与游离酶相比,氨基介孔硅固定化酶具有较好的可重复利用性,降低了生产成本。
(3)氨基介孔硅固定化蜗牛酶贮藏稳定性的测定
将氨基介孔硅固定化蜗牛酶置于4℃条件下保存,每周取样1次,按照上述条件转化淫羊藿总黄酮,HPLC测定,计算固定化蜗牛酶的酶活,连续测定6周,考察氨基介孔硅固定化蜗牛酶的贮藏稳定性,结果见图4。氨基介孔硅固定化蜗牛酶在4℃条件下保存6周后,酶活力仍可保留约80%,具有较好的贮藏稳定性。
5.氨基介孔硅固定化蜗牛酶酶解淫羊藿总黄酮
(1)最适反应pH考察
称取适量游离及氨基介孔硅固定化蜗牛酶,在50℃温度条件下,分别于不同pH值(2.0、3.0、4.0、5.0、6.0、7.0、8.0)条件的磷酸盐缓冲液中酶解淫羊藿总黄酮,底物浓度为0.5mg·mL-1,酶与底物质量比为1:1,反应1h后取样,均加入甲醇终止反应,HPLC测定,结果见图5(A,B)。游离和氨基介孔硅固定化蜗牛酶的酶活及酶解效率均随pH的增大而变化,呈现先增大后减小的趋势;游离蜗牛酶酶解淫羊藿总黄酮提取物的最适反应pH为6.0,此时其酶活及酶解淫羊藿总黄酮提取物的效率均最大;氨基介孔硅固定化蜗牛酶酶解淫羊藿总黄酮提取物的最适反应pH为5.0,此时其酶活及酶解淫羊藿总黄酮提取物的效率均最大。另外,在极端pH条件下,氨基介孔硅固定化蜗牛酶的酶活及酶解效率均明显的高于游离蜗牛酶,表明蜗牛酶经固定化后,酶反应的适宜pH值范围变宽。
(2)最适反应温度考察
称取适量游离及氨基介孔硅固定化蜗牛酶,在pH值为5.0的磷酸盐缓冲液中,分别于4、25、37、50、60、70℃温度条件下酶解淫羊藿总黄酮,底物浓度为0.5mg·mL-1,酶与底物质量比均为1:1,反应1h后取样,均加入甲醇终止反应,HPLC测定,结果见图5(C,D)。游离和氨基介孔硅固定化蜗牛酶的酶活及酶解效率均随温度的增大而变化,呈现先增大后减小的趋势;游离和氨基介孔硅固定化蜗牛酶在50℃条件下酶解淫羊藿总黄酮提取物时,二者的酶活及酶解效率均最高,因此,二者酶解淫羊藿总黄酮提取物的最适反应温度均为50℃。与游离蜗牛酶相比,氨基介孔硅固定化蜗牛酶在不同反应温度下酶活及酶解效率变化较小,在25、37、60、70℃条件下,其酶活和酶解效率均明显高于游离蜗牛酶。实验结果表明,蜗牛酶经固定化后更适合用于不同温度条件下的各种酶解转化反应。
(3)最适底物比考察
称取适量游离及氨基介孔硅固定化蜗牛酶,在最适反应温度和最适反应pH值条件下酶解淫羊藿总黄酮,底物浓度为0.5mg·mL-1,酶与底物质量比分别为1:2,1:1,2:1,3:1,4:1,反应1h后取样,均加入甲醇终止反应,HPLC检测,结果见图5(E,F)。游离蜗牛酶在与淫羊藿总黄酮质量比为1:2时,酶活及酶解效率均最高,随着酶与淫羊藿总黄酮质量比的增加,其酶活及酶解效率逐渐降低;氨基介孔硅固定化蜗牛酶在与淫羊藿总黄酮质量比为1:1时,酶活及酶解效率最高。因此,游离蜗牛酶酶解淫羊藿总黄酮的最适酶与底物质量比为1:2,氨基介孔硅固定化蜗牛酶酶解淫羊藿总黄酮提取物的最适酶与底物质量比为1:1。
6.氨基介孔硅固定化蜗牛酶在不同反应体系中酶解淫羊藿总黄酮
由于淫羊藿总黄酮在水相反应体系中的溶解度较差,反应体系中析出的淫羊藿总黄酮不利于转化反应的进行,因此,我们利用氨基介孔硅固定化蜗牛酶在由DMSO(有机相)和pH5.0的磷酸缓冲盐水溶液(水相)组成的双相体系中酶解淫羊藿总黄酮提取物。不同的体系中DMSO的体积分数为0%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%,将淫羊藿总黄酮提取物溶于上述体系中至饱和,考察不同体系中淫羊藿总黄酮提取物溶解的最大量和不同体系中氨基介孔硅固定化蜗牛酶转化淫羊藿总黄酮的情况。结果见表1(n=3),氨基介孔硅固定化蜗牛酶转化淫羊藿总黄酮的最适双相体系为40%的DMSO(有机相)和60%的pH 5.0磷酸盐缓冲溶液(水相)。在此最适双相体系中,淫羊藿总黄酮在体系中的浓度比单纯水相明显增大,同时,氨基介孔硅固定化蜗牛酶可以保持有效的酶活力为87.86±3.09%。
表1氨基介孔硅固定化蜗牛酶双相反应体系的优化
7.氨基介孔硅固定化蜗牛酶在双相体系中酶解淫羊藿总黄酮的稳定性
氨基介孔硅固定化蜗牛酶和淫羊藿总黄酮提取物加入由40%DMSO和60%pH 5.0的缓冲盐溶液组成的双相反应体系中,二者质量比为1:1。在50℃温度条件下反应,分别于反应1h和2h取样测定,重复三次,测定反应稳定性。反应1h后,淫羊藿总黄酮酶解产物的生成率为54.71±0.62%(n=3),反应2h后,淫羊藿总黄酮酶解产物的生成率为84.30±0.98%(n=3)。测定结果稳定可靠,氨基介孔硅固定化蜗牛酶在最适双相体系中的反应稳定性良好。
8.淫羊藿总黄酮酶解产物的HPLC测定
称取适量游离及氨基介孔硅固定化蜗牛酶,在50℃温度条件下,分别于pH 6.0和5.0的磷酸盐缓冲液中酶解淫羊藿总黄酮,底物浓度为0.5mg·mL-1,酶与底物质量比分别为1:2和1:1,反应2h后加入甲醇终止反应,涡旋后离心取上清液,滤过,即得供试品溶液,HPLC测定图谱见图6。结果表明,游离蜗牛酶和氨基介孔硅固定化蜗牛酶酶解淫羊藿总黄酮所得产物的组成和比例存在显著差异,其中,转化生成的箭藿苷A、箭藿苷B和鼠李糖基淫羊藿次苷II无明显差异,二者转化主要不同之处为宝藿苷和淫羊藿苷元的比例。游离蜗牛酶的淫羊藿总黄酮酶解产物主要由箭藿苷A、箭藿苷B、鼠李糖基淫羊藿次苷II、宝藿苷I和淫羊藿苷元组成,其比例为1.2:2.1:1.0:2.6:3.0;而氨基介孔硅固定化蜗牛酶的淫羊藿总黄酮酶解产物没有淫羊藿苷元,主要由箭藿苷A、箭藿苷B、鼠李糖基淫羊藿次苷II和宝藿苷I组成,其比例为1.5:2.0:1.0:5.8。
实施例2
本实施例说明采用其他固定载体酶解淫羊藿总黄酮的酶解效果。
本实施例对比了采用海藻酸钡、微球和实施例1的氨基介孔硅固定化酶酶解淫羊藿总黄酮的酶解效果。结果如表2所示:
表2不同酶固定技术制备的固定化蜗牛酶比较
可见,采用氨基介孔硅固定化蜗牛酶相比其他固定载体具有更高的结合效率、更好的稳定性和更高的转化率。
实施例3
本实施例说明本发明酶解产物的抗肿瘤活性。
精密称取淫羊藿总黄酮及采用实施例1的方法获取的游离酶酶解产物和固定化酶酶解产物各2.65mg,分别溶于25μL DMSO中,制备成母液。再将母液用RPMI-1640不完全培养基溶液稀释100倍,然后再等倍稀释至不同给药浓度:4.0、17.0、66.0、265.0、1060.0μg·mL-1。取对数生长期的MCF-7、A549、HepG2和Hela细胞分别接种于96孔板,培养24h后加入20μL待测药液,药液的终浓度分别0.4、1.7、6.6、26.5、106.0μg·mL-1。每个样品设置6个复孔,并设置不含药物的不完全培养基空白组,继续培养48h后,每孔加入MTT溶液(5.0mg·mL-1)20μL,培养4h后轻轻吸弃孔中上清液,然后每孔加入150μL的DMSO,微型振荡器振荡5~10min,采用酶标仪在测定波长490nm处,测定每孔的吸光度值A(OD值)。计算各药液的细胞生长抑制率(Inhibiton rate),利用Graphpad软件处理数据,并计算各化合物IC50,实验数据以均数±标准差(Mean±SD)记录。抑制率(Inhibiton rate)计算公式:
淫羊藿总黄酮及其酶解产物作用于MCF-7、A549、HepG2和Hela细胞48h的抑制率结果分别见表3-6(n=6,)。
表3淫羊藿总黄酮及其酶解产物对MCF-7细胞作用48h的抑制率
表4淫羊藿总黄酮及其酶解产物对A549细胞作用48h的抑制率
表5淫羊藿总黄酮及其酶解产物对HepG2细胞作用48h的抑制率
表6淫羊藿总黄酮及其酶解产物对Hela细胞作用48h的抑制率
IC50的计算结果见表7(n=6,)。
表7淫羊藿总黄酮及其酶解产物对A549、HepG2、MCF-7、Hela细胞的IC50
抑制率对给药浓度作图结果见图7和图8。淫羊藿总黄酮及其酶解产物对MCF-7、A549、HepG2和Hela细胞的抑制率均呈现一定的浓度依赖性;淫羊藿总黄酮酶解产物的细胞毒作用明显强于淫羊藿总黄酮原型苷,固定化酶酶解产物的细胞毒作用明显强于游离酶酶解产物;淫羊藿总黄酮及其酶解产物对MCF-7细胞的作用最强,Hela、HepG2次之,A549最弱。
- 还没有人留言评论。精彩留言会获得点赞!