一种治疗高血压的异钩藤碱缓释制剂及其制备方法与流程
本发明涉及一种治疗高血压的异钩藤碱缓释制剂及其制备方法,属于药品技术的领域。
技术背景
高血压是最常见的慢性病,也是心脑血管病最主要的危险因素,脑卒中、心肌梗死、心力衰竭及慢性肾脏病是其主要并发症。高血压的危害性与患者的血压水平相关外,还取决于同时存在的其他心血管病危险因素、靶器官损伤以及合并的其他疾病的情况。高血压患病率随年龄增长而升高,据全国卫生部门统计资料显示,我国现有高血压患者已超过一亿人,每年新增300万以上,我国已成为世界上高血压危害最严重的国家。高血压给患者造成的健康损害是非常巨大的,给患者带来的病痛折磨也是不言而喻的,治疗高血压是所有的患者的共同的心声。治疗高血压除了在生活中做好自我调理,多做运动,调整日常饮食结构,戒烟限酒外。药物治疗高血压仍然是现在广大的高血压患者普遍采用的治疗方法,同时也是最基本的高血压疗法。高血压患者要根据自己的具体病情在医生的正确指导下服用适当的降压药。
高血压是慢性病,患者需长期坚持服药。钩藤Uncari a rhy nchop hy l la(Miq1)J acks.为茜草科(Rubiaceae)钩藤属(Uncari a Schred1)植物,生长于山谷、溪边,广泛分布于我国南方诸省。钩藤为中医传统常用药,性凉、味甘、苦,具有清热平肝、息风定惊之功能。现代药理研究表明,钩藤中的生物碱类成分具有良好的降血压作用。异钩藤碱是从其中提取分离的有效部位。现代药理实验证实,异钩藤碱能降低血压,舒张血管,降低血管平滑肌细胞的钙离子浓度。由于治疗高血压最好的办法是平稳降压。因此如能将异钩藤碱制成缓释制剂则可维持血药浓度的平衡,达到平稳降压的目的。但是异钩藤碱的稳定性极差,在温度高于25℃时易被破坏,如将异钩藤碱按照常规方法制备成缓释制剂,势必使得部分异钩藤碱转化成其它成分,从而达不到发挥药物疗效的目的。因此制备一种能够在常温下制备的治疗高血压的异钩藤碱缓释制剂具有重要的意义。
技术实现要素:
:
本发明所要解决的技术问题在于提供一种治疗高血压的异钩藤碱缓释制剂及其制备方。本发明所述治疗高血压的异钩藤碱缓释制剂能够在常温下进行制备,最大程度保证了异钩藤碱的稳定性,确保了药物的临床疗效。
为解决上述技术问题,本发明采用以下技术方案实现:一种治疗高血压的异钩藤碱缓释制剂,按照重量组分计算,它主要由异钩藤碱1份、1-2%海藻酸钠水溶液0.5-2份、1-2%聚乳酸水溶液0.5-2份、1-2%聚乙烯吡咯烷酮水溶液0.5-2份与0.09-0.21mol/L的氯化钙水溶液制备而成。
前述治疗高血压的异钩藤碱缓释制剂,按照重量组分计算,它主要由异钩藤碱1份、1.5%海藻酸钠水溶液1份、1.5%聚乳酸水溶液1份,1.5%乙烯吡咯烷酮水溶液1份与0.18mol/L的氯化钙水溶液制备而成。
前述治疗高血压的异钩藤碱缓释制剂的制备方法,将异钩藤碱、海藻酸钠水溶液、聚乳酸水溶液、乙烯吡咯烷酮水溶液与氯化钙水溶液制成缓释微丸,再按照常规方法制备成药物制剂。
前述治疗高血压的异钩藤碱缓释制剂的制备方法,所述缓释微丸用肠溶包衣液进行包衣后,再按照常规方法制备成药物制剂。
前述治疗高血压的异钩藤碱缓释制剂的制备方法,所述药物制剂为口服固体制剂。
前述治疗高血压的异钩藤碱缓释制剂的制备方法,所述口服固体制剂为:胶囊剂、片剂、颗粒剂或丸剂。
前述治疗高血压的异钩藤碱缓释制剂的制备方法,所述缓释微丸这样制备:所述海藻酸钠水溶液是先取海藻酸钠溶于水,然后置于恒温磁力搅拌器上搅拌至气泡完全消失,即得;所述聚乳酸水溶液是先取聚乳酸溶于水,然后置于恒温磁力搅拌器上搅拌均匀,即得;所述乙烯吡咯烷酮水溶液是先取乙烯吡咯烷酮溶于水,然后置于恒温磁力搅拌器上搅拌均匀,即得;将异钩藤碱粉末与海藻酸钠水溶液、聚乳酸水溶液、乙烯吡咯烷酮水溶液按比例混合均匀,用7号针头的注射器吸取上述混悬液滴入氯化钙水溶液中,交联0.5-2小时后,滤过,用蒸馏水冲洗2-4遍,置于35-45℃烘箱干燥10-15小时,即得。
前述治疗高血压的异钩藤碱缓释制剂的制备方法,所述缓释微丸这样制备:将异钩藤碱粉末与海藻酸钠水溶液、聚乳酸水溶液、乙烯吡咯烷酮水溶液按比例混合均匀,用7号针头的注射器吸取上述混悬液以40d/min的速度滴入氯化钙水溶液中,交联1小时后,滤过,用蒸馏水冲洗三遍,置于40℃烘箱干燥12小时,即得。
一种治疗高血压的异钩藤碱缓释制剂的制备方法,前述的缓释微丸置于包衣锅中,调整包衣锅转速为50rpm/min使其滚动,然后喷入肠溶包衣液;所述肠溶包衣液是先取30份95%乙醇将0.2份邻苯二甲酸二乙酯、0.1份蓖麻油、0.2份吐温-80溶解,再加入1份聚丙烯酸树脂,溶解,混匀,过夜,即得;然后30℃鼓热风吹干,再喷入上述肠溶包衣液、鼓热风吹干,如此反复,至包衣后小丸增重10%,再按照常规方法制备成药物制剂。
一种治疗高血压的异钩藤碱缓释胶囊的制备方法,前述缓释微丸,填充入胶囊,即得。
天然高分子多糖类物质海藻酸钠具有良好的生物相容性和生物可降解性。《中国药典》2010年版已将海藻酸钠作为药用辅料列入正文。海藻酸钠的分子链上有大量的羧基,所以海藻酸钠水溶液与无水氯化钙水溶液可以通过正、负电荷吸引形成海藻酸钙凝胶微丸,从而在温和的条件下实现对异钩藤碱的包埋,提高制剂稳定性,并可调节药物释放速度。
天然高分子多糖类物质海藻酸钠具有良好的生物相容性和生物可降解性。《中国药典》2010年版已将海藻酸钠作为药用辅料列入正文。海藻酸钠的分子链上有大量的羧基,所以海藻酸钠水溶液与无水氯化钙水溶液可以通过正、负电荷吸引形成海藻酸钙凝胶微丸,从而提高制剂稳定性,并可调节药物释放速度。实验研究中发现,当海藻酸钠浓度过低时,体系中的带负电荷的分子减少,从而与带正电的氯化钙交联不紧密,导致释放加快。而当其浓度过高时,所形成的骨架更稳定,反而导致药物释放不完全。之前,发明人通过大量实验研究结果表明,海藻酸钠的质量浓度15mg/mL,氯化钙浓度为0.18mol/L,海藻酸钠、氯化钙溶液与异钩藤碱的比例为1:1,交联1小时比较合适。此外,我们在之前的研究中还发现,上述方法制备的药物在胃液中会产生一定的药物释放,而异钩藤碱在酸环境中易被破坏,因此发明人将上述方法制成的缓释微丸用肠溶包衣液包衣,让异钩藤碱在胃液中几乎不释放,减少异钩藤碱被破坏的可能性。
后来,发明人发现采用海藻酸钠和氯化钙水溶液制备的微丸可以减少对异钩藤碱的破坏,但是效果还不够好,即:药物释放效果还不够好,溶出率还不够高,进而使得临床效果还不够理想。后来发明人经过大量的实验得出,在现有基础上加入聚乳酸和聚乙烯吡咯烷酮后,制成的治疗高血压的异钩藤碱缓释制剂疗效增强了,以海藻酸钠水溶液、1-2%聚乳酸水溶液、1-2%聚乙烯吡咯烷酮水溶液与氯化钙水溶液为辅料制备微丸可最大限度的减少对异钩藤碱的破坏,最大程度的保证异钩藤碱的稳定性,药物释放效果好,溶出率高,使得临床效果也比之前好。且发明人还发现,当聚乳酸、聚乙烯吡咯烷酮与海藻酸钠的用量相同时,效果最好。
异钩藤碱为吲哚类生物碱,属弱碱性药物,难溶于水且遇高温不稳定,其不稳定性为缓释制剂的制备增加了难度,常规缓释制剂的制备方法需在温度较高的条件下方能进行,而发明人经过大量的实验,通过滴制法将异钩藤碱先制成缓释微丸,所用方法使得反应条件温和,不需要有机溶媒跟高温,常温下就能完成对异钩藤碱的包裹,整个制备过程中对异钩藤碱的破坏很少,避免了常规制备过程中的加热等过程,最大程度保证了异钩藤碱的稳定性,确保了药物的临床疗效。将上述方法制备的缓释微丸用肠溶包衣液包衣,减少了异钩藤碱在胃液中被破坏的可能性。本发明所述方法不仅解决了传统制剂携带及服用上的麻烦,而且还具有缓释功效,维持血药浓度的平衡,达到平稳降压的目的,减少了患者的服药次数,提高了药物的生物利用度,更有利于高血压的治疗。达到了发明目的。
申请人进行了下列实验,可证明本发明具有有效的效果;
实验例1:辅料筛选试验
1.不同浓度海藻酸钠对缓释性能的影响:分别配制1.0%、1.5%、2.0%三种不同浓度的海藻酸钠水溶液,制备凝胶微丸,测定其释放度。结果见图1。
从图1中可看出,当海藻酸钠的浓度过低时,黏度下降,导致释放过快。增加海藻酸钠的浓度,可使黏度增加,释放减慢。但当海藻酸钠的浓度增加到2.0%时,反而导致释放不完全。
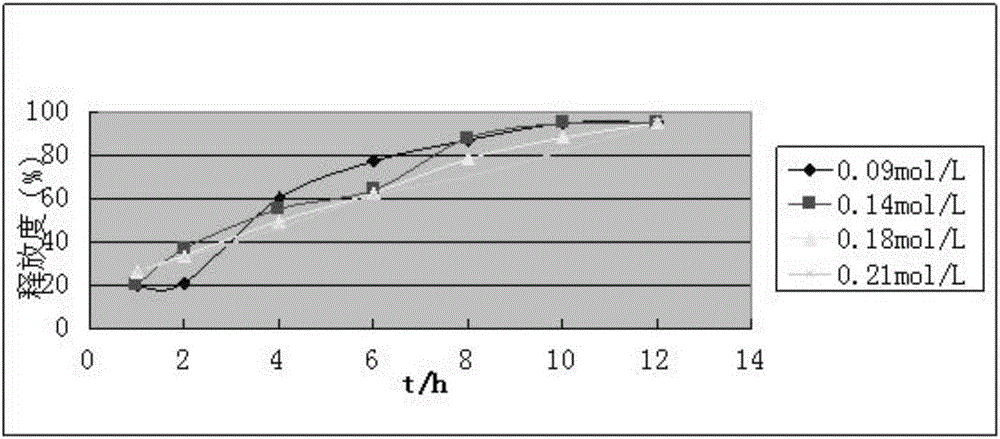
2.不同浓度氯化钙对缓释性能的影响:在确定海藻酸钠溶液浓度的基础上制备凝胶微丸,分别测定0.09mol/L、0.14mol/L、0.18mol/L、0.21mol/L氯化钙水溶液的释放度。结果见图2。
由图2可知,不同浓度氯化钙制备所得的凝胶微丸对释放度有一定的影响。低于0.18mol/L时,释放加快,高于0.18mol/L时,释放减慢。
3.不同浓度的聚乳酸水溶液对缓释性能的影响:分别配制分别配制1.0%、1.5%、2.0%三种不同浓度的聚乳酸水溶液,制备凝胶微丸,测定其释放度。结果见表1。
表1不同浓度的聚乳酸水溶液对缓释性能的影响
从表1中可看出,当聚乳酸水溶液的浓度过低时,黏度下降,导致释放过快。增加聚乳酸水溶液的浓度,可使黏度增加,释放减慢。但当聚乳酸水溶液的浓度增加到2.0%时,反而导致释放不完全。
4.不同浓度的聚乙烯吡咯烷酮水溶液对缓释性能的影响:分别配制分别配制1.0%、1.5%、2.0%三种不同浓度的聚乙烯吡咯烷酮水溶液,制备凝胶微丸,测定其释放度。结果见表2。
表2不同浓度的聚乙烯吡咯烷酮水溶液对缓释性能的影响
从表2中可看出,当聚乙烯吡咯烷酮的浓度过低时,黏度下降,导致释放过快。增加聚乳酸水溶液的浓度,可使黏度增加,释放减慢。但当聚乳酸水溶液的浓度增加到2.0%时,反而导致释放不完全。
5.交联时间对缓释性能的影响:在确定处方因素的条件下,考察不同交联时间对药物释放的影响。结果见图3.
由图3可知,交联时间的长短对释放度有一定的影响,当交联时间延长时药物释放有所减慢。当交联时间为1小时,释放度更佳。
6.海藻酸钠与药物比例对缓释性能的影响:分别测定海藻酸钠与药物比例为2:1、1:1、1:2对释放度的影响。结果见图4。
由图4可知,当海藻酸钠与异钩藤碱之比为1:1时,可达到良好的释放,而当其比例为1:2或2:1时均不符合释放要求。
实验例2:不同工艺及辅料异钩藤碱保存率实验
异钩藤碱具有热不稳定性,温度高易被破坏,如按照常规方法制备成缓释制剂,药物会有较大损失,申请人通过研究发现采用海藻酸钙微丸包裹法制备异钩藤碱缓释胶囊可以减少对异钩藤碱的破坏。
1.方法:
1.1色谱条件
色谱柱:VP-ODS柱(150L×4.6mm),流动相为甲醇:0.05%三乙胺水溶液(70:30),流速为1.0ml.min-1,检测波长为254nm,柱温30℃,进样量10ul。
1.2空白辅料的干扰:称取一定量不含异钩藤碱的空白凝胶微丸,用pH6.8的缓冲液处理,得样品的空白对照,进HPLC,记录色谱图,结果表明辅料在异钩藤碱出峰处无干扰。
1.3标准曲线制备
精密称取异钩藤碱对照品约1mg,置于10mL容量瓶中,加缓冲液溶解(pH6.8)溶解并定容至刻度,作为贮备液,分别取贮备液0.1、0.2、0.4、0.6、0.8、1.2mL置于10mL容量瓶配制成不同浓度的对照品溶液,进样检测,记录峰面积,以峰面积(Y)对药物浓度(X,ug/mL)进行线性回归,得回归方程为:Y=15177X+1516.8,R=0.9999在1~12ug/mL范围内线性关系良好。
1.4样品液配制:
1.4.1缓释微丸的制备
方案一(传统方法):
组方:异钩藤碱10g,赋形剂(淀粉178g、羧甲基纤维素钠88g、微晶纤维素88g、糊精248g和磷酸氢钙88g)共690g、包衣剂(乙基纤维素30g、羟丙基甲基纤维素45g和丙烯酸树脂75g)共150g、润湿剂(聚乙烯吡咯烷酮)100g、表面活性剂(吐温20)3g、增塑剂(邻苯二甲酸二乙酯)5g、遮光剂(二氧化钛)3g。
工艺:包括以下步骤:
a.空白丸芯制备:先将药物与辅料均粉碎过100筛备用;取润湿剂聚乙烯吡咯烷酮溶于乙醇制成10%的聚乙烯吡咯烷酮乙醇溶液,备用;取过筛后的赋形剂及包衣剂分别混合均匀备用;取80%重量的赋形剂,加入85%重量的10%聚乙烯吡咯烷酮乙醇溶液,于挤出滚圆机中制成丸芯,充分干燥,即得空白丸芯;
b.含药微丸的制备:将上述空白丸芯置于包衣锅中,加入过筛的异钩藤碱与剩余的赋形剂、表面活性剂吐温20的混合物,喷入剩余的10%聚乙烯吡咯烷酮乙醇溶液,再加入药粉混合物、再喷入10%聚乙烯吡咯烷酮乙醇溶液,如此反复操作,直至药粉全部加完,取出,置于托盘中50-60℃干燥6~7小时制得含药微丸;
c.缓释小丸制备:取包衣剂加入乙醇溶液中,放置过夜,再加入增塑剂、遮光剂,制得包衣液;将含药微丸置于包衣锅中使其滚动,包衣锅的转速为60~70rpm,然后喷入包衣液,鼓热风吹干,再喷入包衣液、鼓热风吹干,如此反复,至包衣后小丸增重,6~7%,即得缓释微丸。填充胶囊后即得缓释胶囊。
方案二:
组方:异钩藤碱10g、1.5%海藻酸钠水溶液10g、0.18mol/L的氯化钙水溶液10g。
工艺:
所述海藻酸钠水溶液是先取海藻酸钠溶于水,然后置于恒温磁力搅拌器上搅拌至气泡完全消失,即得;将异钩藤碱粉末与海藻酸钠水溶液按比例混合均匀,用7号针头的注射器吸取上述混悬液以40d/min的速度滴入氯化钙水溶液中,交联1小时后,滤过,用蒸馏水冲洗三遍,置于40℃烘箱干燥12小时,即得缓释微丸二。填充胶囊后即得缓释胶囊。
方案三:
按实施例1进行制备的缓释微丸。即为缓释微丸三。
1.4.2样品液的处理:分别上述异钩藤碱缓释微丸各10㎎,研细,精密称重,加甲醇100ml超声30分钟,称重,加甲醇补足失重,过滤,滤液过0.45㎜微孔滤膜,即得样品液。
2.4分别取三种方案所得样品液进行测定,计算异钩藤碱保留率,其结果见表3。
表3
注:与方案一相比,*P<0.05,**P<0.01;
与方案二相比,+P<0.05。
以上实验结果表明,传统生产缓释制剂方法对异钩藤碱破坏较大,采用海藻酸钠和氯化钙水溶液制备的微丸可以减少对异钩藤碱的破坏,但是效果还不够好,以海藻酸钠水溶液、1-2%聚乳酸水溶液、1-2%聚乙烯吡咯烷酮水溶液与氯化钙水溶液为辅料制被微丸可最大限度的减少对异钩藤碱的破坏,且效果优于方案二,即优于仅用海藻酸钠和氯化钙作为辅料时的效果。
实验例3:体外溶出度研究
量取0.1mol/L盐酸900ml置于溶出杯内,加温,使温度恒定在(37±0.5)℃,调整转速至100r/min,使其稳定,分别精密称取实验例2中三种方案制备的缓释微丸0.6g,于10、30、60、90、120min各取样5ml以0.45μm微孔滤膜滤过,同时立即补充37℃同样的溶出介质5ml,自取样至滤过在30s内完成。取出微丸,用少量水洗涤后放入(37±0.5)℃900ml磷酸盐缓冲液(pH=6.8)中,控制转速为100r/min,于1、2、4、8、12h各取样5ml以0.45μm微孔滤膜滤过,同时立即补充37℃同样的溶出介质5ml,自取样至滤过在30s内完成。测定滤液中异钩藤碱含量,计算不同时间的累积溶出百分率,结果见表4、表5:
表4酸液中累计溶出百分率
注:与方案一相比,*P<0.05,**P<0.01;
与方案二相比,+P<0.05。
表5磷酸盐缓冲液中累计溶出百分率
注:与方案一相比,*P<0.05,**P<0.01;
与方案二相比,+P<0.05。
以上实验结果表明,三种方案所得缓释微丸在人工胃液中2小时累计溶出百分率均低于10%,方案三所得制剂在人工胃液中稳定性明显优于其他两种方案;三种方案所得缓释微丸在人工肠液中12小时累计溶出百分率超过90%,具有肠溶缓释效果。
实验例4:药效学研究
申请人对本发明进行了主要药效学研究,通过实验数据说明本发明的有益效果。
1样品制备
本发明缓释微丸:按照实验例1中所述方法进行制备;
对比缓释微丸1:制备同实验例2中方案一;
对比缓释微丸2:制备同实验例2中方案二;
硝苯地平胶囊:山东新华制药厂生产。
2实验动物
自发性高血压大鼠(SHR)购自重庆市动物研究所,饲养条件:室温(25±2)℃,人工照明12h/d,按性别分笼饲养,每笼5只,自由饮水,喂以21%高蛋白块料,每日添加块料1次,换新鲜自来水2次。按体重和血压随机分组,即空白对照组(A,给予生理盐水),方案一所得缓释微丸(B,用药量为0.1g/kg)、方案二所得缓释微丸(C,用药量为0.1g/kg,)、本发明缓释微丸(D,用药量为0.1g/kg),硝苯地平组(E,用药量为0.1g/kg),每组10只,各组动物均以胶囊内容物给药。
3实验方法
3.1单次给药的降压实验SHR雌雄兼用,体重(220±20)g。测压前将大鼠放入(37±1)℃电热恒温箱内加温,10min后用型大鼠电脑血压心率仪间接测定大鼠尾动脉收缩压(SBP)。正式实验前每天测压训练一次,约2周,待大鼠适应环境、血压稳定后,实验时取A、B、C、D、E组。测定给药前及给药后2,4,12,24h的SBP。采用t检验,比较动物自身给药前后SBP均数差异的显著性。
3.2多次给药的降压实验取A、B、C、D、E组,每日给药1次。连续给药20d,每日测定SBP(方法同前)。采用两组间t检验进行统计学处理,比较各给药组与对照组SBP均数差异的显著性。
4实验结果
4.1单次给药的降压效果观察
SHR给予方案一、方案二和本发明缓释微丸组所制备制剂后2h均能达峰值,分别下降(3.19±1.40)kpa、(3.78±2.58)kPa和(4.01±2.95)kPa,12h仍未恢复到给药前水平。给予硝苯地2h,血压下降达峰值(P<0.01),4h时血压回升与治疗前相比仍有显著差异(P<0.05),至6h已接近正常治疗前水平(P<0.05)。
4.2多次给药的降压效果观察
连续给予方案一、方案二和本发明方法所制备制剂后,血压缓慢下降,20d中收缩压平均下降值分别为(2.30±0.41)kpa、(2.79±0.65)kpa、(2.91±0.35)kPa,与对照组比有显著性差异,详见表6。
表6各组SHR连续给药20d的降压效果比较(x±s,n=10)
注:与B组相比,*P<0.05,**P<0.01;
与C组相比,+P<0.05。
结果表明,三种方案均能降低自发性高血压大鼠收缩压,与方案一、二组比较,方案三组(即本发明缓释微丸组)效果更好。
附图说明
图1是不同浓度海藻酸钠水溶液对释放度的影响图
图2是不同浓度氯化钙水溶液对释放度的影响图
图3是不同交联时间对释放度的影响图
图4是不同海藻酸钠与异钩藤碱比例对释放度的影响图
具体实施方式:
实施例1:
制备方法:
精密称取处方量的海藻酸钠制成1.5%的海藻酸钠水溶液,置于恒温磁力搅拌器上搅拌至气泡完全消失;精密称取聚乳酸制成1.5%的聚乳酸水,然后置于恒温磁力搅拌器上搅拌均匀,即得;精密称取乙烯吡咯烷酮制成1.5%的海藻酸钠水溶液,然后置于恒温磁力搅拌器上搅拌均匀,将异钩藤碱粉末与海藻酸钠水溶液、聚乳酸水溶液、乙烯吡咯烷酮水溶液按1:1:1:1比例混合均匀,用7号针头的注射器吸取上述混悬液滴入氯化钙水溶液中,交联1小时后,滤过,用蒸馏水冲洗3遍,置于35-45℃烘箱干燥12小时,即得缓释微丸一。填充胶囊后即得缓释胶囊。
用法用量:口服,每日3次,每次2粒。
规格:0.3g/粒。
实施例2:
制备方法:精密称取处方量的海藻酸钠制成1.5%的海藻酸钠水溶液,置于恒温磁力搅拌器上搅拌至气泡完全消失;精密称取聚乳酸制成1.5%的聚乳酸水,然后置于恒温磁力搅拌器上搅拌均匀,即得;精密称取乙烯吡咯烷酮制成1.5%的海藻酸钠水溶液,然后置于恒温磁力搅拌器上搅拌均匀;将异钩藤碱粉末与海藻酸钠水溶液、聚乳酸水溶液、乙烯吡咯烷酮水溶液按1:1:1:1比例混合均匀,用注射器(7号针头)吸取混悬液以40d/min的速度滴入0.14mol/L的氯化钙水溶液,交联1小时后,滤过,用蒸馏水冲洗三遍,置于40℃烘箱干燥12小时,得含药微丸,将含药微丸置于包衣锅中调整包衣锅转速为50rpm/min使其滚动,然后喷入包衣液(取300ml 95%的乙醇将2g的邻苯二甲酸二乙酯DEP、1g的蓖麻油、2g的吐温-80溶解,再加入10g聚丙烯酸树脂,溶解,混匀,过夜,制成5%的包衣液),30℃鼓热风吹干,再喷入包衣液、鼓热风吹干,如此反复,至包衣后小丸增重10%,即得缓释微丸,即得缓释微丸二,填充胶囊后即得缓释胶囊。
用法用量:口服,每日3次,每次2粒。
规格:0.3g/粒。
实施例3:
所述缓释片剂这样制备:精密称取处方量的海藻酸钠制成1.5%的海藻酸钠水溶液,置于恒温磁力搅拌器上搅拌至气泡完全消失;精密称取聚乳酸制成1.5%的聚乳酸水,然后置于恒温磁力搅拌器上搅拌均匀,即得;精密称取乙烯吡咯烷酮制成1.5%的海藻酸钠水溶液,然后置于恒温磁力搅拌器上搅拌均匀,即得;将异钩藤碱粉末与海藻酸钠水溶液、聚乳酸水溶液、乙烯吡咯烷酮水溶液按2:1:1:1比例混合均匀,用注射器(7号针头)吸取混悬液以40d/min的速度滴入0.14mol/L的氯化钙水溶液,交联0.5小时后,滤过,用蒸馏水冲洗2遍,置于35℃烘箱干燥10小时,冷却后即得缓释微丸,加入制成量20%的淀粉混合,压制成片,包糖衣或薄膜衣,即得。
用法用量:口服,每日3次,每次2片。
规格:0.3g/片。
实施例4:
所述缓释片剂这样制备:精密称取处方量的海藻酸钠制成1.5%的海藻酸钠水溶液,置于恒温磁力搅拌器上搅拌至气泡完全消失;精密称取聚乳酸制成1.5%的聚乳酸水,然后置于恒温磁力搅拌器上搅拌均匀,即得;精密称取乙烯吡咯烷酮制成1.5%的海藻酸钠水溶液,然后置于恒温磁力搅拌器上搅拌均匀,即得;将异钩藤碱粉末与海藻酸钠水溶液、聚乳酸水溶液、乙烯吡咯烷酮水溶液按1:2:2:2比例混合均匀,用注射器(7号针头)吸取混悬液以40d/min的速度滴入0.21mol/L的氯化钙水溶液,交联2小时后,滤过,用蒸馏水冲洗4遍,置于45℃烘箱干燥15小时,含药微丸,将含药微丸置于包衣锅中调整包衣锅转速为50rpm/min使其滚动,然后喷入包衣液(取300ml 95%的乙醇将2g的邻苯二甲酸二乙酯DEP、1g的蓖麻油、2g的吐温-80溶解,再加入10g聚丙烯酸树脂,溶解,混匀,过夜,制成5%的包衣液),30℃鼓热风吹干,再喷入包衣液、鼓热风吹干,如此反复,至包衣后小丸增重10%,即得缓释微丸,填充胶囊,即得。
用法用量:口服,每日3次,每次2片。
规格:0.3g/片。
- 还没有人留言评论。精彩留言会获得点赞!