一种双层乳化液滴、载药微球及其制备方法和装置与流程
本发明涉及一种双层乳化液滴、载药微球及其制备方法和装置,属于生物医药材料及微流控技术领域。
背景技术:
水包油包水或油包水包油双层乳化微液滴、及以它们为模板制备的载药微球在生物医用材料、药物研发等领域有广泛的应用。现有制备方式主要采用传统大尺度的机械搅拌、乳化-交联、复合乳液-溶剂挥发、乳化-凝胶、反向悬浮聚合等技术,第一步先生成双层乳化微液滴,进而通过溶剂挥发、干燥等方法生成微球产品。传统制备方法缺乏对微球尺寸的精准控制,得到的微球产品尺寸范围宽,粒径均一性较差,往往通过筛分获得特定粒径范围的产品;而且在制备过程中所包裹药物损失较多。
微流控液滴技术可以借助微型通道(微纳米尺度)内流体剪切力与表面张力之间的相互作用,对两相不互溶的液体(油和水)进行操控,其中一相流体会形成高度均一的液滴,以实现尺寸、形貌、结构可控微球的制备。微流控液滴技术是自下而上制备乳液的方法,能够以非常高的通量制备高度单分散性的液滴乳液,所形成的载药微球产品尺寸均一性良好。
但是,目前利用微流控技术制备双层乳化微液滴、载药微球的装置结构复杂、操作和控制过程步骤多、不灵活,亦不能实现复乳微液滴的同步固化,且制备成本较高。
技术实现要素:
针对现有双层乳化液滴及载药微球制备过程中装置结构复杂、操作繁琐、高成本等不足,本发明提供一种双层乳化液滴、载药微球及其制备方法和装置,操作工艺简单、装置可灵活组合、成本低,可制备粒径范围在0~1000微米的微球,并且微球粒径均一性良好、可高效载药,解决了现有微球制备工艺存在的粒径不可控、无法同步固化、载药不完全等问题。
本发明的技术方案如下:
一种双层乳化液滴的制备装置,该装置由第一级微通道和第二级微通道串联组成;
所述的第一级微通道为十字型微通道、T型微通道、Y型微通道或共流型微通道;
所述的第二级微通道包括A类或B类两种类型的微通道;
所述的A类第二级微通道包括共轴连接的离散相流体通道、连续相流体通道和收集通道,离散相流体通道和收集通道套接在连续相流体通道中,离散相流体通道靠近收集通道的一端呈锥形,离散相流体通道沿中心轴平分为单层乳化微液滴通入通道和催化剂或固化剂通道;
所述的B类第二级微通道包括单层乳化微液滴通入通道、催化剂或固化剂通道、收集通道和连续相流体通道,单层乳化微液滴通入通道、催化剂或固化剂通道和收集通道组呈Y型连通结构,所述的连续相流体通道设置在单层乳化微液滴通入通道、催化剂或固化剂通道和收集通道的交汇处并且与收集通道垂直连通。
根据本发明,优选的,所述的十字型微通道包括呈十字型结构连通的中间相流体通道、内相流体通道和收集通道。
根据本发明,优选的,所述的T型微通道包括呈T型结构连通的中间相流体通道、内相流体通道和收集通道。
根据本发明,优选的,所述的Y型微通道包括呈Y型结构连通的中间相流体通道、内相流体通道和收集通道。
根据本发明,优选的,所述的共流型微通道包括共轴连接的中间相流体通道、内相流体通道和收集通道,内相流体通道和收集通道套接在中间相流体通道内,内相流体通道呈梯形并且靠近收集通道的一端为小直径端。中间相流体通道的流体流动方向与内相流体通道的流体流动方向相同。
根据本发明,优选的,第一级微通道和第二级微通道串联后,第一级微通道中的收集通道和第二级微通道中的单层乳化微液滴通入通道连通。
根据本发明,优选的,所述的第一级微通道和第二级微通道的通道直径为20‐1000微米,进一步优选50‐500微米。
根据本发明,使用上述装置制备双层乳化液滴的过程中,连续相流体的流动剪切力和/或挤压力与流体之间的界面张力相互作用,液滴在离散相流体与连续相流体通道交汇处生成。在第一级微通道中形成单层乳化液滴,单层乳化液滴由中间相流体携带进入第二级微通道,在第二级微通道的出口处形成双层乳化液滴,双层乳化液滴同步固化形成双层微球,所形成的载药微球粒径均一(尺寸偏差<5%),粒径大小、结构/载药量都可控;可载亲水或亲油类药物,且每个微球之间载药量一致。
根据本发明,第一级微通道和第二级微通道为玻璃或石英毛细管,或通过光、化学、激光等刻蚀方法形成的微通道。
一种双层乳化液滴,该液滴是由内相流体和中间相流体在第一级微通道中形成单层乳化液滴,单层乳化液滴再与催化剂或固化剂溶液、连续相流体在第二级微通道的出口处形成双层乳化液滴。
根据本发明的双层乳化液滴,优选的,所述的内相流体为含有药物的生物相容性高分子聚合物溶液;所述的高分子聚合物为聚乳酸(PLA)、聚乳酸-羟基乙酸共聚物(PLGA)或聚乙二醇(PEG),高分子聚合物溶液的溶剂为二氯甲烷、丙酮、二甲基甲酰胺,高分子聚合物溶液的质量分数为0.1‐10%。
根据本发明的双层乳化液滴,优选的,所述的中间相流体为生物相容性高分子聚合物水溶液和/或交联剂水溶液,高分子聚合物为海藻酸钠、聚乙烯醇、壳聚糖、淀粉或明胶,高分子聚合物水溶液的质量分数为0.1‐10%;交联剂为戊二醛、乙二醛或甲醛,交联剂水溶液的质量分数0.5‐80%。
根据本发明的双层乳化液滴,优选的,所述的催化剂为质子酸或生物酶水溶液,所述的质子酸用于调节中间相流体的酸碱度pH,优选为有机酸或无机酸,质子酸的pH值优选为pH1‐4;所述的生物酶优选能够催化蛋白质分子之间或之内的交联、蛋白质和氨基酸之间的连接的酶,最优选谷氨酰胺转胺酶,生物酶水溶液的质量分数优选0.1‐0.3%。
根据本发明的双层乳化液滴,优选的,所述的固化剂为二价的可溶于水的钙、钡离子水溶液,最优选氯化钙或氯化钡水溶液,固化剂的质量分数优选0.1‐10%。
根据本发明的双层乳化液滴,优选的,所述的连续相流体为与水不互溶的有机溶剂,进一步优选的,连续相流体中含有或不含有表面活性剂;所述的表面活性剂为水溶性或油溶性表面活性剂,更优选的,所述水溶性表面活性剂选择非离子型表面活性剂,包括聚氧乙烯型或多元醇型;所述油溶性表面活性剂选择EM90(鲸蜡基聚乙二醇/聚丙二醇-10/1二甲基硅氧烷),Span 80(司盘80)或DC749(道康宁硅树脂XIAMETER RSN‐0749);
所述的有机溶剂为C12‐18液态烷烃、硅油、石蜡之一或组合。
根据本发明的双层乳化液滴,优选的,所述的液滴粒径为160~650μm,粒径偏差≤2%。
一种载药微球,是在生物相容性高分子聚合物微球内包裹有含药物的内核。
根据本发明的载药微球,优选的,所述含药物的内核是与生物相容性高分子聚合物混合在一起的亲水或亲油类药物;
优选的,所述载药微球粒径为100~1000μm,尺寸偏差小于5%;特别优选的,所述载药微球粒径为110~530μm,粒径偏差≤4%;
优选的,所述生物相容性高分子聚合物为海藻酸钠、聚乙烯醇、壳聚糖、淀粉、明胶、聚乳酸(PLA)、聚乳酸-羟基乙酸共聚物(PLGA)或/和聚乙二醇(PEG)。
本发明的载药微球以双层乳化液滴为模板,在内相流体和中间相流体中加入具有生物相容性的高分子聚合物及药物,固化形成具有内和外双层结构的载药微球。微球粒径均一、内外层厚度可控;经本发明的同步固化工艺,所产生的微球表面光滑、尺寸均一、载药量可控。本发明所述载药微球,内层与外层支撑物均为高分子聚合物,内层球包载药物,外层提供支撑的同时也有助于保持内层药物活性,以实现稳定释药、防止突释、增加安全性;通过改变溶剂与材料的性质、操作参数等,可方便改变微球产品的尺寸、内外层比例,以实现载药、释药可控。
本发明还提供所述载药微球的制备方法,载药微球的尺寸均一、结构/载药量可控。
一种载药微球的制备方法,包括步骤如下:
(1)离散相流体和连续相流体的制备
分别配制离散相流体和连续相流体;
所述离散相流体由内相流体、中间相流体、及催化剂或固化剂水溶液共同组成:
所述内相流体为含有药物的生物相容性高分子聚合物溶液,所述的高分子聚合物为聚乳酸(PLA)、聚乳酸-羟基乙酸共聚物(PLGA)或聚乙二醇(PEG),高分子聚合物溶液的溶剂为二氯甲烷、丙酮、二甲基甲酰胺,高分子聚合物溶液的质量分数为0.1‐8%;
所述中间相流体为生物相容性高分子聚合物水溶液或高分子聚合物水溶液与交联剂水溶液的混合液,高分子聚合物为海藻酸钠、聚乙烯醇、壳聚糖、淀粉或/和明胶,高分子聚合物水溶液的质量分数为0.1‐10%;交联剂为戊二醛、乙二醛或甲醛,交联剂水溶液的质量分数0.5‐80%;
所述的催化剂为质子酸或生物酶水溶液,所述的质子酸优选为有机酸或无机酸,质子酸的pH值优选为pH1‐4;所述的生物酶优选能够催化蛋白质分子之间或之内的交联、蛋白质和氨基酸之间的连接的酶,最优选谷氨酰胺转胺酶,生物酶水溶液的质量分数优选0.1‐0.3%;
所述的固化剂为二价的可溶于水的钙、钡离子水溶液,最优选氯化钙或氯化钡水溶液,固化剂的质量分数优选0.1‐10%。
所述连续相流体为与水不互溶的有机溶剂,连续相流体中含有或不含有表面活性剂;所述有机溶剂为C12‐18液态烷烃、硅油、石蜡之一或组合;
(2)形成双层乳化液滴
将内相流体和中间相流体分别通入第一级微通道的内相流体通道和中间相流体通道,在内相流体通道和中间相流体通道的交汇处形成单层乳化液滴,通过第一级微通道的收集通道收集单层乳化液滴;
在第二级微通道中,将单层乳化液滴通入单层乳化液滴通道,将催化剂或固化剂溶液通入催化剂或固化剂通道,将连续相流体通入连续相流体通道,单层乳化液滴、催化剂或固化剂、连续相流体在交汇处形成双层乳化液滴,通过第二级微通道的收集通道收集得到双层乳化液滴;
(3)同步固化
在形成双层乳化液滴的同时,催化剂或固化剂在第二级微通道内与中间相流体中的高分子聚合物充分混合,双层乳化液滴得以同步固化形成微球,再于20‐80℃温度下静置0.5‐24小时,保证微球完全交联固化,得到载药微球;
(4)微球分离
将步骤(3)交联固化后的反应液过滤,收集固体颗粒,依次用有机溶剂、水洗涤,干燥后得到载药微球产品。
根据本发明载药微球的制备方法,优选的,步骤(1)中连续相流体中含有表面活性剂时,所述表面活性剂为水溶性或油溶性表面活性剂的一种或两种以上混合;进一步优选的,所述水溶性表面活性剂为非离子型表面活性剂,包括聚氧乙烯型和多元醇型非离子型表面活性剂;所述油溶性表面活性剂为EM90(鲸蜡基聚乙二醇/聚丙二醇-10/1二甲基硅氧烷),Span 80(司盘80)或DC749(道康宁硅树脂XIAMETER RSN‐0749)。
根据本发明载药微球的制备方法,优选的,步骤(1)中所述固化剂为氯化钙水溶液,所述固化剂水溶液质量浓度为1‐10%,特别优选质量浓度为2‐5%的氯化钙水溶液。
根据本发明载药微球的制备方法,优选的,步骤(2)在第二级微通道中控制中间相流体流量为:0.5‐8mL/h,催化剂或固化剂水溶液流量为:0.05‐2.0mL/h,控制连续相流体的流量为:1‐20mL/h;
进一步优选的,步骤(2)在第二级微通道中控制中间相流体流量为2‐6mL/h,催化剂或固化剂水溶液流量为0.1‐0.5mL/h,连续相流体的流量为5‐6mL/h。
根据本发明,步骤(2)中双层乳化液滴的形成是在第二级微通道内,利用流体的剪切力和与界面张力之间的相互作用将离散相流体分割成纳升级及纳升级以下的液滴。
根据本发明载药微球的制备方法,优选的,步骤(3)中所述交联固化为:高分子聚合物与交联剂在催化剂或固化剂的作用下进行常规交联反应,例如:聚乙烯醇与醛类化合物在酸性催化剂的催化作用下进行常规交联反应生成聚乙烯醇缩醛产物,或者海藻酸钠在氯化钙的催化下固化形成海藻酸钙;经固化后得到固体颗粒,然后进行分离、洗涤、烘干后处理,得到微球产物。
根据本发明载药微球的制备方法,优选的,步骤(4)中所述洗涤用有机溶剂选自沸点在80℃以下的液态烷烃、60‐90℃石油醚、乙酸乙酯中的一种或两种以上组合。洗涤时间为0.5‐3小时。所述干燥是指真空烘干、冷冻干燥或喷雾干燥。
本发明采用两级微通道串联的方式制备双层乳化微液滴,在第一级微通道中形成单层乳化微液滴,由中间相夹裹携带(或称预混液)进入第二级微通道,在形成双层乳化微液滴的同时,催化剂与高分子聚合物发生作用,微液滴发生固化从而形成微球。其基本原理为依据流体动力学原理制备双层乳化微液滴,以此为模板,在内相流体中加入高分子聚合物单体、药物等,经固化后形成载药微球。由于微球是逐个形成的,因此本发明所述的制备装置及其方法对微球尺寸、内外层厚度、载药量都可以精准控制,所形成的产品球形度好、尺寸均一、结构/载药量都可控。
本发明的有益效果是:
1、本发明基于流体动力学原理制备双层乳化微液滴及载药微球。内层液滴在第一级微通道内在液/液表面张力和剪切力的作用下逐滴形成,在第二级通道内内层液滴由中间相携带并与催化剂或固化剂一起由连续相剪切包裹形成双层乳化液滴的外层。以此双层乳化微液滴为模板,在流体中加入高分子聚合物和药物,经催化剂或固化剂作用,可同步固化形成载药微球。所制得的载药微球粒径均一(尺寸偏差小于5%),载药量均匀/可控。
2、本发明可通过调整流体流速和微通道尺寸来调节液滴大小,因此通过调整流体流速或改变微通道尺寸实现不同粒径与内外层比例的载药微球的制备,具有粒径尺寸、内外层厚度可控制备的优点。
3、本发明所述同步固化工艺使得制得的微球球形度好,避免另行固化的操作影响微球形貌。
4、本发明双层乳化液滴的制备装置结构简单,调整灵活,易于实现乳化液滴和载药微球粒径尺寸、内外层厚度的灵活控制,制备成本低。
附图说明
图1A为十字型第一级微通道A的结构示意图。
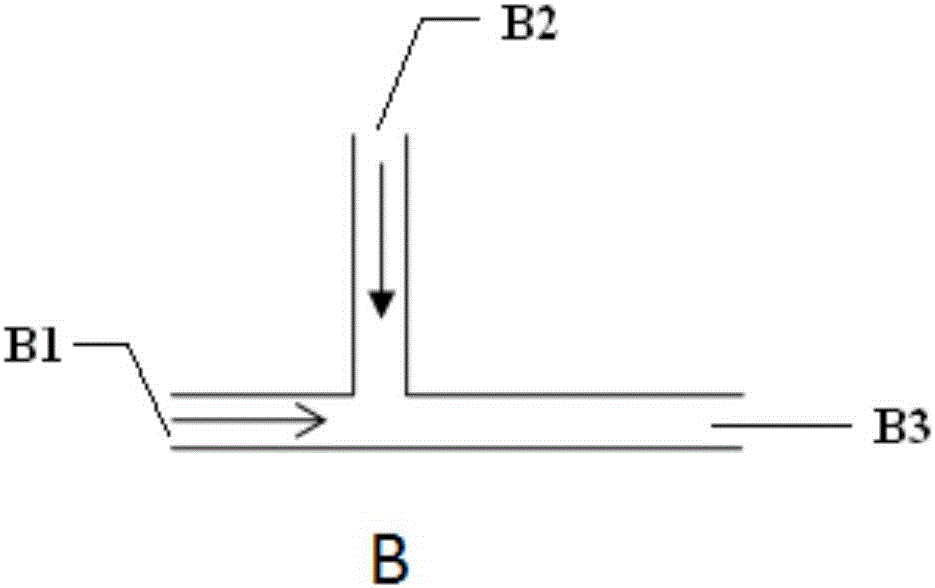
图1B为T型第一级微通道B的结构示意图。
图1C为Y型第一级微通道C的结构示意图。
图1D为共流型第一级微通道D的结构示意图。
图2A为A类第二级微通道的结构示意图。
图2B为B类第二级微通道的结构示意图。
图3为实施例4中双层乳化微液滴的制备装置的结构示意图,即T型第一级微通道B和B类第二级微通道串联形成的制备装置。
图4、5、6、7分别为实施例3、4、5、6制得的载药微球的显微镜照片。
其中:A1、B1、C1、D1、13为中间相流体通道,A2、B2、C2、D2、14为内相流体通道,3、8、15为单层乳化微液滴通入通道,4、9、16为催化剂或固化剂通道,5、10、17为连续相流体通道,A3、B3、C3、D3、6、11、18为收集通道,7、12、20为双层乳化液滴,19为单层乳化液滴。
具体实施方式
下面结合附图和实施例对本发明做进一步说明,但本发明的保护范围并不限于此。
实施例中:A类第二级微通道为玻璃或石英毛细管微通道,B类第二级微通道为经光、化学、激光等刻蚀技术形成的微通道(通道尺度为微米级)。
实施例中的%浓度单位为质量百分比。
实施例中使用的聚乙烯醇分子量为13,000‐23,000,水解99%以上;含量:≥99.0%,白色粒状。
实施例中使用的海藻酸钠分子式为(C6H7O6Na)n,分子量398.31;大分子32,000‐250,000,白色粒状。
实施例1、聚乙烯醇与海藻酸钠混合水溶液的配制
称取10克聚乙烯醇固体颗粒加入90克蒸馏水,在75‐80℃条件下搅拌均匀溶解为透明液体,即得10%质量百分比的聚乙烯醇水溶液。
称取5克海藻酸钠固体颗粒加入95克蒸馏水,在室温条件下搅拌均匀溶解为透明液体,即得5%质量百分比的海藻酸钠水溶液。
按照质量分数,将上述聚乙烯醇与海藻酸钠水溶液配制成终浓度分别为1%和0.5%的聚乙烯醇与海藻酸钠混合水溶液。
实施例中使用的连续相流体为含有2%EM90的石蜡油,称取98克石蜡油,加入2克EM90,即得2%质量百分比的石蜡油连续相流体。
实施例中使用的催化剂为质子酸水溶液,调节质子酸水溶液pH值为1‐6,即得催化剂水溶液。
实施例中使用的交联剂为戊二醛水溶液,计算聚乙烯醇水溶液浓度与戊二醛水溶液的质量分数,按照3:2的比例配制交联剂水溶液。
实施例中使用的固化剂为氯化钙水溶液,称取10克无水氯化钙固体,加入90克去离子水中,即得10%质量百分比的固化剂水溶液。
实施例中使用的内相流体为含有药物的聚乳酸二氯甲烷溶液、溶液的质量分数为2%。
实施例2、
一种双层乳化液滴的制备装置,该装置由第一级微通道和第二级微通道串联组成;
所述的第一级微通道为十字型微通道A、T型微通道B、Y型微通道C或共流型微通道D;
所述的第二级微通道包括A类或B类两种类型的微通道;
所述的A类第二级微通道包括共轴连接的离散相流体通道、连续相流体通道5和收集通道6,离散相流体通道和收集通道6套接在连续相流体通道5中,离散相流体通道靠近收集通道6的一端成锥形,离散相流体通道沿中心轴平分为单层乳化微液滴通入通道3和催化剂或固化剂通道4;
所述的B类第二级微通道包括单层乳化微液滴通入通道8、催化剂或固化剂通道9、收集通道11和连续相流体通道10,单层乳化微液滴通入通道8、催化剂或固化剂通道9和收集通道11组呈Y型连通结构,所述的连续相流体通道10设置在单层乳化微液滴通入通道8、催化剂或固化剂通道9和收集通道11的交汇处并且与收集通道11垂直连通。
第一级微通道和第二级微通道串联后,第一级微通道中的收集通道和第二级微通道中的单层乳化微液滴通入通道连通。
所述的十字型微通道A包括呈十字型结构连通的中间相流体通道A1、内相流体通道A2和收集通道A3。
所述的T型微通道B包括呈T型结构连通的中间相流体通道B1、内相流体通道B2收集通道B3。
所述的Y型微通道C包括呈Y型结构连通的中间相流体通道C1、内相流体通道C2收集通道C3。
所述的共流型微通道D包括共轴连接的中间相流体通道D1、内相流体通道D2和收集通道D3,内相流体通道D2和收集通道D3套接在中间相流体通道D1内,内相流体通道D2呈梯形并且靠近收集通道D3的一端为小直径端。中间相流体通道D1的流体流动方向与内相流体通道D2的流体流动方向相同。
实施例3、载药微球制备:
第一级微通道选用图1A所示的十字型第一级微通道,内相流体通道A2直径为150微米,中间相流体通道A1直径为200微米;第二级微通道选用图2A所示的A类第二级微通道,离散相流体通道直径为250微米,连续相流体通道5直径为300微米。
聚乙烯醇与海藻酸钠混合水溶液质量百分比浓度分别为1.5%和0.5%,交联剂水溶液为50%质量百分比的戊二醛水溶液。按溶质聚乙烯醇:交联剂=3:2质量比将聚乙烯醇水溶液与戊二醛水溶液进行预混,催化剂水溶液为pH=2.0的盐酸水溶液。
分别将聚乙烯醇、海藻酸钠与交联剂混合液、内相流体以0.3mL/h、3mL/h的恒定流量泵入至第一级微通道中,形成的单层乳化微液滴经单层乳化微液滴通入通道3携带进入第二级微通道中(图2A),同时催化剂水溶液以0.8mL/h的恒定流量泵入至催化剂通道4中,液体石蜡以其恒定流量6mL/h泵入连续相流体通道5中,双层乳化微液滴7在交汇处形成,通过收集通道6收集。
将双层乳化微液滴7于25℃室温条件下静置24小时后得到白色固体。然后过滤,收集白色固体。将白色固体通过乙酸乙酯洗涤,然后再通过索氏提取器采用水洗涤24小时,真空4℃干燥后得到白色微球。外层粒径500微米,内层粒径100微米(图4所示),微球尺寸偏差为3%。
实施例4、载药微球制备:
第一级微通道选用图1B所示的T型第一级微通道,内相流体通道B2直径为100微米,中间相流体通道B1直径为200微米;第二级微通道选用图2B所示B类第二级微通道,离散相流体通道直径为200微米,连续相流体通道10直径为300微米。第一级微通道和第二级微通道串联后,如图3所示。
聚乙烯醇水溶液浓度为2%,交联剂水溶液为质量百分比浓度40%的戊二醛水溶液,按溶质聚乙烯醇:交联剂=3:2质量比将聚乙烯醇水溶液与交联剂水溶液进行预混,催化剂水溶液为pH=1.5的硫酸水溶液。分别将聚乙烯醇与交联剂混合液、内相流体以0.5mL/h、2mL/h的恒定流量泵入至第一级微通道中,形成的单层乳化微液滴19经单层乳化微液滴通入通道15进入第二级微通道中,同时催化剂水溶液以0.8mL/h的恒定流量泵入至催化剂通道16中,十二烷以其恒定流量8mL/h泵入连续相流体通道17中。双层乳化微液滴20在交汇处形成,通过收集通道18收集。
将双层乳化微液滴20于25℃室温条件下静置24小时后得到白色固体。然后过滤,收集白色固体。将白色固体通过乙酸乙酯洗涤,然后再通过索氏提取器采用水洗涤24小时,真空4℃干燥后得到白色微球。外层粒径300微米,内层粒径120微米(图5所示),微球尺寸偏差为3%。
实施例5、载药微球制备:
第一级微通道选用图1C所示的Y型第一级微通道,内相流体通道C2直径为80微米,中间相流体通道C1直径为100微米;第二级微通道选用图2B所示B类第二级微通道,离散相流体通道直径为150微米,连续相流体通道10直径为200微米。
海藻酸钠水溶液质量百分比浓度为2%,固化剂水溶液为4mol/L的氯化钙水溶液。分别将海藻酸钠水溶液、中间相以0.5mL/h、3mL/h的恒定流量泵入至第一级微通道中,形成的微液滴经由单层乳化微液滴通入通道8进入第二级微通道中(图2B),同时固化剂水溶液0.5mL/h的恒定流量泵入至固化剂通道9中,甲苯以其恒定流量10mL/h泵入连续相流体通道10中。双层乳化微液滴12在交汇处形成,通过收集通道11收集。
将双层乳化微液滴12于25℃室温条件下静置24小时后得到白色固体。然后过滤,收集白色固体。将白色固体通过石油醚洗涤,然后再通过索氏提取器采用水洗涤24小时,真空4℃干燥后得到白色微球。外层粒径120微米,内层粒径95微米(图6所示),微球尺寸偏差为4%。
实施例6、载药微球制备:
第一级微通道选用图1D所示的共流型第一级微通道,内相流体通道D2直径为150微米,中间相流体通道D1直径为130微米;第二级微通道选用图2A所示A类第二级微通道,离散相流体通道直径为150微米,连续相流体通道5直径为400微米。
明胶水溶液质量浓度为2%,交联剂水溶液为质量浓度为0.2%的谷氨酰胺转胺酶水溶液。分别将明胶水溶液、中间相以1mL/h、6mL/h的恒定流量泵入至第一级微通道中,形成的微液滴经由单层乳化微液滴通入通道3进入第二级微通道中(图2A),同时交联剂水溶液0.8mL/h的恒定流量泵入至催化剂或固化剂通道4中,液体石蜡以其恒定流量8mL/h泵入连续相流体通道5中。双层乳化微液滴7在离散相流体通道出口附近生成,通过收集通道6收集。
将双层乳化微液滴12于25℃室温条件下静置24小时后得到白色固体。然后过滤,收集白色固体。将白色固体通过乙酸乙酯洗涤,然后再通过索氏提取器采用水洗涤24小时,真空4℃干燥后得到白色微球。外层粒径290微米,内层粒径90微米(图7),微球尺寸偏差为3%。
- 还没有人留言评论。精彩留言会获得点赞!