叶酸修饰的载药羟基磷灰石及其制备方法与流程
本发明涉及生物纳米材料领域,具体涉及一种叶酸分子靶向且酸敏响应的羟磷灰石纳米药物复合物及其制备方法和应用。
背景技术:
癌症是危害全人类健康的最主要疾病之一。目前全球每年新发癌症患者高达一千多万,死亡六百多万,其危害的严重性和治疗的艰巨性已引起许多国家公众、政府和科学界的极大重视。发展能够更加有效地治疗这类疾病的手段,对促进人类健康具有重大意义。
抗癌药物化疗是除手术之外最重要的癌症治疗手段。目前多数小分子抗癌药水溶性较差,临床上通常使用表面活性剂对其进行乳化,但血液稳定性较差,基本上不具有缓释或控释性能,而且具有血液半衰期短、毒副作用大等众多缺点。因此,研究新型的高效药物运输载体已成为生物医药领域的当务之急。其中,羟磷灰石纳米药物载体以其优异的生物化学性能和应用发展潜力,不断吸引业界的广泛关注。
通常,实现活性肿瘤靶向的方法主要包括瘤内注射和载体修饰两大类。瘤内注射虽然简便,大多数情况下由于实际肿瘤部位无法精确探知,所以并不适用。目前,更多是用能够识别癌细胞膜上特定分子信号的特殊配体来修饰药物载体外层,主要包括叶酸、缩氨酸(如环状五肽cRGD)、铁传递蛋白和某些抗体。与其他靶向分子相比,叶酸相对分子质量小,无免疫原性,价廉易得,稳定性好,与药物或载体之间的化学键结合简单易行。故叶酸是靶向适配分子较为理想的选择。
叶酸(folic acid,FA)又称蝶酰谷氨酸、维生素B11,是一种人体必需的维生素,在细胞内可还原为四氢叶酸,后者是一碳单位转移酶的辅酶,参与一碳单位代谢和嘌呤、胸腺嘧啶的合成,是细胞代谢、DNA合成及修复的基本组成成分。肿瘤细胞的快速生长需要充足的叶酸以维持DNA的合成。动物细胞内缺少合成叶酸的酶,细胞的生长和增殖依赖从外界环境获得叶酸。叶酸受体(folate receptor,FR)是细胞膜表面糖基化磷脂酰基醇(GPI)锚定的糖化多肽,包括三种异构体:α-FR、β-FR、γ-FR。β-FR是细胞膜相关蛋白,通过GPI锚定在细胞膜上,二者具有70%的同源性。α-FR和γ-FR缺少修饰GPI锚附着的羧基末端信号肽,组成上属于分泌型蛋白。叶酸受体有三个显著特点:(1)FR与游离叶酸的亲和力非常高,解离常数Kd<1nmol/L;(2)FR对叶酸分子通过化学键与其他大分子物质连接形成的复合物的亲和力和胞吞效应与游离叶酸相当,具有良好的入胞转运潜能;(3)FR对叶酸及其衍生物的结合、转运是特异的受体-配体结合,并能被游离叶酸竞争抑制。叶酸与受体结合,通过内化方式通过细胞膜,是叶酸进入细胞内的主要途径。叶酸受体在正常组织中的表达高度保守,只在肾、肺、脉络膜、胎盘中有低到中等水平表达,且以β亚型为主。但在大部分恶性肿瘤细胞中,如卵巢癌、子宫内膜癌、宫颈癌、非小细胞肺癌、结肠癌和鼻咽癌等均高度表达,有时可比正常组织高出100-300倍。叶酸受体转运机制如下:外源性的叶酸复合物与细胞膜表面的叶酸受体特异性结合,周围形成凹陷,进入细胞内形成内涵体。在核体内质子泵的作用下,内涵体内部的pH由7下降至5,使复合物构象改变,叶酸修饰的药物从复合物上解离,释放到细胞内,而叶酸受体可以再回到细胞膜表面,循环转运药物。
由于随着生物体内pH的变化,有机药物载体如脂质体、聚合微球等不稳定,易发生结构的变化,不能有效进行药物释放。所以以无机纳米材料作为药物载体用于靶向药物输送系统,近年来得到迅猛发展。无机药物载体如二氧化硅、四氧化三铁等虽然药物负载能力高,化学稳定性和生物相容性好,但若在体内过量积聚,会对正常组织造成损伤,目前已有文献报道体内过量积聚的二氧化硅对肺和肝的损伤尤为明显。而羟磷灰石(HAP)是脊椎动物骨骼和牙齿的主要无机组成成分,具有优良的生物相容性和生物降解性、安全低毒、稳定的化学结构和载药性广等优点。此外,在酸性条件下(pH3.5-6),羟磷灰石易水解,且对正常细胞无毒副作用,是一种有潜力的药物载体。
技术实现要素:
本发明的主要目的在于提供一种叶酸分子靶向且酸敏响应性的羟磷灰石纳米药物载体,用于靶向表面叶酸受体过表达的肿瘤细胞,从而实现抗癌药物的缓慢靶向释放。
本发明首先公开一种叶酸修饰的载药羟基磷灰石(FA@D@HAP)的制备方法,所述的方法包括:首先制备载药羟基磷灰石(D@HAP),并以硅烷偶联剂或氨基聚合物对其进行表面氨基化处理的步骤,以及以叶酸对所述表面氨基化的载药羟基磷灰石进行修饰的步骤。
本发明目的亦包括提供以上述方法所制备得到的叶酸修饰的载药羟基磷灰石。
由上述本发明的方法制备的表面修饰叶酸的纳米药物载体,其作用在于叶酸受体在大多数肿瘤中高度表达,而叶酸受体同叶酸衍生物及游离叶酸的亲和力均很强,叶酸衍生物与受体结合,并可通过内吞方式穿过细胞膜,从而靶向表面叶酸受体过表达的肿瘤细胞,实现抗癌药物的缓慢靶向释放。
与现有技术相比,本发明的叶酸修饰的载药羟基磷灰石在如下几个方面都有突出的优势:(1)由于随着生物体内pH的变化,有机药物载体如脂质体、聚合微球等不稳定,易发生结构的变化,不能有效进行药物释放。无机药物载体如二氧化硅、四氧化三铁等虽然药物负载能力高,化学稳定性和生物相容性好,但若在体内过量积聚,会对正常组织造成损伤。而羟磷灰石(HAP)是脊椎动物骨骼和牙齿的主要无机组成成分,具有优良的生物相容性和生物降解性、安全低毒、稳定的化学结构和载药性广等优点。此外,在酸性条件下(pH3.5-6),羟磷灰石易水解,且对正常细胞无毒副作用,是一种有潜力的药物载体。(2)本发明所述的药物载体是将抗癌药物和羟磷灰石纳米颗粒进行共掺杂,而非仅仅将抗癌药物修饰在纳米颗粒表面,从而提高了抗癌药物的包覆率。(3)掺杂抗癌药物的羟磷灰石纳米颗粒表面修饰上叶酸后,就如同在该纳米载体表面覆盖上一层薄膜,从而有效地降低了该纳米载体在血液循环过程中的抗癌药物的泄漏率。进而提高了抗癌药物的释放效率和局部浓度并降低抗癌药物的使用剂量和毒副作用等,在癌症治疗领域有着重大的研究价值和应用前景。(4)叶酸受体在大多数肿瘤中高度表达,而叶酸受体同叶酸衍生物及游离叶酸的亲和力均很强,叶酸衍生物与受体结合,并可通过内吞方式穿过细胞膜。因此,本发明制备的FA@DOX@HAP纳米药物载体对肿瘤细胞具有很好的主动响应性能,也就是说该纳米药物载体具有良好的叶酸分子特异靶向性,从而实现抗癌药物的靶向缓慢释放。
附图说明
本发明附图8幅:
图1是实施例2.1FA@DOX@HAP纳米颗粒的透射电镜(TEM)图。其中,a)和b)分别是标尺为1000nm和500nm下的电镜图,c)和d)是标尺为200nm下的电镜图。其形态为棒状,平均长度是50-100nm,平均直径5-20nm,不易聚集,分散性较好。
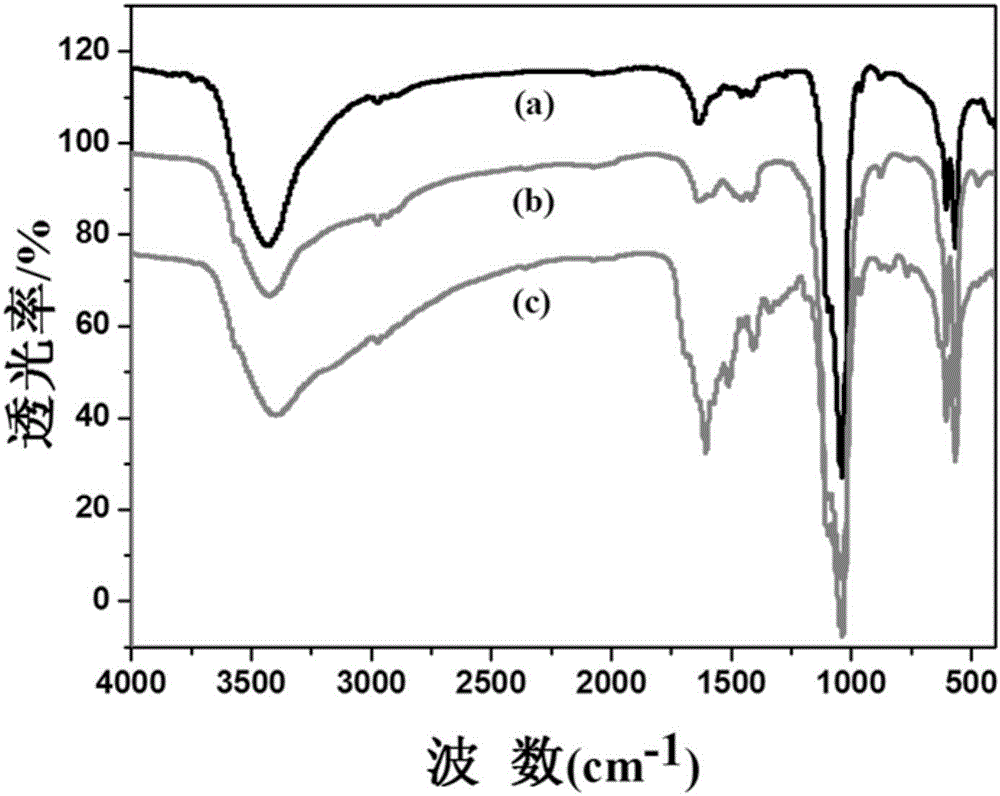
图2是实施例2.2的红外光谱(FTIR)图。其中,a)为DOX@HAP,b)为氨基化的DOX@HAP,c)为FA@DOX@HAP。
图3是实施例2.3HAP,DOX@HAP,氨基化的DOX@HAP,FA@DOX@HAP纳米颗粒的Zeta电位图。其中HAP,DOX@HAP,氨基化的DOX@HAP,FA@DOX@HAP的浓度均为0.5mg/mL。
图4是实施例2.4的XRD图。其中,a)为氨基化的DOX@HAP,b)为FA@DOX@HAP。
图5是实施例3DOX和FA@DOX@HAP纳米颗粒的荧光光谱图。DOX和FA@DOX@HAP浓度分别为2.5mM和5mg/mL,激发波长为480nm。
图6是实施例4FA@DOX@HAP在不同pH值下的药物释放过程。其中,a)为不同pH值下的相对荧光强度图,b)为不同pH值下的药物累积释放率图。激发波长为480nm。
图7是实施例5FA@DOX@HAP纳米颗粒的细胞毒性图。其中,a)为人肝细胞(HL-7702),b)为人肝癌细胞(HepG-2),c)为乳腺癌细胞(MCF-7),d)为宫颈癌细胞(HeLa),e)为四种细胞的细胞毒性折线图。FA@DOX@HAP浓度为5mg/mL,激发波长为480nm。
图8是实施例6FA@DOX@HAP在不同细胞、不同时间的荧光共聚焦显微成像图。其中,a)为非洲绿猴肾细胞(COS-7),b)为人肝细胞(HL-7702),c)为乳腺癌细胞(MCF-7),d)为宫颈癌细胞(HeLa)。FA@DOX@HAP浓度为5mg/mL,激发波长为480nm。
具体实施方式
本发明旨在提供一种叶酸修饰的载药羟基磷灰石(FA@D@HAP)的制备方法,以及由该方法制备得到的产品。所述的制备方法包括:首先制备载药羟基磷灰石(D@HAP),并以硅烷偶联剂或氨基聚合物对其进行表面氨基化处理的步骤,以及以叶酸对所述表面氨基化的载药羟基磷灰石进行修饰的步骤。
如无特殊说明,本说明书中所使用的符号FA均代表叶酸,D代表所载的药物,DOX代表阿霉素,HAP代表羟基磷灰石,D@HAP代表载药羟基磷灰石,FA@D@HAP代表叶酸修饰的载药羟基磷灰石。
具体实施方式中,所述方法中,载药羟基磷灰石由气液沉淀水热法制备:水可溶性钙盐、磷酸盐及药物在乙醇-水体系中,于100~120℃条件下反应制备。其中,所述的可溶性钙盐优选但不限于Ca(NO3)2·4H2O;所述的可溶性磷酸盐优选但不限于(NH4)2HPO4。
另一方面,该所述载药羟基磷灰石中述及的所载药物选自:阿霉素、紫杉醇、顺铂、吉西他滨、氟尿嘧啶、盖诺、表阿霉素、环磷酰胺、长春新碱、博莱霉素、多帕菲或其衍生物。尤其优选阿霉素(DOX)或其衍生物,其可举例但不限于:阿霉素、吡喃阿霉素、表柔比星、米托蒽醌。
所制备的载药羟基磷灰石是棒状材料,平均长度为50-100nm,平均直径为5-20nm。
具体实施方式的另一方面,对所述载药羟基磷灰石的表面氨基化处理通过与硅烷偶联剂或氨基聚合物反应完成,其中所述的硅烷偶联剂可选自但不限于γ-氨丙基三乙氧基硅烷或乙二胺丙基三乙氧基硅烷中的一种;所述的氨基聚合物选自但不限于聚乙烯亚胺或聚丙烯酰胺中的一种。
具体实施方式的再一方面,所述以叶酸对表面氨基化的载药羟基磷灰石进行修饰的步骤是:叶酸(FA)、1-(-3-二甲基氨丙基)-3-乙基碳二亚胺盐酸盐(EDC)和N-羟基琥珀酰亚胺(NHS)按照摩尔比1~2:1~2:1~3的混合物与表面氨基化的载药羟基磷灰石反应。
较为具体完整的具体实施方式中,本发明的叶酸修饰的载药羟基磷灰石的制备方法,包括如下步骤:
(1)水可溶性硝酸盐、磷酸盐及药物在乙醇-水体系中,于100~120℃条件下反应制备载药羟基磷灰石;
(2)硅烷偶联剂或氨基聚合物与载药羟基磷灰石在乙醇-水体系中反应,制备表面氨基化的载药羟基磷灰石;
(3)叶酸(FA)、1-(-3-二甲基氨丙基)-3-乙基碳二亚胺盐酸盐(EDC)和N-羟基琥珀酰亚胺(NHS)按照摩尔比1~2:1~2:1~3的混合物与表面氨基化的载药羟基磷灰石反应,制备叶酸修饰的载药羟基磷灰石。
优选的技术方案中,本发明的叶酸修饰的载药羟基磷灰石的制备方法,包括如下步骤:
(1)向浓度为15~30mg/ml、pH为10.5±0.5的Ca(NO3)2·4H2O的乙醇溶液中缓慢滴加浓度为6~10mg/ml的药物-水溶液,搅拌5~15min后,滴加浓度为60~100mg/ml的(NH4)2HPO4水溶液,继续搅拌1~2h;混合物在100~120℃条件下水热反应12~24h后,高速离心,沉淀物洗涤干燥,得到载药羟基磷灰石;
其中,使用25%(w/w)的氨水来调节所述的Ca(NO3)2·4H2O的乙醇溶液的pH值。
(2)向体积比4:1~10:1的乙醇-水溶液中缓慢滴加质量分数为90~98%的硅烷偶联剂或氨基聚合物,搅拌15~30min后,缓慢加入载药羟基磷灰石,所得混合体系超声1~5min,搅拌1~3h,调节pH至10~12,并继续反应2~3h;高速离心,沉淀物洗涤干燥,得到表面氨基化的载药羟基磷灰石;
(3)将摩尔比为1~2:1~2:4~8的叶酸(FA)、1-(-3-二甲基氨丙基)-3-乙基碳二亚胺盐酸盐(EDC)和去离子水搅拌0.5~2h,将相对于叶酸1~3倍摩尔量的N-羟基琥珀酰亚胺(NHS)加入FA-EDC体系中,继续搅拌5~7h后,缓慢加入相对于叶酸质量1~3倍的表面氨基化的载药羟基磷灰石,调节混合物pH至7~8,继续搅拌2~3h后,高速离心,沉淀物洗涤干燥,得到叶酸修饰的载药羟基磷灰石。
进一步,本发明亦提供上述任意制备方法所制得的叶酸修饰的载药羟基磷灰石。其基于叶酸分子靶向且酸敏响应性羟磷灰石纳米药物载体被用于靶向传输抗癌药物,所得纳米药物载体的结构验证、大小和形态等基本性能分别采用傅里叶红外光谱分析仪(FTIR)、X射线衍射图谱分析仪(XRD)、Zeta电位分析仪、透射电子显微镜(TEM)来测定。其对抗癌药物负载能力的大小则采用紫外可见分光光度计、荧光显微镜来进行验证,并通过体外细胞实验来检测该纳米药物载体的靶向治疗效果。
此外,该纳米药物载体还通过细胞实验来评价这一可定向传输抗癌药物到肿瘤细胞的靶向体系,即采用人肝细胞(HL-7702)、人肝癌细胞(HepG-2)、乳腺癌细胞(MCF-7)、宫颈癌细胞(HeLa)来进行体外的细胞毒性实验,以测定表面修饰叶酸分子并负载抗癌药物的羟磷灰石纳米载体对不同细胞的细胞毒性。其中HL-7702、HepG2、MCF-7是作为对比实验,因为这三种细胞表面叶酸受体低表达。
下述非限制性实施例用于对本发明做进一步的说明,但不应当理解为对本发明内容任何形式的限定。
实施例1.FA@DOX@HAP的制备
1.1载药羟基磷灰石(DOX@HAP)的合成
采用气液沉淀水热法结合,称取30mg盐酸阿霉素,1.490g的Ca(NO3)2·4H2O和0.495g的(NH4)2HPO4分别溶于2mL的超纯水,30mL的无水乙醇和2mL的超纯水中,并将Ca(NO3)2·4H2O的乙醇溶液pH调节至10.5左右。在这种碱性环境下,边搅拌边缓慢滴加盐酸阿霉素的水溶液,稳定10分钟后,继续滴加(NH4)2HPO4水溶液,滴加完毕后,继续搅拌1h,然后将浑浊液倒入反应釜中,120℃条件下水热反应24h,然后高速离心,用超纯水和无水乙醇多次洗涤产物,60℃下真空干燥12h,研磨,即得样品。
1.2制备表面氨基化的载药羟基磷灰石(DOX@HAP表面氨基化)
将100mgγ-氨丙基三乙氧基硅烷加入到27mL无水乙醇和3mL蒸馏水组成的混合溶剂中,室温搅拌30分钟,然后加入300mg载药羟基磷灰石(DOX@HAP),并超声5分钟,使DOX@HAP充分分散于乙醇和水的混合溶剂中。室温下搅拌2h,然后利用氨水将反应体系的pH值调节至10,继续反应3h,高速离心,然后再将固体物质用超纯水和无水乙醇洗涤多次,除去没有键合在纳米DOX@HAP表面的硅烷偶联剂,最后将所得物质真空干燥,得到纳米尺寸的表面氨基化的DOX@HAP。
1.3叶酸修饰的载药羟基磷灰石(FA@DOX@HAP)
称取50mg叶酸(FA)和22mg1-(-3-二甲基氨丙基)-3-乙基碳二亚胺盐酸盐(EDC)溶于140mL去离子水中,并在黑暗的室温环境下搅拌30分钟,随后称取35mg N-羟基琥珀酰亚胺(NHS)加入到EDC-FA体系中,在黑暗的室温环境下搅拌6h。接着称取200mg表面氨基化的DOX@HAP加入其中,并调节pH至7.4,继续搅拌3h,最后高速离心,分别用去离子水和无水乙醇洗涤多次,60℃下真空干燥12h,即得叶酸修饰的载药羟基磷灰石(FA@DOX@HAP)。
实施例2.叶酸修饰的载药羟基磷灰石基本性能的测试
2.1叶酸修饰的载药羟基磷灰石大小和形态的测试
实施例1所得叶酸修饰的载药羟基磷灰石的形态大小采用透射电子显微镜来观察确定,测试结果见图1。从透射电子显微镜图片可以明显看出,通过共沉淀和水热结合的方法合成的FA@DOX@HAP纳米颗粒,其形态为棒状,平均长度是50-100nm,平均直径5-20nm,不易聚集,分散性较好。
2.2高级傅里叶变换红外光谱测定
取1-2mg叶酸修饰的载药羟基磷灰石样品在玛瑙研钵中与干燥的溴化钾粉末(A.R.级)混合并研磨成细粉末,装入模具中,在压片机上压制成片后在6700FTIR(Thermo Fisher,USA)上测试。测试参数为:光谱范围7800-350cm-1,分辨率0.09cm-1,温度25℃。测试结果如图2所示,和DOX@HAP,氨基化的DOX@HAP的FTIR光谱图比较,FA@DOX@HAP在1641cm-1,1590cm-1和1490cm-1处的峰是羧基的伸缩振动和平面弯曲振动。此外,612cm-1处的峰是HAP羰基的伸缩振动,1002cm-1处的峰是HAP的PO43-特征峰。由此证明叶酸很好的修饰在DOX@HAP纳米颗粒的表面上。
2.3Zeta电位的测定
Zeta电位的测量在纳米粒度及Zeta电位分析仪(Nanozs90,UK)上进行。测试参数为:温度25℃,测试数遍取平均值。测试结果如图3所示,由于羟磷灰石几乎是电中性的,故测其Zeta电位接近于零,而表面氨基化之后,其电位增大,表面修饰上叶酸之后,其电位又变为接近于零,这也说明叶酸很好的修饰在DOX@HAP纳米颗粒的表面上。
2.4XRD的测定
XRD的测量在X射线衍射仪(XD-3A,Japan)上进行,测试参数为:衍射角为5-80。,温度为25℃。测试结果如图4所示,FA@DOX@HAP的XRD谱图与标准谱图基本吻合,当2θ=30.9。时,该纳米颗粒对应标准谱图的(211)晶面。
实施例3.叶酸修饰的载药羟基磷灰石光谱性质测试
称取一定质量的FA@DOX@HAP和DOX,将称好的物质分别移入1.5ml的棕色容量瓶里面,用DMSO定容,配成浓度分别为5mg/mL和2.5mM的母液。采用量程为10μL微量进样器吸取3μL母液,移入3ml测试体系石英池中,搅拌均匀,测其吸收和发射波长。测试结果如图5所示,当DOX@HAP的表面修饰上叶酸之后,阿霉素的荧光基本上被完全淬灭,究其原因可能是阿霉素被叶酸完全包覆,泄漏率降低。光谱测试在紫外分光光度计(AgIIlent 8453,USA)和荧光分光光度计(AgIIlent Cary EclIIpse,USA)上进行。测试参数为:抗癌药物的最大吸收波长为480nm,最大发射波长为590nm。
实施例4.叶酸修饰的载药羟基磷灰石中药物释放测试
在不同pH值下,如图6所示,药物的释放量不同,并且随着pH的不断降低,其药物释放量不断增大,阿霉素的荧光不断增强。并且在同一pH值,不同时间内,药物的释放量也不断增大,当pH=5.5时,其药物的最大释放量达到了80%以上,由此说明,合成的该纳米载体可以有效地进行药物缓慢释放,从而达到治疗肿瘤细胞的效果。实施例5.叶酸修饰的载药羟基磷灰石细胞毒性测试
本实验选用噻唑蓝MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)分析法,以细胞的存活率来评估染料对细胞的毒性大小。分别将对数生长期的HL-7702,HepG-2,MCF-7,HeLa细胞以每毫升1×105个细胞浓度接种于96孔板中,每孔加入10μL,于37℃、5%CO2条件下培养24h,分别加入10mg/L,20mg/L,30mg/L,40mg/L,50mg/L的药物载体FA@DOX@HAP,相同条件下再培养24h后弃去原培养液,每孔加入MTT溶液(10μL,5mg/mL)孵育4h后,小心吸掉孔内上清液并加入200μL的DMSO,待甲瓒结晶完全溶解后,在酶标仪上测定570nm的吸光值OD,选择490nm作为参考波长,平行测定三次。细胞存活率=(OD实验组-OD空白对照)/(OD阳性对照-OD空白对照)×100%,空白对照为不加药物载体组。
细胞毒性是衡量纳米载体用于活细胞成像性能好坏的一项重要指标。测试结果如图7所示,从中可以看出,6μL纳米载体与HL-7702,HepG-2,MCF-7,和HeLa细胞共培养24h之后,细胞存活率分别在90%、80%、80%和55%左右,表明该纳米载体对正常细胞和表面叶酸受体低表达的肿瘤细胞具有较低的细胞毒性,对表面叶酸受体过表达的肿瘤细胞具有较高的细胞毒性。该实验结果完全符合实验预想。
实施例6.叶酸修饰的载药羟基磷灰石体外吸收的细胞成像实验
实验过程中用到的细胞主要有HeLa(人宫颈癌细胞)、MCF-7(人乳腺癌细胞)、COS-7(非洲绿猴肾细胞)和HL-7702(人肝细胞)。
细胞孵育:待贴壁生长的细胞长满瓶底,倒掉培养瓶中的培养液,并用PBS缓冲溶液洗两次。加入适量胰酶进行消化,然后加入新鲜的培养基吹掉贴壁细胞,弃去部分细胞悬液,再加入适量新鲜的培养基,放置在37℃,5%CO2的细胞孵育箱中培养。细胞培养基为加入10%的胎牛血清和0.1%的硫酸庆大霉素的DMEM培养基。实验操作过程中,在细胞培养皿中以每毫升2×105个细胞密度种上细胞,置于培养箱中培养,待用。
进行细胞成像时,将6μL母液(5mg/mL)加入到细胞培养皿中,在37℃及5%CO2条件下培养30min后小心地用PBS溶液冲洗除去未进入细胞的染料,加入2mL新DMEM培养基后在Olympus FV1000-IX81激光共聚焦荧光显微镜下进行观察明场和荧光图像。测试结果如图8所示,从中可以看出,纳米载体2h后几乎没有进入表面叶酸受体低表达的细胞(HL-7702,COS-7),仅仅是覆盖在细胞膜表面。MCF-7细胞有少量纳米载体摄入。而对于表面叶酸受体过表达HeLa细胞,其纳米载体摄入量就大大增多,荧光强度也随之增强。以上实验结果表明,纳米载体FA@DOX@HAP能够特异性识别叶酸受体过表达的肿瘤细胞。
- 还没有人留言评论。精彩留言会获得点赞!
- 具有多级缓控释效果的羟基磷灰石载药微球的制备方法与流程
- 一种羟基磷灰石包覆PRB填充材料及其制备方法和地下水除铀应用方法与制造工艺
- 25‑羟基维生素D荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 25‑羟基维生素D3荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 壳聚糖/羟基磷灰石复合纤维的制备方法与制造工艺
- 一种羟基磷灰石‑碳纳米管复合生物陶瓷的制备方法与制造工艺
- 羟基磷灰石‑碳纳米管复合生物陶瓷的制备方法与制造工艺
- 羟基磷灰石吸附特性对水中钴离子的富集检测方法与制造工艺
- 以羟基磷灰石晶须增强可降解共聚物‑硅酸钙复合骨修复材料为原料的骨修复用制品的制造方法与工艺
- 一种胶原蛋白/羟基磷灰石复合人工骨及其制备方法与制造工艺