一种联合代谢阻断的纳米剂型及其耐药逆转应用的制作方法
本发明属于抗肿瘤药物及其耐药逆转应用,具体涉及通过阻断代谢方式、将抗肿瘤药物和代谢阻断剂共载于纳米载体的混合制剂及其用途。
背景技术:
肿瘤相比于正常组织有着独特的病理特征。正常细胞可根据所处环境的氧含量而调节呼吸方式(在有氧情况下进行有氧呼吸,缺氧时主要依赖无氧糖酵解)。然而,肿瘤细胞则以有氧糖酵解为主要呼吸方式,这种特殊的现象即为瓦博格效应(Warburg effect)。这种非正常的代谢方式为肿瘤的蛋白质合成、核酸合成和脂类合成等生命活动提供能量。对于耐药细胞而言,非正常的代谢与耐药性的产生紧密相关,例如,肿瘤细胞通过ATP依赖的转运蛋白增加对治疗药物的外排能力;线粒体对膜通透的耐受;抗凋亡通路激活(Bcl-2上调)和凋亡抑制(caspase-3下调)等。相关研究表明阻断代谢能够增加肿瘤治疗的效果,但是很少提到其对耐药逆转的作用。而且代谢阻断剂单独使用时药效往往较弱,生物利用度较低。
技术实现要素:
本发明的目的是提供一种联合代谢阻断的纳米剂型及其耐药逆转应用,兼顾肿瘤细胞的代谢阻断作用以及克服肿瘤化疗的多药耐药性。
本发明的目的是这样实现的:一种联合代谢阻断的纳米剂型,包括代谢阻断剂、细胞毒性药物和纳米载体;所述代谢阻断剂包括抑制细胞糖酵解及三羧酸循环的抑制剂;所述细胞毒性药物包括生物碱类、抗生素类、代谢类和铂类抗肿瘤药物;所述纳米载体包括脂质体,两亲性树状分子、聚乳酸。
上述细胞毒性药物选自阿霉素(抗生素类)、紫杉醇(生物碱类)、喜树碱(生物碱类)、顺铂(铂类)、奥沙利铂(铂类)或吉西他滨(代谢类)。本发明将代谢阻断剂与细胞毒性抗肿瘤药物联用,发挥两者的协同作用,有望提高肿瘤治疗的效果。同时,结合纳米剂型提高药物的生物利用度。
针对上述问题,本发明提供了一种联合代谢阻断的纳米剂型与抗肿瘤化疗多药耐药逆转策略,以能量代谢通路中各个关键蛋白(如,己糖激酶)为靶标,特异性阻断肿瘤的能量来源,抑制外排能力,同时作用于线粒体,扰乱线粒体膜电位,激活凋亡通路,抑制抗凋亡作用,实现与化疗药物的协同作用。纳米剂型能够提高代谢阻断剂的生物利用度,包括提高体内循环时间、肿瘤组织靶向、细胞摄取和胞内定点释放等。
本发明的技术方案如下:
一种抗肿瘤药物联合代谢阻断剂。
作为可选方式代谢阻断剂可以为(STF-31,葡萄糖转运体1抑制剂)、(Lonidamine,己糖激酶2抑制剂)、(CPI-613,丙酮酸脱氢酶抑制剂)、(AZD3965,单羧酸转运蛋白1抑制剂)中的一种。
作为可选方式,与代谢阻断剂联用的抗肿瘤药物(即细胞毒性药物)可以为阿霉素、紫杉醇、喜树碱和吉西他滨中的一种。
本发明还提供了一种纳米化的药物递送方式。
作为可选方式,包载代谢阻断剂和抗肿瘤药物的纳米载体可以为脂质体,PLGA,两亲性树状分子中的一种。
作为可选方式,可将代谢阻断剂和抗肿瘤药物中的一种修饰为两亲性前药分子,通过组装形成的纳米粒包载另一种药物,所用于修饰的分子可以为肽类树状大分子,聚合物,磷脂中的一种。
本说明书中公开的所有特征,或公开的所有方法或过程中的步骤,除了互相排斥的特征和/或步骤以外,均可以以任何方式组合。
本发明的有益效果:本发明提供了一种新的联合治疗策略,将抗肿瘤药物与代谢阻断剂联合使用,针对肿瘤细胞及耐药肿瘤细胞的代谢特性,以代谢通路中的关键蛋白为靶标,利用代谢抑制剂进行分子靶向治疗。成功阻断了肿瘤细胞的物质合成和能量供应,增加肿瘤细胞对抗肿瘤药物的敏感性,克服多药耐药。
本说明提供的纳米化的联合治疗策略,增加也了药物的水溶性,利用纳米粒子被动靶向至肿瘤组织的特性,解决了抗肿瘤药物及代谢阻断剂的体内循环、生物分布和毒副作用等问题。
附图说明
图1为示意图。
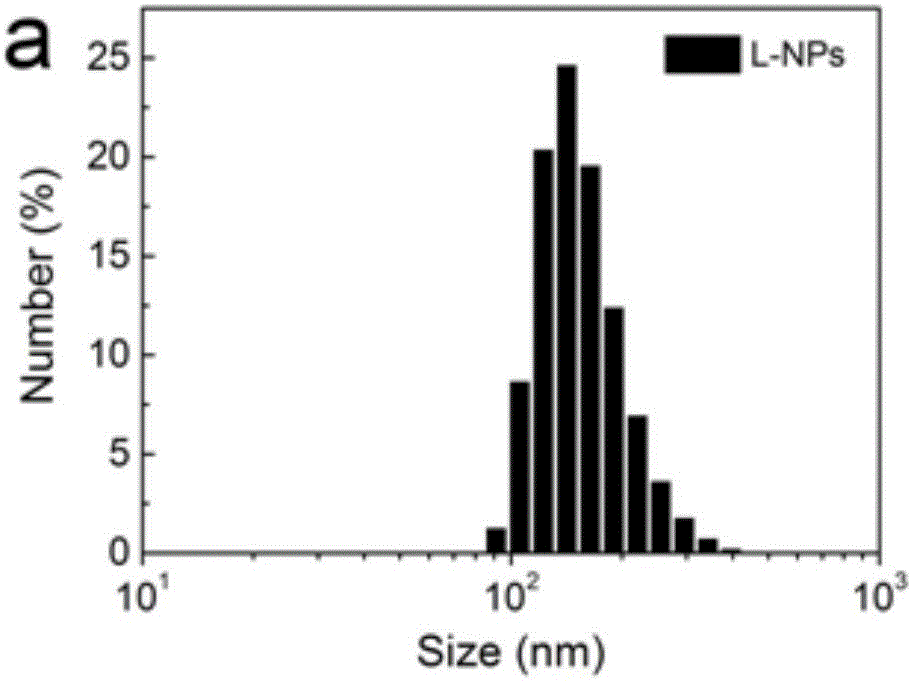
图2a为L-NPs的粒。
图2b为透射电镜照片。
图2c为原子力显微镜照片。
图3为不同环境中LND的累积释放曲线。
图4为MCF7/ADR与不同浓度的Dendrimer、DOX、DOX.HCl、NPs和L-NPs孵育48h后的细胞毒性。
图5为MCF7/ADR对DiIC1(5)和DiIC1(5)-NPs的摄取照片。
图6为己糖激酶活性测定。
图7为ATP含量测定。
图8为药物外排测定。
图9为线粒体膜电位测定,分别用流式细胞仪(左)和共聚焦显微镜(右)定量和定性测定MCF7/ADR细胞的线粒体膜电位。
图10为免疫蛋白质印迹法分析不同药物处理后MCF7/ADR细胞内Caspase-3和Bcl-2蛋白的表达水平。
图11a为MCF7/ADR细胞内caspase-3活性测定,通过激光共聚焦显微镜照片测定(caspase-3活性与其荧光强度呈正相关)。
图11b为荧光强度定量分析数据。
图12为凋亡检测:不同药物处理后,通过Annexin V-FITC/PI染色,检测MCF7/ADR细胞凋亡比例。
图13为体外渗透研究:激光共聚焦观察游离的DiIC1(5)和DiIC1(5)-NPs在MCF7/ADR细胞球内的分布。
图14为1h、3h、6h和12h时DOX.HCl、NPs和L-NPs在体内的分布。
图15为离体组织分布照片:利用小动物活体成像仪观察DOX在各个组织的分布。
图16为MCF7/ADR肿瘤体积变化。
图17为治疗结束后心、肝、脾、肺和肾的病理切片。
图18为治疗后肿瘤组织的免疫组化切片分析。
图19为不同时间点DOX.HCl、NPs和L-NPs在体内的血药浓度。
具体实施方式
以下通过实施例的具体实施方式再对本发明的上述内容作进一步的详细说明。但不应当将此理解为本发明上述主题的范围仅限于以下的实例。在不脱离本发明的精神和原则之内做的任何修改,以及根据本领域普通技术知识和惯用手段做出的等同替换或者改进,均应包括在本发明的保护范围内。
实施例1:两亲性前药分子(DPs)的制备
将多重敏感的树状分子与阿霉素(DOX)通过酸敏感的腙键偶联。精确称取0.5g多重敏感的树状分子和115.83mg盐酸阿霉素置于带有支管的单口瓶中,氮气保护下加入甲醇溶解,并加入催化量的冰醋酸。室温反应72小时,减压浓缩,加入蒸馏水溶解。将溶液置于截留分子量为2000Da的透析袋中透析,然后冷冻干燥得到DPs。
实施例2:将客体分子包载于前药纳米粒子中。
将客体分子(包括亲水性或疏水性的分子)与前药分子共同溶解于DMSO中,充分混合后,在超声条件下滴入水中,然后用截留分子量为2000Da的透析袋透析,冷冻干燥后得到载药纳米粒子。
将Lonidamine(LND,己糖激酶抑制剂)以LND:DOX=1:2(质量比)的比例,按照上述方法包载于前药纳米粒子中制备得到LND包载的纳米粒子(L-NPs)。
实施例3:L-NPs的表征
配置100μg/mL L-NPs的水溶液,利用动态光散射激光粒度仪(DLS)测定其粒径和电位。
将L-NPs的水溶液滴在铜网上室温挥干,然后用透射电子显微镜观察。
将L-NPs的水溶液滴在云母片上室温挥干,然后用原子力显微镜观察其纳米结构。
如图2所示,DLS测定L-NPs的粒径约为130nm。透射电镜显微镜和原子力显微镜照片表示L-NPs具有规整的球型纳米结构。
实施例4:L-NPs的体外释放
将L-NPs溶解于1mLPBS中,分别溶解于1mL pH 7.4、2μg/mL金属基质蛋白酶-2、10mM DTT、10μM DTT、pH 6.8和pH 5.0的TCNB缓冲液中,并转移截留分子量为1000Da的透析袋中。在预先设定的时间点取出1mL外液,然后再补加1mL外液。样品中的LND含量用高效液相色谱测定,DOX含量用荧光光谱测定。
如图3所示,LND在生理环境下(pH 7.4)释放量较低,约为20%,10mMDTT及pH 5.0条件下组装体解组装LND快速释放,12h内释放量达到80%以上。然而,在肿瘤微环境条件下(pH 6.8和10μMDTT)释放较少,约为20%。
实施例5:对耐药肿瘤细胞的体外抗肿瘤效果
在96孔培养板中接种人乳腺癌阿霉素耐药细胞系(MCF7/ADR),细胞密度为1×104细胞/孔。培养24h后加入不同LND浓度的L-NPs(DOX浓度恒定为10μg/mL,LND浓度为0.5μg/mL、1.0μg/mL、5.0μg/mL、10.0μg/mL),孵育48h后,用CCK-8法测定细胞毒性。
在96孔培养板中接种人乳腺癌阿霉素耐药细胞系(MCF7/ADR),细胞密度为1×104细胞/孔。培养24h后加入不同浓度的LND、DOX、DOX.HCl、NPs和L-NPs,孵育48h后,测定细胞存活率。
如图3所示,DOX浓度恒定时,LND用量高于5μg/mL后体外肿瘤抑制效果不再提高,因此选择LND 5μg/mL和DOX 10μg/mL进行后续研究。
如图4所示,L-NPs对MCF7/ADR的抑制效果明显优于其他实验组,IC50为8.4μg/mL,明显低于DOX(55.7μg/mL)和DOX.HCl(27.4μg/mL)。表明LND与DOX联用后能够有效克服MCF7/ADR的耐药性,提高药效。
实施例6:细胞摄取研究
以荧光染料DiIC1(5)作为模型分子,将其载入NPs内研究客体分子在胞内的递送过程。
将MCF7/ADR细胞接种于玻底皿中,培养24h。加入包载DiIC1(5)的NPs(NPs浓度为70μg/mL;DiIC1(5)为3.5μg/mL),与MCF7/ADR细胞孵育2h,然后用PBS洗两次,利用共聚焦显微镜观察药物DOX和客体分子DiIC1(5)的摄取量。
如图5所示,与游离的DiIC1(5)相比,将DiIC1(5)包载入NPs后能够增加细胞对其摄取量。
实施例7:耐药逆转机理研究
a)己糖激酶活性测定
LND能够和己糖激酶结合抑制己糖激酶的活性,从而抑制葡萄糖转化为6磷酸葡萄糖,阻断糖酵解通路。
将MCF7/ADR细胞接种于6孔培养板中,细胞密度为3×105细胞/孔。培养24h后加入LND和L-NPs(LND浓度为1μg/mL、5μg/mL、10;DOX浓度为10μg/mL),孵育24h。利用己糖激酶活性测定试剂盒(Hexokinase Colorimetric Assay Kit,Sigma)测定酶活。
如图6所示,L-NPs能够增加LND对己糖激酶活性的抑制。单独使用LND时,己糖激酶活性只能降低10%左右。而L-NPs能够抑制约50%。
b)胞内三磷酸腺苷(ATP)含量测定
将MCF7/ADR细胞接种于6孔培养板中,细胞密度为3×105细胞/孔。培养24h后加入LND和L-NPs(LND浓度为1μg/mL、5μg/mL、10μg/mL;DOX浓度为10μg/mL),孵育24h。利用ATP含量测定试剂盒(ATP assay kit,Beyotime)测定胞内ATP含量。
如图7所示,L-NPs能够有效降低胞内ATP的水平,阻断药物外排的能量来源。c)药物外排研究
MCF7/ADR细胞的耐药机理为药物外排转运体的高表达,外排转运体发挥功能时需要消耗ATP,因此LND将ATP合成通路阻断后会抑制外排转运体功能的发挥。
将MCF7/ADR细胞接种于12孔培养板,培养12h。除去培养基,加入DOX.HCl、NPs和L-NPs(5μg/mL LND;10μg/mL DOX),在无血清条件下孵育2h。将药物除去后用PBS洗两遍,加入培养基。在预设的时间点收集各个孔的培养基,然后将细胞裂解。培养基及细胞裂解液中的DOX通过酸碱处理后,利用氯仿将其萃取至有机相,将有机溶剂挥干,用DMSO溶解。通过荧光光谱测定DOX含量。
如图8所示,外排6h后L-NPs组的外排量较低,为19.2%,而DOX.HCl组接近60%。表明L-NPs能够抑制耐药细胞对药物的外排作用。
d)线粒体膜电位测定
LND能够作用于线粒体,引起线粒体膜电位的降低,激活凋亡通路。
将MCF7/ADR细胞接种于玻底皿,培养12h。加入DOX、DOX.HCl、LND、NPs和L-NPs(10μg/mL DOX;5μg/mL LND)孵育24h。将细胞用MitoView 633对线粒体染色,通过激光共聚焦观察荧光强度。线粒体的荧光强度与线粒体膜电位呈正相关。将MCF7/ADR细胞接种于6孔培养板中,通过相同的处理后用流式细胞仪测定。
如图9所示,DOX、DOX.HCl和LND对线粒体膜电位影响较小。L-NPs作用后细胞的红色荧光明显减弱,且流式分析的结果也与此一致。
e)凋亡蛋白检测
凋亡通路激活后,引起凋亡相关蛋白(如,Bcl-2、Caspase-3等)的上调或下调。
将MCF7/ADR细胞接种于6孔培养板中,培养12h。加入DOX、DOX.HCl、LND、NPs和L-NPs(10μg/mL DOX;5μg/mL LND)孵育48h。将细胞收集后通过蛋白印记法定性分析细胞内Bcl-2和Caspase-3蛋白的含量。
如图10所示,与DOX、DOX.HCl和LND相比,L-NPs能够提高胞内促凋亡蛋白Caspase-3的水平,同时降低抗凋亡蛋白Bcl-2的水平。
f)Caspase-3活性检测
将MCF7/ADR细胞接种至玻底皿中,培养12h。加入DOX、DOX.HCl、LND、NPs和L-NPs(10μg/mL DOX;5μg/mL LND)孵育36h。用PBS洗两次,加入caspase-3活性检测染料NucView 405。Caspase-3的活性与荧光强度呈正相关。利用LAS X软件计算每个细胞的平均荧光强度值。
如图11所示,L-NPs组的绿色细胞明显多于其他各组,且荧光定量结果也表明L-NPs组的caspase-3活性比空白组提高了6倍。
实施例8:凋亡检测
将MCF7/ADR细胞接种于6孔培养板中,培养12h。加入DOX、DOX.HCl、LND、NPs和L-NPs(10μg/mL DOX;5μg/mL LND)孵育36h。将细胞用胰酶消化后收集,离心,用PBS洗两次。然后加入Annexin V-FITC/PI凋亡检测液,染色20min,利用流式细胞仪检测。
如图12所示,L-NPs引起晚期凋亡的比例达到55.2%,而DOX、DOX.HCl、LND和NPs组的晚期凋亡数量仅为3.6%、5.1%、0.5%和36.8%。
实施例9:DiIC1(5)-NPs的渗透效果
利用肿瘤多细胞球作为体外渗透模型。将MCF7/ADR细胞接种于1%琼脂糖的包覆6孔培养板中,培养约10天,肿瘤多细胞球直径达到约200μm。将细胞球转移至玻底皿中,加入DiIC1(5)包载的NPs,孵育2h,用共聚焦显微镜观察各个层面中DOX和DiIC1(5)的分布。
如图13所示,与游离的DiIC1(5)相比DiIC1(5)-NPs能够渗透至肿瘤多细胞球的深处,而DiIC1(5)大部分分布在细胞球的外围。
实施例10:体内药物分布
将MCF7/ADR细胞接种于Balb/c裸鼠背部右侧腋下皮下位置,接种密度为1×107细胞/只。肿瘤形成后,通过尾静脉注射生理盐水、DOX.HCl、NPs和L-NPs(5mg LND/kg;10mg DOX/kg)。利用小动物活体成像,分别观察1h、3h和12hDOX的荧光分布。观察结束后将动物处死,收集心、肝、脾、肺、肾和肿瘤组织,观察离体组织的DOX荧光。然后将肿瘤组织冰冻切片,分别用DAPI和AF594-CD31抗体标记细胞核和肿瘤血管。
如图14和15所示,NPs和L-NPs能够富集在肿瘤部位。L-NPs将能量代谢通路抑制后能够较多的富集在肿瘤部位。
如图15所示,L-NPs能够将DOX递送至肿瘤部位,且分布均匀。
实施例11:体内抗肿瘤效果
肿瘤体积达到50mm3时,通过尾静脉注射生理盐水、DOX.HCl、NPs和L-NPs(2.5mg LND/kg;5mg DOX/kg)进行治疗,每隔两天治疗一次,共4次。同时测定小鼠的肿瘤体积和体重,每隔两天测量一次,共测量9次。
治疗结束后将小鼠处死,收集心、肝、脾、肺、肾和肿瘤组织,通过H&E染色观察各个组织的病理变化。利用免疫组织化学法观察肿瘤组织的凋亡(Tunel)、新生血管(CD-31)和增殖细胞(Ki67)的数量。
如图16所示,L-NPs对于MCF7/ADR耐药肿瘤的抑制效果最好,肿瘤增长缓慢,抑制率达到84%。DOX.HCl的抑制率仅为32%。
如图17所示,H&E染色结果表明DOX.HCl对小鼠的心脏毒性较大,心脏的病理变化明显。而NPs和L-NPs对正常组织影响较小。而对于肿瘤组织,L-NPs组肿瘤细胞较稀疏。
如图18所示,L-NPs能够有效抑制肿瘤细胞的增殖(Ki67),同时凋亡细胞明显增多(Tunel)。
实施例12:药物代谢动力学研究
将BALB/c小鼠随机分为三组每组18只,通过尾静脉注射DOX.HCl、NPs和L-NPs,药物浓度为10mg DOX/kg。在给药后2min,30min,1h,6h和12h,通过小鼠眼球取血,并分离血浆。将血浆利用酸碱处理后,用氯仿/异丙醇(体积比为4:1)将药物萃取至有机相。有机溶剂挥发干后加入100μL乙腈,用高效液相色谱分析药物浓度。如图19所示,NPs和L-NPs能够明显增加药物的血液循环时间,避免被内皮网状系统清除。
以上所述仅为本发明的优选实施例,对本发明而言仅是说明性的,而非限制性的;本领域普通技术人员理解,在本发明权利要求所限定的精神和范围内可对其进行许多改变,修改,甚至等效变更,但都将落入本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!