麦蓝菜种子提取物在促进奶牛泌乳中的应用的制作方法
本发明涉及一种麦蓝菜提取物在促进奶牛泌乳中的应用。
背景技术:
麦蓝菜[Vaccaria segetalis(Neck.)Garcke]为石竹科麦蓝菜属一年生或二年生草本植物,别名叫禁宫花、煎金花等。广泛分布于亚洲、欧洲、北美及世界其他地区。麦蓝菜在日本被作为园林植物种植已有几百年的历史。
麦蓝菜的成熟干燥种子是我国的传统常用中药——王不留行(Semen vaccariae,Saponaria vaccaria,Vaccariae Semen),又名王不留、麦蓝子、奶米、留行子、王母牛、大麦牛、金剪刀草等。据《本草》记载,麦蓝菜的药用部位多系根、茎、叶、花与种子并用,而目前则多用种子。
奶牛是我国畜牧养殖业中重要的经济动物之一,我国奶牛业普遍存在产奶量低、乳脂率和乳蛋白含量不高等问题,这些问题制约了我国奶牛业发展。目前国内外都积极探索提高奶牛泌乳量的有效方案。传统方法采用添加抗生素及一些化学合成物质作为饲料添加剂来提高奶牛产奶性能或防治泌乳期奶牛疾病,但这些添加剂具有毒副作用大、残留高、易产生抗、耐药性和致癌、致突变等缺陷。2006年,欧盟全面禁止使用促生长抗生素类饲料添加剂。
技术实现要素:
本发明的目的是提供一种麦蓝菜种子提取物在促进奶牛泌乳中的应用。
本发明提供了麦蓝菜种子提取物的应用,为如下(1)-(6)中的至少一种:
(1)促进奶牛泌乳;
(2)促进奶牛乳腺上皮细胞分泌乳糖;
(3)促进奶牛乳腺上皮细胞分泌β-酪蛋白;
(4)促进奶牛乳腺上皮细胞分泌甘油三酯;
(5)促进奶牛乳腺上皮细胞中Stat5基因表达;
(6)提高奶牛乳腺上皮细胞中Stat5蛋白的表达量和/或活性。
本发明还保护麦蓝菜种子提取物在制备产品中的应用;所述产品的用途为促进奶牛泌乳。
本发明还保护麦蓝菜种子提取物在制备产品中的应用;所述产品的用途为如下(a1)-(a3)中的至少一种:
(a1)促进奶牛乳腺上皮细胞分泌乳糖;
(a2)促进奶牛乳腺上皮细胞分泌β-酪蛋白;
(a3)促进奶牛乳腺上皮细胞分泌甘油三酯。
本发明还保护麦蓝菜种子提取物在制备产品中的应用;所述产品的用途为如下(b1)和/或(b2):
(b1)促进奶牛乳腺上皮细胞中Stat5基因表达;
(b2)提高奶牛乳腺上皮细胞中Stat5蛋白的表达量和/或活性。
本发明还保护一种产品,活性成分为麦蓝菜种子提取物,所述产品的用途为促进奶牛泌乳。
本发明还保护一种产品,活性成分为麦蓝菜种子提取物,所述产品的用途为如下(a1)-(a3)中的至少一种:
(a1)促进奶牛乳腺上皮细胞分泌乳糖;
(a2)促进奶牛乳腺上皮细胞分泌β-酪蛋白;
(a3)促进奶牛乳腺上皮细胞分泌甘油三酯。
本发明还保护一种产品,活性成分为麦蓝菜种子提取物,所述产品的用途为如下(b1)和/或(b2):
(b1)促进奶牛乳腺上皮细胞中Stat5基因表达;
(b2)提高奶牛乳腺上皮细胞中Stat5蛋白的表达量和/或活性。
以上任一所述麦蓝菜种子提取物为提取物I、提取物II、提取物III、提取物IV或提取物V或提取物VI;
所述提取物I的制备方法包括如下步骤:
①取麦蓝菜种子或麦蓝菜种子粉末,采用溶液甲进行提取,得到提取液;所述溶液甲为57体积份甲醇与43体积份水的混合液;
②取步骤①得到的提取液,进行高效液相色谱纯化,收集洗脱液;
③将步骤②得到的洗脱液冷冻干燥,得到提取物I;
所述提取物II的制备方法包括如下步骤:
①取麦蓝菜种子或麦蓝菜种子粉末,采用所述溶液甲进行提取,得到提取液;
②取步骤①得到的提取液,进行高效液相色谱纯化,收集洗脱液,得到提取物II;
所述提取物III的制备方法包括如下步骤:
①取麦蓝菜种子或麦蓝菜种子粉末,采用溶液乙进行提取,得到提取液;所述溶液乙为甲醇与水的混合液;
②取步骤①得到的提取液,进行高效液相色谱纯化,收集洗脱液;
③将步骤②得到的洗脱液冷冻干燥,得到提取物III;
所述提取物IV的制备方法包括如下步骤:
①取麦蓝菜种子或麦蓝菜种子粉末,采用所述溶液乙进行提取,得到提取液;
②取步骤①得到的提取液,进行高效液相色谱纯化,收集洗脱液,得到提取物IV;
所述提取物V的制备方法包括如下步骤:
取麦蓝菜种子或麦蓝菜种子粉末,采用所述溶液甲进行提取,得到提取物V;
所述提取物VI的制备方法包括如下步骤:
取麦蓝菜种子或麦蓝菜种子粉末,采用所述溶液乙进行提取,得到提取物VI。
所述提取物I的制备方法中,步骤①中,溶液甲与麦蓝菜种子的配比具体可为50mL∶1g。
所述提取物I的制备方法中,步骤①中,所述提取的时间为15min。
所述提取物I的制备方法中,步骤①中,所述提取具体可为微波辅助提取。
所述微波辅助提取的参数具体可为:温度65℃,微波功率400W。
所述麦蓝菜种子粉末的制备方法具体如下:取干燥的麦蓝菜种子,粉碎后过60目筛。
所述提取物I的制备方法中,步骤②中,所述高效液相色谱纯化的参数如下:色谱柱为HIQ sil C18W柱;流动相由3体积份溶液A和7体积份溶液B组成;溶液A为甲醇;溶液B为0.6体积份磷酸和99.4体积份水的混合液;流动相流速为1mL/min;收集保留时间为19min出现的色谱峰对应的洗脱液。进样体积具体可为10μL。检测波长具体可为332nm。所述HIQ sil C18W柱具体型号可为:5μm。
所述提取物II的制备方法中,步骤①中,溶液甲与麦蓝菜种子的配比具体可为50mL∶1g。
所述提取物II的制备方法中,步骤①中,所述提取的时间为15min。
所述提取物II的制备方法中,步骤①中,所述提取具体可为微波辅助提取。
所述微波辅助提取的参数具体可为:温度65℃,微波功率400W。
所述麦蓝菜种子粉末的制备方法具体如下:取干燥的麦蓝菜种子,粉碎后过60目筛。
所述提取物II的制备方法中,步骤②中,所述高效液相色谱纯化的参数如下:色谱柱为HIQ sil C18W柱;流动相由3体积份溶液A和7体积份溶液B组成;溶液A为甲醇;溶液B为0.6体积份磷酸和99.4体积份水的混合液;流动相流速为1mL/min;收集保留时间为19min出现的色谱峰对应的洗脱液。进样体积具体可为10μL。检测波长具体可为332nm。所述HIQ sil C18W柱具体型号可为:5μm。
所述提取物III的制备方法中,步骤①中,溶液乙与麦蓝菜种子的配比具体可为50mL∶1g。
所述提取物III的制备方法中,步骤①中,所述提取的时间为15min。
所述提取物III的制备方法中,步骤①中,所述提取具体可为微波辅助提取。
所述微波辅助提取的参数具体可为:温度65℃,微波功率400W。
所述麦蓝菜种子粉末的制备方法具体如下:取干燥的麦蓝菜种子,粉碎后过60目筛。
所述提取物III的制备方法中,步骤②中,所述高效液相色谱纯化的参数如下:色谱柱为HIQ sil C18W柱;流动相由3体积份溶液A和7体积份溶液B组成;溶液A为甲醇;溶液B为0.6体积份磷酸和99.4体积份水的混合液;流动相流速为1mL/min;收集保留时间为19min出现的色谱峰对应的洗脱液。进样体积具体可为10μL。检测波长具体可为332nm。所述HIQ sil C18W柱具体型号可为:5μm。
所述提取物IV的制备方法中,步骤①中,溶液乙与麦蓝菜种子的配比具体可为50mL∶1g。
所述提取物IV的制备方法中,步骤①中,所述提取的时间为15min。
所述提取物IV的制备方法中,步骤①中,所述提取具体可为微波辅助提取。
所述微波辅助提取的参数具体可为:温度65℃,微波功率400W。
所述麦蓝菜种子粉末的制备方法具体如下:取干燥的麦蓝菜种子,粉碎后过60目筛。
所述提取物IV的制备方法中,步骤②中,所述高效液相色谱纯化的参数如下:色谱柱为HIQ sil C18W柱;流动相由3体积份溶液A和7体积份溶液B组成;溶液A为甲醇;溶液B为0.6体积份磷酸和99.4体积份水的混合液;流动相流速为1mL/min;收集保留时间为19min出现的色谱峰对应的洗脱液。进样体积具体可为10μL。检测波长具体可为332nm。所述HIQ sil C18W柱具体型号可为:5μm。
所述提取物V的制备方法中,溶液甲与麦蓝菜种子的配比具体可为50mL∶1g。
所述提取物V的制备方法中,所述提取的时间为15min。
所述提取物V的制备方法中,所述提取具体可为微波辅助提取。
所述微波辅助提取的参数具体可为:温度65℃,微波功率400W。
所述麦蓝菜种子粉末的制备方法具体如下:取干燥的麦蓝菜种子,粉碎后过60目筛。
所述提取物VI的制备方法中,溶液乙与麦蓝菜种子的配比具体可为50mL∶1g。
所述提取物VI的制备方法中,所述提取的时间为15min。
所述提取物VI的制备方法中,所述提取具体可为微波辅助提取。
所述微波辅助提取的参数具体可为:温度65℃,微波功率400W。
所述麦蓝菜种子粉末的制备方法具体如下:取干燥的麦蓝菜种子,粉碎后过60目筛。
以上任一所述产品具体可为饲料添加剂。
本发明通过实验证明,本发明的麦蓝菜种子提取物能够提高奶牛乳腺上皮细胞(具有泌乳功能)活力及增殖能力,促进奶牛乳腺上皮细胞中乳糖、β-酪蛋白和甘油三酯的分泌,增强奶牛乳腺上皮细胞的泌乳功能。麦蓝菜种子提取物促泌乳活性的确定将为其天然药物的开发提供有益启示,为深度开发麦蓝菜种子在制备饲料添加剂中的应用打下基础。
附图说明
图1为奶牛乳腺上皮细胞形态学观察结果。
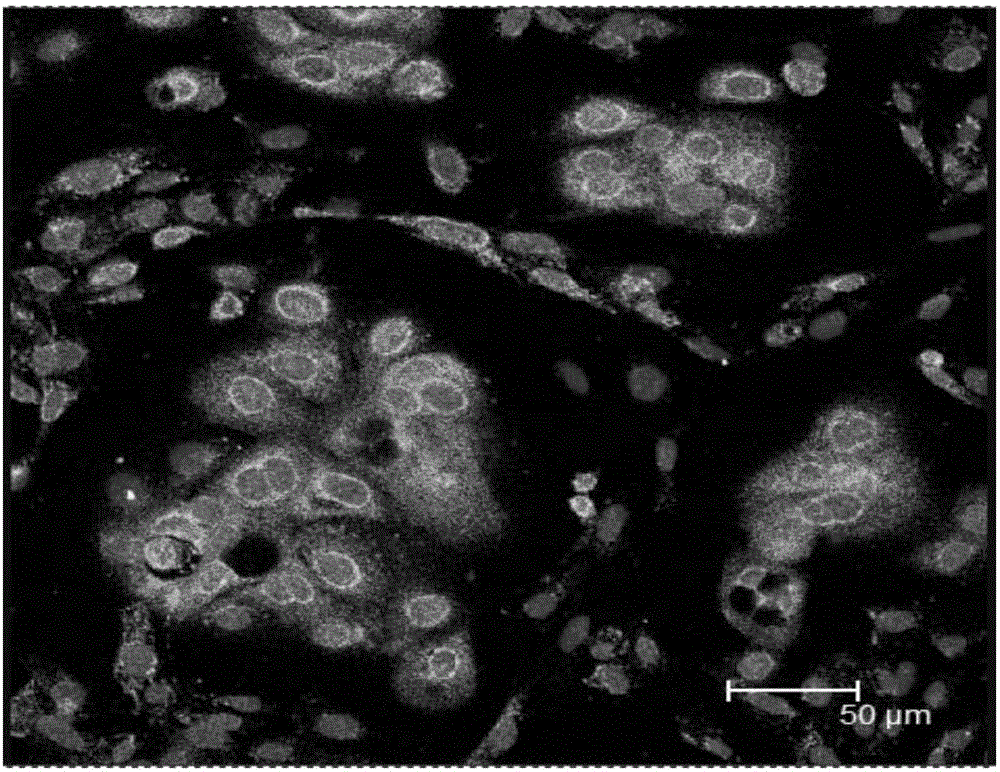
图2为奶牛乳腺上皮细胞激光扫描共聚焦显微镜下观察结果。
图3为乳糖标准品的液相色谱图。
图4为乳糖含量检测结果。
图5为β-酪蛋白标准品的液相色谱图。
图6为β-酪蛋白含量检测结果。
图7为甘油三酯含量检测结果。
图8为奶牛乳腺上皮细胞泌乳相关信号分子的RT-PCR检测统计结果。
图9为奶牛乳腺上皮细胞泌乳相关信号分子的Western blot结果图。
图10为奶牛乳腺上皮细胞泌乳相关信号分子的Western blot检测统计结果。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。以下实施例中的双抗为青链霉素。
麦蓝菜种子:购于河北省安国市药材公司。
MAS-II微波反应罐:新仪微波化学科技有限公司。
高效液相色谱仪(PU-980控制泵,UV-975紫外检测器):日本Jasco公司。
DMEM/F12培养液:将DMEM/F12干粉1袋倒于1000mL三角瓶中,先加入800mL放置于室温的新鲜灭菌去离子水,轻摇溶解后,加入1.2g NaHCO3,溶解后调整pH值至7.2,定容至1000mL。无菌条件下,0.22μm微孔滤膜过滤除菌,分装,4℃保存备用。
DMEM/F12干粉:Gibco公司。
Anti-Cytokeration 18:德国Acris公司。
乳糖标准品:德国Dr公司。
β-酪蛋白标准品:Sigma公司。
TG试剂盒:南京建成生物工程研究所。
实时荧光定量试剂盒 Primx ExTaqTM:TaKaRa公司。
实施例1、奶牛乳腺上皮细胞的获得
1、取得健康的泌乳中期荷斯坦奶牛(饲养于东北农业大学畜牧高新技术园区)的乳腺组织,培育奶牛乳腺上皮细胞(方法参照文献:陈建晖.奶牛乳腺上皮细胞系的建立[D].东北农业大学,2008.)。培育得到的乳腺细胞均为上皮样细胞,呈短梭形或多角形,形态均一,细胞之间排列紧密(如图1所示,200×)。
2、对步骤1得到的乳腺上皮细胞进行鉴定,依次按照如下步骤操作:
(1)制作细胞铺片:将一块洁净的盖玻片放入6孔细胞板中,待细胞融合80%单层时,吸去培养液,PBS缓冲液冲洗细胞两次,每次5min;
(2)预冷甲醇固定10min,PBS冲洗细胞3次,每次5min,用干净滤纸擦掉边缘残液;
(3)用含5%BSA的TBST封闭液,37℃,轻摇封闭1h;
(4)弃去封闭液,滴加Anti-Cytokeration 18(封闭液1∶10稀释),37℃,孵育细胞1h,TBST冲洗后滴加FITC标记二抗(封闭液1∶50稀释),37℃,孵育细胞1h;
(5)TBST冲洗细胞后用干净滤纸吸去边缘残液;
(6)滴加1μg/mL的PI溶液,室温作用10min;
(7)将抗荧光淬灭剂滴于1片洁净载玻片上;
(8)封片:TBST再次冲洗铺片后,小心将其从培养孔中取出,将附着细胞的一面轻贴在载玻片上,避免产生气泡;
(9)激光扫描共聚焦显微镜下观察。
鉴定结果如图2所示(200×)。如图所示,在细胞质中有绿色荧光的角蛋白18表达,红色部分是经PI染色的细胞核,角蛋白18的表达呈阳性证明了培养的细胞是乳腺上皮细胞。
本实施例中制备的奶牛乳腺上皮细胞可传30代左右,后续实验采用传代1-2次的细胞作为研究材料。
实施例2、麦蓝菜种子提取物的获得
1、取干燥的麦蓝菜种子,粉碎后过60目筛。
2、取步骤1得到的麦蓝菜种子粉末(1g)放入MAS-II微波反应罐,进行微波辅助提取。提取条件为:溶剂:57%(体积分数)甲醇水溶液;温度65℃;液固比50mL/g;微波功率400W;提取时间15min。
3、将步骤2得到的提取液过0.45μm滤膜过滤,得到滤液。
4、将步骤3得到的滤液采用高效液相色谱仪纯化,收集第19min时出现的色谱峰对应的洗脱液。
高效液相色谱检测条件如下所示:
色谱柱:HIQ sil C18W柱(5μm);
流动相由溶液A(30%)和溶液B(70%)组成;溶液A为甲醇;溶液B为0.6%(体积分数)磷酸水溶液;
体积流量:1mL/min;
进样体积:10μL;
检测波长:332nm。
5、将步骤4得到的洗脱液进行冷冻干燥,得到麦蓝菜种子提取物A。将麦蓝菜种子提取物A溶解于DMSO中,得到提取物母液A,后续实验时将母液用DMEM/F12培养液稀释为各实验所需浓度。
6、取步骤1得到的麦蓝菜种子粉末(25g),加水250ml浸泡半个小时后煎煮,煮沸后文火30min,用四层纱布过滤药液,药渣加水125ml煮沸后文火煎30min,过滤药液,合并两次药液,用文火浓缩至25ml,0.22μm滤膜过滤,得到浓缩液。将浓缩液冷冻干燥,得到麦蓝菜种子提取物B。将麦蓝菜种子提取物B溶解于DMSO中,得到提取物母液B,后续实验时将母液用DMEM/F12培养液稀释为各实验所需浓度。
7、将步骤1得到的麦蓝菜种子粉末溶解于DMSO中,得到麦蓝菜种子粉末溶液,后续实验时将麦蓝菜种子粉末溶液用DMEM/F12培养液稀释为各实验所需浓度。
实施例3、麦蓝菜种子提取物对奶牛乳腺上皮细胞增殖能力及活力影响
1、将实施例1制备的对数生长期的乳腺上皮细胞接种至12孔板(每孔1×106个细胞),采用DMEM/F12培养液(20%胎牛血清+0.1%双抗)37℃静置培养直至细胞长至70%-80%。
2、完成步骤2后,取所述12孔板,进行如下分组处理:
药物组1:吸弃培养上清,加入含0.1μg/mL提取物A的DMEM/F12培养液(20%胎牛血清+0.1%双抗),37℃静置24小时;提取物A的加入形式为提取物母液A;
药物组2:吸弃培养上清,加入含1μg/mL提取物A的DMEM/F12培养液(20%胎牛血清+0.1%双抗),37℃静置24小时;提取物A的加入形式为提取物母液A;
药物组3:吸弃培养上清,加入含10μg/mL提取物A的DMEM/F12培养液(20%胎牛血清+0.1%双抗),37℃静置24小时;提取物A的加入形式为提取物母液A;
药物组4:吸弃培养上清,加入含100μg/mL提取物A的DMEM/F12培养液(20%胎牛血清+0.1%双抗),37℃静置24小时;提取物A的加入形式为提取物母液A;
药物组5:吸弃培养上清,加入含1000μg/mL提取物A的DMEM/F12培养液(20%胎牛血清+0.1%双抗),37℃静置24小时;提取物A的加入形式为提取物母液A;
对照组:吸弃培养上清,加入DMEM/F12培养液(20%胎牛血清+0.1%双抗)。
每组设置三个重复。
完成培养后,收集细胞,检测细胞活力(检测时总细胞中活细胞所占的百分比)及细胞增殖能力(检测时的活细胞数目减去加药处理前的活细胞数目)。
结果如表1所示。
表1细胞活力及细胞增殖情况检测结果
注:同列实验数据分别与对照组相比,*表示差异显著(P<0.05),**表示差异显著(P<0.01)。
结果表明,提取物A浓度为0.1、1、10、100μg·mL-1时,作用于奶牛乳腺上皮细胞24h后,奶牛乳腺上皮细胞的细胞活力和增殖能力呈逐渐增加的趋势,各药物组的细胞活力和细胞增殖能力均显著高于对照组(P<0.05),且具有剂量依赖效应;当药物浓度达1000μg/mL时,细胞活力和增殖能力下降,这说明提取物浓度过高会对细胞产生细胞毒作用。100μg/mL时提取物A对奶牛乳腺上皮细胞的增殖能力影响最为显著,以此浓度作为研究提取物促进奶牛乳腺上皮细胞泌乳分子机制研究的最佳剂量。
实施例4、麦蓝菜种子提取物在促进奶牛泌乳中的应用
一、麦蓝菜种子提取物对奶牛乳腺上皮细胞分泌乳糖的影响
1、将实施例1制备的对数生长期的乳腺上皮细胞接种至12孔板(每孔1×106个细胞),采用DMEM/F12培养液(20%胎牛血清+0.1%双抗)37℃静置培养直至细胞长至70%-80%。
2、完成步骤2后,取所述12孔板,进行如下分组处理:
药物组A:吸弃培养上清,加入含100μg/mL提取物A的DMEM/F12培养液(20%胎牛血清+0.1%双抗),37℃静置24小时;提取物A的加入形式为提取物母液A;
药物组B:吸弃培养上清,加入含100μg/mL提取物B的DMEM/F12培养液(20%胎牛血清+0.1%双抗),37℃静置24小时;提取物B的加入形式为提取物母液B;
药物组C:吸弃培养上清,加入含100μg/mL麦蓝菜种子粉末的DMEM/F12培养液(20%胎牛血清+0.1%双抗),37℃静置24小时;麦蓝菜种子粉末的加入形式为麦蓝菜种子粉末溶液;
对照组:吸弃培养上清,加入DMEM/F12培养液(20%胎牛血清+0.1%双抗)。
将各组分别于培养后的12h、24h、36h、48h及72h收集奶牛乳腺上皮细胞,对细胞的乳糖分泌能力进行HPLC检测。检测方法如下:
测样品的处理:用5%(体积分数)乙腈水溶液溶解不同浓度的乳糖标准样品,不同处理的细胞用超纯水重悬后用匀浆器破碎,然后用0.22μm滤膜过滤,收集滤液进行乳糖的检测。
色谱柱:HIQ sil C18W柱(5μm);
流动相:5%(体积分数)乙腈水溶液,经过0.22μm滤膜过滤,超声脱气;
流速:恒流0.6mL/min;
进样体积:10μL;
检测波长:195nm。
乳糖标准品的液相色谱图如图3所示。图3中,横坐标为保留时间(min),纵坐标为峰高,标准品的保留时间为4.5min,在相同条件下出峰位置为±0.5min以内,可以认定为同一物质。
乳糖含量检测结果如图4所示,图4中,横坐标为处理时间(h),纵坐标为乳糖含量(mg/mL)。结果表明,随着提取物A作用时间的延长,奶牛乳腺上皮细胞乳糖的分泌能力均高于对照组。作用24h、36h、48h时,药物组A较对照组乳糖的分泌量提高9.1%、8.7%、7.1%,差异显著(p<0.05)。药物组B较对照组乳糖的分泌量提高2.3%、2.1%、1.8%。药物组C较对照组乳糖的分泌量提高1.3%、1.4%、0.9%。结果表明,麦蓝菜种子提取物A可以显著刺激奶牛乳腺上皮细胞乳糖的分泌,其效果显著高于麦蓝菜种子提取物B和麦蓝菜种子粉末。
二、麦蓝菜种子提取物对乳腺上皮细胞分泌β-酪蛋白的影响
1、将实施例1制备的对数生长期的乳腺上皮细胞接种至12孔板(每孔1×106个细胞),采用DMEM/F12培养液(20%胎牛血清+0.1%双抗)37℃静置培养直至细胞长至70%-80%。
2、完成步骤2后,取所述12孔板,进行如下分组处理:
药物组A:吸弃培养上清,加入含100μg/mL提取物A的DMEM/F12培养液(20%胎牛血清+0.1%双抗),37℃静置24小时;提取物A的加入形式为提取物母液A;
药物组B:吸弃培养上清,加入含100μg/mL提取物B的DMEM/F12培养液(20%胎牛血清+0.1%双抗),37℃静置24小时;提取物B的加入形式为提取物母液B;
药物组C:吸弃培养上清,加入含100μg/mL麦蓝菜种子粉末的DMEM/F12培养液(20%胎牛血清+0.1%双抗),37℃静置24小时;麦蓝菜种子粉末的加入形式为麦蓝菜种子粉末溶液;
对照组:吸弃培养上清,加入DMEM/F12培养液(20%胎牛血清+0.1%双抗)。
将各组分别于培养后的12h、24h、36h、48h及72h收集奶牛乳腺上皮细胞,对细胞的β-酪蛋白分泌能力进行HPLC检测。检测方法如下:
测样品的处理:用超纯水溶解不同浓度的β-酪蛋白标准品,不同处理的细胞用超纯水重悬后用匀浆器破碎,然后用0.22μm滤膜过滤,收集滤液进行β-酪蛋白的检测。
色谱柱:TSK凝胶柱(Φ7.8×300mm);
流动相:超纯水;
流速:恒流0.6mL/min;
进样体积:10μL;
检测波长:280nm。
β-酪蛋白标准品的液相色谱图如图5所示。图5中,横坐标为保留时间(min),纵坐标为峰高,标准品的保留时间为6min,在相同条件下出峰位置为±1min以内,可以认定为同一物质。
β-酪蛋白含量检测结果如图6所示,图6中,横坐标为处理时间(h),纵坐标为β-酪蛋白含量(mg/mL)。结果表明,随着提取物A作用时间的延长,奶牛乳腺上皮细胞的β-酪蛋白分泌能力均高于对照组。作用24h、36h、48h时,药物组A较对照组乳糖的分泌量提高32%、24%、23%,差异显著(p<0.05);药物组B较对照组乳糖的分泌量提高12%、10%、9%;药物组C较对照组乳糖的分泌量提高5%、7%、7%。结果表明,麦蓝菜种子提取物A可以刺激奶牛乳腺上皮细胞β-酪蛋白的分泌,其效果显著高于麦蓝菜种子提取物B和麦蓝菜种子粉末。
三、麦蓝菜种子提取物对乳腺上皮细胞分泌甘油三酯的影响
1、将实施例1制备的对数生长期的乳腺上皮细胞接种至12孔板(每孔1×106个细胞),采用DMEM/F12培养液(20%胎牛血清+0.1%双抗)37℃静置培养直至细胞长至70%-80%。
2、完成步骤2后,取所述12孔板,进行如下分组处理:
药物组A:吸弃培养上清,加入含100μg/mL提取物A的DMEM/F12培养液(20%胎牛血清+0.1%双抗),37℃静置24小时;提取物A的加入形式为提取物母液A;
药物组B:吸弃培养上清,加入含100μg/mL提取物B的DMEM/F12培养液(20%胎牛血清+0.1%双抗),37℃静置24小时;提取物B的加入形式为提取物母液B;
药物组C:吸弃培养上清,加入含100μg/mL麦蓝菜种子粉末的DMEM/F12培养液(20%胎牛血清+0.1%双抗),37℃静置24小时;麦蓝菜种子粉末的加入形式为麦蓝菜种子粉末溶液;
对照组:吸弃培养上清,加入DMEM/F12培养液(20%胎牛血清+0.1%双抗)。
将各组分别于培养后的12h、24h、36h、48h及72h收集奶牛乳腺上皮细胞,采用TG试剂盒对细胞的甘油三酯分泌能力进行检测。
结果如图7所示。图7中,横坐标为处理时间(h),纵坐标为甘油三酯含量(mmol/L)。结果表明随着提取物A作用时间的延长,奶牛乳腺上皮细胞的甘油三酯分泌能力均高于对照组,作用24h时,药物组A较对照组甘油三酯的分泌量提高11.5%,差异显著(p<0.05);药物组B较对照组甘油三酯的分泌量提高4.1%;药物组C较对照组甘油三酯的分泌量提高2.3%。结果表明,麦蓝菜种子提取物A可以刺激体外培养的奶牛乳腺上皮细胞甘油三酯的分泌,其效果显著高于麦蓝菜种子提取物B和麦蓝菜种子粉末。
步骤三、四、五的实验结果表明,麦蓝菜种子提取物A可以促进乳腺上皮细胞分泌β-酪蛋白、乳糖及甘油三酯,确实有催乳作用,且催乳效果显著高于麦蓝菜种子提取物B和麦蓝菜种子粉末。
实施例5、麦蓝菜种子提取物A对奶牛乳腺细胞信号传导通路的影响
一、奶牛乳腺上皮细胞泌乳相关信号分子的RT-PCR检测
1、将实施例1制备的对数生长期的乳腺上皮细胞接种至12孔板(每孔1×106个细胞),采用DMEM/F12培养液(20%胎牛血清+0.1%双抗)37℃静置培养直至细胞长至70%-80%。
2、完成步骤2后,取所述12孔板,进行如下分组处理:
药物组:吸弃培养上清,加入含100μg/mL提取物A的DMEM/F12培养液(20%胎牛血清+0.1%双抗),37℃静置24小时;提取物A的加入形式为提取物母液A;
对照组:吸弃培养上清,加入DMEM/F12培养液(20%胎牛血清+0.1%双抗)。
将各组分别于培养后的12h、24h、36h、48h及72h收集奶牛乳腺上皮细胞,提取细胞的总RNA,反转录为cDNA。以cDNA为模板,采用实时荧光定量试剂盒 Primx ExTaqTM进行Real-time PCR反应,Real-time PCR反应使用的引物如表2所示。
表2引物序列
Real-time PCR反应体系: Premix Ex TaqTM12.5μL,引物F 0.5μL,引物R0.5μL,模板2μL,dH2O 9.5μL。
Real-time PCR反应程序:95℃,10s;95℃,5s,60℃,31s,40个循环。
检测结果如图8所示。图8A为Stat5基因相对表达水平,图8B为β-酪蛋白基因相对表达水平。图8中,横坐标为处理时间(h),纵坐标为相对表达量。结果表明,转录因子STAT5及β-酪蛋白mRNA的表达水平在提取物A作用后的12h至48h较对照组有较显著的表达水平(P<0.05),到72h时其表达恢复为与对照组基本一致的水平。
二、奶牛乳腺上皮细胞泌乳相关信号分子的Western blot检测
1、将实施例1制备的对数生长期的乳腺上皮细胞接种至12孔板(每孔1×106个细胞),采用DMEM/F12培养液(20%胎牛血清+0.1%双抗)37℃静置培养直至细胞长至70%-80%。
2、完成步骤2后,取所述12孔板,进行如下分组处理:
药物组:吸弃培养上清,加入含100μg/mL提取物A的DMEM/F12培养液(20%胎牛血清+0.1%双抗),37℃静置24小时;提取物A的加入形式为提取物母液A;
对照组:吸弃培养上清,加入DMEM/F12培养液(20%胎牛血清+0.1%双抗)。
将各组分别于培养后的12h、24h、36h、48h及72h收集奶牛乳腺上皮细胞,提取细胞总蛋白,进行Western blot检测细胞中Stat5、β-酪蛋白表达。
检测结果如图9和图10所示。图9中泳道1到10依次对应:12h对照组,12h药物组,24h对照组,24h药物组,36h对照组,36h药物组,48h对照组,48h药物组,72h对照组,72h药物组。图10A为Stat5蛋白相对表达水平,图10B为β-酪蛋白蛋白相对表达水平。图10中,横坐标为处理时间(h),纵坐标为相对表达量。结果表明在提取物A作用24h之后,其可以显著诱导奶牛乳腺上皮细胞的Stat5转录因子和β-酪蛋白的表达水平(P<0.05),这与该分子的荧光定量结果相一致,结合提取物A可以诱导β-酪蛋白mRNA和蛋白表达水平的升高,提示提取物A诱导了乳腺上皮细胞Stat5介导的泌乳信号通路,进而影响其下游β-酪蛋白表达。
- 还没有人留言评论。精彩留言会获得点赞!