杞菊地黄丸的使用于视网膜缺血及其相关疾病、病况或病状的治疗的制作方法
本发明是关于杞菊地黄丸(一种传统中国处方用药,其是由熟地黄、山茱萸、山药、茯苓、牡丹皮、泽泻、枸杞及菊花所组成)的使用于视网膜缺血的治疗上。本发明更具体地涉及一包含杞菊地黄丸的组合物的使用用于视网膜缺血及其相关疾病、病况或病状的治疗及/或预防。
背景技术:
视网膜血管阻塞(retinal vascular occlusion)、青光眼(glaucoma)、糖尿病性视网膜病(diabetic retinopathy)和老年性黄斑部病变(age related macular degeneration;AMD)都与视网膜缺血相关。而视网膜血管阻塞包括如中心或分支视网膜动脉阻塞(central or branch retinal artery occlusion;CRAO或BRAO)。该定义的眼部病症经常导致严重的并发症。所以,视网膜缺血性损伤的治疗是非常重要的。
无轴突细胞(Amacrines)及其神经元突起(neuronal processes)易受缺血再灌注(ischemia plus reperfusion;I/R)的影响。在缺血再灌注(I/R)后,米勒细胞(Müller cell)内的中间丝蛋白(vimentin)/胶质原纤维酸性蛋白(glial fibrillary acidic protein;GFAP)的免疫标记会增强。基质金属蛋白酶9(Matrix metalloproteinase-9;MMP-9)是蛋白水解酶并能够降解细胞外基质。缺血也已显示会导致视网膜神经节细胞(retinal ganglion cell;RGC)的死亡,其与MMP-9的量增加有关。另一方面,第一型血红素氧化酶(heme oxygenase-1;HO-1)是一参与对氧化压力(oxidative stress)及缺氧(hypoxia)的进行反应的诱导型异构物。HO-1的表达增加似乎能够藉由抗氧化活性提供一对视网膜缺血及/或老年性黄斑部病变的保护作用。
有丝分裂活化蛋白激酶(mitogen-activated protein kinases;MAPKs)是讯息传递路径上关键性蛋白激酶。此外,MAPK亚科的主要成员(如JNK、p38及ERK1/2)与神经损伤及疾病有关。因MAPK蛋白(p38)会被各种压力(包括缺血和氧化压力)所刺激,故已显示与细胞凋亡过程有关。
“杞菊地黄丸”(Chi-Ju-Di-Huang-Wan;CJDHW;台湾台北的顺天堂药厂股份有限公司)是中国传统的中草药配方,其由“六味地黄丸”配方(熟地黄(Rehmanniae Radix Preparata)、山茱萸(Corni Fructus)、山药(Rhizoma Diocoreae)、茯苓(Poria)、牡丹皮(Cortex Moutan Redicis)及泽泻(Alismatis Rhizoma))加上枸杞(Fructus Lycii)及菊花(Chrysanthemi Flos)所组成。有时,将蜂蜜额外添加于配方中以加强风味,并让老人和小孩容易吞服(Chang YH,Lin HJ,Li WC:Clinical evaluation of the traditional chinese prescription Chi-Ju-Di-Huang-Wan for dry eye.Phytother Res 2005,19:349-354)。“杞菊地黄丸”据报导能有效治疗干眼症。“杞菊地黄丸”是泪膜(tear film)的有效稳定剂,并降低角膜上皮的异常情况。然而,杞菊地黄丸作用的相关治疗机制仍然未知。配方中已知活性化合物包括抗氧化剂玉米黄素(zeaxanthin)和叶黄素(lutein)(其存在于枸杞和菊花中)、和海藻糖(trehalose)(其出现于熟地黄)。
技术实现要素:
本发明探讨杞菊地黄丸(Chi-Ju-Di-Huang-Wan;CJDHW)是否能够减轻视网膜缺血性损伤,以及藉由电生理、视网膜厚度、胆碱乙酰基转移酶(Choline acetyltransferase;ChAT)免疫组织化学染色、中间丝蛋白(vimentin)/胶质原纤维酸性蛋白(Glial fibrillary acidic protein;GFAP)免疫组织化学染色(以米勒细胞(Müller cell)为指标)、荧光金逆行视网膜神经节细胞(RGC)的标记、TUNEL染色(针对凋亡细胞)、Bcl-2/HO-1/磷酸化-p38(P-p38)/MMP-9蛋白表达量分析及以酶谱(zymography)计算MMP-9的活性、以及测量Thy-1和MMP-9的mRNA表达量以评估其功效。
所定义的视网膜缺血性改变包括以下特征:视网膜电位图(ERG)的b波振幅的减小,内层视网膜厚度变薄,胆碱乙酰基转移酶(Choline acetyltransferase;ChAT)免疫标记减少,中间丝蛋白/胶质原纤维酸性蛋白(Glial fibrillary acidic protein;GFAP)的免疫反应性增强,神经节细胞层出现更多的凋亡细胞,以及少数的视网膜神经节细胞。此外,在缺血性视网膜上分别发现Thy-1及基质金属蛋白酶9(MMP-9)的mRNA表达量减少和增加。更进一步,当第一型血红素氧化酶(heme oxygenase-1;HO-1)、磷酸化p38(P-p38)、有丝分裂活化蛋白质激酶(mitogen-activated protein kinase;MAPK)及MMP-9增加时,B细胞淋巴瘤-2(Bcl-2)的蛋白表达量降低。重要的是,以4.2g/kg/天的杞菊地黄丸(CJDHW)先处理可显著地调节缺血诱发的变化。特别是,CJDHW和2nmole的SB203580(p38MAPK抑制剂)两者一起可减弱与缺血有关的P-p38和MMP-9的增加。
本发明藉由视网膜电位图(electroretinography)(b波指标性米勒细胞(Müller cell)和双极细胞(bipolar cell))、免疫组织化学染色(ChAT标记的无轴突细胞、中间丝蛋白/GFAP标记Müller细胞、荧光金标记的视网膜神经节细胞(RGC))、组织病理学(视网膜厚度测量、RGC层中的TUNEL阳性细胞)、免疫印迹法(Bcl-2、HO-1、P-p38及MMP-9)和实时PCR分析(Thy-1和HO-1)证实大鼠的视网膜各种缺血性改变。重要的是,在缺血再灌注(I/R)前以杞菊地黄丸(CJDHW)处理可明显调节所有这些定义的缺血性相关特征。
CJDHW藉由保留视网膜电生理功能(图1A至1B),抵消内层视网膜厚度的减少或胆碱神经元死亡(图2A至2J和图3A至3J;表2和3),减少米勒细胞、中间丝蛋白/GFAP神经胶细胞活化(图4A至4R),使RGC层的凋亡细胞数量下降(表4)以及钝化Thy-1的mRNA的下调(图6和表6)和使通过荧光金标记所侦测到RGC死亡下降(图5A至5J;表5)以保护抵抗视网膜缺血性损伤。如目前免疫印迹法分析结果(图7和表7),CJDHW是能够保护缺血性损伤的视网膜细胞,如无轴突细胞和神经节细胞(图3A至3J,图5A至5J和图6;表3、5及6);因此它很可能是,至少在某一部分,因为HO-1过度表达与抗氧化作用有关(图7和表7)。最重要的是,通过CJDHW和SB203580(p38MAPK抑制剂)两者一起抑制缺血MMP-9的量增加及活性增强(图7和图8)。
在这样的情况下,一个合理的结论是:CJDHW能够通过抗氧化作用和经由抗凋亡作用(分别增加HO-1和Bcl-2的量)给予视网膜缺血的神经保护。尤其,CJDHW也显示经由p38MAPK以下调MMP-9来保护防止视网膜缺血。
在本发明中,显示出当患者有老年性黄斑部病变(AMD)或糖尿病的家族病史、及/或当有和中心或分支视网膜动脉阻塞(CRAO或BRAO)相关的诱发因子,即高血压、冠状/颈动脉疾病、高血脂症或心脏瓣膜疾病时,先给予CJDHW作为预防方法上有临床上重要性。
本发明的电生理结果指出缺血后给予CJDHW明显减弱视网膜缺血相关视觉机能障碍(b波降低)。所以,杞菊地黄丸(CJDHW)在预防或缓解急性和可能早期慢性视网膜缺血性损伤的神经元伤害是有用的。因此,CJDHW可以是一个有效的方法,用以保护防止所定义的对视力有威胁的视网膜缺血性疾病,例如中心视网膜动脉阻塞、中心视网膜静脉阻塞、其它视网膜血管阻塞症、青光眼性视神经病变(glaucomatous optic neuropathy)、糖尿病性视网膜病和湿性老年性黄斑部病变(wet age related macular degeneration;wAMD)。
因此,本发明提供一种组合物用于制备治疗视网膜缺血或其相关疾病、病况或病症的药物的用途,其中所述组合物包含一杞菊地黄丸(Chi-Ju-Di-Huang-Wan;CJDHW),其中所述杞菊地黄丸包括熟地黄(Rehmanniae Radix Preparata)、山茱萸(Corni Fructus)、山药(Rhizoma Diocoreae)、茯苓(Poria)、牡丹皮(Cortex Moutan Redicis)、泽泻(Alismatis Rhizoma)、枸杞(Fructus Lycii)及菊花(Chrysanthemi Flos),或由它们所组成。在一具体实施例中,所述组合物进一步包含一蜂蜜。在一具体实施例中,其中所述视网膜缺血的相关疾病、病况或病症包含视网膜血管阻塞(retinal vascular occlusion)、青光眼(glaucoma)、糖尿病性视网膜病(diabetic retinopathy)或老年性黄斑部病变(age related macular degeneration)。因为视网膜是中枢神经系统的延伸,故本领域的技术人员可以合理地推断本组合物可以进一步用于治疗脑部缺血(brain ischemia)(中风(stroke))。较佳的是,所述药物作用在哺乳动物;更佳的是,所述哺乳动物为人类。较佳的是,所述药物是经口服投药。
在一具体实施例中,所述组合物的治疗有效量包含所述杞菊地黄丸的剂量范围从约1g/kg/天到10g/kg/天(克/公斤体重/天)。在另一具体实施例中,所述组合物的治疗有效量包含所述杞菊地黄丸的剂量范围从约1g/kg/天至约5g/kg/天。在又一具体实施例中,所述组合物的治疗有效量包含杞菊地黄丸的剂量范围从约2.8g/kg/天至约4.2g/kg/天。在另一实施例中,所述组合物的治疗有效量包含杞菊地黄丸的剂量范围从约2.8g/kg/天至约4.2g/kg/天以口服方式给予啮齿动物。
值得注意的是,上述的剂量主要是通过口服给药方式用于大鼠上。因此,如果需要治疗的个体是人类,则所述剂量应根据本领域中熟知的转换方法重新计算。例如,大鼠(标准体重为0.2kg)和人类(标准体重70kg)之间的剂量的转换可以如下所示:
1(g/kg)X 0.2X 56/70=0.16(g/kg);
2.8(g/kg)X 0.2X 56/70=0.448(g/kg);
4.2(g/kg)X 0.2X 56/70=0.672(g/kg);
5(g/kg)X 0.2X 56/70=0.8(g/kg);或
10(g/kg)X 0.2X 56/70=1.6(g/kg)。
也就是说,用于大鼠上1至10g/kg(克/公斤体重)的剂量大约等于使用于人类身上0.16至1.6g/kg(克/公斤体重)。
因此,在一具体实施例中,杞菊地黄丸对人类的剂量范围可从约0.1g/kg/天至约2g/kg/天、从约0.16g/kg/天至约1.6g/k/天、从约0.16g/kg/天至约0.8g/kg/天、从约0.4g/kg/天至约0.7g/kg/天、或从约0.448g/kg/天至约0.672g/kg/天。
附图说明
图1A及1B显示视网膜电位图(ERG),其为杞菊地黄丸(CJDHW)对视网膜缺血再灌注(I/R)的作用。图1A:相较于对照组的假手术的视网膜(假手术;sham),在I/R+媒剂组的代表性动物因接受压力诱发视网膜缺血及先给予媒剂(Vehicle),其ERG的b波振幅出现相当程度的减少。显示每个界定的组别的大鼠先给予CJHDW(2.8g/kg/天(I/R+CJDHW 2.8);4.2g/kg/天(I/R+CJDHW 4.2))减少剂量反应反作用。图1B:相较于假手术的对照组,I/R+媒剂组在缺血后第1,3,5和7天的b波率显著减少(*p<0.05)。先给予2.8g/kg/天(I/R+CJDHW2.8)和4.2g/kg/天(I/R+CJDHW 4.2)的CJDHW可达到呈现剂量反应且显著使缺血诱发的减少衰减该结果以平均值±标准误差(SEM)表示(数量为5)。
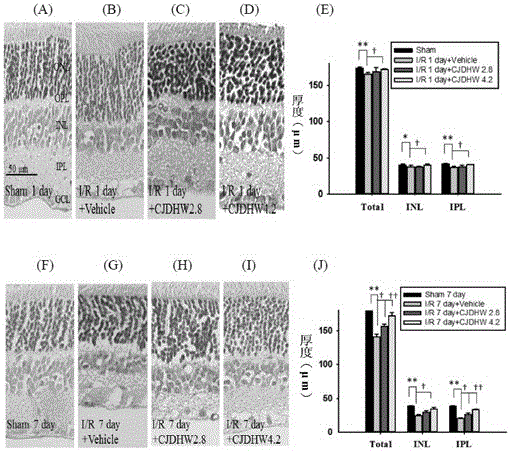
图2A至2J显示各种视网膜层的厚度。这些图显示来自大约相同的偏心度的视网膜的切片。图2A或图2F分别为假手术后第1天(sham 1day)或第7天(sham 7day)的对照组的视网膜。图2B或图2G分别先以媒剂(Vehicle)处理的缺血再灌注后第1天(I/R 1day+Vehicle)或第7天(I/R 7day+Vehicle)的视网膜。相较于对照组的视网膜(图2A及2F),以先给予媒剂的缺血性视网膜的内视网膜(内核层(INL),内丛层(IPL)和神经节细胞层(GCL))的厚度呈现相当程度的变薄(图2B及2G)。以2.8g/kg/天及4.2g/kg/天的杞菊地黄丸(CJDHW)先处理并受缺血再灌注的动物可缓减内视网膜层的变薄(I/R 1day+CJDHW 2.8(图2C)、I/R 7day+CJDHW 2.8(图2H)、I/R 1day+CJDHW4.2(图2D)及I/R 7day+CJDHW 4.2(图2I))。比例尺=50μm。此处呈现来自相似偏心率的切片上的各种视网膜层的厚度的形态分析(图2E及2J)。相较于对照组的视网膜(sham 1day及sham 7day),在以媒剂先处理的缺血性视网膜,其整个视网膜层、内核层(INL)和内丛层(IPL)的厚度显著降低。此外,当以2.8及4.2g/kg/天的CJDHW先处理的缺血性视网膜会以剂量依赖性形式且显著地降低衰减。结果以实验的数量的平均值±标准误差(SEM)表示(数量为)。*:与对照组的眼有显著差异(p<0.05)。:与I/R 1day+Vehicle组或I/R7day+Vehicle组有显著差异(p<0.05)。Total:整个视网膜。
图3A至3J表示胆碱乙酰基转移酶(Choline acetyltransferase;ChAT,以红色表示)免疫组织化学染色。在假手术的第1天(sham 1d(图3A))及第7天(sham 7d(图3F))的视网膜中,无轴突细胞体(以短箭头表示)位于内核层(inner nuclear layer;INL)和神经节细胞层(ganglion cell layer;GCL)内;无轴突细胞体的神经突(以长箭头表示)在内丛层(inner plexiform layer;IPL)显示两个清楚的描绘区段。视网膜缺血再灌注1天或7天可引起IPL的ChAT免疫标记显著减少,以及ChAT所标记的无轴突细胞体的数目少许多;而先给予媒剂并不影响所界定的缺血性改变(I/R 1d+Vehicle(图3B);I/R 7d+Vehicle(图3G))。然而,先给予2.8g/kg/天及4.2g/kg/天的杞菊地黄丸(CJHDW)可明显减缓这种缺血性改变(I/R 1d+CJDHW2.8(图3C);I/R 7d+CJDHW 2.8(图3H);I/R 1d+CJDHW 4.2(图3D);I/R7d+CJDHW 4.2(图3I))。ChAT免疫标记图像与4,6-二脒基-2-苯基吲哚-二氢化氯(4,6-diamidine-2-phenylindole dihydrochloride;DAPI,以蓝色表示,图3A至3D;图3F至3I)的图像合并。假手术或缺血性手术后1天(图3E)及7天(图3J)中,每一条代表平均值±SEM(数量为6)。*代表有显著差异(p<0.05;sham对I/R 1d+Vehicle;sham对I/R 7d+Vehicel)。代表有显著差异(p<0.05;I/R 1d+Vehicel对I/R 1d+CJDHW 2.8或I/R 1d+CJDHW 4.2;I/R 7d+Vehicel对I/R+7d CJDHW2.8或I/R 7d+CJDHW 4.2)。比例尺为 35μm。
图4A至4R显示中间丝蛋白(vinmemtin)免疫组织化学染色。在假手术后的第1天(sham 1d(图4B))或第7天(sham 7d(图4K))中,以中间丝蛋白免疫标记(以绿色表示)证实米勒细胞(Müller cell)在神经节细胞层(ganglion cell layer;GCL,以箭头表示)的末支(end feet)和米勒细胞的突起在内丛层(inner plexiform layer;IPL,以箭号表示)、内核层(inner nuclear layer;INL)和外核层(outer nuclear layer;ONL)。相较于假手术的视网膜,抗中间丝蛋白免疫标记在先给予媒剂(Vehicle)后第1天及第7天增加(I/R 1d+Vehicle(图4C);I/R 7d+Vehicle(图4L))。这种增加会被以2.8g/kg/天(I/R 1d+CJDHW2.8(图4D);I/R 7d+CJDHW 2.8(图4M))或4.2g/kg/天(I/R 1d+CJDHW4.2(图4E);I/R 7d+CJDHW 4.2(图4N))的杞菊地黄丸(CJDHW)所减缓。假手术的视网膜上的细胞核以4,6-二脒基-2-苯基吲哚-二氢化氯(4,6-diamidine-2-phenylindole dihydrochloride;DAPI)进行免疫标记(以蓝色表示)(图4A及图4J)。胶质原纤维酸性蛋白(Glial fibrillary acidic protein;GFAP)免疫组织化学染色。与经假手术后第1天及第7天的对照组的视网膜相比(sham 1d(图4F);sham 7d(图4O)),抗GFAP免疫标记在先给予媒剂后第1天及第7天亦增加(I/R 1d+Vehicle(图4G);I/R 7d+Vehicle(图4P))。这种增加会被以2.8g/kg/天(I/R1d+CJDHW 2.8(图4H);I/R 7d+CJDHW 2.8(图4Q))或4.2g/kg/天(I/R 1d+CJDHW 4.2(图4I);I/R 7d+CJDHW 4.2(图4R))的CJDHW所减弱。比例尺为25μm。
图5A至5J显示荧光金标记。显微镜图像显示在假手术后第1天及第7天(sham 1d(图5A);sham 7d(图5F)),或先给予媒剂(Vehicle)(I/R 1d+Vehicle(图5B);I/R 7d+Vehicle(图5G))或2.8g/kg/天及4.2g/kg/天的杞菊地黄丸(CJDHW)(I/R 1d+CJDHW 2.8(图5C);I/R 7d+CJDHW2.8(图5H);I/R 1d+CJDHW 4.2(图5D);I/R 7d+CJDHW 4.2(图5I))缺血再灌注后第1及7天的视网膜神经节细胞
(retinal ganglion cell;RGC)的密度。每一条以平均值±SEM表示(图5E及5J;数量为3)。**表示显著差异(p<0.01;sham对I/R 1d+Vehicle或I/R 7d+Vehicle);表示显著差异(p<0.05;I/R 1d+Vehicle对I/R1d+CJDHW 4.2;I/R 7d+Vehicle对I/R 7d+CJDHW4.2)。比例尺为25μm。
图6表示Thy-1(A)、基质金属蛋白酶9(matrix metalloproteinase-9;MMP-9)(B)及β-肌动蛋白(β-actin)的mRNA表达量。在视网膜缺血再灌注(I/R)后24小时,从假手术(sham)的视网膜或给予媒剂(水)、低剂量(2.8g/kg/天)/高剂量(4.2g/kg/天)的杞菊地黄丸(CJDHW)的缺血性视网膜中萃取且分离全部的mRNA。评估每一个所界定的化合物对Thy-1/MMP-9的mRNA浓度(除以β-肌动蛋白的mRNA表达量)的影响。**代表有显著差异(p<0.01;假手术对I/R+媒剂)。或代表分别对Thy-1有显著差异(p<0.05;I/R+媒剂对I/R+CJDHW 4.2)或对MMP-9有显著差异(p<0.01;I/R+媒剂对I/R+CJDHW 4.2)。结果以平均值±SEM表示(Thy-1:数量为5;MMP-9:数量为)。
图7显示免疫印迹法(western blotting)。抗Bcl-2(A1)、第一型血基质氧化酶(heme oxygenase-1;HO-1)(B1),磷酸化-p38(phosphorylated-p38;P-p38)(C1)、MMP-9(D1)及β-肌动蛋白的抗体分别以26kDa、34.6kDa,43kDa、及43kDa的条带表示。每一条代表Bcl-2(数量为A2)、HO-1(数量为4,B2)、P-p38(数量为C 2)或MMP-9(数量为5,D2)对β-肌动蛋白(β-actin)的比率。*或分别代表有显著差异(p<0.05;假手术(sham)对I/R+媒剂(I/R+Vehicle))或显著差异(p<0.05;I/R+媒剂对I/R+CJDHW 4.2;I/R+媒剂对SB203580)。此外,对于P-p38来说,**或分别代表有显著差异(p<0.01;假手术对I/R+媒剂)或显著(p<0.01和p<0.05;I/R+媒剂对SB203580和I/R+媒剂对I/R+CJDHW 4.2)。结果以平均值±SEM表示。
图8显示凝胶酶谱(Gel zymography)。(A)为明胶酶谱的一个例子,其用于通过光密度(densitometry)定量分析MMP-9的定量蛋白表达量。72及97kDa的明胶分解的条带(gelatinolytic band)分别对应MMP-2和活化的MMP-9。第1行:假手术的视网膜(假手术;sham);第2行:以媒剂(Vehicle)先处理的缺血性视网膜(I/R+媒剂);第3行:以SB203580(p38MAPK抑制剂)先处理的缺血性视网膜
(I/R+SB203580);第4和5行:分别为以4.2g/kg/天(I/R+CJDHW 4.2)和2.8g/kg/天的杞菊地黄丸(CJDHW)(I/R+CJDHW 2.8)先处理的缺血性视网膜。(B)中每一条以平均值±SEM表示(数量为)。**表示有显著差异(p<0.01;假手术对I/R+媒剂)。代表有显著差异(p<0.01;I/R+媒剂对I/R+CJDHW 4.2;I/R+Vehicle对SB203580)。代表有显著差异(p<0.05;I/R+媒剂对I/R+CJDHW 2.8)。与MMP-9的结果相反,当以媒剂或CJDHW 4.2/CJDHW 2.8先处理的缺血后24小时后测量MMP-2的表达量,发现有与对照组(假手术)相似的蛋白质表达量。
具体实施方式
下列实施例并非限制,且仅作为本发明的不同面向及特色的代表。
实施例1
方法
动物
振兴医院(CHGH;台北;台湾)的实验动物照护及使用委员会同意所有的动物实验(批准文号:CHIACUC 102-08),其遵守视觉与眼科研究协会(Association for Research in Vision and Ophthalmology)的视觉与眼科研究上使用动物声明。Wistar大鼠(BioLasco,台北,台湾)饲养于动物房中,其维持湿度:40至60%、温度:19至23℃、光暗循环周期为12小时、换气次数为每小时12-15次的环境。食物和水则让它们任意采食。
动物麻醉及安乐死
以克他明(ketamine,100mg/kg)及甲苯噻嗪(xylazine,5mg/kg)进行麻醉,其通过腹腔注射的方式给予动物。采用人道方式(根据1986年的科学程序法案;Scientific Procedures Acts 1986),将戊巴比妥钠(sodium pentobarbitone)(>140mg/kg)以腹腔给药方式处死动物。
视网膜缺血模型的建立
麻醉后,将动物(200至250克)固定于一立体定位仪上。用一连接生理食盐水瓶的30号的针头穿刺进大鼠的眼睛的前房,以升高并诱发出120毫米水银柱的高眼球内压(high intraocular pressure;HIOP),维持60分钟。通过眼部基底白化(pale eye fundus)的检测以确认缺血性损伤的诱发情况(Chao HM,Chen IL,Liu JH:S-allyl L-cysteine protects the retina against kainate excitotoxicity in the rat.Am J Chin Med.2014,42(3):693-708;Peng PH,Chao HM,Juan SH,Chen CF,Liu JH,Ko ML:Pharmacological preconditioning by low dose cobalt protoporphyrin induces heme oxygenase-1overexpression and alleviates retinal ischemia-reperfusion injury in rats.Current eye research 2011,36:238-246)。对照组中大鼠的眼睛接受假手术,即大鼠的眼压并未升高。
药物供应
在高眼球内压(HIOP)损伤手术的前或后,每天给予可口服摄取的水、低摄取量的杞菊地黄丸(CJDHW)(2.8g/kg/天,CJDHW 2.8)或高摄取量的杞菊地黄丸(4.2g/kg/天,CJDHW 4.2)连续7天,直到处死动物为止。下列大鼠的正常眼睛作为对照组。眼睛遭受缺血手术的受测试大鼠喂食相关量的杞菊地黄丸(I/R+CJDHW 2.8;I/R+CJD HW4.2)或“相同”量的媒剂(Vehicle)(I/R+Vehicle)。举例来说,喂食重量250g的大鼠低剂量杞菊地黄丸(0.7g/0.5ml水/天)、高剂量杞菊地黄丸(1.05g/3.5ml水/天)或3.5ml的水。
用1%的睫状肌麻痹剂(tropicamide)及2.5%的脱羟肾上腺素(phenylephrine)使瞳孔扩大后,利用一连接25μl注射器的30号的针头进行玻璃体内注射(intravitreal injection)。在某些情况下,在压力诱发视网膜缺血的15分钟前,在缺血眼睛上施行玻璃体内注射4μl的浓度2nmol的SB203580(Calbiochem公司,圣地亚哥,加州)或媒剂(等体积的二甲亚砜(DMSO))。
闪烁视网膜电位图测量
记录缺血手术前(作为第0天)及缺血手术后(给予适当的化合物)第1、3、5和7天所有的动物的视网膜电位图(electroretinogram;ERG)的数据。大鼠需经至少对黑暗适应8小时,且ERG记录过程中处于麻醉状态,并用1%的睫状肌麻痹剂(tropicamide)及2.5%的脱羟肾上腺素(phenylephrine)使其瞳孔扩大。每只大鼠的眼睛前2公分放置一闪光灯(strobe)以诱发出0.5Hz的刺激。在10kHz时以每2秒的时间间隔内连续记录15次的反应,并将这些反应扩大且平均;其依据先前所述(Chao HM,Chen IL,Liu JH:S-allyl L-cysteine protects the retina against kainate excitotoxicity in the rat.Am J Chin Med.2014,42(3):693-708)。已被广泛接受的是b波反应出视网膜内层及双极细胞(bipolar cell)的功能。为了进行比较,经处理后缺血性视网膜的b波振幅除以未处理的对侧正常视网膜的b波振幅以计算出b波率(b-wave ratio)(Chao HM,Chen IL,Liu JH:S-allyl L-cysteine protects the retina against kainate excitotoxicity in the rat.Am J Chin Med.2014,42(3):693-708)。
苏木素-伊红染色
在视网膜缺血再灌注后第1或7天,在角膜的12点钟方向以丝线缝合以对眼球做上记号;然后将眼球摘除并放入于4%三聚甲醛(paraformaldehyde)中于4℃下固定24小时。固定后,移除眼球前端部分,且将含有视盘的眼球后端部分通过一系列梯度设计的乙醇进行脱水,再包埋于石蜡中。进行苏木素(hematoxylin)-伊红(eosin)染色(HE stain)(Schatz A,Arango-Gonzalez B,Fischer D,Enderle H,Bolz S,T,Naycheva L,Grimm C,Messias A,Zrenner E:Transcorneal electrical stimulation shows neuroprotective effects in retinas of light-exposed rats.Invest Ophthalmol Vis Sci 2012,53:5552-5561),沿着垂直子午线(vertical meridian)切出5μm厚的切片,并在显微镜(Leica公司,海德堡,德国)下进行观察。
为了量化视网膜缺血性损伤,测量不同层的厚度。整个视网膜厚度(从内限界膜(inner limiting membrane)到视网膜色素上皮细胞(retinal pigment epithelium;RPE)层)、内视网膜厚度(从内限界膜到内核层(inner nuclear layer;INL))和内丛层(inner plexiform laye;IPL)的厚度都被测量,所有测量均从视盘开始约1000μm进行测定。每个眼睛取三个切片进行平均。此外,为了适当地探究四组(假手术组(sham)、I/R+媒剂(I/R+Vehicle)、I/R+CJDHW 2.8及I/R+CJDHW4.2)之间厚度的任何差异,研究人员在不知组织的来源的情形下进行各种厚度的测量。
免疫荧光分析
在大鼠处死后,在该大鼠心内灌注生理盐水(w/v)。在其后,回收视网膜切片,并浸泡于4%三聚甲醛(paraformaldehyde)中固定45分钟,再浸入30%的蔗糖溶液内以进行冷冻切片(Chao HM,Chen IL,Liu JH:S-allyl L-cysteine protects the retina against kainate excitotoxicity in the rat.Am J Chin Med.2014,42(3):693-708)。收集先给予杞菊地黄丸(CJDHW)或媒剂的视网膜缺血,或假手术后第1及7天的视网膜切片。将视网膜样本与初级抗体(包括如先前所述的羊的抗胆碱乙酰基转移酶(ChAT)的多克隆抗体、小鼠的抗中间丝蛋白(vimentin)的单克隆抗体及兔的抗胶质原纤维酸性蛋白(GFAP)的多克隆抗体(Chao HM,Chen IL,Liu JH:S-allyl L-cysteine protects the retina against kainate excitotoxicity in the rat.Am J Chin Med.2014,42(3):693-708))一同培养至过夜。之后,将视网膜样本与二级抗体(包括如先前所述的玫瑰红(rhodamine)共轭的兔的抗山羊抗体,异硫氰酸荧光素(fluorescein isothiocyanate)共轭的山羊的抗小鼠的免疫球蛋白G(IgG)或荧光蛋白(FITC)共轭的山羊的抗兔的免疫球蛋白G(IgG)(Chao HM,Chen IL,Liu JH:S-allyl L-cysteine protects the retina against kainate excitotoxicity in the rat.Am J Chin Med.2014,42(3):693-708))一同培养。同时,如前所述细胞核用4,6-二脒基-2-苯基吲哚-二氢化氯(4,6-diamidine-2-phenylindole dihydrochloride;DAPI)进行染色(Chao HM,Chen IL,Liu JH:S-allyl L-cysteine protects the retina against kainate excitotoxicity in the rat.Am J Chin Med.2014,42(3):693-708)。如先前所述,利用荧光显微镜以评估视网膜样本(Chao HM,Chen IL,Liu JH:S-allyl L-cysteine protects the retina against kainate excitotoxicity in the rat.Am J Chin Med.2014,42(3):693-708)。
末端脱氧核苷酸转移酶调介脱氧尿苷三磷酸切口末端标记染色(TUNEL)分析
在缺血再灌注(I/R)手术后的第1天及第7天,移除大鼠眼睛进行末端脱氧核苷酸转移酶调介脱氧尿苷三磷酸切口末端标记染色(Terminal deoxynucleotidyl-transferase(TdT)-mediated dUTP nick end-labeling;TUNEL)(原位细胞死亡侦测试剂(In situ Cell Death Detection Kit),荧光素;罗氏,曼海姆,德国)以研究细胞凋亡。视网膜样本以10%三聚甲醛(paraformaldehyde)固定24小时。视网膜样本浸泡于蛋白酶K(proteinase K,25μg/ml),随后于25℃下在过氧化氢(H2O2)/甲醇中培育5分钟以使内源性氧化物酶(endogenous peroxidases)失去活性。阴性和阳性对照组如先前所述进行测量(Peng PH,Chao HM,Juan SH,Chen CF,Liu JH,Ko ML:Pharmacological preconditioning by low dose cobalt protoporphyrin induces heme oxygenase-1overexpression and alleviates retinal ischemia-reperfusion injury in rats.Current eye research 2011,36:238-246)。用三羟甲基氨基甲烷缓冲食盐水(Tris buffered saline)洗涤后,视网膜样本于37℃下在末端脱氧核苷酸转移酶(TdT)酶/标记反应混合物中浸泡90分钟。藉由TdT酶使地高辛-dUP(digoxigenin-dUTP)与DNA的3'-OH末端结合促使反应开始,接着与过氧化物酶(peroxidase)共轭的抗地高辛抗体中培养。一旦通过一终止缓冲液终止标记反应的进行,该视网膜切片进行一以二甲基联苯胺(3,3'diaminobenzidine)作为显色过氧化物酶受质的标准辣根过氧化酶(streptavidin-horseradish peroxidase;HRP)的反应,并用甲基绿(methyl green)对比染色。每个视野下的TUNEL阳性细胞的平均数如前所述计算(Peng PH,Chao HM,Juan SH,Chen CF,Liu JH,Ko ML:Pharmacological preconditioning by low dose cobalt protoporphyrin induces heme oxygenase-1overexpression and alleviates retinal ischemia-reperfusion injury in rats.Current eye research 2011,36:238-246)。
视网膜神经节细胞的逆行标记
其如前所述,在麻醉后,在大鼠的头皮制造2公分的切口,并钻出两个小孔以深入头盖骨颅(Peng PH,Chao HM,Juan SH,Chen CF,Liu JH,Ko ML:Pharmacological preconditioning by low dose cobalt protoporphyrin induces heme oxygenase-1overexpression and alleviates retinal ischemia-reperfusion injury in rats.Current eye research 2011,36:238-246)。接着,通过微量滴管将2μl的5%荧光金(fluorogold)(Sigma-Aldrich公司)注射入头盖骨下深度3.8、4.0和4.2mm的位置。视网膜神经节细胞(retinal ganglion cell;RGC)逆行免疫标记三天后,在动物的右眼进行高眼球内压(HIOP)手术,而对侧眼则进行假程序手术。轻轻取出视网膜,将其固定,解剖并如前所述进行后续动作(Peng PH,Chao HM,Juan SH,Chen CF,Liu JH,Ko ML:Pharmacological preconditioning by low dose cobalt protoporphyrin induces heme oxygenase-1overexpression and alleviates retinal ischemia-reperfusion injury in rats.Current eye research 2011,36:238-246)。RGC的平均密度定义为计算全部RGC数量占总视网膜面积的比率(Peng PH,Chao HM,Juan SH,Chen CF,Liu JH,Ko ML:Pharmacological preconditioning by low dose cobalt protoporphyrin induces heme oxygenase-1overexpression and alleviates retinal ischemia-reperfusion injury in rats.Current eye research 2011,36:238-246)。
各种视网膜的mRNA浓度的测量
利用实时反转录聚合酶链式反应(real-time PCR)技术对Thy-1和基质金属蛋白酶9(MMP-9)的视网膜mRNA浓度进行研究(Chao HM,Chen IL,Liu JH:S-allyl L-cysteine protects the retina against kainate excitotoxicity in the rat.Am J Chin Med.2014,42(3):693-708)。在先给予上述化合物的视网膜缺血手术或假程序手术后一天,将动物处死并对视网膜取样进行处理如先前所述(Chao HM,Chen IL,Liu JH:S-allyl L-cysteine protects the retina against kainate excitotoxicity in the rat.Am J Chin Med.2014,42(3):693-708)。萃取视网膜的RNA,且在2μg的脱氧核糖核酸酶(DNase)处理的RNA中进行第一链互补DNA(complementary DNA;cDNA)的合成。第一链cDNA随后进行实时PCR。PCR和循环的进行如先前的指示(Chao HM,Chen IL,Liu JH:S-allyl L-cysteine protects the retina against kainate excitotoxicity in the rat.Am J Chin Med.2014,42(3):693-708)。利用β-肌动蛋白(β-actin)为内部对照组进行相对定量。此过程将mRNA目标(target)(Ct)的测量标准化,并对总RNA的量的变化考虑应用到每个反应(ΔCt)上。相对Thy-1/MMP-9的量的差异是以相对于关于校准仪的对照组的倍率变化进行测量(ΔΔCt)。mRNA量的相对测量是基于2-ΔΔCt的公式作说明(Chao HM,Chen IL,Liu JH:S-allyl L-cysteine protects the retina against kainate excitotoxicity in the rat.Am J Chin Med.2014,42(3):693-708)。从AB应用生物系统公司(AB Applied Biosystems)购买PCR试剂、软件和机器。收集的结果是由每个管理员一个一个进行比较,并测量相对应于对照组的总百分比的变化。如表1中所述,以下的PCR的寡核苷酸引物(oligonucleotide primer)(β-actin、Thy-1及MMP-9)是从MISSION BIOTECH(台北,台湾)所购得。
表1、寡核苷酸引物序列及PCR的详细信息
F:正向(forward);R:反向(reverse);s:秒
免疫印迹法分析
在先给予相关化合物的视网膜缺血手术或假程序手术后一天,将动物处死。回收视网膜样本,并在溶解缓冲液及哺乳动物蛋白提取试剂(Pierce,IL)中进行超声波处理(sonicate)。如先前所述,等量变性蛋白(30μg/20μl/孔)在十二烷基磺酸钠-聚丙烯酰胺胶凝体电泳中处理(SDS-PAGE;Bio-Rad公司,赫拉克勒斯,加利福尼亚州)(Chao HM,Chuang MJ,Liu JH,Liu XQ,Ho LK,Pan WHT,Zhang XM,Liu CM,Tsai SK,Kong CW,Lee SD,Chen MM,Chao FP:Baicalein protects against retinal ischemia by antioxidation,antiapoptosis,downregulation of HIF-1alpha,VEGF,and MMP-9 and upregulation of HO-1.J Ocul Pharmacol Ther 2013,29:539-549)。硝酸纤维素印迹(nitrocellulose blots;NC)于4℃下与各种初级抗体浸泡12小时,其中该初级抗体包含:小鼠单克隆抗体[AC-15]抗β-肌动蛋白(β-actin)抗体(1:5000;Abcam公司,剑桥,英国)、兔单克隆抗体Bcl-2(50E3;1:1000;细胞信号,丹弗斯,MA 01923,美国)、小鼠单克隆抗体HO-1(Ab 13248)(1:1000;Abcam公司公司,剑桥,英国),小鼠单克隆抗体P-p38MAPK(1:1000;细胞信号,丹弗斯,MA 01923,美国)、兔单克隆抗体p38MAPK(1:1000;细胞信号,丹弗斯,MA 01923,美国)和兔单克隆抗体MMP-9(EP1255Y;1:1000;Abcam公司,剑桥,英国)。如前所述,该印迹于37℃下与相关的二级抗体、辣根过氧化物酶共轭的山羊的抗兔或抗小鼠的IgG(1:5000或1:2000,Amersham公司)浸泡1小时。最后,于膜上建立和暴露(Chao HM,Chuang MJ,Liu JH,Liu XQ,Ho LK,Pan WHT,Zhang XM,Liu CM,Tsai SK,Kong CW,Lee SD,Chen MM,Chao FP:Baicalein protects against retinal ischemia by antioxidation,antiapoptosis,downregulation of HIF-1alpha,VEGF,and MMP-9 and upregulation of HO-1.J Ocul Pharmacol Ther 2013,29:539-549),然后扫视密度以评估各蛋白质的量。
凝胶酶谱法(Gel zymography)
用前述的免疫印迹法分析类似的方法制备蛋白质样本;然后这些样本用含有0.1%明胶(gelatin)的10%Tris-甘氨酸胶作为蛋白酶受质进行装载到和分离(Marecko I,Cvejic D,Selemetjev S,Paskas S,Tatic S,Paunovic I,Savin S:Enhanced activation of matrix metalloproteinase-9correlates with the degree of papillary thyroid carcinoma infiltration.Croat Med J 2014,55:128-137)。通过电泳分离后,将凝胶于室温下在复性缓冲液(renaturation buffer)(2.7%的Triton X-100于中蒸馏水中)中以轻微振荡培养30分钟。倒掉复性缓冲液,以显影缓冲液(developing buffer)(50mmol/L的Tris base,40mmol/L的盐酸,200mmo/L的氯化钠,5mmol/L的氯化钙,0.2%的Brij 35)取代。以显影缓冲液均衡30分钟后,将凝胶于37℃下在新鲜的显影缓冲液培养48小时。在显影后,以0.5%考马斯蓝(Coomassie blue)R-250将凝胶染色30分钟,然后适当地脱色。然后通过扫描光密度法对可见条带进行分析。
统计分析
三个或以上的组别以单向变异数分析(ANOVA)进行比较。进一步以杜克多重比较测试(Tukey multiple-comparison test)来比较对照组(例如,媒剂处理的缺血性视网膜)和其他组(例如,杞菊地黄丸处理的缺血性视网膜)。p值<0.05时,定义为有显著差异。
结果
杞菊地黄丸对b波的影响
图1A及1B显示杞菊地黄丸(CJDHW)对视网膜缺血再灌注(I//R)的影响,其是根据视网膜电位图(electroretinogram;ERG)的结果。在假手术的视网膜(假手术(sham),图1A)中,ERG的b波计算在0.98mV。视网膜缺血再灌注1天后,b波大大地下降。这种下降并不受先给予媒剂(Vehicle)的影响(I/R+媒剂:0.11mV,图1A)。然而,先给予CJDHW(I/R+CJDHW 2.8g/kg/天;I/R+CJDHW 4.2g/kg/天)会呈现剂量反应形式抵消缺血所诱发的b波下降的情况,且b波值分别提高至0.26和0.39mV(在缺血再灌注(I/R)后1天)。
如图1B所示(数量为5),与缺血前b波率(作为基线,0天:0.95±0.04)相比,先给予媒剂的I/R(I/R+媒剂)后第1、3、5及7天,存在b波率明显下降的情况(第1天:0.44±0.03;第3天:0.44±0.02;第5天:0.37±0.02;第7天:0.38±0.01)(p<0.05)。然而,在先给予杞菊地黄丸(CJDHW)(I/R+CJDHW)后,存在剂量反应相关形式(2.8g对4.2g/kg/天)和显著(p<0.05;在2.8及4.2g/kg/天)地缓解缺血诱发的b波率下降的情况,在缺血后第1天(0.66±0.03对0.72±0.03)、第3天(0.70±0.02对0.78±0.02)、第5天(0.68±0.02对0.80±0.01)及第7天(0.69±0.02对0.81±0.01)。此外,缺血前b波率(第0天)记录为0.99±0.05对0.93±0.05。
另一方面(未示于图中;数量为5),当与缺血前的b波率(第0天作基线:1.04±0.04)相比,I/R后第7天与缺血后给予媒剂,b波率显著下降(0.34±0.08)(p<0.05)。相反地,I/R后第7天与缺血后给予CJDHW,会有浓度依赖性(2.8对4.2g/kg/天)且显著(p<0.05;4.2g/kg/天)地改善缺血所诱发的b波率下降的情况(0.56±0.07与0.61±0.07)。
当对ERG的b波率进行比较时(假手术的眼对另一侧的正常眼),在假手术前(第0天)与假手术后(第1、3、5及7天)的ERG的b波率之间并无显著差异。
CJDHW对HE染色的各种视网膜层的厚度的影响
图2A至2J及表2显示4组来自相似偏心度(从视盘偏1mm)的视网膜切片(数量为),其中可看出当与假手术的视网膜相比(假手术后第1天(sham 1day):整个视网膜:174.0±1.66μm,内核层(INL):40.08±1.43μm,内丛层(IPL):41.29±1.01μm(图2A及2E);假手术后第7天(sham 7day):整个视网膜:180.25±1.77μm,INL:38.10±0.57μm,IPL:38.38±0.58μm(图2F及2J)),先给予媒剂(Vehicle)的缺血再灌注1和7天(I/R 1day+Vehicle(图2B及2E)对I/R 7day+Vehicle(图2G及2J))的INL(33.13±1.44μm对24.74±1.61μm)、IPL(36.06±0.76μm对20.34±0.80μm)及整个视网膜(162.42±2.98μm对141.02±4.24μm)的厚度均显著变薄(*p<0.05;**p<0.01)。以CJDHW剂量依赖性的动物处理(于2.8g/kg/天有些微的影响;I/R 1day+CJDHW 2.8的整个视网膜:165.95±4.40μm,INL:37.52±1.05μm,IPL:37.1 6±2.28μm(图2C及2E);I/R 7day+CJDHW2.8的整个视网膜:156.18±3.96μm,INL:29.23±2.71μm,IPL:26.20±1.80μm(图2H及2J))显著(在4.2g/kg/天)抵消缺血再灌注的效果(I/R 1day+CJDHW 4.2的整个视网膜:172.25±2.51μm,INL:38.99±1.85μm,IPL:39.14±0.92μm(图2D及2E);I/R 7day+CJDHW 4.2的整个视网膜:171.78±5.19μm,INL:34.45±2.01μm,IPL:33.53±0.92μm(图2I及2J))。遭受视网膜缺血及接收不同界定试剂的眼睛的各种分层的厚度的定量分析示于图2E及2J。在缺血后的第7天,相比于假手术组(sham:76.48±0.70μm),缺血明显减少内视网膜层的厚度(INL+IPL:45.08±1.28μm)。这显著减少的量可被CJDHW以剂量反应形式显著性地降低(2.8g/kg/天:55.43±3.81μm;4.2g/kg/天:67.98±2.74μm,未示于图中)。
表2、苏木素-伊红染色
§与对照组的视网膜相比(假手术后第1或7天(sham 1day,数量为8;sham 7day,数量为6)),先给予媒剂的视网膜缺血再灌注1或7天(I/R1day+Vehicle,数量为4;I/R 1day+Vehicle,数量为5)的整个视网膜、INL及IPL的厚度有显著下降(*p<0.05;**p<0.01)。相反地,以CJHDW先处理会以剂量依赖性形式(在2.8g/kg/天有些微功效,I/R+CJDHW 2.8,数量为4)及显著抑制这种显著下降的情况(I/R+CJDHW 2.8;I/R+CJDHW 4.2,数量为4)。结果以平均值±SEM表示(μm)。CJDHW 4.2:4.2g/kg/天的CJDHW;INL:内核层;IPL:内丛层。
CJDHW对ChAT免疫标记的影响
在图3A至3J和表3(数量=6)中,在假手术后第1及7天(对照组:图3A及3E;图3F及3J),在内核层(inner nuclear layer;INL)和神经节细胞层(ganglion cell layer;GCL)上,胆碱乙酰基转移酶(ChAT)免疫标记(以红色表示)与无轴突细胞体(amacrine cell body)(以短箭头表示)有相关(假手术后1天(sham 1d):34.33±2.70个细胞/视野(图3A及3E);假手术后7天(sham 7d):36.83±2.73个细胞/视野(图3F及3J));此外,其如前所述,在内丛层(inner plexiform layer;IPL)中,其神经突起以2阶层图像(2-strata picture)呈现(以长箭头表示)(Chao HM,Chen IL,Liu JH:S-allyl L-cysteine protects the retina against kainate excitotoxicity in the rat.Am J Chin Med.2014,42(3):693-708)。在经历先给予媒剂的缺血视网膜上,且在视网膜缺血再灌注1和7天后,无轴突细胞体的免疫标记几乎不存在(I/R 1d+Vehicel:12.67±1.15个细胞/视野(图3B及3E);I/R 7d+Vehicel:13.17±1.66个细胞/视野(图3G及3J)。此外,IPL的免疫反应急剧下降。最重要的是,当先给予低剂量(2.8g/kg/天)或高剂量(4.2g/kg/天)的CJDHW时,会呈现剂量反应形式使I/R的作用显著衰减(I/R 1d+CJDHW 2.8g/kg/天:28.33±0.88个细胞/视野(图3C及3E);I/R 7d+CJDHW 2.8g/kg/天:23.50±1.41个细胞/视野(图3H及3J);I/R 1d+CJDHW 4.2g/kg/天:31.67±1.59个细胞/视野(图3D及3E);I/R 7d+CJDHW 4.2g/kg/天:28.50±1.88个细胞/视野(图3I及3J))。
表3、胆碱乙酰基转移酶(ChAT)免疫标记
§与对照组的视网膜相比(假手术(sham)后第1或7天),先给予媒剂的视网膜缺血再灌注(I/R 1day+Vehicle)1或7天的内核层及神经节细胞层中每个视野下ChAT免疫标记的无轴突细胞数量显著降低(*p<0.05)。与此相反,藉由以CJHDW先处理会以剂量依赖性形式(在2.8g/kg/天有些微功效,I/R+CJDHW 2.8)及显著抑制这种显著下降的情况(I/R+CJDHW 2.8;I/R+CJDHW 4.2)。结果以平均值±SEM表示(μm;数量为6)。CJDHW 4.2:4.2g/kg/天的CJDHW;INL:内核层;IPL:内丛层。
CJHDW对中间丝蛋白或GFAP免疫反应性的影响
如图4A至4R所示,假手术后第1和7天(对照组:sham 1d(图4B);sham 7d(图4K)),米勒细胞(cell)的突起的中间丝蛋白(vimentin)免疫标记从末支(end foot)延伸至内丛层(IPL)以及进入内核层(INL)和外核层(outer nuclear layer;ONL),其如前所述(Chao HM,Chen IL,Liu JH:S-allyl L-cysteine protects the retina against kainate excitotoxicity in the rat.Am J Chin Med.2014,42(3):693-708)。先给予媒剂的I/R后第1及7天,抗中间丝蛋白的免疫标记增强(I/R 1d+Vehicle(图4C);I/R 7d+Vehicle(图4L))。然而,先给予低剂量(I/R 1d+CJDHW 2.8g/kg/天(图4D);I/R 7d+CJDHW2.8g/kg/天(图4M))或高剂量(I/R 1d+CJDHW 4.2g/kg/天(图4E);I/R 7d+CJDHW 4.2g/kg/天(图4N))的CJDHW可减缓缺血造成的影响。利用4,6-二脒基-2-苯基吲哚-二氢化氯(DAPI)(以蓝色呈现(图4A及4J))对正常对照组的细胞核进行免疫染色。
当与对照组的视网膜(sham 1d(图4F);sham 7D(图4O))相比时,已先给予媒剂(Vehicle)的视网膜缺血后第1及7天,其抗胶质原纤维酸性蛋白(GFAP)免疫反应性也增强(I/R 1d+Vehicle(图4G);I/R 7d+Vehicle(图4P))。藉由先给予低剂量(I/R 1d+CJDHW 2.8g/kg/天(图4H);I/R 7d+CJDHW 2.8g/kg/天(图4Q))或高剂量(I/R 1d+CJDHW 4.2g/kg/天(图4I);I/R 7d+CJDHW 4.2g/kg/天(图4R))的CJDHW可使这种增强失效。
CJDHW对RGC层中凋亡细胞的出现的影响
在表4中(数量为5),和假手术后第1及7天的对照组的视网膜相反(sham 1d和sham 7d:无TUNEL阳性细胞),先给予媒剂的缺血后第1及7天的视网膜在视网膜神经节细胞(RGC)层上有明显较多的TUNEL阳性细胞出现(I/R+Vehicel第1天:1.40±0.25个细胞/视野;第7天:1.4±0.24个细胞/视野)(**p<0.01)。当已先给予低剂量或高剂量的CJDHW的缺血后第1及7天会呈现剂量反应形式且显著地减缓这种增加(于2.8g/kg/天时具有较少影响;于I/R+CJDHW 2.8第1天:0.80±0.20个细胞/视野;第7天:0.80±0.37个细胞/视野)(I/R+CJDHW4.2第1天:0.40±0.25个细胞/视野;第7天:0.60±0.24个细胞/视野;)。
表4、TUNEL(末端脱氧核苷酸转移酶调介脱氧尿苷三磷酸切口末端标记)
视网膜神经节细胞逆行的荧光金免疫标记
在图5和表5(数量为3),在假手术(sham)后第1和7天的视网膜神经节细胞(RGC)的密度为1952.16±72.33(sham 1d)和1737.23±87.72个细胞/平方毫米(mm2)(sham 7d)。相比之下,先给予媒剂的视网膜缺血后第1和7天,其RGC的密度明显降低至929.01±77.94(I/R1d+Vehicel)和887.73±91.32(I/R 7d+Vehicel)。这种降低会以剂量反应的方式被减缓(对于2.8g/kg/天时具有较少的影响;I/R 1d+CJDHW 2.8:1112.65±94.74个细胞/平方毫米;I/R 7d+CJDHW2.8:941.89±22.47个细胞/平方毫米)。当给予高剂量的CJDHW时,这种减缓会更明显(I/R+1d CJDHW 4.2g/kg/天:1691.36±137.16;I/R 7d+CJDHW 4.2g/kg/天:1389.02±30.72)。
表5、荧光金免疫标记
N:细胞数量
CJDHW对Thy-1及MMP-9的视网膜的mRNA浓度的影响
如图6和表6所示(Thy-1:数量为5;MMP-9:数量为),在与对照组的假手术的视网膜相比,在视网膜缺血24小时后,先给予媒剂的缺血性视网膜的Thy-1和MMP-9的比率明显改变(**p<0.01)。和先给予媒剂的缺血性视网膜相比,经历先给予CJDHW的缺血性视网膜呈现相关剂量反应形式(对于2.8g/kg/天时有些微效果)且明显地使MMP-9的过量表达无效(4.2g/kg/天;p<0.05)并减弱Thy-1的抑制表达(4.2g/kg/天;p<0.05)。
表6、Thy-1或MMP-9相对于β-肌动蛋白的mRNA浓度比率
CJDHW对活体内视网膜蛋白(即相对于β-肌动蛋白的蛋白表达量的
Bcl-2、HO-1、P-p38MAPK及MMP-9)的蛋白表达量的影响
如图7和表7所示(Bcl-2的数量为HO-1的数量为4;P-p38的数量为MMP-9数量为5),与对照组的假手术的视网膜相反(在假手术后24小时),先给予媒剂(vehicle)的视网膜缺血再灌注24小时出现B细胞淋巴瘤-2(B-cell lymphoma 2;Bcl-2)的比率显著下降的情况(*p<0.05),或第一型血红素氧化酶(heme oxygenase-1;HO-1)、磷酸化p38(P-p38)和基质金属蛋白酶9(MMP-9)的比率显著增加(*p<0.05或**p<0.01)。相反的,在先给予CJHDW及/或SB203580(p38MAPK抑制剂)后,这些显著的变化会以呈现剂量反应形式(对于CJDHW 2.8时有些微效果),并显著改变(I/R+CJDHW2.8或I/R+CJDHW 4.2,I/R+SB203580,或),以及进一步的显著增加HO-1的蛋白表达量(I/R+CJDHW4.2,)。尽管有上述的变化,和各界定的组别交叉比对后,在视网膜上的总p38蛋白的表达量保持不变(未显示数据)。
表7、Bcl-2、HO-1、P-p38或MMP-9相对于β-肌动蛋白的蛋白浓度比率(免疫印迹法)
当藉由酶谱(zymography)检测在视网膜中MMP-9的活性(图8及表8;数量为),与假手术的对照组的视网膜(假手术;sham)(假手术后24小时)相反,先以媒剂(DMSO)处理的缺血性视网膜(I/R+媒剂(I/R+vehicle))在缺血后24小时的MMP-9反应明显增强(**p<0.01)。然而,相对于先给予媒剂的缺血性视网膜,先给予CJDHW或SB203580(p38MAPK抑制剂)的缺血性视网膜证明一相关的剂量反应形式(于2.8g/kg/天CJDHW有些微影响)且显著缓解MMP-9活性的增加(I/R+CJDHW 4.2和I/R+SB203580,)。
表8、MMP-9相对于β-肌动蛋白的蛋白浓度比率(凝胶酶谱)
一个本领域技术人员能很快体会到本发明可很容易达成目标,并获得所提到的结果及优点,以及那些存在于其中的东西。本发明中的方法是较佳实施例的代表,其为示范性且不仅局限于本发明领域。本领域技术人员将会想到其中可修改之处及其他用途。这些修改都蕴含在本发明的精神中,并在权利要求书中界定。
本发明的内容叙述与实施例均揭示详细,得使任何本领域技术人员能够制造及使用本发明,即使其中有各种不同的改变、修饰、及进步之处,仍应视为不脱离本发明的精神及范围。
说明书中提及的所有专利及出版品,都以和发明有关领域的一般技术为准。所有专利和出版品都在此被纳入相同的参考程度,就如同每一个个别出版品都被具体且个别地指出纳入参考。
在此所适当地举例说明的发明,可能得以在缺乏任何要件,或许多要件、限制条件或并非特定为本文中所揭示的限制情况下实施。所使用的名词及表达是作为说明书的描述而非限制,同时并无意图使用这类排除任何等同于所示及说明的特点或其部份的名词及表达,但需认清的是,在本发明的权利要求范围内有可能出现各种不同的改变。因此,应了解到虽然已根据较佳实施例及任意的特点来具体揭示本发明,但是本领域技术人员仍会修改和改变其中所揭示的内容,诸如此类的修改和变化仍在本发明的权利要求范围内。
SEQUENCE LISTING
<110> 赵效明
<120> 杞菊地黄丸的使用于视网膜缺血及其相关疾病、病况或病状的治疗
<130> 16612CN
<160> 6
<170> PatentIn version 3.5
<210> 1
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> beta-Actin正向引物.
<220>
<221> 引物结合
<222> (1)..(20)
<400> 1
agggaaatcg tgcgtgacat 20
<210> 2
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> beta-Actin反向引物.
<220>
<221> 引物结合
<222> (1)..(20)
<400> 2
gaaccgctca ttgccgatag 20
<210> 3
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> Thy-1正向引物.
<220>
<221> 引物结合
<222> (1)..(20)
<400> 3
accaaggatg agggcgacta 20
<210> 4
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> Thy-1反向引物.
<220>
<221> 引物结合
<222> (1)..(21)
<400> 4
caggcttatg ccaccacact t 21
<210> 5
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> MMP-9正向引物.
<220>
<221> 引物结合
<222> (1)..(20)
<400> 5
tgcgctgggc ttagatcatt 20
<210> 6
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> MMP-9反向引物.
<220>
<221> 引物结合
<222> (1)..(23)
<400> 6
tggatgcctt ttatgtcgtc ttc 23
- 还没有人留言评论。精彩留言会获得点赞!