一种仿生人工骨支架及其制备方法与流程
本发明属于组织工程技术领域,具体涉及一种仿生人工骨支架及其制备方法。
背景技术:
全世界每年骨缺损患者数以千万计,使得骨修复支架材料成为临床上需求量最大的生物医用材料之一。长期以来,研制和开发理想的人工骨支架来治疗骨缺损一直是科学工作者们的热点研究课题。
目前临床上使用的人工骨修复材料,有以金属、陶瓷或高分子制造的不同类型,它们在生物活性、生物相容性、生物可降解性、力学性能和使用寿命等方面具有各自的优缺点。然而,现有人工骨支架普遍存在的问题是,虽然种植体与骨界面可形成一定的骨性结合,但由于新骨生长受局部微环境的限制,爬行替代缓慢,在治疗大范围骨缺损时,成骨仅限于植体边缘区域,难以实现支架与骨的整合以及缺损区的完整修复和重建。
研究证实,即使支架材料具有较高孔隙率和孔间贯通性,受植区的成骨量也十分有限,新骨组织长入材料的深度至多能达到其表面孔径的10倍。(Davies JE,et al.Topographic scale-range synergy at the functional bone/implant interface.Biomaterials 2014(35):25-35)对于生物可降解性材料而言,如果材料与宿主骨不能完全融合,其内部累积的降解产物难以参与人体正常生理代谢,容易出现无菌性炎症而导致手术失败。
骨缺损修复和再生需要适宜的外界微环境,如果材料的内部框架结构不能模拟自然骨细胞外基质形成的网络结构,不利于细胞相互之间的联系及信息传递,参与骨修复的细胞生长和迁移受限,难以实现骨整合。要从根本上解决植入体与宿主骨组织的整合问题,需通过调控支架材料的构成组分和微观结构来优化其性能。从材料学的角度看,自然骨是一种从纳米尺度到宏观水平分级排列精密构建的胶原纤维-磷灰石复合生物材料。骨组织中的基本结构单元—骨单位(Osteons)由同心圆排列的哈佛骨板(Haversian lamella)构成,直径为100~500μm,中央管内为血管神经,外围骨板中的胶原纤维呈螺旋状走行,相邻骨板的纤维方向互成直角,骨细胞取向分布于矿化的三维网络矩阵中。自然状态的骨微环境为细胞生长提供了极为有利的条件,均衡的营养和物质能量交换,促进了细胞增殖和细胞外基质的分泌。在体外如何构建这一微环境,实际上要解决纳米纤维从构成组分到形貌尺寸、表面纹理、取向度及精密空间排布的协同调控,以利于不同细胞的粘附和长期生长,使支架、细胞和外基质形成一个有机的结合体并最终形成功能化组织。
静电纺丝制备的纤维直径与细胞外基质中的微丝相当,加之彼此连通的微小孔隙结构,能够很好地模拟天然细胞外基质结构,为细胞生长提供理想微环境,通过改变静电纺丝供液和接收装置的形式,还可得到具有特殊取向结构的纳米纤维,以满足不同的细胞生长需求。美国Clemson大学生物工程研究院设计了一种新型静电纺丝收集装置,采用两条平行传送带接收纳米纤维。这种装置能控制纳米纤维取向排列并避免其相互粘连,得到稀疏层叠排列的三维支架,使细胞较好地粘附并穿透纤维支架内部生长。但该方法制备的纳米纤维支架力学强度欠佳,限制了其在人工骨替代材料方面的应用。(Beachley V,et al.A novel method to precisely assemble loose nanofiber structures for regenerative medicine applications.Adv.Healthc.Mater.2013(2):343-51)近期上海东华大学联合美国Cornell大学报道了一种各向异性的编织型纳米纤维支架,通过对两组供液针头施加相反的电压,以使带相反电荷的聚合物溶液喷射流(各自从针头拉出)向中间区域聚集,再结合电子提花和环锭捻线工艺构建出不同花纹的纳米纤维平面编织网络结构。将人主动脉瓣间质细胞(HAVIC)和人主动脉根部平滑肌细胞(HASMC)包封在水凝胶/编织型纳米纤维复合材料中,构成了类心脏瓣膜细胞外基质的微环境并显示出各向异性的生物力学特性。这种支架具有优异的力学性能,但其微观结构与骨单位中胶原纤维的螺旋取向空间排布还有较大差异,不适用于骨组织缺损的修复重建。(Wu S,et al.Fabrication of aligned nanofiberpolymer yarn networks for anisotropic soft tissue scaffolds.ACS Appl.Mater.Interfaces 2016(8):16950-60)迄今为止,尚未见以静电纺纳米纤维按照分层交错螺旋的方式构建仿生人工骨支架用于骨缺损修复治疗的文献报道。
技术实现要素:
有鉴于此,本发明的目的在于:(1)提供一种仿生人工骨支架的制备方法;(2)提供一种仿生人工骨支架。
为达到上述目的,本发明提供如下技术方案:
1、一种仿生人工骨支架的制备方法,包括如下步骤:
(1)将I型胶原和生物可降解高分子溶于溶剂中,制得材料溶液A;
(2)将纳米羟基磷灰石加入步骤(1)中制得的溶液A中,制得材料溶液B;
(3)利用静电纺丝法以步骤(1)中材料溶液A为原料纺制支架的中心通道层,再以步骤(2)中材料溶液B为原料在制得的中心通道层上纺制支架的外围柱体层。
进一步,步骤(1)中,所述I型胶原和生物可降解高分子的质量比为99~50:1~50。
进一步,步骤(1)中,所述生物可降解高分子为壳聚糖、透明质酸、海藻酸钠、聚氧化乙烯、聚丙交酯-乙交酯、聚乙烯醇、聚己内酯或聚乳酸中的一种或多种。
进一步,步骤(1)中,所述溶剂为水、乙酸、六氟异丙醇、四氢呋喃、二甲基甲酰胺、二甲基亚砜中的一种或多种。
进一步,步骤(1)中,所述材料溶液A还包含VEGF、b-FGF、Ang-1,2、TGF-β或EGF中的一种或多种,在所述材料溶液A中的质量分数为0.00001~0.01%。
进一步,步骤(2)中,所述材料溶液B还包含BMP-2,7、OGP、PDGF、TGF-β、SGF或IGF-1,2中的一种或多种,在所述材料溶液B中的质量分数为0.00001~0.01%。
进一步,步骤(2)中,所述材料溶液B中纳米羟基磷灰石的质量分数为10~80%;所述纳米羟基磷灰石由钙盐和磷酸或钙盐和磷酸盐按钙/磷摩尔配比1.67:1在pH为10~14条件下反应合成;所述钙盐为Ca(NO3)2、CaCl2、Ca(OH)2、Ca(CH3COO)2或CaCO3中的一种;所述磷酸盐为(NH4)2HPO4、NH4H2PO4、Na3PO4、Na2HPO4或NaH2PO4中的一种。
进一步,步骤(3)中,所述支架的中心通道层和外围柱体层具体由以下方法制得:
1)将所述材料溶液A和材料溶液B分别注入推注器至各推注器内无空气;
2)利用静电纺丝法,首先将步骤1)中的推注器安装在静电纺丝装置中平移装置的移动滑块上,调整推进挡板位置,设置静电纺丝参数,然后推注所述材料溶液A,调整电压至推注器喷头液滴形成稳定喷射流,推注过程中所述移动滑块始终保持同向移动,待接收装置上形成所述中心通道层后,开始推注所述材料溶液B,同时停止推注所述材料溶液A,此推注过程中所述移动滑块移动方向交替变换,最终形成所述支架外围柱体层。
进一步,步骤2)中,所述静电纺丝参数具体为:温度20~60℃,湿度40~80%,所述推注器喷头与接收装置之间电势差为5~20V,电极间距10~20cm,推注速度0.01~0.60mm/min,平移速度0~500mm/min,平移行程0~100mm,接收装置转速1000~3000rpm。
2、由所述的一种仿生人工骨支架的制备方法制得的仿生人工骨支架,其特征在于,所述仿生人工骨支架包括中心通道层和套设在所述中心通道层上的外围柱体层;所述中心通道层和外围柱体层均由若干个纳米纤维层同轴设置,所述中心通道层中的相邻两个所述纳米纤维层的纤维螺旋方向相同;所述外围柱体层中的相邻两个所述纳米纤维层的纤维螺旋方向相反;所述纳米纤维层由纤维沿其轴向螺旋排列组成。
进一步,所述纳米纤维层中纤维直径为10~800nm,纤维间孔径为0.01~100μm。
进一步,其特征在于,所述支架的高度为0.1~10cm;所述纳米纤维层的厚度为1~100μm;所述中心通道层的厚度为1~500μm;所述外围柱体层的厚度为10μm~25mm。
本发明的有益效果在于:本发明提供一种仿生人工骨支架及其制备方法,所述方法操作简便,条件温和易控,使用原料来源广泛,运用静电纺丝制备装置,通过装置中的微型杆状收集装置,联合辅助电极和平移装置,并通过对温度、湿度、电压、电极间距、推注速度、接收转速等参数设置,可协同调控纳米纤维层中纤维的空间排列方式,排列的角度和间隙可根据实际应用需求进行灵活调控,构建出精致模拟骨单位结构的中空圆柱状、具有中心通道层和套设在所述中心通道层上的外围柱体层的仿生人工骨支架,其中,所述中心通道层中的相邻两个所述纳米纤维层的纤维螺旋方向相同;所述外围柱体层中的相邻两个所述纳米纤维层的纤维螺旋方向相反,这种纳米纤维交错取向能够极大地增强支架的结构稳定性,为骨缺损部位提供有效的力学支撑,实现缺损位与正常骨组织间的力学传递,交错取向的纳米纤维构成互通的特殊网络结构,既能保持孔隙的贯通性,有利于细胞渗透生长及血管和神经长入,也便于营养物质传递和细胞代谢废物排出。同时,在支架中分层添加不同生长因子可为种子细胞BMSCs提供差异化诱导环境,仿生构建出中心通道层血管化组织、外围柱体层骨组织的人工骨支架,能够增强人工骨材料修复骨缺损的能力,为大范围骨缺损修复提供有效的治疗策略,且该支架在体内可吸收降解,其降解产物无毒副作用,生物安全性高,在生物医学材料及组织工程领域中具有理想的推广和应用价值。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
图1为仿生人工骨支架的结构示意图;
图2为仿生人工骨支架的制备装置示意图;
图3为实施例4仿生人工骨支架的实物图;
图4为实施例4仿生人工骨支架中纳米纤维层的扫描电镜图和偏角分布分析图;
图5为实施例4中细胞沿着仿生人工骨支架取向生长的荧光显微镜图。
其中,图1中A为仿生人工骨支架示意图,a为支架的中心通道层,b为支架的外围柱体层;B为多个仿生人工骨支架平行并列组装形成的类哈佛系统组合式结构体;C为中心通道层上BMSCs向血管内皮细胞分化示意图;D为外围柱体层上BMSCs向成骨细胞分化示意图;
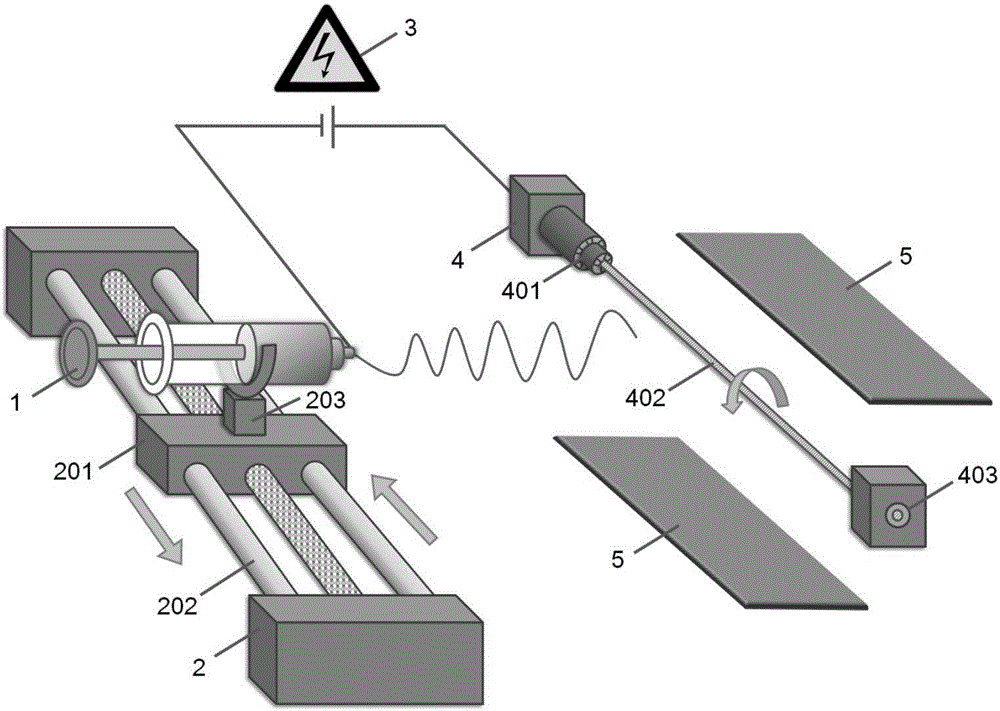
图2中,仿生人工骨支架的制备装置包括推注器1、平移装置2、移动滑块201、导轨202、加紧装置203、高压电源3、收集装置4、固定夹401、接收杆402、导向器403和辅助电极5;
图4中,A图为中心通道层中纳米纤维层的扫描电镜图;B图为中心通道层中纳米纤维层的偏角分布分析图;C图为外围柱体层中纳米纤维层的扫描电镜图;D图为外围柱体层中纳米纤维层的偏角分布分析图;
图5中,A图为鬼笔环肽荧光染色图,B图为DAPI染色图,C图为Merge合成图。
具体实施方式
下面将结合附图,对本发明的优选实施例进行详细的描述。
采用如图2所示的制备装置制备仿生人工骨支架。
实施例1
(1)将I型胶原与生物可降解高分子按质量比99:1溶于六氟异丙醇和二甲基甲酰胺的复合溶剂中(六氟异丙醇与二甲基甲酰胺的体积比为2:1)中,并加入细胞生长因子,制得材料溶液A,其中,可降解高分子为聚丙交酯-乙交酯;细胞生长因子为VEGF和b-FGF,在材料溶液A中的质量分数分别为0.001%和0.00001%;
(2)将纳米羟基磷灰石(n-HA)加入步骤(1)中制得的I型胶原/聚丙交酯-乙交酯混合溶液中,并加入细胞生长因子,制得材料溶液B,其中,n-HA由Ca(OH)2和磷酸按钙/磷摩尔配比1.67:1在pH为10的条件下反应合成,在材料溶液B中的质量分数为20%;细胞生长因子为BMP-7和OGP,在材料溶液B中的质量分数分别为0.005%和0.00002%;
(3)利用静电纺丝法以步骤(1)中材料溶液A为原料纺制支架的中心通道层,再以步骤(2)中材料溶液B为原料在制得的中心通道层上纺制支架的外围柱体层,具体步骤如下:
1)将所述材料溶液A和材料溶液B分别注入推注器至各推注器内无空气;
2)利用静电纺丝法,首先将步骤1)中的推注器安装在静电纺丝装置中的进样泵上,调整推进挡板位置,选用直径0.1mm,长度2cm的微型接收杆为接收器,制备中心通道层时静电纺丝参数设置为:温度50℃,湿度60%,所述推注器喷头与接收装置之间电势差为5V,电极间距10cm,推注速度0.01mm/min,平移速度0mm/min,平移行程0mm,接收装置转速1000rpm,制备外围柱体层时静电纺丝参数设置为:温度50℃,湿度60%,所述推注器喷头与接收装置之间电势差为7V,电极间距10cm,推注速度0.01mm/min,平移速度200mm/min,平移行程10mm,接收装置转速1800rpm,然后推注所述材料溶液A,调整电压至推注器喷头液滴形成稳定喷射流,推注过程中固定有推注器的移动滑块位于平移装置中部且保持不动,待接收装置上形成厚度为1μm的中心通道层后,开始推注所述材料溶液B,同时停止推注所述材料溶液A,此推注过程中固定有推注器的移动滑块的移动方向交替变换,具体移动方式为:所述移动滑块由平移装置中心向一个方向移动后返回中心位置,再往另一个方向移动后再次返回中心位置,如此往复运动,最终形成厚度为10μm的支架外围柱体层,制得的人工支架高度为2cm。
(4)将制得的仿生人工支架从接收杆上取下,用75%乙醇或环氧乙烷灭菌后浸泡于培养基中,按照5×104个/mL的细胞密度接种BMSCs,采用细胞转瓶培养系统进行体外培养,促使细胞沿纳米纤维框架网孔渗透生长和定向分化,最后将长有细胞的支架植入骨缺损处用以引导新骨再生重建。
实施例2
(1)将I型胶原与生物可降解高分子按质量比80:20溶于质量分数为3%的乙酸溶液中,并加入细胞生长因子,制得材料溶液A,其中,可降解高分子为壳聚糖和透明质酸的混合物(壳聚糖和透明质酸的质量比为7:3);细胞生长因子为VEGF、Ang-1和Ang-2,在材料溶液A中的质量分数分别为0.001%、0.0001%和0.0001%;
(2)将纳米羟基磷灰石(n-HA)加入步骤(1)中制得的I型胶原/壳聚糖/透明质酸混合溶液中,并加入细胞生长因子,制得材料溶液B,其中,n-HA由Ca(NO3)2和(NH4)2HPO4按钙/磷摩尔配比1.67:1在pH为11的条件下反应合成,在材料溶液B中的质量分数为60%;细胞生长因子为BMP-2和TGF-β,在材料溶液B中的质量分数分别为0.003%和0.0001%;
(3)利用静电纺丝法以步骤(1)中材料溶液A为原料纺制支架的中心通道层,再以步骤(2)中材料溶液B为原料在制得的中心通道层上纺制支架的外围柱体层,具体步骤如下:
1)将所述材料溶液A和材料溶液B分别注入推注器至各推注器内无空气;
2)利用静电纺丝法,首先将步骤1)中的推注器安装在静电纺丝装置中的进样泵上,调整推进挡板位置,选用直径0.3mm,长度5cm的微型接收杆为接收器,制备中心通道层时静电纺丝参数设置为:温度30℃,湿度70%,所述推注器喷头与接收装置之间电势差为8V,电极间距14cm,推注速度0.1mm/min,平移速度4mm/min,平移行程50mm,接收装置转速1500rpm,制备外围柱体层时静电纺丝参数设置为:温度30℃,湿度70%,所述推注器喷头与接收装置之间电势差为10V,电极间距14cm,推注速度0.1mm/min,平移速度300mm/min,平移行程25mm,接收装置转速2200rpm,然后推注所述材料溶液A,调整电压至推注器喷头液滴形成稳定喷射流,推注过程中固定有推注器的移动滑块位于平移装置一端,且始终保持同向移动,待接收装置上形成厚度为50μm的中心通道层后,开始推注所述材料溶液B,同时停止推注所述材料溶液A,此推注过程中固定有推注器的移动滑块位于平移装置的中心,且移动方向交替变换,具体移动方式为:所述移动滑块由平移装置中心向一个方向移动后返回中心位置,再往另一个方向移动后再次返回中心位置,如此往复运动,最终形成厚度为1mm的支架外围柱体层,制得的人工支架高度为5cm。
(4)将制得的仿生人工支架从接收杆上取下,用75%乙醇或环氧乙烷灭菌后浸泡于培养基中,按照5×104个/mL的细胞密度接种BMSCs,采用细胞转瓶培养系统进行体外培养,促使细胞沿纳米纤维框架网孔渗透生长和定向分化,最后将长有细胞的支架植入骨缺损处用以引导新骨再生重建。
实施例3
(1)将I型胶原与生物可降解高分子按质量比70:30溶于二甲基亚砜中,并加入细胞生长因子,制得材料溶液A,其中,可降解高分子为聚乳酸和聚乙烯醇的混合物(聚乳酸和聚乙烯醇的质量比为1:1);细胞生长因子为VEGF、TGF-β和b-FGF,在材料溶液A中的质量分数分别为0.002%、0.002%和0.001%;
(2)将纳米羟基磷灰石(n-HA)加入步骤(1)中制得的I型胶原/聚乳酸/聚乙烯醇混合溶液中,并加入细胞生长因子,制得材料溶液B,其中,n-HA由CaCl2和Na3PO4按钙/磷摩尔配比1.67:1在pH为12的条件下反应合成,在材料溶液B中的质量分数为40%;细胞生长因子为BMP-7和PDGF的混合物,在材料溶液B中的质量分数分别为0.004%和0.001%;
(3)利用静电纺丝法以步骤(1)中材料溶液A为原料纺制支架的中心通道层,再以步骤(2)中材料溶液B为原料在制得的中心通道层上纺制支架的外围柱体层,具体步骤如下:
1)将所述材料溶液A和材料溶液B分别注入推注器至各推注器内无空气;
2)利用静电纺丝法,首先将步骤1)中的推注器安装在静电纺丝装置中的进样泵上,调整推进挡板位置,选用直径6.0mm,长度8cm的微型接收杆为接收器,制备中心通道层时静电纺丝参数设置为:温度40℃,湿度80%,所述推注器喷头与接收装置之间电势差为15V,电极间距16cm,推注速度0.4mm/min,平移速度8mm/min,平移行程80mm,接收装置转速1800rpm,制备外围柱体层时静电纺丝参数设置为:温度40℃,湿度80%,所述推注器喷头与接收装置之间电势差为17V,电极间距16cm,推注速度0.4mm/min,平移速度300mm/min,平移行程40mm,接收装置转速2400rpm,然后推注所述材料溶液A,调整电压至推注器喷头液滴形成稳定喷射流,推注过程中固定有推注器的移动滑块位于平移装置一端,且始终保持同向移动,待接收装置上形成厚度为100μm的中心通道层后,开始推注所述材料溶液B,同时停止推注所述材料溶液A,此推注过程中固定有推注器的移动滑块位于平移装置的中心,且移动方向交替变换,具体移动方式为:所述移动滑块由平移装置中心向一个方向移动后返回中心位置,再往另一个方向移动后再次返回中心位置,如此往复运动,最终形成厚度为10mm的支架外围柱体层,制得的人工支架高度为8cm。
(4)将制得的仿生人工支架从接收杆上取下,用75%乙醇或环氧乙烷灭菌后浸泡于培养基中,按照5×104个/mL的细胞密度接种BMSCs,采用细胞转瓶培养系统进行体外培养,促使细胞沿纳米纤维框架网孔渗透生长和定向分化,最后将长有细胞的支架植入骨缺损处用以引导新骨再生重建。
实施例4
(1)将I型胶原与生物可降解高分子按质量比60:40溶于四氢呋喃和二甲基甲酰胺的复合溶液中(四氢呋喃与二甲基甲酰胺的体积比为1:1)中,并加入细胞生长因子,制得材料溶液A,其中,可降解高分子为聚己内酯、聚丙交酯-乙交酯(聚己内酯与聚丙交酯-乙交酯质量比为1:2);细胞生长因子为VEGF,在材料溶液A中的质量分数为0.002%;
(2)将纳米羟基磷灰石(n-HA)加入步骤(1)中制得的I型胶原/聚己内酯/聚丙交酯-乙交酯混合溶液中,并加入细胞生长因子,制得材料溶液B,其中,n-HA由Ca(CH3COO)2和NaH2PO4按钙/磷摩尔配比1.67:1在pH为13的条件下反应合成,在材料溶液B中的质量分数为10%;细胞生长因子为BMP-2和PDGF,在材料溶液B中的质量分数分别为0.004%和0.002%;
(3)利用静电纺丝法以步骤(1)中材料溶液A为原料纺制支架的中心通道层,再以步骤(2)中材料溶液B为原料在制得的中心通道层上纺制支架的外围柱体层,具体步骤如下:
1)将所述材料溶液A和材料溶液B分别注入推注器至各推注器内无空气;
2)利用静电纺丝法,首先将步骤1)中的推注器安装在静电纺丝装置中的进样泵上,调整推进挡板位置,选用直径0.5mm,长度2cm的微型接收杆为接收器,制备中心通道层时静电纺丝参数设置为:温度30℃,湿度40%,所述推注器喷头与接收装置之间电势差为13V,电极间距15cm,推注速度0.2mm/min,平移速度10mm/min,平移行程20mm,接收装置转速2000rpm,制备外围柱体层时静电纺丝参数设置为:温度30℃,湿度40%,所述推注器喷头与接收装置之间电势差为15V,电极间距15cm,推注速度0.2mm/min,平移速度240mm/min,平移行程10mm,接收装置转速2800rpm,然后推注所述材料溶液A,调整电压至推注器喷头液滴形成稳定喷射流,推注过程中固定有推注器的移动滑块位于平移装置一端,且始终保持同向移动,待接收装置上形成厚度为200μm的中心通道层后,开始推注所述材料溶液B,同时停止推注所述材料溶液A,此推注过程中固定有推注器的移动滑块位于平移装置的中心,且移动方向交替变换,具体移动方式为:所述移动滑块由平移装置中心向一个方向移动后返回中心位置,再往另一个方向移动后再次返回中心位置,如此往复运动,最终形成厚度为2.5mm的支架外围柱体层,制得的人工支架高度为2cm。
(4)将制得的仿生人工支架从接收杆上取下,用75%乙醇或环氧乙烷灭菌后浸泡于培养基中,按照5×104个/mL的细胞密度接种BMSCs,采用细胞转瓶培养系统进行体外培养,促使细胞沿纳米纤维框架网孔渗透生长和定向分化,最后将长有细胞的支架植入骨缺损处用以引导新骨再生重建。
实施例5
(1)将I型胶原与生物可降解高分子按质量比50:50溶于水中,并加入细胞生长因子,制得材料溶液A,其中,可降解高分子为海藻酸钠和聚氧化乙烯的混合物(海藻酸钠和聚氧化乙烯的质量比为4:1);细胞生长因子为VEGF和EGF,在材料溶液A中的质量分数分别为0.008%和0.002%;
(2)将纳米羟基磷灰石(n-HA)加入步骤(1)中制得的溶液A中,并加入细胞生长因子,制得材料溶液B,其中,n-HA由CaCO3和Na2HPO4按钙/磷摩尔配比1.67:1在pH为14的条件下反应合成,在材料溶液B中的质量分数为80%;细胞生长因子为SGF、IGF-1和IGF-2,在材料溶液B中的质量分数分别为0.005%、0.003%和0.002%;
(3)利用静电纺丝法以步骤(1)中材料溶液A为原料纺制支架的中心通道层,再以步骤(2)中材料溶液B为原料在制得的中心通道层上纺制支架的外围柱体层,具体步骤如下:
1)将所述材料溶液A和材料溶液B分别注入推注器至各推注器内无空气;
2)利用静电纺丝法,首先将步骤1)中的推注器安装在静电纺丝装置中的进样泵上,调整推进挡板位置,选用直径2.0mm,长度6cm的微型接收杆为接收器,制备中心通道层时静电纺丝参数设置为:温度40℃,湿度60%,所述推注器喷头与接收装置之间电势差为19V,电极间距20cm,推注速度0.6mm/min,平移速度12mm/min,平移行程60mm,接收装置转速2200rpm,制备外围柱体层时静电纺丝参数设置为:温度60℃,湿度90%,所述推注器喷头与接收装置之间电势差为20V,电极间距20cm,推注速度0.6mm/min,平移速度500mm/min,平移行程30mm,接收装置转速3000rpm,然后推注所述材料溶液A,调整电压至推注器喷头液滴形成稳定喷射流,推注过程中固定有推注器的移动滑块位于平移装置一端,且始终保持同向移动,待接收装置上形成500μm的中心通道层后,开始推注所述材料溶液B,同时停止推注所述材料溶液A,此推注过程中固定有推注器的移动滑块位于平移装置的中心,且移动方向交替变换,具体移动方式为:所述移动滑块由平移装置中心向一个方向移动后返回中心位置,再往另一个方向移动后再次返回中心位置,如此往复运动,最终形成25mm的支架外围柱体层,制得的人工支架高度为6cm。
(4)将制得的仿生人工支架从接收杆上取下,用75%乙醇或环氧乙烷灭菌后浸泡于培养基中,按照5×104个/mL的细胞密度接种BMSCs,采用细胞转瓶培养系统进行体外培养,促使细胞沿纳米纤维框架网孔渗透生长和定向分化,最后将长有细胞的支架植入骨缺损处用以引导新骨再生重建。
图1为仿生人工骨支架的结构示意图,由图1A可知,本发明中的仿生人工骨支架包括中心通道层a和套设在所述中心通道层上的外围柱体层b,所述中心通道层a和外围柱体层b均由若干个纳米纤维层同轴设置,所述中心通道层中的相邻两个所述纳米纤维层的纤维螺旋方向相同,所述外围柱体层中的相邻两个所述纳米纤维层的纤维螺旋方向相反;所述纳米纤维层由纤维沿其轴向螺旋排列组成,且多个人工仿生人工骨支架可平行并列组装形成类哈佛系统组合式结构体(如图1B所示);中心通道层上BMSCs沿着纳米纤维取向排列延伸,并向血管内皮细胞分化(如图1C所示),外围柱体层中不同层面的BMSCs沿着纤维粘附铺展并向成骨细胞分化,交错取向分布于支架的三维网络框架中(如图1D所示),构建出与天然骨相类似的微环境。
图2为仿生人工骨支架的制备装置示意图,包括推注器1、平移装置2、高压电源3、收集装置4和辅助电极5,所述平移装置2包括导轨202和设置在导轨上可沿导轨往复运动的移动滑块201,所述移动滑块201上设置有可固定推注器1的加紧装置203;所述高压电源3的一端与助推器1的喷嘴相连,另一端与收集装置4相连;所述收集装置4包括固定夹401、接收杆402和导向器403,所述固定夹401的孔径可调节,用于固定不同尺寸的接收杆402,并通过电机带动接收杆402沿轴心旋转运动,所述接收杆402的直径为0.1~8.0mm,长度为2~10cm,所述导向器403套设在接收杆402外围末端,用于控制接收杆402的方向,防止其在高速旋转时剧烈晃动,根据接收杆402的直径大小来选择与之匹配尺寸的导向器403;所述辅助电极5包含两个极板,所述收集装置4设置在所述两个极板之间。
图3为由实施例4中的方法制备得到的仿生人工骨支架的实物图。
图4中,A图和C图分别为仿生人工骨支架中心通道层和外围柱体层中纳米纤维层的扫描电镜图,由图4A可以看出,纳米纤维表面光滑,直径在200~300nm,孔径为0.8~2.2μm,图4C中的纳米纤维由于加入了羟基磷灰石成分,表面比图4A中的纳米纤维略为粗糙,其直径在240~360nm,孔径为0.8~3.0μm,两组纳米纤维的微观尺寸均匀,具有良好的分散性,呈取向排列。根据材料溶液成分和所选择溶剂的不同,以及静电纺丝条件参数(包括温度、湿度、电压、电极间距、推注速度、平移速度、接收装置转速等)的改变,纳米纤维支架的直径和孔径会随之发生变化,其直径范围为10~800nm,纤维间孔径范围为0.01~100μm;B图和D图分别为仿生人工骨支架中心通道层和外围柱体层中纳米纤维层的偏角分布分析图,由图4B可以看出,纤维取向分布主要集中在偏角为70°~110°,其中偏角分布在85°~90°的概率最高,由图4D可以看出,纤维取向分布主要集中在偏角为95°~135°,其中偏角分布在110°~115°的概率最高,两组数据均服从正态分布。
图5为实施例4中细胞沿着仿生人工骨支架取向生长的荧光显微镜图,由图5可见,细胞在纳米纤维上粘附良好并沿着纤维取向延伸,大部分细胞呈梭形铺展,延伸进入纤维间隙中,呈三维生长。由于纳米纤维的空间排列方式,可以影响细胞的粘附、迁移、增殖和分化行为,取向排列的仿生人工骨支架,能够引导细胞沿其三维网络框架结构取向生长,随着材料的降解和细胞外基质的堆积,细胞将会自组装出一种具有组织形态的构造体,有望实现材料与骨组织的整合以及缺损区的完整修复和重建。
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!