人参皂苷Rg1及PPT作为非经典炎症小体抑制剂的应用的制作方法
本发明涉及天然药物领域,具体涉及人参皂苷Rg1及其活性代谢产物原人参三醇PPT作为非经典炎症小体抑制剂的应用。
背景技术:
感染性休克亦称脓毒性休克是指由微生物及其毒素产物引起的脓毒病综合征伴休克。感染灶中的微生物及其毒素激活宿主的各种细胞和体液系统,产生细胞因子和内源性介质作用于机体的各种器官,导致器官功能障碍甚至衰竭。病原菌入侵机体释放出内毒素诱发感染性休克,细菌内毒素可通过激活炎症小体的第一信号使炎症因子的表达量增加;进入细胞的内毒素可以激活炎症小体的第二信号使caspase-11/4/5剪切活化从而使炎症因子的分泌量增加同时诱导细胞焦亡,细胞焦亡即细胞释放出大量的乳酸脱氢酶细胞毒性增加,从而细胞的死亡率增加。细胞焦亡本质上是一种程序性细胞坏死,细胞膜形成孔洞,细胞逐渐膨胀至细胞膜破裂,最终导致大量细胞内容物释放,激活剧烈的炎症反应。免疫细胞大量焦亡,免疫系统坍塌,造成多器官损伤,进而导致感染性休克。因此抑制细胞焦亡在感染性休克的治疗过程中具有重要意义。
参麦注射液的主要成分人参具有抗病毒、增强机体的免疫功能等多方面的作用。目前从人参中提取出的有效成分有皂苷糖类和蛋白质,人参皂苷为人参的主要有效成分之一。CN200710009171.0公开了人参皂苷Rg1治疗、预防阿尔茨海默病的用途;CN200810103061.5公开了人参皂苷Rg1、Rh1、ppt在抗认知、学习记忆功能障碍的用途;CN201110022884.7公开了人参皂苷Rg1在制备抗抑郁药物中的应用;CN201410751138.5公开了人参皂苷Rg1作为CCL2-CCR2信号通路抑制剂及中枢抗炎药物的应用;CN201410378683.4公开了人参皂苷Rg1预防或治疗心肌缺血的药物中的应用;CN201410565911.9公开了人参皂苷Rg1在制备治疗胆汁酸升高制剂中的应用;CN201410707438.3公开了原人参三醇在预防和改善代谢性疾病的作用;CN201610427621.7公开了胡椒碱在因感染而引起引起细胞焦亡和多脏器损伤药物的应用;CN200810228187.5公开了人参皂苷Re的抗休克作用;CN201410638185.9公开了一种治疗感染性休克并发多器官功能不全综合征的中药组合物。以上相关专利揭示了人参皂苷在抗炎、抗心血管及代谢相关疾病中的应用,以及其它药物通过抑制细胞焦亡保护组织器官在感染性疾病中的应用。人参皂苷Rg1及其活性代谢产物PPT抑制细胞焦亡,目前尚未见报道。本专利首次公开人参皂苷Rg1及其代谢产物PPT作为新型的非经典炎症小体通路中caspase11抑制剂抑制细胞焦亡的应用,及利用该机制将Rg1及PPT制备成为抗感染性休克药物的应用。
技术实现要素:
本发明旨在公开人参皂苷Rg1及其活性代谢产物PPT作为新型的非经典炎症小体通路中caspase11抑制剂抑制细胞焦亡的应用。所述的人参皂苷Rg1及其活性代谢产物PPT通过抑制caspase-11的剪切活化,增加细胞的存活率降低胞内LPS产生的细胞毒性,抑制细胞焦亡;所述的人参皂苷Rg1及其活性代谢产物PPT通过降低血清中IL-1β和谷丙转氨酶的释放量,提高感染性休克小鼠的存活率。
附图说明
图1:人参皂苷Rg1及原人参三醇PPT抑制LPS诱导的非经典炎症小体通路中caspase-11的剪切活化。
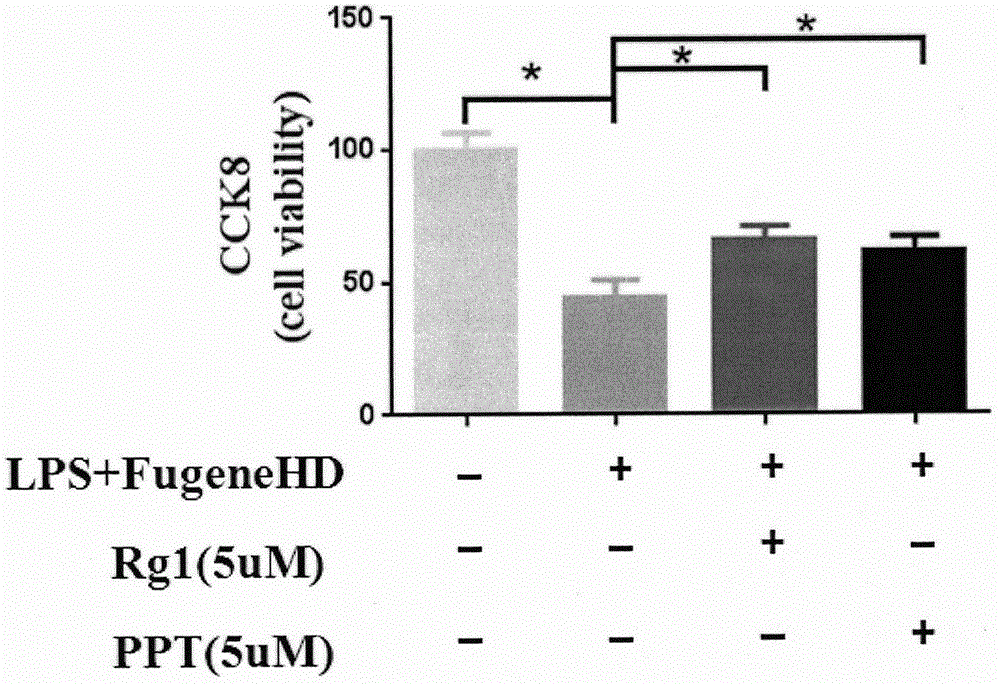
图2:人参皂苷单体Rg1及原人参三醇PPT能够显著降低LPS诱导的BMDMs细胞死亡率。
图3:人参皂苷单体Rg1及原人参三醇PPT能够显著降低LPS诱导的BMDMs细胞毒性。
图4:人参皂苷单体Rg1及其原人参三醇PPT能够显著降低感染性休克小鼠血清中IL-1b的分泌量。
图5:灌胃给予人参皂苷单体Rg1及原人参三醇PPT能够显著降低LPS诱导的感染性休克小鼠血清中谷丙转氨酶的量。
图6:灌胃给予人参皂苷单体Rg1及原人参三醇PPT能够显著增加LPS诱导的感染性休克小鼠的存活率。
具体实施方式
实施例1.Western Blot实验
实验材料:
C57BL/6雄性小鼠购自于上海斯莱克实验动物有限责任公司,室内保持温度(25℃)湿度(60%)恒定,保持自由饮水饮食,并保证12h昼/12h夜日照循环;LPS(Lipopolysaccharides from Escherichia coli0111:B4)100mg购于Sigma;转染试剂FugeneHD Transfection Reagent购于Promega;人参皂苷Rg1及原人参三醇PPT均购于吉林大学;生理盐水购于安徽双鹤药业有限公司;THP-1细胞购自上海细胞库,于37℃,5%CO2条件下常规培养,培养基为含10%小牛血清的1640(Gibco);胎牛血清(Fetal bovine serum)购于Hyclone(Logan,Utah,USA);胰蛋白酶(Trypsin)购于Amersco(Solon,Ohio,USA);CCK-8试剂盒(Cell Counting Kit-8)购于日本同仁化学研究所;小鼠IL-1βELISA试剂盒购自依科赛生物科技有限公司;乳酸脱氢酶细胞毒性检测试剂盒购自碧云天生物技术研究所;caspase-11抗体购自CellSignalingTechnology,Inc(CST)公司、GAPDH抗体购自Bioworld公司;RIPA细胞裂解液、BCA蛋白定量试剂盒购自碧云天生物技术研究所。
实验方法:
将C57BL/6雄性小鼠脱颈处死,于75%乙醇中浸泡消毒5min后去皮剪取后肢,将后肢浸泡于75%乙醇中消毒5min,剔除后肢肌肉组织,在关节处剪断腿骨,用含有1640培养基的注射器将腿骨内细胞冲出来收集到50mlEP管中,将提取的细胞400g离心5min,用含20%L929上清和10%小牛血清的1640培养基重悬细胞,将细胞按1.3*107/孔的密度点到10cm大皿中,三天后换一次培养基,继续培养三天后成功分化成巨噬细胞。实验分组空白对照组、FugeneHD(0.25%)+LPS(2ug/ml)模型组、人参皂苷Rg1预给药+FugeneHD(0.25%)+LPS(2ug/ml)、人参皂苷PPT预给药+FugeneHD(0.25%)+LPS(2ug/ml)。预给药组分别预给人参皂苷Rg1、Ppt 5uM 6h,然后复合1ug/ml LPS刺激6h,撤药后用转染试剂0.25%体积比的FugeneHD将2ug/mlLPS转入BMDM细胞12h达到药物作用时间构建成细胞焦亡模型。PBS洗涤细胞一次后,置于冰板上,用细胞刮子将细胞刮下收集,5000rpm×5min离心得到细胞沉淀,每20μL细胞压积中加入150μL RIPA细胞裂解液,冰上裂解30min后,超声破碎5次,每次2s,15000rpm×10min离心得到上清即为提取到的总蛋白样品。BCA法测定蛋白含量。蛋白样品按体积比3∶1加入上样缓冲液并煮沸5min。制备12%SDS-PAGE,对样品进行电泳分离。电泳分离后,进行半干转,将蛋白转至PVDF膜。PVDF膜在含5%脱脂奶粉的TBST溶液中封闭1h后,4℃孵育一抗过夜,相应二抗室温孵育1h,ECL显影,Bio-Rad凝胶成像仪成像。
实施例2.细胞增殖与活性检测实验
实验材料:同实施例1。
实验方法:
BMDM细胞的提取、分化、给药同实施例4。将细胞按2*105/孔的密度点到96孔板中,三天后换一次培养基,继续培养三天后成功分化成巨噬细胞。细胞分组空白对照组、FugeneHD(0.25%)+LPS(2ug/ml)模型组、人参皂苷Rg1预给药+FugeneHD(0.25%)+LPS(2ug/ml)、人参皂苷PPT预给药+FugeneHD(0.25%)+LPS(2ug/ml)。预给药组分别预给人参皂苷Rg1、PPT 5uM 6h,然后复合1ug/ml LPS刺激6h,撤药后用转染试剂FugeneHD将2ug/mlLPS转入BMDM细胞12h后将孔里的培养基转入到空白的96孔板中。按CCK-8说明书将CCK-8工作液加入含有细胞的96孔板中,CCK-8被细胞内脱氢酶生物还原后生成的橙色甲臜染料能够溶解在组织培养基中,生成的甲臜量与活细胞数量成正比。达到作用时间后置于酶标仪检测。细胞存活率通过以下公式计算:
细胞活力=[A(加药)-A(空白)]/[A(0加药)-A(空白)]×100%
实施例3.细胞毒性检测实验
实验材料:同实施例1。
实验方法:
BMDM细胞的提取、分化、给药同实施例4。给药达到药物作用时间后将96孔板中的培养基转入新的96孔板中。按照乳酸脱氢酶细胞毒性检测试剂盒说明书将工作液加入含有培养基的96孔板中,在乳酸脱氢酶的作用下,NAD+被还原生成NADH,NADH和INT被硫辛酰胺脱氢酶催化反应生成NAD+和强生色物甲臜,在490nm波长下产生吸收峰,从而可以通过比色来定量乳酸脱氢酶的活性。吸光度与乳酸脱氢酶活性成线性正相关。达到作用时间后置于酶标仪检测。细胞存活率通过以下公式计算:
细胞毒性=(处理样品吸光度-样品对照孔吸光度)/(细胞最大酶活性的吸光度-样品对照孔吸光度)×100%
实施例4.血清中IL-1β含量测定实验
实验材料:同实施例1。
实验方法:
小鼠的饲养条件和给药条件同实施例1,小鼠血液的采取和处理方法同实施例2。血清用生理盐水按1∶4比例稀释,按照小鼠IL-1βELISA试剂盒说明书逐步加入工作液,达到作用时间后取出置于酶标仪检测其在450nm波长的OD值。在450nm处的吸光度值与IL-1β的浓度呈正相关,根据吸光度值就可以计算出相应IL-1β的浓度。
实施例5.血清中谷丙转氨酶含量测定实验
实验材料:同实施例1。
实验方法:
小鼠的饲养条件和给药条件同实施例1。在小鼠腹腔注射LPS 6h时间点通过眼眶静脉取血,然后脱颈处死,解剖取出各组织于-80℃贮存。取出的血液静置2h后,6000rpm离心10min,取出上层血清。血清用生理盐水按1∶1比例稀释,送于中大医院检验科测定谷丙转氨酶的含量。
实施例6.小鼠存活率实验
实验材料:同实施例1。
实验方法:
C57BL/6雄性六周龄小鼠饲养条件:室内保持温度(25℃)湿度(60%)恒定,保持自由饮水饮食,并保证12h昼/12h夜日照循环。按体重随机分成四组每组10只,即空白对照组、LPS感染性休克模型组、Rg1预给药+LPS、PPT预给药+LPS。Rg1、PPT预给药组提前三天每只小鼠按20mg/kg的剂量灌胃给予人参皂苷Rg1、PPT,第四天继续灌胃给予人参皂苷Rg1、PPT30min后每只小鼠按30mg/kg剂量腹腔注射LPS,LPS模型组同样30mg/kg剂量腹腔注射LPS。然后在2h、4h、6h、8h、12h、24h、36h、48h、96h时间点观察小鼠的存活率。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种对11种人参皂苷类成分同时进行定性及定量的方法
- 含有人参皂苷rh4的皮肤外用剂组合物的制作方法
- 一种三七皂苷R1、人参皂苷Rg1、Re、Rb1和Rd的制备方法
- 含有杂质三七皂苷R<sub>1</sub>的人参皂苷Rg<sub>1</sub>的制作方法
- 人参皂苷Compound K酯类衍生物及其在制备防治动脉粥状硬化的药物中的应用的制作方法
- 一种含有人参皂苷Rh2、麦冬皂苷B的药物组合物的制作方法
- 通过微波辐照产生的具有提高的人参皂苷Rg3、Rg5和Rk1含量比的人参属植物提取物、制 ...的制作方法
- 含有来自水耕栽培人参的人参皂苷f2的皮肤外用剂组合物的制作方法
- 20(R)-人参皂苷Rg3在制备白癜风药物中的应用的制作方法
- 20(R)-人参皂苷Rg3在制备痛经药物中的应用的制作方法