使用针对母源脑反应性抗体的诱饵抗原抑制孤独症谱系障碍的制作方法
本申请要求2015年10月5日递交的美国临时申请号62/237,150的权益,其内容通过引用并入本文。
政府支持的声明
本发明是在由美国国防部授予的资助号AR130137和由美国国立卫生研究院授予的资助号MH106195的政府支持下完成的。政府对本发明享有一定的权利。
发明背景
在整个本申请中,在括号中用数字引用了多种专利和其他出版物。参考文献的完整引用可以在说明书末尾找到。本文提及的这些参考文献和所有专利、专利申请出版物和书籍的公开内容通过引用整体并入本申请,以更充分地描述本发明所属领域。
孤独症谱系障碍(ASD)是一组以沟通和社交困难以及行为刻板为特征的神经发育综合征。2013年,据美国疾病控制中心估计,88名美国儿童中就有1名患有ASD,并且在过去的四十年中诊断已经增加10倍。虽然ASD无法治愈,但早期发现和干预可显著提高患者的认知能力和语言技能。
本发明使用针对母源脑反应性抗体的诱饵抗原解决了对孤独症谱系障碍的诊断和抑制性治疗的需求。
发明概述
本申请提供了抑制或降低胎儿或婴儿中孤独症谱系障碍的发展的方法,其包括给怀有胎儿的母亲或在母亲怀孕期间胎儿出生成为婴儿之前的母亲施用一定量的结合针对Caspr2、KCNAB2、KCNAB1、内皮整联蛋白配体(EDIL3)、IVD、脑特异性硫酸转移酶(sultatransferase)(SULT4A1)、TNIP2、视黄酸诱导的16(RAI16)或GDP D5的抗体的药剂,所述药剂有效抑制或减少胎儿或婴儿中的孤独症谱系障碍的发展。
还提供了抑制或降低胎儿或婴儿中孤独症谱系障碍的发展的方法,其包括用一定量的结合针对Caspr2、KCNAB2、KCNAB1、内皮整联蛋白配体(EDIL3)、IVD、脑特异性硫酸转移酶(SULT4A1)、TNIP2、视黄酸诱导的16(RAI16)或GDP D5的抗体的药剂体外接触怀有胎儿的母亲或在母亲怀孕期间胎儿出生成为婴儿之前的母亲的血液,以降低针对Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5的抗体的血液水平,并且使如此处理的血液再循环回该母亲,以有效抑制或减少胎儿或婴儿中的孤独症谱系障碍的发展。
还提供了确定有怀孕预期的母亲的胎儿或婴儿将出现孤独症谱系障碍的可能性的方法,其包括定量获自母亲血液的样品中针对Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5中的一种或多种的抗体水平,并将各自的定量水平与各自抗体的预定对照水平进行比较,其中针对Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5中一种或多种的一种或多种抗体的滴度增加表示具有怀孕预期的母亲的胎儿或婴儿将出现孤独症谱系障碍的可能性增加。
根据下面的描述,本发明的其它目的将显而易见。
附图简要说明
图1A-1B:脑反应性单克隆抗体C6结合Caspr2。(1A)C6(左上图),但不是B1-对照(左下图),结合表达tGFP-Caspr2的活HEK 293T细胞上的Caspr2(中图)。在仅表达tGFP的细胞或未转染的细胞上没有观察到染色(数据未显示)(1B)脑反应性C6与CNTNAP2-/-小鼠的海马中的CA1区域的结合减少。
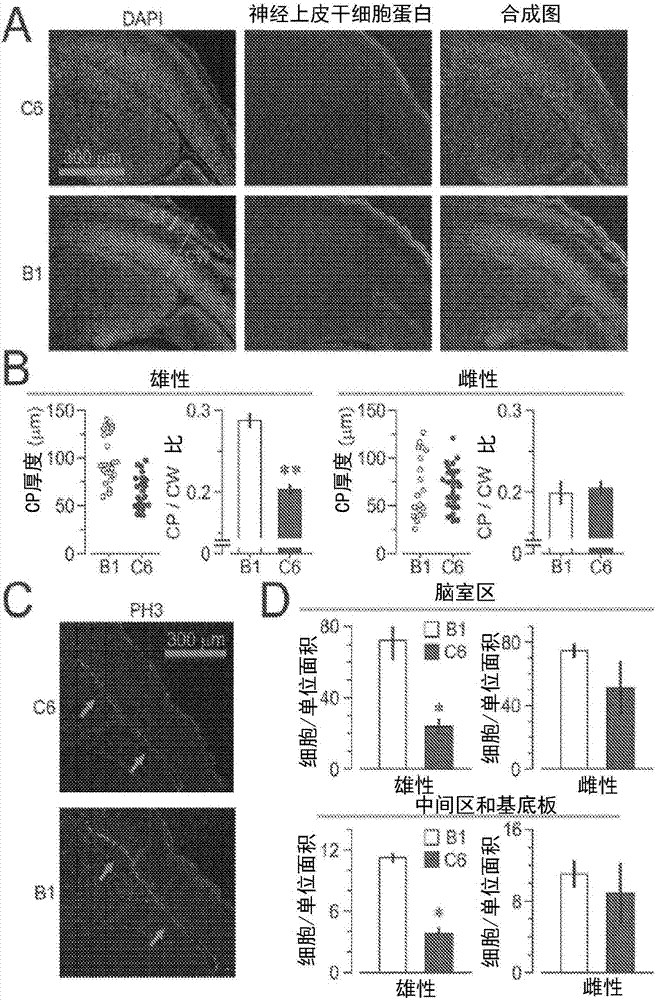
图2A-2D:暴露于C6的胎儿的产前皮质异常。(2A)神经上皮干细胞蛋白染色显示,暴露于C6相比于暴露于B1的雄性脑中皮质板(CP)薄。(2B)雄性和雌性胎儿脑中CP和CP:皮质宽度(CW)比。**P<0.0001,t=7.15,t检验。(2C)PH3+染色显示暴露于C6中的有丝分裂较少。箭头标识脑室区(VZ)中的神经发生区域。(2D)VZ、中间区(IZ)和基底板(sub-plate)(SP)中的PH3+的定量。单位面积=62.5mm2。
*P<0.05,Z=2.34,Mann Whitney检验。(B、D)小鼠数量:B1=5,C6=4,每种抗体2窝(litter)。
图3A-3F:暴露于C6的雄性小鼠中出生后海马CA1异常。(3A-3E)暴露于C6的小鼠的CA1锥体神经元显示树突长度和棘密度(spine density)减少。分析包括:2周龄小鼠(每组n=3);神经元:B1=45,C6=49,成年动物(每组n=4);神经元:B1=70,C6=83。每组包括来自2窝的动物。(3A)来自2周龄(左)和成年(16-20周龄)(右)暴露于B1和C6的小鼠的代表性高尔基体浸染的CA1锥体神经元的底图。(3B)分支(branch)总数的累计概率。2周龄B1vs C6,P<0.003,D=0.35,Kolmogorov-Smirnov(KS)检验;成年P<0.001,D=0.64,KS检验。方块插图表示分支的总数,数据以平均值和四分位数表示。(3C)Scholl分析将树突长度描述为离胞体的距离的函数。左:2周龄小鼠,P<0.005,D=0.44,KS。右:成年小鼠,P<0.001,D=0.97,KS检验。(3D)树突分支的数量作为分支级数的函数,离心地定义成从树的原点开始并继续向外朝向终点,并定义为从原点穿过的段的数量。暴露于C6和B1的小鼠在两种鼠龄上显著不同:2周龄,P<0.01,D=0.6,KS检验;成年,P<0.03,D=0.45,KS检验。(3E)暴露于C6的小鼠的CA1神经元中突触树突棘密度下降;B1=1.18±0.04棘/μ;C6=0.92±0.02棘/μ;**P<0.001,t=4.78,t检验(3F)上图,显示标记的PV+中间神经元的CA1区的代表性显微照片。下图,成年B1(n=1251)和C6(n=998)组中PV+神经元的定量,**P<0.001Z=4.25Mann-Whitney,每组4只动物,2窝。
图4A-4C:在类似于核心ASD症状的任务中暴露于C6的雄性后代的表现受损。暴露于母源抗体的雄性小鼠在成年期(10-14周)进行受行为评价。(4A)社交偏好任务。左侧柱(物体),暴露于C6的小鼠(n=15)检查新型物体持续与B1组中小鼠(n=15)近似量的时间;右侧柱(社交),暴露于C6的小鼠在不熟悉的小鼠附近花费显著较少的时间,显示社交偏好受损;*P<0.005,t=3.2,t检验;每组4-5窝。(4B)弹珠埋藏任务。左,在两组中埋藏模式的代表性实例。右,暴露于C6的小鼠(n=14)显示出增强的刻板行为,因为它们比B1组(n=15)埋藏了更多的弹珠;**P<0.0005,t=4.2,t检验;每组4-5窝。(4C)时钟迷宫任务。左,该图显示从迷宫中心逃到位于周边的出口的等待时间(latency)。在最初阶段(出口11),暴露于C6的小鼠(n=6)执行类似于暴露于B1的小鼠(n=11),但在学习不同位置(出口7)时,在第二阶段中受损。右,(在方法中定义的)灵活性比表明,暴露于C6的小鼠从熟悉的出口转变为新出口的可能性显著较低,表现出灵活学习受损;*P<0.02,Z=2.36,Mann Whitney检验,每组2-3窝。
图5:暴露于抗CASPR2单克隆抗体的胎儿皮质薄。将抗CASPR2(上图)或非脑反应性对照抗体(下图)注射入怀孕的小鼠(E13.5),36小时后收获胎儿并处理染核(Dapi)、神经上皮干细胞蛋白或二者(合成图)。白色条表示皮质厚度。
图6:克隆自ASD孩子的母亲的脑反应性单克隆抗体引发ASD样行为。将抗CASPR2(栗色)或非脑反应性对照抗体(黑色)注射入怀孕的小鼠(E13.5),分析后代在成年期的社交偏好(上部柱状图)、运动异常(中图)或焦虑(下部柱状图)。请注意,雄性(左图)而不是雌性(右图)后代表现出ASD相关行为。
发明详述
提供了抑制或降低胎儿或婴儿中孤独症谱系障碍的发展的方法,其包括给怀有胎儿的母亲或在母亲怀孕期间胎儿出生成为婴儿之前的母亲施用一定量的结合针对Caspr2、KCNAB2、KCNAB1、内皮整联蛋白配体(EDIL3)、IVD、脑特异性硫酸转移酶(SULT4A1)、TNIP2、视黄酸诱导的16(RAI16)或GDP D5的抗体的药剂,有效抑制或减少胎儿或婴儿中的孤独症谱系障碍的发展。在实施方案中,Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16和GDP D5分别是人Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16和GDP D5。在该方法的实施方案中,药剂包含肽,所述肽包含Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5的细胞外部分的序列。在实施方案中,肽由所有的D氨基酸制备而成。
还提供了抑制或降低胎儿或婴儿中孤独症谱系障碍的发展的方法,其包括用一定量的结合针对Caspr2、KCNAB2、KCNAB1、内皮整联蛋白配体(EDIL3)、IVD、脑特异性硫酸转移酶(SULT4A1)、TNIP2、视黄酸诱导的16(RAI16)或GDP D5的抗体的药剂体外接触怀有胎儿的母亲或在母亲怀孕期间胎儿出生成为婴儿之前的母亲的血液,以降低针对Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5的抗体的血液水平,并且使如此处理的血液再循环回该母亲,以有效抑制或减少胎儿或婴儿中的孤独症谱系障碍的发展。
在包括体外接触血液的实施方案中,药剂可以固定至支持物。在无菌条件下,血液可以流过或通过支持物,以降低血液中针对Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16和/或GDP D5的抗体水平,然后将血液返回母亲。在实施方案中,通过血液滤过降低针对Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5的抗体的血液水平。在实施方案中,通过血液吸附(hemoadsorption)降低针对Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5的抗体的血液水平。在实施方案中,通过血浆过滤降低针对Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5的抗体的血液水平。
在这些方法的实施方案中,药剂结合针对KCNAB2的抗体。
在这些方法的实施方案中,药剂结合针对EDIL3的抗体。
在这些方法的实施方案中,药剂结合针对IVD的抗体。
在这些方法的实施方案中,药剂结合针对SULT4A1的抗体。
在这些方法的实施方案中,药剂结合针对TNIP2的抗体。
在这些方法的实施方案中,药剂结合针对RAI16的抗体。
在这些方法的实施方案中,药剂结合针对GDP D5的抗体。
在这些方法的实施方案中,药剂结合针对KCNAB1的抗体。
在这些方法的实施方案中,药剂结合针对Caspr2的抗体。
在这些方法的实施方案中,Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5是人的。
在这些方法的实施方案中,药剂包含融合蛋白,所述融合蛋白包含含有Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5的细胞外部分的序列的肽。
在这些方法的实施方案中,融合蛋白还包含免疫球蛋白Fc序列。在这些方法的实施方案中,免疫球蛋白是IgG。在这些方法的实施方案中,IgG是IgG1。在这些方法的实施方案中,IgG是IgG2。在这些方法的实施方案中,IgG是IgG3。在这些方法的实施方案中,IgG是IgG4。在这些方法的实施方案中,免疫球蛋白是IgM。
在这些方法的一个实施方案中,本文所使用的融合蛋白意味着由免疫球蛋白的部分和Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5的细胞外部分构建的融合蛋白,或者具有与其相同的序列的蛋白。在实施方案中,Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5分别具有人Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5的序列。在实施方案中,免疫球蛋白的部分是IgG或IgM的部分。在实施方案中,它作为IgG的部分。融合蛋白的IgG部分可以是例如IgG1、IgG2、IgG2a、IgG2b、IgG3或IgG4或其部分中任一种。在实施方案中,该部分是Fc序列(整个Fc区的序列)。在实施方案中,融合蛋白包含与人IgG1、人IgG2、人IgG2a、人IgG2b、人IgG3或人IgG4的Fc部分相同的序列。在实施方案中,融合蛋白包含与人IgG1的Fc部分相同的序列。
在实施方案中,Fc结构域具有与人IgG1Fc结构域相同的序列或者95%或更高序列相似的序列。在实施方案中,Fc结构域具有与人IgG2Fc结构域相同的序列或者95%或更高序列相似的序列。在实施方案中,Fc结构域具有与人IgG3Fc结构域相同的序列或者95%或更高序列相似的序列。在实施方案中,Fc结构域具有与人IgG4Fc结构域相同的序列或者95%或更高序列相似的序列。在实施方案中,Fc结构域不是突变的。在实施方案中,Fc结构域在CH2-CH3结构域界面处突变以提高在酸性pH但不是中性pH下IgG对FcRn的亲和力。
在这些方法的实施方案中,融合蛋白包含与人Ig Fc序列具有相同序列的免疫球蛋白Fc序列。免疫球蛋白Fc序列是本领域众所周知的。在实施方案中,本文的术语“Fc序列”用于定义免疫球蛋白重链的C末端区域,包括天然序列的Fc区域和变体Fc区域。尽管免疫球蛋白重链的Fc序列的边界可能发生变化,但是人IgG重链Fc通常定义为从位置Cys226的氨基酸残基或从Pro230延伸至其羧基末端。在实施方案中,可以例如在生产或纯化过程中,或通过对编码抗体重链的核酸进行重组工程改造,来去除Fc的C末端赖氨酸。
在融合蛋白中,Fc结构域的存在显著提高延长治疗活性的附接蛋白的血浆半衰期。此外,Fc结构域还使得融合蛋白能够与Fc受体相互作用。在实施方案中,融合蛋白包含与Fc结构域连接的Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5部分。在实施方案中,Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5部分通过肽键直接结合至Fc结构域。在这些方法的实施方案中,Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5部分通过接头连接至Fc结构域。在实施方案中,Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5部分是细胞外部分。在实施方案中,它经允许柔性的肽接头进行连接。在实施方案中,接头是刚性的。在实施方案中,接头是可切割的。本发明范围内的柔性接头的非限制性实例是Gn和GGGGS和(GGGGS)n,其中n=2、3、4或5。本发明范围内的刚性接头的非限制性实例是(EAAAK)n、(XP)n。本发明范围内的可切割接头的非限制性实例包括二硫键和蛋白酶可切割接头。在优选实施方案中,接头是肽接头。
本文所述的融合蛋白的Fc序列可以是突变的。优选实施方案包括K322A和N297D人IgG1Kabat编号。突变K322A和N297D显示有限(减少)的经胎盘转移。突变K322A是基于Fc AA的75-53.K322A.HC1f-位置322的赖氨酸突变成丙氨酸的标准Kabat编号。突变N297D是基于Fc AA的75-53.N297D.HC1f-位置297的天冬酰胺突变成天冬氨酸的标准Kabat编号。相比之下,P329A(位置329的脯氨酸突变成丙氨酸)显示与测试抗体(例如AQP4IgG)在新生儿Fc受体(FcRn)结合方面相同的经胎盘转移。
在实施方案中,本文所述的融合蛋白是重组产生的。在实施方案中,融合蛋白是在真核表达系统中产生的。在实施方案中,在真核表达系统中产生的融合蛋白包含在Fc部分上的残基处的糖基化。
在实施方案中,融合蛋白是同二聚体。在实施方案中,融合蛋白是单体。在实施方案中,融合蛋白是多聚体。
在这些方法的实施方案中,药剂包含血浆可溶性肽,所述血浆可溶性肽包含Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5的细胞外部分的序列。
在这些方法的实施方案中,母亲或胎儿已经通过方法被诊断为胎儿处于孤独症谱系障碍的风险中,所述方法包括获得来自母亲血液的样品并定量样品中针对Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5的抗体水平,并且将所定量的水平与各自抗体的预定对照水平进行比较,其中超过对照水平的样品抗体水平已经得到测定,因而将母亲或胎儿诊断为胎儿处于孤独症谱系障碍的风险中。
通常,“有效的”药剂(例如治疗剂、组合物和/或制剂例如该药剂或包含该药剂的组合物)的量是有效实现所述效果、引发所期望的生物应答的量。在一些实施方案中,物质的治疗有效量是当向怀孕母亲施用时足以减少怀孕母亲的胎儿或怀孕母亲所生婴儿的孤独症谱系障碍的可能性或程度的量。如本领域普通技术人员将理解的,有效量的物质可以根据诸如期望的生物终点、待递送的物质、化合物的药代动力学、靶细胞或组织、被治疗的疾病、施用方式和患者等的因素而变化。例如,治疗疾病、障碍和/或病症的组合物和/或制剂的有效量是对于疾病、病症和/或病症的一种或多种症状或特征有减轻、改善、缓解、抑制、预防、延迟发作、降低严重程度和/或减少发生的量。本领域普通技术人员将会理解,通常,有效量将通过一系列单独剂量来施用。在一些实施方案中,当在药学上下文(例如药学有效量)中使用时,术语“有效量”是指药剂以足以实现期望的治疗效果的量存在。
本发明方法包括的母体施用途径包括但不限于以下各个途径及其任何子集:耳,颊,结膜,皮肤,皮下,宫颈内,窦内(endosinusial),气管内,肠内,硬膜外,经血液透析,间质,腹腔内,羊膜内,动脉内,关节内,胆管内,支气管内,囊内(intrabursal),心内,软骨内,尾内(intracaudal),海绵体内,腔内,脑内,脑池内,角膜内,冠状动脉内,真皮内,椎间盘内,管内,表皮内,食道内,胃内,阴道内,牙龈内,回肠内,管腔内,病灶内,淋巴内,髓内,脑膜内,肌内,眼内,卵巢内,心外膜内,腹膜内,胎盘内,胸膜腔内,前列腺内,肺内,窦内(intrasinal),脊柱内,滑膜内,腱内,睾丸内,鞘内,胸廓内,小管内,肿瘤内,鼓室内,子宫内,血管内,静脉内,脑室内,膀胱内,玻璃体内,喉,鼻,鼻饲,眼,口,口咽,肠胃外,经皮,关节周,硬膜外,直肠,吸入,眼球后,蛛网膜下腔,结膜下,舌下,粘膜下,局部,透皮,透粘膜,经胎盘,经气管,输尿管,尿道(uretheral)和阴道施用。
在这些方法的实施方案中,该方法进一步包括接收将母亲鉴定为其怀有的胎儿处于孤独症谱系障碍的风险中并给所鉴定的母亲施用一定量的药剂的初始步骤。在实施方案中,其中被鉴定为母亲怀孕的胎儿没有患有孤独症谱系障碍的风险的母亲不施用该药剂的量。
还提供了确定具有怀孕预期的母亲的胎儿或婴儿将出现孤独症谱系障碍的可能性的方法,其包括定量获得自母亲血液的样品中针对Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5中的一种或多种的抗体水平,并将各自的定量水平与各自抗体的预定对照水平进行比较,其中针对Caspr2、KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5中的一种或多种的抗体的滴度增加表示,具有怀孕预期的母亲的胎儿或婴儿将出现孤独症谱系障碍的可能性增加。
如这里所使用的,预定对照水平是作为对照的通常预先决定或获得的值。对照的概念在该领域中已被明确确立,并且可以在非限制性实例中根据经验从非受累受试者(相对于受累受试者)确定,并且可以根据需要被标准化(在非限制性实例中,对于体积、质量、年龄、地点、性别)来否定一个或多个变量的影响。
在这些方法的实施方案中,受试者是人。
本文所述的各种元件的所有组合均在本发明的范围内,除非本文另外指出或以其他方式明显与上下文矛盾。
从下面的实验细节中将更好地理解本发明。然而,本领域技术人员将容易认识到,所讨论的具体方法和结果仅仅是对在所附的权利要求书中更全面描述的本发明的说明。
实验结果
序言
孤独症谱系障碍(ASD)在67名新生儿中有1人出现并在不断上升,造成经济成本和情感成本的损失。在病理生理机制方面理解的进展暗示在ASD发展中的母源脑反应性抗体。
母源抗体能够进入胎儿脑部(7)并且脑反应性抗体能够影响胎儿脑部发育并导致该子代认知损伤。本实验室和其它实验室已经显示ASD儿童的母亲与未选择的育龄妇女或典型发育中孩子的母亲相比,具有显著更多的对脑抗原具有反应性的循环抗体(9、10)。对孕鼠或猴静脉内施用血清或选择的脑抗原特异性抗体引起该子代的神经发育和行为缺陷(11、12)。
理解这种机制需要分离和研究单克隆抗体并鉴定特异性脑部抗原性。分离了结合接触蛋白相关蛋白样2(Caspr2)的单克隆抗体(命名为C6),Caspr2是Kv1钾通道的组分并且对于AMPA和NMDA受体的膜稳定性是必需的。在ASD儿童的血清阳性母亲中观察到这些特异性抗体的滴度升高。为了证明它们对ASD的贡献,将小鼠在子宫内暴露于母源C6。这介导了皮质发育异常,抑制性神经元减少,并且雄性子代的海马中兴奋性神经元的树突复杂性降低,并且在社交偏好、灵活的学习方面具有相关损伤,重复行为增加。这些结果表明母体循环中的单克隆抗体可以介导已经与ASD相关的脑部异常。
实施例1
由之前已显示其具有脑反应性多克隆抗体的ASD儿童的母亲的血液样品产生单克隆抗体。由于这些血液样品是在受影响的孩子出生后数年获得的,因此针对存在于人胎儿脑裂解物中的抗原起反应的记忆(CD27+)B细胞受到关注。为了使得能够检测这些细胞,将人胎儿脑裂解物片段生物素化并与B细胞一起孵育。分离通过链霉抗生物素蛋白结合检测到的结合胎儿脑片段的个体CD19+CD27+B细胞。通过PCR扩增免疫球蛋白重链和轻链可变区基因并在人胚肾细胞(HEK 293)中体外表达为IgG1,κ抗体(13)。
在免疫组织学测定中鉴定了几种以5μg/ml结合小鼠脑的抗体(9)。使用两个平台来确定这些抗体的抗原特异性:含有9,000种蛋白质的人抗原阵列(Invitrogen)和针对以前显示与在ASD中重要的抗原的反应性的基于细胞的测定。研究了我们称为C6的单克隆抗体,它结合Caspr2的细胞外部分(图1A),Caspr2是电压门控Kv1钾通道的组分(14)。Caspr2是稳定神经元细胞膜上的通道的跨膜蛋白(15)。Caspr2存在于体细胞、轴突和树突棘,(14,16)并且在胎儿发育期间开始在大脑中表达[数据未显示,也在(14,17)中]。
免疫组织化学分析显示,与缺失CNTNAP2(编码Caspr2的基因)的小鼠的脑切片相比,C6与野生型小鼠脑切片的结合显著增强(图1B),证实了其对Caspr2的特异性。重要的是,衍生C6的雌性血清显示出与CNTNAP2-/-小鼠脑结合减少,但不是不存在。
为了确定C6单克隆抗体的致病可能性,在妊娠第E13.5天将它静脉内(200μg)施用于雌性小鼠,第E13.5天是当抗体穿过胎盘并仍能穿透胎儿脑组织(7)以及当Caspr2在大脑中转录的时间(14,17)。作为对照,使用先前显示不影响胎儿大脑发育的人单克隆抗体B1(18)。初次暴露于C6后2天处死的母鼠(dams)的雄性胎儿表现出变薄的皮质板;这种异常没有在雌性胎儿中观察到,也没有出现在暴露于B1的雄性或雌性胎儿中(图2A、B)。根据以前的报告显示,产后雄性皮质板比雌性皮质板厚(19),暴露于B1抗体的雄性与雌性胎儿相比,观察到较厚的皮质板。与暴露于B1的雄性胎儿相比,暴露于C6的雄性胎儿在发育中的皮质中也显示出有丝分裂细胞的减少;在暴露于C6的雌性胎儿中未观察到这种异常(图2C、D)。
在16-20周龄分析了在子宫内暴露于C6或B1的雄性小鼠的大脑。甲酚紫染色的脑切片的评估显示脑结构没有重大改变。更高分辨率的分析显示与暴露于B1的小鼠的海马神经元相比,暴露于C6的小鼠的海马神经元表现出较少的树突突起(dendritic processes)和树突棘,并且具有更少的树突分支(图3A-E)。直到~4周龄时,海马CA1神经元才得到充分发育,并且在那之前,它们具有减少的树突长度和分支(20)。为了评估结构损伤的时间过程,检查2周龄小鼠中的CA1神经元。与暴露于B1的8周龄小鼠相比,来自暴露于B1的2周龄小鼠的CA1神经元显示未成熟的树突结构。2周龄暴露于C6的小鼠表现出减少的顶端树突分支,并且成年暴露于C6的小鼠显示与暴露于B1的2周龄小鼠相似数量的分支(图3B-D)。有趣的是,在培养的神经元中Caspr2的下调导致体外树突突起的减少(21)。
在子宫内暴露于C6或B1的成年雄性小鼠中,也对GABAergic小清蛋白阳性(PV+)神经元染色。在暴露于C6的雄性小鼠的海马CA1区域中观察到PV+神经元的减少(图3F),这与CNTNAP2-/-小鼠表现出海马的GABAergic PV+中间神经元数量减少20%的报道一致。
为了检查子宫内暴露于C6对行为的潜在影响,研究了子宫内暴露于C6或B1的小鼠作为成年各种关注ASD核心症状的任务(22)。暴露于C6的任一性别的小鼠没有表现出疾病行为,或者体重、皮毛、握力强度、体态或反射的改变,无监督的行进(P>0.4,t检验n=17,5窝)或旷场试验中测量的焦虑(P>0.8,ANOVA n=17,5窝)。
暴露于C6的雄性小鼠在社交偏好测试中接近另一只小鼠所花费的时间显著更短,但接近新物体花费的时间量与暴露于B1的小鼠相似(图4A)。此外,在测量刻板或强迫行为的弹珠埋藏测试中,暴露于C6的小鼠埋入的弹珠明显大于暴露于B1的小鼠(图4B)。它们在学习时钟迷宫中的新出口位置时也受到损害,但在初始任务中表现出正常学习,因此表现出在灵活学习中的缺陷(图4C)。相比之下,在子宫内暴露于C6或B1的雌性子代在所有任务中均等效地进行,证实组织学发育数据显示抗体对雌性胎儿脑无影响。
为了确定具有这种特异性的抗体在有ASD儿童的女性群体中的频率,检查了先前已显示具有脑反应性血清的ASD儿童的母亲的血浆(9)。37%(53个中的20个)的血浆样品结合非透化的转染Caspr2的HEK 293T细胞的细胞膜,而来自缺乏脑反应性抗体的ASD儿童的母亲的样品只有12%(63个中的8个),12%(51个中的6个)来自未选择的育龄女性的样品表现出这样的反应性(P<0.001,卡方检验)。
这些结果直接证实,一些ASD儿童的母亲体内表达结合胎儿脑抗原的抗体。对Caspr2具有特异性的C6介导异常胎儿大脑发育并导致长期行为受损。由于胎儿血脑屏障对抗体是可渗透的(7),母体血液中存在的致病性自身抗体即使在母体中没有可检测到的疾病时也可能影响发育中的脑。这种母源抗体影响胎儿大脑发育并具有长期认知影响的模式已经在系统性红斑狼疮中得到报道(18,23),其中子宫内暴露于NMDA受体反应性自身抗体导致发育胎儿脑部异常和持续的神经认知缺陷(18)。
编码Caspr2的基因的罕见CNTNAP2变体与ASD有关(24)。突变CNTNAP2家族(编码Caspr2的家族)显示癫痫(25),强迫行为(26)脑内可变的性别依赖性结构异常(27)。缺失CNTNAP2的小鼠显示破坏的神经元迁移、抑制性GABAergic神经元的损失和被认为代表小鼠中ASD样表型的行为特征,例如活动过度、刻板行为、在莫里斯水迷宫中灵活学习减少和社交偏好异常(17)。在发育过程中,Caspr2在心室增生区高表达(14,17),缺乏Caspr2的小鼠表现出神经元迁移损伤。有趣的是,已经在ASD中观察到皮质厚度的变化以及神经元堆积减少(28)。有可能皮质变薄和增殖细胞数量减少由另一种称为瞬时轴突糖蛋白-1(TAG1)的蛋白间接介导,该蛋白与Caspr2共定位(15)并在皮质的增殖神经元迁移中起作用。
还发现在子宫内暴露于C6的成年小鼠在海马中显示出树突分支(arborization)减少。数据表明,在成年期,这些小鼠表现出的树突复杂性水平与2周龄B1对照小鼠类似。还观察到海马中GABAeric PV+神经元的减少。同时,观察到在社交偏好和灵活学习以及增加的刻板行为方面的受损。这些行为被认为涉及皮质纹状体回路并且对海马输入敏感(29,30)。
考虑到ASD中强烈的雄性偏倚,只有子宫内暴露于C6抗体的雄性小鼠表现出神经发育异常这一事实,特别令人感兴趣(31)。本发明人没有发现到任何其他报告涉及ASD小鼠模型中的性别偏倚。然而,男性性别是CNTNAP2与人谱系语言发育受损之间连锁关联的重要因素(24)。具有Caspr2特异性的抗体似乎在ASD儿童的母亲中频繁出现。
实施例2
独特的人血液来源(Simons Simplex Collection,Autism Genetic Resources and GAP registry,The Feinstein Institute for Medical Research)用于证实ASD儿童的母亲血液中的抗脑抗体的频率(11%)显著高于对照组(2%,p<0.0001)。鉴定了脑反应性单克隆抗体和克隆自ASD儿童的母亲的单个细胞(来自细胞分选的记忆B细胞的IgG结构域的单细胞表达克隆)。简言之,将来自外周血的分离的B细胞与事先用生物素标记的人胎儿脑裂解物孵育,并且使用抗生物素蛋白层析分离B细胞-脑抗原复合物。由于血液是在产生ASD儿童的怀孕后数年获得的,因此有理由认为只有记忆隔室中的B细胞才有意义。幸运的是,这种记忆B细胞在人体中持续存在数年至数十年,因此能够提供一个可能在几年前发生的怀孕期间已经存在的自体反应性的窗口。因此,下一步使用荧光标志物和流式细胞术将单个记忆B细胞分选到单个孔中。使用Nussenzweig和同事首次描述的技术,将IgG重链和轻链可变区克隆到人构建体中(34)。然后对这些进行测序并共转染到HEK 293T细胞中进行表达。使用对胎儿和成年小鼠脑的免疫组织化学对脑的免疫反应性进行验证,并且表达感兴趣的单克隆抗体和用蛋白G层析纯化。生成了20种脑反应性单克隆抗体的文库。与记忆B细胞的选择一致,这些单克隆大多数包含可变区的大量体细胞超突变,这是已经通过生发中心反应成熟并且已经进入记忆细胞隔室的B细胞的一个特征。通过在全长人蛋白质阵列上筛选汇集的抗体制备物,随后针对选择的抗体的免疫印迹,来鉴定推定的抗原。
20种这样的脑反应性单克隆抗体中有8种被确定为针对已知参与神经变性疾病的靶标(KCNAB2、KCNAB1、EDIL3、IVD、SULT4A1、TNIP2、RAI16或GDP D5)反应。这8种推定的抗原中,所有抗原均存在于参与神经变性疾病的蛋白上,4种抗原存在于单个蛋白复合物—钾电压门控通道的亚单位上(2种单克隆结合KCNAB1和2种结合KCNAB2)。此外,序列分析表明,这2种抗KCNAB2抗体采用相同的重链。这些发现特别具有挑战性,因为在Genome Wide Association Study(GWAS)中已经将kcnab2基因与ASD相关连。
当在第E13.5天在怀孕小鼠中静脉内注射时,一种人抗KCNAB2单克隆抗体导致雄性但不是雌性的子代的皮质发育异常和行为异常。对于这些研究,怀孕的小鼠含有13.5天龄的胎儿——正在形成与ASD相关的脑结构的发育阶段。当在抗体施用后36小时分析时,来自注射了非脑反应性对照IgG的小鼠的胎儿显示正常组织学。相反,注射C6抗KCNAB2IgG的小鼠的胎儿显示异常薄的大脑皮质层(图5),这与穿透胎儿脑的抗体一致。在此时间窗口上的平行磷酸-组蛋白3染色显示,暴露于抗KCNAB2抗体的胎儿中显著更少的有丝分裂细胞(未显示)。最后,当作为成年(10-14周)进行分析时,当使用各种小鼠ASD行为表型分析(例如焦虑、运动、社交;图6)评估时,来自注射了非脑反应性对照IgG的怀孕小鼠的雄性和雌性子代均显示正常行为。引人注目的是,对注射了抗KCNAB2IgG的小鼠的成年后代进行的平行行为测定揭示了性别特异性异常:只有雄性(图6,左侧)但不是雌性(图6,右侧)子代在全部三个标准的ASD行为测定(社交偏好、旋转杆和旷场)中显示ASD相关行为。鉴于ASD优先折磨男性儿童,小鼠中的这些性别特异性行为异常特别有趣。
方法
研究目的:来自ASD儿童的母亲的血浆获得自Simons Simplex Collection(SSC,sfari.org/resources/simons-simplex-collection)(35)。来自育龄女性的对照血浆获得自North Shore-LIJ Health System临床实验室和注册于Feinstein Institute for Medical Research的参与成员worldwideweb.gapregistry.org)。两个队列之前描述过(36)。所有个体都通过适当的机构审查委员会提供知情同意。
样品收集:将先前被鉴定为具有脑反应性抗体的来自登记于SSC中的同意母亲的血液收集入肝素化管中(36)。该操作方案得到SSC以及Feinstein Institute for Medical Research Institute Review Board的同意。
单细胞分选:如前所述(37)并进行了若干修改进行单个人记忆脑反应性B细胞的分离。通过使用B细胞试剂盒(StemCell Technology)通过阴性选择从新鲜单核细胞纯化B细胞。然后使用EZ-Link Sulfo-NHS-Biotin标记试剂盒(Life Technologies)将它们在室温下与用生物素标记的人胎脑裂解物(3mg/ml,Nouvus)孵育30min。用生物素选择试剂盒(StemCell Technologies)分离与生物素化的脑抗原结合的细胞,并且用FITC缀合的抗人CD19、藻红蛋白(PE)缀合的抗人CD27和别藻蓝蛋白(APC)链霉抗生物素蛋白染色,以分离CD19+、CD27+、脑裂解物+记忆B细胞。作为对照,将最初被鉴定为非脑反应的部分与生物素化的脑抗原孵育并如上所述进行染色。在该部分中没有检测到APC阳性细胞。最后,如(38)所述在BD FACSAria上分离CD19+、CD27+、APC+单细胞。
cDNA合成和RT-PCR:如之前所述(37,38)进行单个IgH(仅γ)和IgL链(k或1)的cDNA合成。将重链和轻链可变区基因连接到含有IgG1或k恒定区的质粒中(来自M.Nussenzweig,Rockefeller University,NY的礼物)。
抗体产生:如之前所述(38)略有修改地体外表达抗体。简言之,用重链和轻链二者的质粒转染之前24h,将人胚肾成纤维细胞293T(HEK-293T)细胞分至补充有热灭活的胎牛血清(FBS,10%)、谷氨酰胺(1%)和青霉素-链霉素(1%,HyClone,GE Healthcare)的高糖DMEM(HyClone,GE Healthcare)的100x 20mm培养皿。随后,在转染前8小时,将培养基更换为补充有谷氨酰胺(1%)和青霉素-链霉素(1%)的SFM4Transfx-293(HyClone,GE Healthcare)。然后使用Lipofectamine 2000(Life Technologies)将细胞与编码IgH和IgL链的质粒DNA(5μg)共转染。培养7天后收集上清液。在蛋白G-sepharose(GE Healthcare,Life Technologies)上纯化抗体,用甘氨酸缓冲液(0.1M,pH3.5)洗脱并在Tris-HCl(1M,pH8)中中和。通过抗人IgG ELISA测定上清液中的抗体浓度(37,38)。纯化的抗体用PBS充分透析;通过用考马斯蓝染色的非还原性SDS凝胶来确定它们的完整性,并且通过抗人IgG ELISA(37,38)和Nanodrop二者来测量它们的浓度。
使用转染的HEK-293T细胞进行结合测定:如先前所述(40),使用基于活细胞的免疫荧光测定分析血浆和人单克隆抗体C6和B1(39)与Caspr2的结合。使用Tgfp-Caspr2或Tgfp载体(Origene)转染HEK-293T细胞并培养72小时。细胞用C6或B1(10mg/ml,溶于PBS/10%FBS中)染色。通过Alexa 594缀合的山羊抗人IgG(Life Technologies)检测与Caspr2转染的细胞结合的抗体。为了测试血浆中抗Caspr2抗体的存在,将细胞用溶于PBS和FCS(10%)中的山羊IgG(Sigma-Aldrich)封闭,用预先吸收的(兔肝粉,Sigma-Aldrich)血浆样品(稀释度1:100和1:200)孵育。用Alexa 594缀合的山羊抗人IgG(Life Technologies)检测IgG结合。用DAPI染色(Sigma-Aldrich)对死细胞进行观察,而对活细胞分析Caspr2-IgG的结合。针对细胞外表位的市售可得的抗Caspr2抗体(NeroMab!UC Davis,CA)用作阳性对照。针对细胞质表位的抗Caspr2抗体(Abcam)用作阴性对照。用tGFP载体转染的细胞和未转染的细胞也用作对照。
Caspr2蛋白表达:收获胚胎脑和胎盘并立即在液氮中冷冻并储存(-80℃)。将脑和胎盘在含有蔗糖(0.32M)、HEPES(10mM)、EDTA(2mM)以及蛋白酶和磷酸酶抑制剂(Fisher Scientific)的冰冷匀浆缓冲液中匀浆,然后将匀浆的脑离心(1000x g)15分钟。回收上清液并以200,000x g再次离心。将沉淀重新悬浮于缓冲液中并以200,000x g再次离心。最后,将沉淀重悬于裂解缓冲液(20mM Tris-HCl pH 8、137mM NaCl、10%甘油、1%NP-40、2mM EDTA)中并储存(-80℃)。为了测定蛋白质浓度,用Compat-AbleTM蛋白质测定制备试剂盒(Thermo scientific)处理样品,并通过BCA蛋白质测定试剂盒(Thermo scientific)进行测定。使用NuPAGE(Invitrogen)对脑和胎盘膜裂解物进行SDS-PAGE电泳并转移至PDVF膜。将膜在封闭缓冲液中于RT(4%牛奶,0.1%PBS-Tween)中染色1小时,然后在4℃下用抗Caspr2单克隆抗体(Abcam)(1:500稀释于封闭缓冲液中)孵育过夜。将膜用抗兔IR Dye 680CW染色并使用Odyssey红外成像系统(LI-COR Biosciences)观察。用抗体(Abcam,1:10,0000)检测钠钾ATP酶并用作上样对照。只有二抗显示无结合。
Caspr2RNA表达:用RNeasy试剂盒(Qiagen)从脑和胎盘中提取总RNA,并用iScript cDNA合成试剂盒(Bio-Rad)进行逆转录。使用针对小鼠CNTNAP2和Polr2A的TaqMan探针(Applied Biosystems,Thermo Fisher Scientific),通过使用LightCycler 480反应混合物(master mix)的定量聚合酶链式反应(qPCR)分析cDNA。数据标准化为Polr2a;通过ΔΔCt计算相对诱导。
对孕鼠施用抗体:从Jackson Laboratory获得C57BL/6小鼠(6-8周龄)。动物的使用根据Feinstein Institute for Medical Research的机构指南。对于定时(timed)怀孕,2只雌性和1只雄性共同饲养14小时。将雄性小鼠从笼中取出的时间称为胚胎(E)第0.5天。在第E13.5天,在轻度麻醉下,通过眼眶后注射将C6抗体(200mg)或B1对照抗体(200mg)施用于定时怀孕(time-pregnant)小鼠(5)。在第E15.5天收获胚胎并处理用于性别鉴定(描述于(41))和胎脑病理学。额外的妊娠允许达到足月。
胎脑的免疫组织学:将E15.5脑在4℃下在多聚甲醛(4%)中固定过夜,接着蔗糖溶液(30%)在4℃下固定48小时,然后在OCT.化合物(Sakura)中在干冰上冷冻并储存(-80℃)。在Cryostat(Leica)上切割矢状切片(12μm厚),置于明胶包被的载玻片上并储存(-80℃)。染色前,切片融合至室温,用PBS冲洗两次并用Triton X100(0.1%)中的PBS(5%)牛血清白蛋白(BSA)室温封闭1h。加入抗PH3+抗体(1:100,Millipore)或抗神经上皮干细胞蛋白抗体(1:200,Millipore)和DAPI(1μg/ml,Life Technologies),4℃过夜。在PBS/0.1%Tween中洗涤之后,使用Alexa 488山羊抗兔或抗小鼠IgG(Life Technologies)检测抗体结合,并用Axio-Imager(Z-1,Axio-Vision4.7,Zeiss)进行观察。如描述于(39),进行PH3+细胞定量。从每只动物的多个切片获得皮质板和皮质宽度测量结果,描述于(39)。
成年脑的免疫组织学:在灌注之前通过用异氟烷麻醉小鼠来制备脑切片。用肝素预灌注缓冲液替换血液后用多聚甲醛(4%)灌注。如前所述(36)对未经操作的C57BL/6(Jackson Laboratories)或CNTNAP2-/-小鼠(来自Dr.Brett S.Abrahams,Albert Einstein College of Medicine,NY的礼物),进行血浆或细胞上清液的脑反应性抗体的免疫染色。
高尔基体染色与分析:在2周或16-20周龄时研究在子宫内暴露于抗体的小鼠。根据制造商的操作方案,通过FD Rapid GolgiStain试剂盒(Ellicott City,MD)完成脑和高尔基染色的制备。分析海马CA1区的冠状切片(100μm厚)。为了纳入棘或树突分支的分析,神经元必须包括顶端树突和细胞体。分支(arbor)需要从视觉上与邻近的神经元区分开来。CA1锥体层的Z-堆叠(0.5μm间隔)显微照片用于棘分析(N.A.=1.4;Axio-Imager.Z-1,Axio-Vision 4.8,Zeiss)。图像被转移到显示Z堆叠信息的软件程序(Neurolucida,MBF)中,使得树突上的棘被可视、识别和计数。对于树突分析,收集Z堆叠(2.0μm间隔,345X273-μm拼块,N.A.=0.75),将文件转移进行分析,并对树突分支的迹线(tracing)进行量化和分析。
小清蛋白染色:对于该分析,我们使用了进行了行为评价的16-20周龄小鼠。用切片机对脑进行切片(40μm厚),按前面的方法每四个切片进行收集和放置(8)。每八个切片在以1:500稀释于PBS(0.1M,pH 7.4)的抗小清蛋白抗体(Abcam)中4℃过夜孵育,然后洗涤,与生物素化的抗兔IgG(1:200,Vector Laboratories)和1:100稀释的抗生物素蛋白-生物素辣根过氧化物酶复合物孵育1小时,接着1:200的来自Vectastain Elite ABC试剂盒(Vector,PK-6100)的溶液,和3,3'-二氨基联苯胺(DAB,0.05%)与过氧化氢(0.003%)。切片脱水并安装至盖玻片。对于定量,我们计数了来自跨背侧海马CA1区域的锥体层的匹配冠状切片的小清蛋白抗体染色呈阳性的神经元(Br-1.20μm至-1.80μm)。(N.A.=0.45,600x200-μm拼块;Axio-Imager Z1;Zeiss)。对可比体积进行采样(平均值±sem,C6=0.154±0.005mm2,B1=0.145±0.003mm2,P=0.18)。
行为评价:在10-14周龄时评价了子宫内暴露于C6或B1的小鼠。它们维持于黑暗(09:00至21:00)和光照(21:00至9:00)的反向时间表(reverse schedule),随意获得食物和水。在测试前一周,在其昼夜节律周期的黑暗期间,将小鼠以5-10min的时段处理5天。进行行为筛选(43)以确定在暴露于C6的小鼠中自主神经反应和神经反射正常(数据未显示)。使用旷场实验来检查在暴露于C6的小鼠中移动是正常的;将每只小鼠置于黑墙(高30厘米)的方形竞技场(侧面40厘米)的中央,并允许自由移动10分钟。使用视频跟踪软件(EthoVision v8.5,Noldus,Attleboro,MA,USA)用在中央放置的摄像机记录动物行为。我们分析了作为焦虑量度的竞技场中心(10×10平方厘米)的占有率,发现暴露于C6的小鼠与暴露于B1的小鼠相当(数据未显示)。类似于ASD核心症状的行为测试是弹珠埋藏测定、社交偏好测试和时钟迷宫任务。依次进行这些测试,并且在两次测试之间出现至少48小时的休息期。弹珠埋藏测定(44)在具有软草垫(4.5cm深)的笼子(38×26cm2,壁高18cm)中进行,其中将20个黑玻璃弹珠(直径1.2cm)以4×5排列放置。实验前一天,每只小鼠熟悉笼子(没有弹珠)20分钟,在第二天将其放置在笼子中(有弹珠)30分钟。记录埋藏的弹珠的数目(被草垫材料覆盖的弹珠大于50%)。社交偏好测试在Y形迷宫中进行(由有机玻璃(Plexiglas)制成的,每个臂为27x 14cm2,壁高20cm),并在地上放置了一层薄草垫。Y形迷宫的一个臂包含一个新的物体(由塑料制成,直径约5厘米,高5厘米,位于臂的末端),第二个臂有一只小鼠(置于倒置的滤网杯内),其从来没有接触过测试小鼠,而第三个臂是空的。使用含有新小鼠的滤网杯确保社交方法仅由受试小鼠启动。测试前一天,将每只小鼠置于空的Y形迷宫中10分钟,第二天将其放置10分钟并记录其行为(Ethovision v8.5)。每次运行之间用乙醇和水清洗物体。探索物体和新小鼠所花的时间被用来分析社交偏好。时钟迷宫任务(43)在圆形迷宫中进行,有12个出口,这些出口位于竞技场的壁上,就像时钟面上的数字一样。除了通向隧道的一个出口外,所有出口都被堵住(黑色塞子)。小鼠学会从竞技场逃跑,该竞技场充满了水(20℃)至2厘米深,足以弄湿小鼠腹部的下侧并提供寻找出口的动机。在第一阶段,每只动物每天进行6次试验,连续两天,试验间的间隔至少20分钟。在第二阶段,改变出口位置并且使小鼠在一天进行6次试验。用软件(Ethovision 8.5)记录试验,并使用逃跑等待时间来测量学习。通过以下等式计算灵活性比:(L2–L1)/(L2+L1),其中L1是第一阶段最后3次试验等待时间的平均倒数,L2是第二阶段任务前3次试验等待时间的平均倒数。
统计分析:使用方差分析(ANOVA)以及对于正态分布(并且样本大于10)的数据集使用Student's t检验。对于较小的数据集,使用Mann-Whitney检验。为了分析分类数据,使用独立性卡方检验。使用非参数Kolmogorov Smirnov检验用于不是正态分布的大数据集。使用Origin(版本9和11)的统计工具箱进行所有检验,并在文中进行了说明。p<0.05的值被认为是显著的。
参考文献
1.Diagnostic and statistical manual of mental disorders(5th ed.).A.P.Association,Ed.,(American Psychiatric Publishing.,Arlington,VA,2013).
A.P.Association,Ed.,(American Psychiatric Publishing.,
3.N.Risch et al.,Am J Psychiatry,(Jun 27,2014).
4.H.O.Atladottir,T.B.Henriksen,D.E.Schendel,E.T.Parner,Pediatrics 130,e1447(Dec,2012).
5.P.H.Patterson,Brain Behavior Immunity 26,393(2012).
6.V.Mazina et al.,J Dev Behav Pediatr 36,61(Feb-Mar,2015).
7.V.Braniste et al.,Sci Transl Med 6,263ra158(Nov 19,2014).
8.B.Diamond,G.Honig,S.Mader,L.Brimberg,B.T.Volpe,Annu Rev Immunol 31,345(2013).
9.L.Brimberg,A.Sadiq,P.K.Gregersen,B.Diamond,MolPsychiatry 18,1171(Nov,2013).
10.L.A.Croen et al.,Biological psychiatry 64,583(Oct 1,2008).
11.P.Dalton et al.,Annals of neurology 53,533(Apr,2003).
12.M.D.Bauman et al.,Transl Psychiatry 3,e278(2013).
13.T.Tiller et al.,J Immunol Methods 329,112(Jan 1,2008).
14.S.Poliak et al.,Neuron 24,1037(Dec,1999).
15.S.Poliak et al.,J Cell Biol 162,1149(Sep 15,2003).
16.O.Varea et al.,Proc Natl Acad Sci U S A 112,6176(May 12,2015).
17.O.Penagarikano et al.,Cell 147,235(Sep 30,2011).
18.J.Y.Lee et al.,Nature medicine 15,91(Jan,2009).
19.J.A.Markham et al.,Neuroscience 116,71(2003).
20.J.R.Casanova,M.Nishimura,J.W.Swann,Brain Res Bull 103,39(Apr,2014).
21.G.R.Anderson et al.,Proc Natl Acad Sci U S A 109,18120(Oct30,2012).
22.J.L.Silverman,M.Yang,C.Lord,J.N.Crawley,Nature reviews.Neuroscience 11,490(Jul,2010).
23.L.Wang et al.,The Journal of experimental medicine 209,1083(Jun 4,2012).
24.M.Alarcon et al.,Am J Hum Genet 82,150(Jan,2008).
25.K.A.Strauss et al.,N Engl J Med 354,1370(Mar 30,2006).
26.A.J.Verkerk et al.,Genomics 82,1(Jul,2003).
27.G.C.Tan,T.F.Doke,J.Ashburner,N.W.Wood,R.S.Frackowiak,Neuroimage 53,1030(Nov 15,2010).
28.M.L.Simms,T.L.Kemper,C.M.Timbie,M.L.Bauman,G.J.Blatt,Acta Neuropathol 118,673(Nov,2009).
29.R.M.Deacon,Nat Protoc 1,122(2006).
30.J.H.Kogan,P.W.Frankland,A.J.Silva,Hippocampus 10,47(2000).
31.MMWR Surveill Summ 63,1(Mar 28,2014).
32.E.Lancaster et al.,Ann Neurol 69,303(Feb,2011).
33.S.R.Irani et al.,Brain 133,2734(Sep,2010).
34.Tiller,T,et al.Efficient generation of monoclonal antibodies from single human B cells by single cell RT-PCR and expression vector cloning.J Immunol Methods 329,112-124(2008).
35.G.D.Fischbach,C.Lord,Neuron 68,192(Oct 21,2010).
36.L.Brimberg,A.Sadiq,P.K.Gregersen,B.Diamond,Mol Psychiatry 18,1171(Nov,2013).
37.J.Zhang et al.,J Immunol Methods 338,79(Sep 30,2008).
38.T.Tiller et al.,J Immunol Methods 329,112(Jan 1,2008).
39.J.Y.Lee et al.,Nature medicine 15,91(Jan,2009).
40.S.Mader et al.,PLoS One 5,e10455(2010).
41.L.Wang et al.,The Journal of experimental medicine 209,1083(Jun 4,2012).
42.L.A.DeGiorgio et al.,Nat Med 7,1189(Nov,2001).
43.S.S.Chavan et al.,Mol Med 18,930(2012).
44.A.Thomas et al.,Psychopharmacology(Berl)204,361(Jun,2009).
- 还没有人留言评论。精彩留言会获得点赞!