HBV衣壳组装抑制剂和干扰素的组合疗法的制作方法
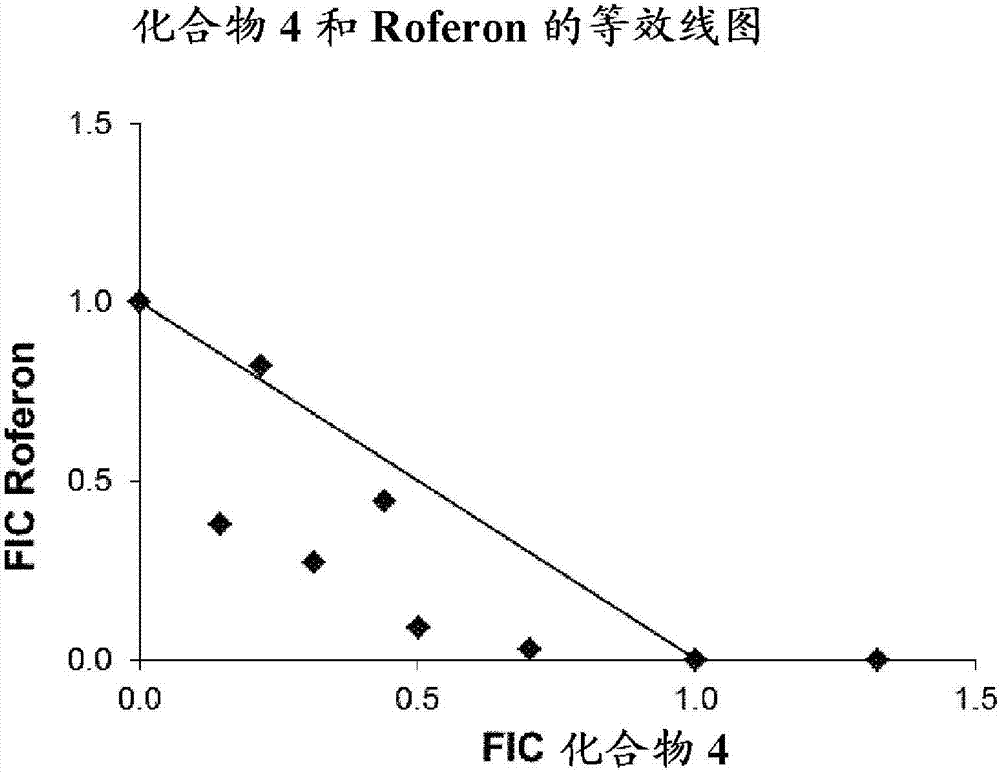
发明领域乙型肝炎病毒(HBV)的慢性感染是一种严重的公共健康问题,全球有超过2.4亿人受到慢性感染。HBV属于嗜肝脱氧核糖核酸病毒科(Hepadnaviridae)家族,具有包含240个衣壳(或核心)蛋白拷贝的二十面体核心。衣壳蛋白的主要生物学功能是用作结构蛋白以使前基因组RNA壳体化并在细胞质中形成不成熟的衣壳颗粒。该步骤是病毒DNA复制的先决条件。在进入肝细胞后,其病毒基因组被递送到核中,其中通过部分双链病毒基因组的DNA修复形成共价闭合的环状DNA(cccDNA)。所述cccDNA进而用作病毒RNA转录的模板。病毒前基因组RNA与另外两种病毒组分(衣壳蛋白和聚合酶)相互作用以形成其中发生病毒DNA复制的衣壳颗粒。当通过病毒前基因组RNA的逆转录形成接近全长的松弛环状DNA时,不成熟的衣壳变成成熟的衣壳。大多数壳体化基因组的拷贝有效地与细胞脂质和病毒包膜蛋白(S、M和L)结合以进行病毒体组装和分泌。然而,非感染性颗粒的产生量远远超过感染性病毒体。这些空的包膜颗粒被称为亚病毒颗粒(SVP)。S、M和L包膜蛋白由还有三个不同起始密码子的单个ORF(可读框)表达。所有三种蛋白质在它们的C-末端共享226aa序列,即S-结构域。S-结构域还有HBsAg表位(Lambert,C.&R.Prange.VirolJ,2007,4,45)。许多观察结果表明,多种HBV病毒蛋白可通过干扰病毒识别信号系统和随后的干扰素(IFN)抗病毒活性来抵消最初的宿主细胞应答。其中,HBV空亚病毒颗粒的过度分泌可能参与维持慢性感染患者(CHB)中观察到的免疫耐受状态。持续暴露于HBsAg和其它病毒抗原可导致HBV特异性T细胞缺失或进行性功能受损(Kondo等人JournalofImmunology1993,150,4659–4671;Kondo等人JournalofMedicalVirology2004,74,425–433;Fisicaro等人Gastroenterology,2010,138,682-93;)。此外,已经报道了HBsAg通过直接相互作用抑制免疫细胞功能,例如单核细胞、树突细胞(DC)和天然杀伤(NK)细胞(OpdenBrouw等人Immunology,2009b,126,280-9;Woltman等人PLoSOne,2011,6,e15324;Shi等人JViralHepat.2012,19,e26-33;Kondo等人ISRNGasteroenterology,2013,ArticleID935295)。HBV衣壳蛋白在HBV复制中发挥重要作用已经得到充分研究。在基于组织培养的筛选中发现了杂芳基二氢嘧啶类化合物或HAP,包括名为Bay41-4109、Bay38-7690和Bay39-5493的化合物(DeresK.等人Science2003,893)。这些HAP类似物用作合成的变构激活剂并且能诱导导致核心蛋白质降解的异常衣壳形成。HAP类似物还将来自预装配的衣壳的核心蛋白质重组入非衣壳聚合物中,推定是通过HAP与衣壳'呼吸'期间释放的二聚体的相互作用、各亚基间键的瞬时实现的。将Bay41-4109施用于HBV感染的转基因小鼠模型或人源化小鼠模型,显示出了体内功效,伴有HBVDNA减少(DeresK.等人Science2003,893;BrezillonN.等人PLoSONE2011,e25096)。乙型肝炎的另一种一线治疗是IFN-α(干扰素α),不过它受到其不良、长期反应和副作用的限制。已知作为抵抗病毒感染的前线宿主防御的IFN-α诱导干扰素刺激基因(ISG),其在靶向于病毒复制周期的不同步骤的各种病毒功能中发挥多样且多效的作用,从而有力地抑制病毒感染。此外,IFN-α具有免疫调节作用,其能通过在体内影响细胞介导的免疫来间接抑制HBV复制(MiccoL.等人,J.Hepatol,2013,58,225-233)。即使已经证明IFN施用在体外和体内均抑制HBV复制(ChristenV.等人,J.Virol.2007,81:159–165;GuanS.H.等人,J.Gastroenterol,2007,13:228–235;WielandS.F.等人,J.Virol.,2000,74,4165–4173),但是许多个体、特别是那些表现出高病毒载量的个体反应不佳,这提示HBV可能已经进化出拮抗IFN应答的机制,如前所述。慢性HBV感染通常以先天性和适应性免疫应答功能失调为特征(BoniC.,J.Virol.,2007,81,4215–4225)。例如,在HBV感染的黑猩猩中,IFN-α未被诱导(WielandS.等人,Proc.Natl.Acad.Sci.USA,2004,101,6669–6674)。当用聚乙二醇化的IFN-α治疗时,在临床研究中仅约30%的HBeAg-阳性和40%的HBeAg-阴性病例获得了持续的病毒学应答的有效性(PerrilloR.,Hepatology,2009,49,S103-111;JanssenH.L.等人,Lancet,2005,365,123-129;LauG.K.等人,N.Engl.J.Med.,2005,352,2682-2695)。干扰素α的抗病毒机制和在治疗的患者中有差别治疗响应的原因仍然有待阐明。HBsAg是慢性乙型肝炎预后和治疗响应的生物标志物。HBV感染的临床治愈标准是HBsAg的缺失和/或血清转化。然而,目前的疗法已证明HBsAg清除率极低,与在安慰剂中观察到的相差无几(Janssen等人Lancet,2005,365,123-9;Marcellin等人N.Engl.J.Med.,2004,351,1206-17;Buster等人Hepatology,2007,46,388-94)。因此,对旨在提高诱导HBsAg缺失和/或HBeAg缺失和/或HBVDNA减少和/或HBV清除和/或血清转化和/或ALT正常化和/或促进抗HB的产生的成功率的新疗法存在巨大的未满足的医疗需求。发明概述本发明涉及包含在药学上可接受的载体中的HBV衣壳组装抑制剂和干扰素的药物组合物。本文的“HBV衣壳组装抑制剂”是式(I)、(II)或(III)的化合物或专利WO2014/037480、WO2014/184328和WO2015/132276中公开的化合物中的任意一种;具体地,本文的“HBV衣壳组装抑制剂”是(S)-4-[(R)-6-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-吗啉-3-甲酸;(R)-6-((S)-2-羧基-4,4-二氟-吡咯烷-1-基甲基)-4-(2-氯-4-氟-苯基)-2-噻唑-2-基-1,4-二氢-嘧啶-5-甲酸甲酯;(2R,3S)-4-[(R)-6-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-2-甲基-吗啉-3-甲酸;2-[(1R,3S,5S)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸;2-[(1S,3R,5R)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸;3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸;3-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸;3-[(8aS)-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸;4-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-3,3-二甲基-丁酸;(8S,8aR)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸;或(8R,8aS)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸;或其药学上可接受的盐或对映体或非对映体。本文的“干扰素”选自干扰素α、聚乙二醇干扰素-α2a、重组干扰素α-2a、干扰素α-2a、聚乙二醇干扰素α-2b、重组干扰素α-2b、干扰素α-2b、糖基化干扰素α-2b、干扰素α-2bXL、重组干扰素α-2c、干扰素α-2c、干扰素β、聚乙二醇干扰素β-1a、干扰素β-1a、干扰素δ、聚乙二醇干扰素λ-1、干扰素λ、干扰素ω、干扰素τ、γ干扰素、干扰素alfacon-1、干扰素α-nl、干扰素α-n3、alb干扰素α-2b、BLX-883、DA-3021、PEG-Infergen和Belerofon。在一个实施方案中,所述干扰素是y-支链聚乙二醇化重组人干扰素α-2b注射剂(或来自AmoytopBiotech的PaiGeBin)。在一个实施方案中,所述干扰素是非缀合的干扰素α或聚乙二醇化α-型干扰素;特别地,所述干扰素是RoferonA、IntronA、Pegasys或PegIntron;更特别地,所述干扰素是RoferonA或Pegasys。附图简要说明图1:Roferon和化合物1(在50%效应水平)的配对棋盘组合的FIC的等效线图。对角线泳道连接点(0,1)和(1,0)表示相加作用(CI=1)。该泳道下方的数据点表示协同作用,上方的数据点表示拮抗作用。所给出的是来自3个独立实验的平均值。图2:Roferon和化合物4(在50%效应水平)的配对棋盘组合的FIC的等效线图。对角线泳道连接点(0,1)和(1,0)表示相加作用(CI=1)。该泳道下方的数据点表示协同作用,上方的数据点表示拮抗作用。所给出的是来自3个独立实验的平均值。图3:化合物4与Pegasys组合在PHH细胞中的作用。左图是具有相应药物浓度的化合物4和Pegasys存在下的HBVDNA抑制图,抑制百分比是基于未处理的感染对照(VC作为0%抑制)和阳性药物对照(10nMETV为100%抑制)计算的;在右图中显示了来自95%置信区间数据的相加药物相互作用,所计算的相加相互作用从基于平均背景的实验测定值中被减去,峰是具有颜色的显示了协同或拮抗作用的水平(高于相加作用的%抑制)和影响抗病毒活性的协同或拮抗相互作用下的相应药物浓度。图4:化合物3和Pegasys组合在HepaRG细胞中的作用。左图是具有相应药物浓度的化合物3和Pegasys存在下的HBVDNA抑制图,抑制百分比是基于未处理的感染对照(VC作为0%抑制)和阳性药物对照(10nMETV为100%抑制)计算的;在右图中显示了来自化合物3和Pegasys的95%置信区间数据的相加药物相互作用,所计算的相加相互作用从基于平均背景的实验测定值中被减去,峰是具有颜色的显示了协同或拮抗作用的水平(高于相加作用的%抑制)和影响抗病毒活性的协同或拮抗作用下的相应药物浓度。发明详述除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。如本文所用,术语“C1-6烷基”是指1-6个碳原子的一价的直链或支链的饱和烃基。在特定的实施方案中,C1-6烷基具有1-6个碳原子,在更特定的实施方案中,具有1-4个碳原子。C1-6烷基的实例包括甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基。如本文所用,术语“卤代”或“卤素”在本文中可以互换使用,是指氟、氯、溴或碘。术语“卤代C1-6烷基”是指其中C1-6烷基的至少一个氢原子已经被相同或不同的卤素原子、特别是氟原子代替的C1-6烷基。卤代C1-6烷基的实例包括一氟-、二氟-或三氟-甲基、-乙基或-丙基,例如3,3,3-三氟丙基、2-氟乙基、三氟乙基、氟甲基、二氟甲基、二氟乙基或三氟甲基。如本文所用,术语“C1-6烷氧基”是指基团C1-6烷基-O-,其中的“C1-6烷基”如上文所定义;例如甲氧基、乙氧基、丙氧基、异丙氧基、正丁氧基、异丁氧基、2-丁氧基、叔丁氧基等。特定的“C1-6烷氧基”是甲氧基和乙氧基,更特定地是甲氧基。如本文所用,术语“C3-7环烷基”是指含有3-7个碳原子、特别是3-6个碳原子的饱和碳环,例如环丙基、环丁基、环戊基、环己基、环庚基等。特定的“C3-7环烷基”是环丙基、环戊基和环己基。如本文所用,术语“杂环”或“杂环基”是指含有3-10个环原子的饱和的或部分不饱和的单环或二环,所述环原子可以包含1、2或3个选自氮、氧和/或硫的原子。特别地含有3-7个环原子的单环杂环基的实例包括、但不限于氮丙啶基、氮杂环丁烷基、氧杂环丁烷基、哌啶基、哌嗪基、氮杂基、二氮杂环庚烷基、吡咯烷基、吗啉基、二氢呋喃基、四氢呋喃基、四氢吡喃基、四氢噻喃基和硫吗啉基。二环杂环基可以是二环稠环或二环桥环。二环杂环基实例是8-氮杂-二环[3.2.1]辛基、奎宁环基、8-氧杂-3-氮杂-二环[3.2.1]辛基、9-氮杂-二环[3.3.1]壬基、3-氧杂-9-氮杂-二环[3.3.1]壬基、3-硫杂-9-氮杂-二环[3.3.1]壬基或二氟氮杂二环[3.2.1]辛基。单环和二环杂环基可以进一步被卤素、C1-6烷基、氰基、羧基、羧基C1-6烷基取代。如本文所用,术语“非对映体”是指具有两个或更多个手性中心并且其分子彼此不互为镜像的立体异构体。非对映体具有不同的物理性质例如熔点、沸点、光谱性质、活性和反应性。如本文所用,术语“对映体”是指彼此是不可叠加的镜像的化合物的两种立体异构体。如本文所用,术语“药学上可接受的盐”是指在生物学方面或其它方面不具有不期望的性质的盐。药学上可接受的盐包括酸加成盐和碱加成盐。如本文所用,术语“前药”是指一种形式的化合物或化合物的衍生物,其在体内代谢、例如在施用后被个体的生物流体或酶代谢成化合物的药理学活性形式,以产生期望的药理学作用。前药描述在例如RichardB.Silverman,OrganicChemistryofDrugDesignandDrugAction,AcademicPress,SanDiego,2004,第8章ProdrugsandDrugDeliverySystems,pp.497-558中。术语“药学上可接受的酸加成盐”是指与无机酸和有机酸形成的那些药学上可接受的盐,所述无机酸例如盐酸、氢溴酸、硫酸、硝酸、碳酸、磷酸,所述有机酸选自脂肪族、脂环族、芳族、芳脂族、杂环、羧酸和磺酸可的有机酸例如甲酸、乙酸、丙酸、乙醇酸、葡糖酸、乳酸、丙酮酸、草酸、苹果酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、天冬氨酸、抗坏血酸、谷氨酸、邻氨基苯甲酸、苯甲酸、肉桂酸、扁桃酸、双羟萘酸(embonicacid)、苯乙酸、甲磺酸、乙磺酸、对甲苯磺酸和水杨酸。术语“药学上可接受的碱加成盐”是指与有机碱或无机碱形成的那些药学上可接受的盐。可接受的无机碱的实例包括钠盐、钾盐、铵盐、钙盐、镁盐、铁盐、锌盐、铜盐、锰氧和铝盐。衍生自药学上可接受的有机无毒碱的盐包括伯胺、仲胺和叔胺的盐;取代的胺,包括天然存在的取代的胺,环状胺和碱性离子交换树脂,例如异丙胺、三甲胺、二乙胺、三乙胺、三丙胺、乙醇胺、2-二乙基氨基乙醇、三甲胺、二环己胺、赖氨酸、精氨酸、组氨酸、咖啡因、普鲁卡因、哈胺(hydrabamine)、胆碱、甜菜碱、乙二胺、葡糖胺、甲基葡糖胺、可可碱、嘌呤、哌嗪、哌啶、N-乙基哌啶和聚胺树脂。如本文所用,“combo”是指组合。如本文所用,“HBVDNA”是指HBV的DNA物质。如本文所用,“HBsAg”是指乙型肝炎表面抗原。如本文所用,“HBeAg”是指乙型肝炎e抗原。如本文所用,“乙型肝炎病毒”或“HBV”是指嗜肝脱氧核糖核酸病毒科(Hepadnaviridae)家族的成员,其具有约3,200个碱基对的小双链DNA基因组和对肝细胞的趋向性。“HBV”包括感染各种哺乳动物(例如人、非人灵长动物等)和禽(鸭等)宿主中的任一种的乙型肝炎病毒。“HBV”包括任何已知的HBV基因型,例如血清型A,B,C,D,E,F和G;任何HBV血清型或HBV亚型;任何HBV分离物;HBV变体,例如HBeAg阴性变体、耐药HBV变体(例如拉米夫定抗性变体;阿德福韦抗性突变体;替诺福韦抗性突变体;恩替卡韦抗性突变体等)等。如本文所用,“HBV衣壳组装抑制剂”是指抑制和/或破坏和/或加速和/或阻碍和/或延迟和/或减少和/或改变正常HBV衣壳组装(例如在成熟过程中)和/或正常衣壳解装配(例如在感染期间)和/或和/或干扰衣壳稳定性、从而诱导异常衣壳形态和功能的化合物。术语“治疗有效量”是指当施用于个体时(i)治疗或预防特定疾病、病症或障碍、(ii)减弱、改善或消除特定疾病的一种或多种症状,或(iii)预防或延迟本文所述的特定疾病、病症或障碍的一种或多种症状的发作的本发明的化合物或分子的量。治疗有效量将根据化合物、被治疗的疾病状态、所治疗的疾病的严重程度、个体的年龄和相对健康状况、施用途径和形式、主治医师或兽医从业者的判断和其它因素的不同而改变。术语“干扰素”还包括缀合物,例如干扰素α(IFN-α)缀合物,其可以通过将干扰素α与水溶性聚合物偶联来制备。这些聚合物的非限制性列表包括其它聚环氧烷均聚物例如聚乙二醇(PEG)、聚丙二醇、聚氧乙烯化多元醇、其共聚物和其嵌段共聚物。作为基于聚环氧烷的聚合物的替代选择,可以使用有效的非抗原性材料例如葡聚糖、聚乙烯吡咯烷酮、聚丙烯酰胺、聚乙烯醇、基于碳水化合物的聚合物等。这类干扰素α-聚合物缀合物描述在美国专利US4,766,106、美国专利US4,917,888、欧洲专利申请号0236987、欧洲专利申请号0510356、0593868和0809996(聚乙二醇化的干扰素α-2a)和国际公开号WO95/13090中。如本文所用,术语“聚乙二醇化的”是指一个或多个聚乙二醇(PEG)分子和一个或多个α-或β-型干扰素分子的共价缀合物。用在本发明的制剂中的优选的缀合物具有1-4个PEG分子/干扰素分子,更优选地,缀合物是单一PEG分子与单一干扰素分子之间的。聚乙二醇化的干扰素可以包含单一位置异构体或缀合物位置异构体的混合物,例如PEG分子与各干扰素分子上的不同氨基酸残基共价连接。例如,美国专利号US5,951,974描述了PEG-干扰素α缀合物位置异构体的混合物的制备,其中异构体的一些是PEG与干扰素分子的组氨酸残基之间的缀合物,混合物中的另一些异构体是PEG与干扰素赖氨酸残基之间的缀合物,还有另一些异构体是PEG与干扰素分子的氨基末端之间的缀合物。本发明涉及包含在药学上可接受的载体中的HBV衣壳组装抑制剂和干扰素的药物组合物。在本发明的一个实施方案中,所述“HBV衣壳组装抑制剂”是式(I)的化合物:其中R1是C1-6烷基或三氟甲基-CxH2x-,其中x是1、2、3、4、5或6;R2和R3中一个是苯基,其被C1-6烷基、氰基或卤素取代1次或2次或3次;另一个是氢或氘;R4是苯基、噻唑基、唑基、咪唑基、噻吩基或吡啶基,其是未被取代的或被C1-6烷基、C1-6烷基硫基、卤素或环烷基取代,其中C1-6烷基可以进一步任选地被卤素取代;A是其未被取代的或被选自C1-6烷基、氘和卤素的基团取代;或其药学上可接受的盐或对映体或非对映体。更特定地,本发明的HBV衣壳组装抑制剂涉及(S)-4-[(R)-6-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-吗啉-3-甲酸;(R)-6-((S)-2-羧基-4,4-二氟-吡咯烷-1-基甲基)-4-(2-氯-4-氟-苯基)-2-噻唑-2-基-1,4-二氢-嘧啶-5-甲酸甲酯;或(2R,3S)-4-[(R)-6-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-2-甲基-吗啉-3-甲酸;或专利WO2014/037480中公开的任意另外的化合物;或其药学上可接受的盐或对映体或非对映体。可以通过WO2014/037480中所述的合成方法获得式(I)的化合物和化合物1、2和3。在本发明的另一个实施方案中,所述HBV衣壳组装抑制剂是式(II)的化合物:其中R5是C1-6烷基;R6是苯基,其被卤素或C1-6烷基取代1次或2次或3次;R7是氢或C1-6烷基;R8是二环桥连杂环基;或其药学上可接受的盐或互变异构体或对映体或非对映体。更特定地,本发明的HBV衣壳组装抑制剂涉及2-[(1R,3S,5S)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸;或2-[(1S,3R,5R)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸;或专利WO2014/184328中公开的任意另外的化合物;或其药学上可接受的盐或互变异构体或对映体或非对映体。可以通过WO2014/184328中所述的合成方法获得式(II)的化合物以及化合物8和9。在本发明的另一个实施方案中,所述HBV衣壳组装抑制剂是式(III)的化合物:其中R9是氢、卤素或C1-6烷基;R10是氢或卤素;R11是氢或卤素;R12是C1-6烷基;R13是氢、羟基C1-6烷基、氨基羰基、C1-6烷氧基羰基或羧基;R14是氢、C1-6烷氧基羰基或羧基-CmH2m-;X是羰基或磺酰基;Y是-CH2-、-O-或-N(R15)-,其中R15是氢、C1-6烷基、卤代C1-6烷基、C3-7环烷基-CmH2m-、C1-6烷氧基羰基-CmH2m、-CtH2t-COOH、-卤代C1-6烷基-COOH、-(C1-6烷氧基)C1-6烷基-COOH、-C1-6烷基-O-C1-6烷基-COOH、-C3-7环烷基-CmH2m-COOH、-CmH2m-C3-7环烷基-COOH、羟基-CtH2t-、羧基螺[3.3]庚基或羧基苯基-CmH2m-、羧基吡啶基-CmH2m-;W是-CH2-、-C(C1-6烷基)2-、-O-或羰基;n是0或1;m是0-7;t是1-7;或其药学上可接受的盐或对映体或非对映体。更特定地,本发明的HBV衣壳组装抑制剂涉及3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸;3-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸;3-[(8aS)-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸;4-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-3,3-二甲基-丁酸;(8S,8aR)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸;或(8R,8aS)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸;或专利WO2015/132276中公开的任意另外的化合物;或其药学上可接受的盐或对映体或非对映体。可以通过WO2015/132276中所述的合成方法获得式(III)的化合物以及化合物4、5、6、7、10和11。在本发明的另一个实施方案中,用于与干扰素组合的HBV衣壳组装抑制剂是选自专利WO2008154817、WO2008154819、WO2014029193、WO2015074546、CN103664897和CN103664925中的任意化合物。本发明的适合的干扰素可以是本领域技术人员已知的任意天然存在的或重组的干扰素α、β或γ。可以使用的天然和重组α-干扰素包括干扰素α-n1(例如)、干扰素α-n3、干扰素α-2a(RoferonHoffmann-LaRoche,Inc.)、干扰素α-2b(IntronSchering-PloughCorp.)、干扰素α-2c(BoehringerIngelheim,Inc.)和复合干扰素(consensusinterferon)(InterMune,Inc.)。优选的干扰素是干扰素α-2a和干扰素α-2b。在本发明的一个实施方案中,本发明的适合的干扰素包括、但不限于重组干扰素α-2b,例如Intron重组干扰素α-2a,例如Roferon重组干扰素β-1b,例如重组干扰素β-1a,例如和和重组干扰素γ-1b,例如优选使用重组干扰素α-2a或α-2b。术语“干扰素α-2a”、“干扰素α-2b”和“干扰素β-1a”进一步包括“聚乙二醇化的”类似物,意指干扰素α-2a的聚乙二醇修饰的缀合物如干扰素α-2b如和干扰素β-1a如优选使用聚乙二醇化的重组干扰素α-2a或α-2b。在本发明的一个实施方案中,“干扰素”是非缀合的干扰素α或其聚乙二醇化的缀合物。更特定地,“干扰素”分别选自干扰素α-2a如干扰素α-2b如Intron聚乙二醇化的干扰素α-2a如和聚乙二醇化的干扰素α-2b如从天然或重组来源获得和分离干扰素α是众所周知的(Pestka,Arch.Biochem.Biophys.221,1(1983);欧洲专利号043980。进一步更特定地,“干扰素”是非缀合的干扰素α-2a(例如Roferon)或聚乙二醇化的α-型干扰素(例如):在另一个实施方案中,上述聚乙二醇化的α-型干扰素是α-2a干扰素。在本发明的一个实施方案中,所述药物组合物包含HBV衣壳组装抑制剂和干扰素,其中所述HBV衣壳组装抑制剂和所述干扰素独立地选自表1。表1.HBV衣壳组装抑制剂和干扰素列表更特定地,本发明涉及包含在药学上可接受的载体中的选自以下组合中的任意一种的HBV衣壳组装抑制剂和干扰素的药物组合物:化合物1和化合物12;化合物2和化合物12;化合物3和化合物12;化合物4和化合物12;化合物5和化合物12;化合物6和化合物12;化合物7和化合物12;化合物8和化合物12;化合物9和化合物12;化合物10和化合物12;化合物11和化合物12;化合物1和化合物13;化合物2和化合物13;化合物3和化合物13;化合物4和化合物13;化合物5和化合物13;化合物6和化合物13;化合物7和化合物13;化合物8和化合物13;化合物9和化合物13;化合物10和化合物13;化合物11和化合物13;化合物1和化合物14;化合物2和化合物14;化合物3和化合物14;化合物4和化合物14;化合物5和化合物14;化合物6和化合物14;化合物7和化合物14;化合物8和化合物14;化合物9和化合物14;化合物10和化合物14;化合物11和化合物14;化合物1和化合物15;化合物2和化合物15;化合物3和化合物15;化合物4和化合物15;化合物5和化合物15;化合物6和化合物15;化合物7和化合物15;化合物8和化合物15;化合物9和化合物15;化合物10和化合物15;化合物11和化合物15。上述组合中的化合物1-11可以被其相应的药学上可接受的盐、对映体或非对映体代替,这是本发明的另一个方面。更特定地,本发明涉及包含在药学上可接受的载体中的选自以下组合中任意一种的HBV衣壳组装抑制剂和干扰素的药物组合物:(S)-4-[(R)-6-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-吗啉-3-甲酸和RoferonA;(R)-6-((S)-2-羧基-4,4-二氟-吡咯烷-1-基甲基)-4-(2-氯-4-氟-苯基)-2-噻唑-2-基-1,4-二氢-嘧啶-5-甲酸甲酯和RoferonA;(2R,3S)-4-[(R)-6-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-2-甲基-吗啉-3-甲酸和RoferonA;3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和RoferonA;3-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和RoferonA;3-[(8aS)-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和RoferonA;4-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-3,3-二甲基-丁酸和RoferonA;2-[(1R,3S,5S)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸和RoferonA;2-[(1S,3R,5R)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸和RoferonA;(8S,8aR)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸和RoferonA;(8R,8aS)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸和RoferonA;(S)-4-[(R)-6-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-吗啉-3-甲酸和IntronA;(R)-6-((S)-2-羧基-4,4-二氟-吡咯烷-1-基甲基)-4-(2-氯-4-氟-苯基)-2-噻唑-2-基-1,4-二氢-嘧啶-5-甲酸甲酯和IntronA;(2R,3S)-4-[(R)-6-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-2-甲基-吗啉-3-甲酸和IntronA;3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和IntronA;3-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和IntronA;3-[(8aS)-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和IntronA;4-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-3,3-二甲基-丁酸和IntronA;2-[(1R,3S,5S)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸和IntronA;2-[(1S,3R,5R)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸和IntronA;(8S,8aR)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸和IntronA;(8R,8aS)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸和IntronA;(S)-4-[(R)-6-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-吗啉-3-甲酸和Pegasys;(R)-6-((S)-2-羧基-4,4-二氟-吡咯烷-1-基甲基)-4-(2-氯-4-氟-苯基)-2-噻唑-2-基-1,4-二氢-嘧啶-5-甲酸甲酯和Pegasys;(2R,3S)-4-[(R)-6-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-2-甲基-吗啉-3-甲酸和Pegasys;3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和Pegasys;3-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和Pegasys;3-[(8aS)-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和Pegasys;4-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-3,3-二甲基-丁酸和Pegasys;2-[(1R,3S,5S)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸和Pegasys;2-[(1S,3R,5R)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸和Pegasys;(8S,8aR)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸和Pegasys;(8R,8aS)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸和Pegasys;(S)-4-[(R)-6-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-吗啉-3-甲酸和Pegasys;(R)-6-((S)-2-羧基-4,4-二氟-吡咯烷-1-基甲基)-4-(2-氯-4-氟-苯基)-2-噻唑-2-基-1,4-二氢-嘧啶-5-甲酸甲酯和Pegasys;(2R,3S)-4-[(R)-6-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-2-甲基-吗啉-3-甲酸和Pegasys;3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和Pegasys;3-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和Pegasys;3-[(8aS)-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和Pegasys;4-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-3,3-二甲基-丁酸和Pegasys;2-[(1R,3S,5S)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸和Pegasys;2-[(1S,3R,5R)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸和Pegasys;(8S,8aR)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸和Pegasys;或(8R,8aS)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸和Pegasys。在本发明的一个实施方案中,所述药物组合物由在药学上可接受的载体中的HBV衣壳组装抑制剂和干扰素组成。更特定地,所述组合物由在药学上可接受的载体中的以下物质组成:(S)-4-[(R)-6-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-吗啉-3-甲酸和RoferonA;3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和RoferonA;3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和Pegasys;或(2R,3S)-4-[(R)-6-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-2-甲基-吗啉-3-甲酸和Pegasys。在本发明的另一个实施方案中,其它干扰素或HBV衣壳组装抑制剂也可以用在包含小分子或大分子的药物组合物中。其它HBV衣壳组装抑制剂的实例包括、但不限于Bay41-4109、Bay38-7690、Bay39-5493、GLS4、AT-61和AT-130。其它干扰素的实例包括、但不限于Surniferon、Sumitomo、Berofor、Infergen、Multiferon、Rebif、Avonex、Cinnovex、Betaseron/Betaferon、Imukin、Plegridy、Actimmune、ReiferonRetard和Pegetron。HBV衣壳组装抑制剂和/或干扰素的典型剂量可以在制造商推荐的范围内,并且在动物模型的体外反应指示的情况下,可以减少高达约一个数量级的浓度或量。因此,实际剂量将取决于医生的判断、患者的状况以及基于适当动物模型的体外响应的治疗方法的有效性。本发明的另一个实施方案涉及制造用于治疗或预防乙型肝炎病毒感染的药剂的方法,其特征在于在所述药剂中使用HBV衣壳组装抑制剂和干扰素。本发明的另一个实施方案涉及制造用于治疗或预防乙型肝炎病毒感染的药剂的方法,其特征在于HBV衣壳组装抑制剂和干扰素在相同的制剂或不同的制剂中共同施用。对于本发明的目的而言,“共同施用”是指HBV衣壳组装抑制剂和干扰素作为两种活性剂的任何分开施用或一起施用,其中所述两种活性剂作为适宜的剂量方案的一部分被施用,所述剂量方案被设计用于获得组合治疗益处。因此,所述两种活性剂可以作为相同药物组合物的一部分被施用或在分开的药物组合物中被施用。而且,所述两种活性剂可以在相同的时间施用或依次施用。HBV衣壳组装抑制剂和干扰素的药物组合物可以与各种药学上可接受的惰性载体一起以片剂、胶囊、锭剂(lozengen)、药片、硬糖、散剂、喷雾剂、乳膏、药膏(salve)、栓剂、胶冻剂(jelly)、凝胶剂、糊剂、洗剂、软膏剂、酏剂、糖浆剂等形式施用。这类剂型的施用可以以单剂量或多剂量进行。载体包括填充剂的固体稀释剂、无菌水介质和各种无毒的有机溶剂。这类剂型的施用可以通过口服施用、肠胃外施用、兽医施用来进行,但不限于这些。本发明的另一个实施方案涉及制造用于治疗或预防乙型肝炎病毒感染的药剂的方法,其特征在于HBV衣壳组装抑制剂和干扰素通过相同途径或不同途径被施用于个体。本发明的另一个实施方案涉及制造用于治疗或预防乙型肝炎病毒感染的药剂的方法,其特征在于HBV衣壳组装抑制剂和干扰素通过肠胃外或口服施用被施用于个体。本发明的另一个实施方案涉及制造用于治疗或预防乙型肝炎病毒感染的药剂的方法,其特征在于将其HBV衣壳组装抑制剂和干扰素施用于个体是同时的或依次的。在本发明的任意一种方法中,同时施用活性剂可以通过在相同的时间分开或依次施用活性剂或者以固定组合的形式一起施用活性剂来进行。而且,在本发明的任意一种方法中,分开或依次施用活性剂可以以任何顺序进行。本发明的另一个实施方案涉及制备用于治疗或预防乙型肝炎病毒感染的组合物的方法,其特征在于其HBV衣壳组装抑制剂是式(I)、式(II)或式(III)的化合物或其药学上可接受的盐、对映体或非对映体。特定地,其HBV衣壳组装抑制剂是(S)-4-[(R)-6-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-吗啉-3-甲酸;(R)-6-((S)-2-羧基-4,4-二氟-吡咯烷-1-基甲基)-4-(2-氯-4-氟-苯基)-2-噻唑-2-基-1,4-二氢-嘧啶-5-甲酸甲酯;(2R,3S)-4-[(R)-6-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-2-甲基-吗啉-3-甲酸;2-[(1R,3S,5S)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸;2-[(1S,3R,5R)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸;3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸;3-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸;3-[(8aS)-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸;4-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-3,3-二甲基-丁酸;(8S,8aR)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸;或(8R,8aS)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸;或其药学上可接受的盐或对映体或非对映体。本发明的另一个实施方案涉及制备用于治疗或预防乙型肝炎病毒感染的药剂的方法,其特征在于其干扰素是非缀合的干扰素α或聚乙二醇化的α-型干扰素;特定地,所述干扰素是RoferonA、IntronA、Pegasys或PegIntron;更特定地,所述干扰素是RoferonA或Pegasys。本发明的另一个实施方案涉及制备用于治疗或预防乙型肝炎病毒感染的药剂的方法,其特征在于所述药剂中所用的HBV衣壳组装抑制剂和干扰素是在药学上可接受的载体中的(S)-4-[(R)-6-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-吗啉-3-甲酸和RoferonA;3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和RoferonA;3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和Pegasys;或(2R,3S)-4-[(R)-6-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-2-甲基-吗啉-3-甲酸和Pegasys。本发明的另一个实施方案涉及药盒,其包含含有HBV衣壳组装抑制剂和干扰素的容器,所述药盒还可以包含无菌稀释剂。本发明的另一个实施方案涉及所述药盒,其中所述药盒还可以包含包装说明书,其包含作为用于治疗或预防乙型肝炎病毒感染的方法的指导使用HBV衣壳组装抑制剂和干扰素的组合治疗的印刷的说明书。本发明的另一个实施方案涉及所述药盒,其中HBV衣壳组装抑制剂是(S)-4-[(R)-6-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-吗啉-3-甲酸;(R)-6-((S)-2-羧基-4,4-二氟-吡咯烷-1-基甲基)-4-(2-氯-4-氟-苯基)-2-噻唑-2-基-1,4-二氢-嘧啶-5-甲酸甲酯;(2R,3S)-4-[(R)-6-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-2-甲基-吗啉-3-甲酸;2-[(1R,3S,5S)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸;2-[(1S,3R,5R)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸;3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸;3-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸;3-[(8aS)-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸;4-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-3,3-二甲基-丁酸;(8S,8aR)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸;或(8R,8aS)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸;或其药学上可接受的盐或对映体或非对映体。本发明的另一个实施方案涉及所述药盒,其特征在于其干扰素是非缀合的干扰素α或聚乙二醇化的α-型干扰素;特定地,所述干扰素是RoferonA、IntronA、Pegasys或PegIntron;更特定地,所述干扰素是RoferonA或Pegasys。本发明的另一个实施方案涉及所述药盒,其特征在于所述容器中使用的HBV衣壳组装抑制剂和干扰素是:在药学上可接受的载体中的(S)-4-[(R)-6-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-吗啉-3-甲酸和RoferonA;3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和RoferonA;3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和Pegasys;或(2R,3S)-4-[(R)-6-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-2-甲基-吗啉-3-甲酸和Pegasys。本发明的另一个实施方案涉及用于治疗或预防乙型肝炎病毒感染的方法,其包括给个体施用有效的第一剂量的HBV衣壳组装抑制剂或其药学上可接受的盐、对映体或非对映体;和第二剂量的干扰素;其中所述HBV衣壳组装抑制剂是(S)-4-[(R)-6-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-吗啉-3-甲酸;(R)-6-((S)-2-羧基-4,4-二氟-吡咯烷-1-基甲基)-4-(2-氯-4-氟-苯基)-2-噻唑-2-基-1,4-二氢-嘧啶-5-甲酸甲酯;(2R,3S)-4-[(R)-6-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-2-甲基-吗啉-3-甲酸;2-[(1R,3S,5S)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸;2-[(1S,3R,5R)-8-[[(4R)-4-(2-氯-3-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-6,6-二氟-8-氮杂二环[3.2.1]辛烷-3-基]乙酸;3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸;3-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸;3-[(8aS)-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸;4-[(8aS)-7-[[(4R)-4-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-3,3-二甲基-丁酸;(8S,8aR)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸;或(8R,8aS)-2-叔丁基-7-[[(4R)-4-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-8-甲酸;或其药学上可接受的盐或对映体或非对映体。本发明的另一个实施方案涉及用于治疗或预防乙型肝炎病毒感染的方法,其包括给个体施用有效的第一剂量的HBV衣壳组装抑制剂或其药学上可接受的盐、对映体或非对映体;和第二剂量的干扰素;其中其干扰素是非缀合的干扰素α或聚乙二醇化的α-型干扰素;特定地,所述干扰素是RoferonA、IntronA、Pegasys或PegIntron;更特定地,所述干扰素是RoferonA或Pegasys。本发明的另一个实施方案涉及用于治疗或预防乙型肝炎病毒感染的方法,其中个体所用的HBV衣壳组装抑制剂和干扰素是在药学上可接受的载体中的(S)-4-[(R)-6-(2-氯-4-氟-苯基)-5-甲氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-吗啉-3-甲酸和RoferonA;3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和RoferonA;3-[(8aS)-7-[[(4S)-5-乙氧基羰基-4-(3-氟-2-甲基-苯基)-2-噻唑-2-基-1,4-二氢嘧啶-6-基]甲基]-3-氧代-5,6,8,8a-四氢-1H-咪唑并[1,5-a]吡嗪-2-基]-2,2-二甲基-丙酸和Pegasys;或(2R,3S)-4-[(R)-6-(2-氯-3-氟-苯基)-5-乙氧基羰基-2-噻唑-2-基-3,6-二氢-嘧啶-4-基甲基]-2-甲基-吗啉-3-甲酸和Pegasys。本发明的另一个实施方案涉及上文所述的药物组合物作为抗病毒药剂、特别是作为用于治疗或预防乙型肝炎病毒感染的药剂的用途。本发明的另一个实施方案涉及HBV衣壳组装抑制剂和干扰素在制备上文所述的作为抗病毒药剂、特别是用于治疗或预防乙型肝炎病毒感染的药剂的药物组合物中的用途。实施例通过参考下面的实施例将更完整地理解本发明。然而,不应当将它们视为限制本发明的范围。缩写3TC拉米夫定CI组合指数CL置信界限CTGCellTiterGlodHepaRG分化的HepaRG细胞DMSO二甲亚砜ETV恩替卡韦FBS胎牛血清FIC部分抑制浓度(frationalinhibitionconcentration)FRGFah–/–Rag2–/–Il2rg–/–GE基因组当量HBV乙型肝炎病毒IC5050%抑制浓度IU/mL每毫升国际单位μM微摩尔min分钟nM纳摩尔PBS磷酸盐缓冲盐水PEG聚乙二醇PHH原代人肝细胞qPCR实时定量聚合酶链反应SD标准差sec秒UDG尿嘧啶DNA糖基化酶材料和方法病毒和细胞HepG2.2.15细胞在补充有10%FBS、1%Pen/Strep(Gibco,#15140)和G-418(250μg/mL)的DMEM+GlutamaxI培养基(Gibco,#21885)中培养HepG2.2.15细胞,并且用于产生感染性HBV(基因型D)。将来自三个T175烧瓶的90%汇合的细胞用胰蛋白酶消化并转移到一个胶原蛋白包被的hyperflask(550mL)中。一旦细胞汇合,则将培养基更换为含有1%DMSO和2.5%FBS的DMEM+GlutamaxI培养基。一旦细胞略微过度融合,则将培养基更换为补充有MEM非必需氨基酸(6mL,Gibco,#11140)、P/S(6mL)、丙酮酸钠(6mL)、DMSO(9mL)和FBS(10mL)(全部是每500mL培养基的量)的DMEM/F12+GlutamaxI培养基(Gibco,,#31331)。培养基每3天更换一次,收获上清液2周。通过PEG沉淀从上清液中浓缩病毒,通过qPCR测定滴度(基因组当量(GE)/mL)。简言之,将上清液与40%PEG溶液按照4:1的比例混合,在振荡器上于4℃孵育过夜,然后使用50mLfalcon管在4℃以3724g(RCF)离心1小时。弃去上清液,重新使用试管用新的上清液重复离心步骤,直至处理所有PEG沉淀的上清液。将沉淀以每ml107-109基因组当量(GE)的浓度重新混悬于WillamsE培养基(Gibco,#22551)中并在-80℃下冷冻。DNA拷贝数计算基于由已知浓度的HBV质粒稀释液产生的标准曲线。HepaRG细胞在工作生长培养基(具有50mL来自Biopredic的HepaRG生长补充剂、5mLGlutamax-I(Gibco,#35050)和5mLPen/Strep的500mLWillamsE培养基)中培养HepaRG细胞(BiopredicInternational,Saint-Gregoire,France)2周。2周后,将培养基更换为含有1.8%DMSO(500mLWillamsE培养基,其具有50mL来自Biopredic的HepaRG生长补充剂、5mLPen/Strep、5mLGlutamax-I和9mLDMSO)的分化培养基。培养基每周更换两次,直到2周。一旦完全分化,则用胰蛋白酶消化细胞并将其接种到分化培养基中的胶原蛋白化的96-孔板(在100μL中50,000μL/孔)或24-孔板(在500μL中300,000个细胞/孔)中。在它们感染HBV之前,将细胞在板中培养至少5天。PHH细胞本研究中的HBV阳性血清得自被HBV患者血清(基因型B,e阴性)感染的FRG小鼠(WuxiAppTec,#34459),给FRG小鼠尾静脉注射1×109GEHBV。在接种后第30天使用体外灌注装置使用胶原酶进行两步灌注分离PHH,将PHH接种在胶原蛋白化的24-孔板中用于离体组合处理。数据分析和计算模型等效线图模型使用Craig等人(CraigJ,DuncanI,WhittakerL和RobertsN.(1990)AntiviralsynergybetweeninhibitorsofHIVproteinaseandreversetranscriptase.AntiviralChem.Chemother.4:161-166)描述的模型分析组合实验结果。获得单独使用的和与其它化合物组合使用的化合物的EC50值。为了将这两个值联系起来并描述它们之间的协同/相加/拮抗程度,首先计算部分抑制浓度(FIC)并用于产生等效线图。简言之,FIC是组合药物的EC50与药物自身的EC50的比:FIC=比值[EC50组合:EC50单独]然后使用通过加入两种化合物的FIC获得的组合指数(CI)来描述组合中使用的化合物之间的作用。CI<1表示协同作用,CI=1表示相加作用,CI>1表示拮抗作用。CalcuSyn模型每个实验至少一式三份地进行,并独立进行3次。根据所有实验计算基于DNA拷贝数的HBV复制的平均抑制百分比,并且基于Chou和Talalay(ChouTC(2006)Theoreticalbasis,experimentaldesign,andcomputerizedsimulationofsynergismandantagonismindrugcombinationstudies.Pharmacol.Rev.,58:621-681)所述的Loewe相加模型使用Calcusyn软件(CalcuSyn版本2.11,Biosoft,Cambridge,UK)分析。为了进行CalcuSyn评价,使用来自棋盘板的每条泳道的药物组合的恒定浓度比的三条对角线泳道的数据(在表2中以粗体标出)。在第一步中,该程序将每种药物或药物组合的剂量-效应曲线转换为中位数效应图。然后通过以下方程计算每个实验组合的组合指数(CI)(对于相互非排他的相互作用):[(D)1/(Dx)1]+[(D)2/(Dx)2]+[(D)1(D)2/(Dx)1(Dx)2]其中(Dx)1和(Dx)2是当每种药物单独使用时具有x效应的药物1和药物2的剂量,(D)1和(D)2是当它们分别组合使用时具有相同的x效应的药物1和药物2的剂量。用软件计算组合的50%、75%和90%抗病毒作用下的CI。基于总CI值(在50%、75%和90%效应水平下的CI值的平均值)如下进行组合效应评价:CI值<0.7为协同作用,0.7-0.9为轻度至中度协同作用,0.9-1.1为相加作用,1.1至1.5为轻度至中度的拮抗作用,>1.5为拮抗作用(ChouTC(2006).Theoreticalbasis,experimentaldesign,andcomputerizedsimulationofsynergismandantagonismindrugcombinationstudies.Pharmacol.Rev.,58:621-681)。在跨越且包括它们的EC50的近似比例的3种不同的固定药物比例下分析药物组合。MacSynergy模型每个实验至少一式三份地进行。根据所有实验计算基于DNA拷贝数的HBV复制的平均抑制百分比,使用MacSynergyTMII文件(MarkNealPrichard,UniversityofMichigan,USA)进行分析。该程序允许使用Bliss-Independence模型对两种化合物进行三维检查。由复制数据确定置信界限。如果95%置信水平不与理论相加表面重叠,则两种药物之间的相互作用显著不同于相加作用。如果相互作用仅为相加作用,则得到的表面将以高于计算值的0%抑制下的水平面的形式出现。平面上方的任何峰都表示协同作用。类似地,任何平面的下降都表明拮抗作用。实验剂量-响应表面周围的置信区间用于以统计学方式评价数据,计算峰的体积且用于定量所产生的协同作用的量。实施例1.在HepaRG细胞中用Roferon进行的组合研究对于分化的HepaRG细胞的HBV感染,移除培养基并添加含有4%PEG-8000和病毒储备液(20-30GE/细胞)的新的分化培养基(120μL/孔)。将细胞在37℃下培养16-20小时,然后除去培养基,用PBS洗涤细胞4次,加入新的分化培养基(120μL/孔)。感染后第4天,除去培养基,向每个孔中加入100μL新的分化培养基。从15μL未稀释的化合物(最高测试浓度的400倍浓度)开始在100%DMSO(HBV衣壳组装抑制剂)或培养基(Roferon)中制备药物A和药物B的3倍连续稀释液(5μL化合物至10μLDMSO)。然后按照表2所示的设计将5μL药物A和药物B稀释液以棋盘方式添加到在96-孔板中的990μL培养基(含有1.3%DMSO)中。将其100μL加入到dHepaRG细胞中,最终DMSO浓度为1.8%。对于药物A(化合物1或化合物4),测试的浓度范围为100nM至1.23nM,而对于药物B(Roferon),测试的浓度范围为30IU/mL至0.04IU/mL。培养基在感染后第7天用具有化合物的新培养基替换,在感染后第11天收获细胞上清液并直接用于HBVDNA提取或储存于-20℃。使用下文所述的细胞存活率测定法测定了细胞的细胞存活率。表2.具有Roferon的组合的板布局X:PBSCC:细胞对照(未感染的)VC:病毒对照ETV:参比对照(200nM恩替卡韦)A1-5:药物A的系列稀释液B1-7:药物B的系列稀释液A1+B7:不同比例的药物A和B的组合的实例DNA提取和qPCR使用MagNAPure96(Roche)机器人提取来自dHepaRG细胞上清液的HBVDNA。将100μL上清液在具有200μLMagNAPure96外部裂解缓冲液(Roche,目录号06374913001)的处理盒中混合并孵育10分钟。然后使用“MagNAPure96DNA和病毒核酸小体积试剂盒”(Roche,目录号06543588001)和“病毒NA血浆SV外部裂解2.0”方案提取DNA。DNA洗脱体积为50μL。提取的HBVDNA的量化使用TaqmanqPCR机器(ViiA7,lifetechnologies)进行。每个DNA样品在PCR中一式两份地进行测试。将5μLDNA样品加入到在384-孔板中的15μL含有10μLTaqMan基因表达主混合物(AppliedBiosystems,目录号4369016)、0.5μLPrimeTimeXLqPCR引物/探针(IDT)和4.5μL蒸馏水的PCR混合物中,使用以下设置进行PCR:UDG孵育(2min,50℃),酶活化(10min,95℃)和PCR(40个循环15秒,95℃变性1min,60℃退火和延伸)。通过ViiA7软件基于HBV质粒DNA标准曲线由Ct值计算DNA拷贝数。TaqMan引物和探针(IDT)序列正向核心引物(F3_核心):CTGTGCCTTGGGTGGCTTT(SEQID:No.1)反向引物(R3_核心):AAGGAAAGAAGTCAGAAGGCAAAA(SEQID:No.2)Taqman探针(P3_核心):56-FAM/AGCTCCAAA/ZEN/TTCTTTATAAGGGTCGATGTCCATG/3IABkFQ(SEQID:No.3)细胞存活率测定法使用CellTiter-发光细胞存活率测定法(Promega,目录号G7572)在感染后第11天测定HBV感染的且处理的HepaRG细胞的细胞存活率。将100μLCTG试剂加入到细胞的每个孔中,孵育10min,将每个孔的80μL转移到新的白色96孔板中。使用Envision读数器(PerkinElmer)测量发光(0.2秒)。组合研究采用CalcuSyn软件分析化合物1与Roferon之间的相互作用。研究和计算结果如表3、4和5中所示。3种不同浓度比例的总CI为0.41-0.66,因此化合物1与Roferon的组合是协同的。还采用等效线图模型分析了化合物1与Roferon之间的相互作用(图1)。对于每个实验将化合物1与Roferon的组合的FIC值用一个对另一个的方式绘图。分析显示大部分CI值<1。因此,化合物1与Roferon的组合是协同的。采用CalcuSyn软件分析化合物4与Roferon之间的相互作用。研究和计算结果如表3、4和5中所示。3种不同浓度比例的总CI为0.69-0.77,因此化合物4与Roferon的组合是中度协同的。还采用等效线图模型分析了化合物4与Roferon之间的相互作用(图2)。对于每个实验将化合物4与Roferon的组合的FIC值用一个对另一个的方式绘图。分析显示大部分CI值<1。因此,化合物4与Roferon的组合是协同的。所述组合中没有任何组合对细胞存活率具有显著影响。表3.组合研究中所用的各化合物的平均EC50±SD值表3中所示的结果是来自n次独立实验的HBV感染的HepaRG细胞中各化合物的平均EC50±SD值。表4.组合研究中所用的各化合物的细胞毒性分析表4中所示的结果是在n次独立实验中用于处理HBV感染的HepaRG细胞的各化合物的最大浓度下的平均%细胞存活率±SD。进行细胞毒性分析以证实药物未显示可能干扰抗病毒活性的细胞毒性作用(也在高浓度下)。表5.配对棋盘组合的基于CalcuSyn的组合指数(HBVDNA)a)独立实验的数量b)评价基于上文“数据分析和计算模型”部分中所述的总CI值。用不同的药物组合处理HBV感染的HepaRG细胞,采用CalcuSyn软件评价对HBVDNA的作用,计算结果如表5中所示。3TC和3TC的组合在本测定法中用作相加作用对照。实施例2.在PHH细胞中用Pegasys进行的组合研究从HBV感染的FRG小鼠中分离PHH细胞并将其接种在胶原蛋白化的24-孔板中用于离体组合处理,第二天用化合物4与Pegasys的连续组合处理HBV感染的PHH。将化合物首先在DMSO中连续稀释至100×终浓度,然后用培养基进一步稀释。Pegasys在培养基中连续稀释至100×终浓度,然后用培养基进一步稀释。培养基中DMSO的最终浓度为2%。从第0天到第6天,用化合物4(B1:3μM,B2:300nM,B3:30nM,B4:3nM)对HBV感染的PHH细胞进行单处理6天,用10nMETV(E)作为对照。每2天用化合物4更新培养基,每次收集培养物上清液。从第6天起,用Pegasys(A3:0.03IU/mL,A2:0.3IU/mL,A1:3IU/mL)和化合物4(B1:3μM,B2:300nM,B3:30nM,B4:3nM,10nMETV作为对照)再处理24天,然后每2天用上述化合物更新培养基,并且每次收集培养物上清液用于分析。按照表6进行板布局(一式三份)。表6.在PHH细胞中具有Pegasys的组合的板布局123456aVCB1B2B3B4ETVbA3A3+B1A3+B2A3+B3A3+B4ETV+A3cA2A2+B1A2+B2A2+B3A2+B4ETV+A2dA1A1+B1A1+B2A1+B3A1+B4ETV+A1VC:病毒对照ETV:参比对照(10nM恩替卡韦)A1-3:药物A的系列稀释液B1-4:药物B的系列稀释液A3+B1:不同浓度的药物A和B的组合的实例E+A1:作为对照的ETV和药物A的组合的实例DNA提取和qPCR根据手册用QIAamp96DNA血液试剂盒分离血清中的DNA,并通过实时PCR(快速实时PCR系统,ABI)定量。将10μLDNA样品加入到在96孔板中含有12.5μL主混合物、1μLHBV引物正向/反向、0.5μLHBV特异性探针的15μLPCR主混合物中,即用于DNA拷贝数计算的标准的HBV质粒DNA。qPCR在95℃下进行10min,然后在95℃下循环15秒,60℃下1min,40个循环。TaqMan引物和探针的序列:正向引物:5’-GTGTCTGCGGCGTTTTATCA-3’(SEQID:No.4)反向引物:5’-GACAAACGGGCAACATACCTT-3’(SEQID:No.5)探针:FAM5’-CCTCTKCATCCTGCTGCTATGCCTCATC-3’Tamra(SEQID:No.6)组合研究检验了组合化合物4与Pegasys对HBVDNA的抗-HBV活性,采用MacSynergyII分析化合物4与Pegasys的相互作用(图3),得到的表面显示了显示协同作用的高于平面的峰,log体积是9.79,因此化合物4与Pegasys的组合是协同的。实施例3.在HepaRG细胞中用Pegasys进行的组合研究将dHepaRG细胞接种于24-孔板中以恢复7天,然后进行HBV感染,将含有4%PEG-8000的分化培养基(300μL/孔)中的HBV病毒(200GE/细胞)添加至dHepaRG细胞中16小时,然后用PBS洗涤细胞3次,加入新的分化培养基,培养基每3天更新一次。在病毒感染后的第13天,用化合物3和Pegasys的连续组合处理HBV感染的dHepaRG细胞。化合物首先在DMSO中连续稀释成100×终浓度,然后用培养基进一步稀释。Pegasys在培养基中连续稀释至100×终浓度,然后用培养基进一步稀释。培养基中DMSO的最终浓度为2%。从第13天开始,用化合物3(B1:100nM,B2:20nM,B3:5nM)对HBV感染的HepaRG细胞进行单处理5天,用10nMETV(E)作为对照。每2.5天更新一次培养基,包含化合物,每次收集培养物上清液。在5天单处理后,将dHepaRG细胞用Pegasys(A1:3IU/mL,A2:0.3IU/mL,A3:0.03IU/mL)和化合物3(B1:100nM,B2:20nM,B3:5nM,ETV作为对照)再处理10天,每2.5天用上述化合物更新培养基,每次收集培养物上清液用于分析。表7中列出了板布局(一式三份)。表7.在HepaRG细胞中具有Pegasys的组合的板布局123456aUCVCB1B2B3ETVbVCA1A1+B1A1+B2A1+B3ETV+A1cVCA2A2+B1A2+B2A2+B3ETV+A2dVCA3A3+B1A3+B2A3+B3ETV+A3UC:未感染的对照(前-S1肽用作进入抑制剂)VC:病毒对照ETV:参比对照(10nM恩替卡韦)A1-3:药物A的系列稀释液B1-3:药物B的系列稀释液A1+B1:不同浓度的药物A和B的组合的实例E+A1:作为对照的ETV和药物A的组合的实例DNA提取和qPCR根据手册用MagNApure96仪器分离给定时间的培养物上清液中的DNA并通过实时PCR(LightCycler480II,Roche)进行定量。将5μLDNA样品加入到384-孔板中的含有10μL主混合物、0.5μLHBV引物正向/反向、0.25μLHBV特异性探针和3.75μLddH2O的15μLPCR主混合物中,即用于DNA拷贝数计算的标准的HBV质粒DNA。PCR在95℃下进行10min,然后在95℃下循环15秒,60℃下1min,40个循环。TaqMan引物和探针的序列:正向引物:5’-AAGAAAAACCCCGCCTGTAA-3’(SEQID:No.7)反向引物:5’-CCTGTTCTGACTACTGCCTCTCC-3’(SEQID:No.8)探针:5'-TAMRA+CCTGATGTGATGTTCTCCATGTTCAGC+BHQ2-3'(SEQID:No.9)组合研究:检验了组合化合物3与Pegasys对HBVDNA的抗-HBV活性,采用MacSynergyII分析化合物3与Pegasys的相互作用(图4),得到的表面显示了显示协同作用的高于平面的峰,log体积是12.98,因此化合物3与Pegasys的组合是协同的。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- SPNP‑I在制备Nav1.7通道工具试剂中的应用的制造方法与工艺
- SPNP‑I在制备Nav1.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.3通道工具试剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.5通道抑制剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- 一种多肽在制备Nav1.3钠通道工具试剂中的应用的制造方法与工艺
- SPKP‑XI在制备Kv4.2通道抑制剂中的应用的制造方法与工艺
- SGLT‑2糖尿病抑制剂及其中间体的制备方法与流程