红景天苷或其可药用盐在制备防治阻塞性睡眠呼吸暂停诱导型高血压药物和保健品中的应用的制作方法
本发明涉及阻塞性睡眠呼吸暂停诱导型高血压治疗领域,特别涉及红景天苷在制备防治阻塞性睡眠呼吸暂停诱导型高血压药物和保健品中的应用。
背景技术:
阻塞性睡眠呼吸暂停(Obstructive sleep apnea,OSA)是指由咽部狭窄以及气道松弛引起的完全或部分上气道阻塞为特征的常见慢性疾病,其主要表现为夜间睡眠时打鼾、呼吸气流消失或受限导致间歇性低氧和睡眠片段化,由此出现日间嗜睡,可累及呼吸、循环和代谢等多器官多系统。在美国,约有26%的成人患有不同程度的OSA;2016年《睡眠白皮书》显示:我国20.4%的成人患有OSA,且随着肥胖症的流行,OSA发病率呈逐年增加的趋势。
越来越多的研究证据表明,OSA是高血压发生和进展的独立危险因素。流行病学调查显示,OSA患者高血压发生率为50%,高血压患者OSA发生率为30%[1],顽固性高血压患者合并OSA发生率高达83%[2];中重度OSA患者4年后发生高血压概率为未患OSA者的3倍之多[3]。美国高血压预防、治疗和评价委员会第七次报告中已经把OSA列为继发性高血压的病因之一[4]。2013年欧洲高血压学会/欧洲心脏病学会(ESH/ESC)发布的高血压指南也指出OSA是导致顽固性高血压发生发展的原因之一[5]。
OSA以慢性间歇性缺氧(Chronic intermittent hypoxia,CIH)为核心病理特征,表现为睡眠中由上气道塌陷堵塞引起的长期并反复出现缺氧-复氧,间歇性口鼻呼吸气流消失持续10秒以上,使机体出现间歇低氧和睡眠结构紊乱。OSA模式CIH不同于急性缺氧或慢性缺氧,主要区别在于缺氧频率和持续时间的不同以及复氧事件的有无,这是与心脑血管意外导致的急性缺氧、慢性阻塞性肺病导致的慢性缺氧以及高原缺氧的本质不同之处。已有研究表明,缺氧-复氧所产生的氧化应激和炎症反应对心血管系统造成的损害可能比持续性慢性缺氧更为显著[6]。
动物模型的发展进一步证实了OSA模式CIH与高血压间的因果关系。目前OSA诱导型高血压和心血管病模型建立主要选用成年雄性啮齿类动物(大鼠、小鼠),选用能够自动控制气体输入、高精度氧浓度实时检测、密闭性良好的动物三气培养箱(应用最广的仪器如美国BioSpherix公司的OxyCyler model A84system),通过输入氮气、氧气等不同气体改变培养箱内的氧浓度,使其在5%-10%至空气氧浓度(21%)间循环变化。每日处理8-12h,连续处理约4-12周,可观察到动脉氧分压(PO2)及氧饱和度(SaO2)的间歇性降低和恢复、血压升高、氧化应激、炎症反应、血管内皮损伤、动脉斑块形成等心血管病理变化[10-14]。研究表明,OSA模式CIH主要通过刺激血管内皮细胞、平滑肌细胞和巨噬细胞释放ROS,激活氧化应激,启动多种细胞因子生成和释放,促进炎症过程发生发展,导致内皮功能障碍及血管重塑,并增强血管收缩,最后导致高血压的发生[15]。同时,CIH诱导的高血压还与中枢及外周神经系统和转录因子等方面紧密相关[10,16]。
由于CIH这一独特而重要的参与因素,OSA诱导型高血压的发生发展不同于经典的原发性高血压和其他因素引起的继发性高血压,由此导致其治疗方法相对于其他类型的高血压具有特殊性。另外,OSA患者的高血压还具有夜间“反勺型”特征[9],与其他类型高血压相比,“反勺型”高血压具有更严重的器官损害和心血管不良事件后果。
目前在临床上对于OSA诱导型高血压的治疗手段主要包括传统降压药物治疗、持续气道正压通气(Continuous positive airway pressure,CPAP)治疗或其二者的组合、外科手术等。在临床研究中发现,尽管OSA诱导型高血压和其他原因引起的高血压都出现类似的内皮依赖性舒张功能障碍,但对伴有OSA的高血压患者,单纯应用降压药物治疗效果较差。传统降压药物如ACEI、β-受体阻滞剂不仅疗效有限,还会引起喉咽部炎症,增加患者体重,加剧上气道水肿和阻塞[17]。利尿剂虽然可以减少咽部的水肿,但长期应用会干扰糖代谢[18]。目前并无明显的降压药物被反复证实对OSA诱导型高血压有效[19-20]。CPAP治疗可一定程度控制这类患者血压。同时,对于顽固性高血压患者,与其他高血压患者相比较,使用CPAP治疗血压下降的效果更明显[2,7,8]。然而,虽然CPAP效果显著,但其疗效更多依赖于患者依从性,并且其仪器价格昂贵、使用不便,鼻咽部不舒适、憋气感、机器噪音大,严重影响了CPAP的应用推广[21]。鼾症手术适应症要求严格,亦无法达到理想的降压效果。
目前尚无能够明确防治OSA诱导型高血压的药物的报道。因此,针对OSA诱导型高血压独特的发病机制,开发安全有效的OSA诱导型高血压的防治药物迫在眉睫。
红景天苷(Salidroside,Sali)是一种重要的酪醇类化合物,化学名称为2-(4-羟基苯基)乙基-β-D-葡萄糖苷,分子式为C17H20O7(相对分子质量300.3,CAS登录号为10338-51-9,结构式如图1),在室温条件下为无色透明针状结晶,熔点158℃-160℃,可溶于水、乙醇、正丁醇等物质。该化合物是药用植物红景天的特征性单体成分,除主要从植物根、茎提取外,亦可通过其他途径合成。中医学认为,红景天具有抗缺氧和抗疲劳的功效,现代药理学研究也证实红景天及特征单体成分红景天苷具有抗氧化、抗炎、抗肿瘤、改善动脉粥样硬化[22]、改善慢性缺氧诱导的肺动脉高压[23]、保护慢性间歇性缺氧诱导的心肌细胞凋亡[24]等多种药理活性,应用前景广阔。
中国专利申请公布号CN103463115A公开了红景天苷在制备防治高血压药物中的应用,其唯一的实施例中使用了自发性高血压大鼠(SHR)作为动物模型,这是一种模拟原发性高血压的经典动物模型,而且全文未提及OSA诱导型高血压这一特殊的高血压类型。鉴于原发性高血压与OSA诱导型高血压对降压药显著不同的响应性、OSA诱导型高血压所面临的CIH这一独特的病理特征以及现有技术的相关教导(如上所述),有充分的理由可以确信该篇专利的作者并未意识到红景天苷能够用于治疗OSA诱导型高血压。
技术实现要素:
一方面,本发明提供了红景天苷或其可药用盐在制备治疗阻塞性睡眠呼吸暂停诱导型高血压的药物中的应用,其中红景天苷或其可药用盐以治疗有效量存在于所述药物中。
优选地,所述药物的给药途径为口服和/或肠胃外途径。
优选地,所述肠胃外途径包括经表面、颊、舌下、肺、透皮、透粘膜以及静脉内、皮下、腹膜内和/或肌内注射。
优选地,所述药物还包含可药用的赋形剂。优选地,所述可药用的赋形剂选自稀释剂、增溶剂、醇类、粘合剂、受控释放聚合物、肠溶聚合物、崩解剂、着色剂、调味剂、甜味剂、抗氧化剂、防腐剂、颜料、添加剂、填充剂、悬浮剂和/或表面活性剂。
优选地,所述药物的剂型包括片剂、丸剂、胶囊剂、颗粒剂、散剂、咀嚼胶剂、混悬剂、乳液、栓剂、溶液和/或脂质体注射悬液。
优选地,所述红景天苷或其可药用盐以25-50mg/kg的剂量给药,例如30-45mg/kg、35-40mg/kg。
优选地,所述可药用盐包括衍生自无机酸和/或有机酸的盐。优选地,所述无机酸包括盐酸、氢溴酸、硫酸、氨基磺酸、磷酸和/或硝酸,所述有机酸包括乙酸、丙酸、琥珀酸、乙醇酸、硬脂酸、乳酸、苹果酸、酒石酸、柠檬酸、抗坏血酸、双羟萘酸、马来酸、羟基马来酸、苯基乙酸、谷氨酸、苯甲酸、水杨酸、对氨基苯磺酸、2-乙酰氧基苯甲酸、富马酸、甲苯磺酸、甲磺酸、乙二磺酸、草酸和/或羟乙磺酸。
另一方面,本发明提供了红景天苷或其可药用盐在制备预防阻塞性睡眠呼吸暂停诱导型高血压的保健品中的应用,其中红景天苷或其可药用盐以预防有效量存在于所述保健品中。
本发明人应用动物三气培养箱(环境氧浓度21%-5%,90秒/循环,10小时/天)模拟重度OSA患者慢性间歇性缺氧状态,建立OSA合并高血压小鼠模型,对大量受试化合物进行了筛选,从中发现红景天苷可缓解CIH诱导的高血压和内皮功能损伤,其作用机制与其改善CIH诱导血管内皮细胞氧化应激状态有关,具有防治OSA诱导型高血压的应用价值,由此完成了本发明。
附图说明
图1示出了红景天苷的化学结构式。
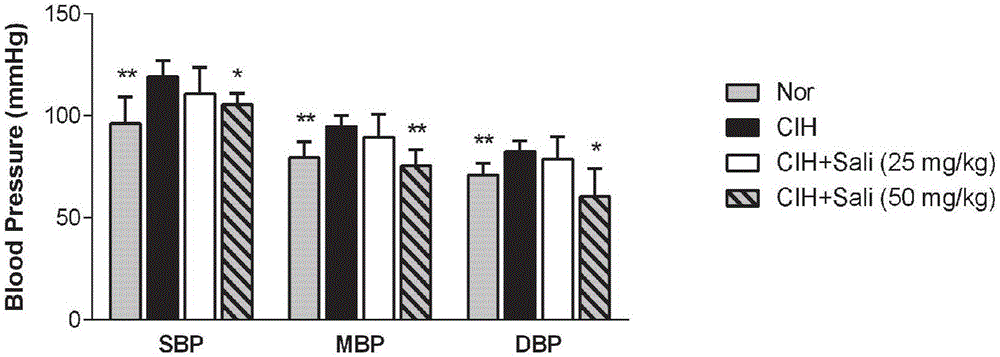
图2示出了红景天苷低剂量组(25mg/kg)和高剂量组(50mg/kg)灌胃给药对慢性间歇性缺氧C57小鼠血压的影响(n=10)。Nor,正常对照组;CIH,模型组;CIH+Sali(25mg/kg),红景天苷低剂量组;CIH+Sali(50mg/kg),红景天苷高剂量组。*P<0.05,**P<0.01,与模型对照组比较(t-检验)。
图3示出了红景天苷高剂量组(50mg/kg)灌胃给药对慢性间歇性缺氧C57小鼠内皮依赖舒张功能的影响。Nor,正常对照组;CIH,模型组;CIH+Sali(50mg/kg),红景天苷高剂量组。*P<0.05,与模型对照组比较(t-检验)。
图4示出了红景天苷低剂量组(25mg/kg)和高剂量组(50mg/kg)灌胃给药对慢性间歇性缺氧apoE小鼠血压的影响。Nor,正常对照组;CIH,模型组;CIH+Sali(25mg/kg),红景天苷低剂量组;CIH+Sali(50mg/kg),红景天苷高剂量组。**P<0.01,***P<0.001,与模型对照组比较(t-检验)。
图5示出了红景天苷高剂量组(50mg/kg)灌胃给药对慢性间歇性缺氧apoE小鼠内皮依赖舒张功能的影响。C57,C57正常对照组;Nor,正常对照组;CIH,模型组;CIH+Sali(50mg/kg),红景天苷高剂量组。*P<0.05,与模型对照组比较(t-检验)。
图6示出了红景天苷低剂量组(10μM)和红景天苷高剂量组(100μM)对慢性间歇性缺氧诱导的人脐静脉内皮细胞(HUVECs)氧化应激的影响(ROS探针为DCFH-DA)。CIH,慢性间歇性缺氧;Blank,正常对照组;CON,模型组;Sali 10μM,红景天苷低剂量组;Sali 100μM,红景天苷高剂量组。*P<0.05,与模型对照组比较(t-检验)。
具体实施方式
下面,将结合具体实施例对本发明进行更详细的说明,但本发明的范围将不限于此。
除非另有定义,本文中使用的所有技术和科学术语具有与本发明所属领域的普通技术人员所通常理解的相同的意义。在本文中具体提到的所有出版物,为包括描述和公开在出版物中报道的可能与本发明相结合使用的化学物质、仪器、统计分析和方法在内的所有目的,以其全部内容通过参考并入本文。在本说明书中引用的所有参考文献应该被视为指示了本领域的技术水平。本文中的任何内容不应被解释为承认本发明没有权利早于通过在先发明的这些公开。
当在本文中使用时,“可药用”包括在合理的医学判断范围内,适于与人类和动物的组织接触而无过多毒性、刺激性、过敏反应或者与合理的效益/风险比相称的其它问题并发症的那些化合物、材料、组合物和/或剂型。
当在本文中使用时,“可药用盐”包括所公开化合物的衍生物,其中母体化合物是通过制备其酸或碱盐来改性。可药用盐的实例包括但不限于碱性残余物如胺的无机或有机酸盐;酸性残余物如羧酸的碱或有机盐;等等。因此,术语“酸加成盐”包括已经通过添加酸来制备的母体化合物的相应盐衍生物。可药用盐包括例如由无机或有机酸形成的母体化合物的常规盐或季铵盐。例如,这些常规盐包括(但不限于)衍生自无机酸如盐酸、氢溴酸、硫酸、氨基磺酸、磷酸、硝酸等的那些盐;和由有机酸如乙酸、丙酸、琥珀酸、乙醇酸、硬脂酸、乳酸、苹果酸、酒石酸、柠檬酸、抗坏血酸、双羟萘酸、马来酸、羟基马来酸、苯基乙酸、谷氨酸、苯甲酸、水杨酸、对氨基苯磺酸、2-乙酰氧基苯甲酸、富马酸、甲苯磺酸、甲磺酸、乙二磺酸、草酸、羟乙磺酸等制备的盐。
当在本文中使用时,药物是根据可接受的制药程序来制备,例如Remington’s Pharmaceutical Sciences(雷明顿制药科学),第17版,Alfonoso R.Gennaro编,Mack Publishing Company,Easton,PA(1985)中所述。可药用载体包括可与制剂中的其它成分相容并且在生物学上可接受的载体。
当在本文中使用时,术语“包括”和“包含”是开放性术语,并且应该被解释为意味着“包括但不限于”。这些术语涵盖了更加限制性的术语“基本上由……构成”和“由……构成”。还应该指出,术语“包含”与“包括”、“特征在于”与“具有”可以互换使用。
当在本文中使用时,没有具体数量的指称包括其单数或复数指称物,除非上下文明确叙述不是如此。此外,无具体数量的指称、术语“一个或多个”和“至少一个”可以互换使用。
当提供值的范围时,应该理解,在所述范围的上下限之间的每个居间值和居间值的任何组合或子组合,以及所述陈述的范围内的任何其他陈述的或居间的值,都被涵盖在所叙述的值的范围之内。
当在本文中使用时,“给药”是指将化合物导入到受试者的身体中,优选导入到受试者的系统循环中,正如在下面更详细描述的。实例包括但不限于口服、表面、颊、舌下、肺、透皮、透粘膜以及皮下、腹膜内、静脉内和肌内注射,或采取通过消化道的液体或固体药剂的形式。
当在本文中使用时,化合物的“治疗有效量”是足以在疾病或病症的治疗或管理中提供治疗性益处,或延迟或最小化与所述疾病或病症相关的一种或多种症状的量。化合物的“治疗有效量”意味着单独或与其他疗法组合时,在所述疾病或病症的治疗或管理中提供治疗性益处的治疗药剂的量。术语“治疗有效量”可以涵盖改善总体治疗、减少或避免疾病或病症的症状或病因、或提高另一种治疗药剂的治疗效能的量。“治疗有效量”将随着化合物、待治疗的疾病状态、待治疗疾病的严重性、受试者的年龄和相对健康、给药途径和形式、主治医疗或兽医从业人员的判断和其他因素而变。
当在本文中使用时,化合物的“预防有效量”是足以在潜在的疾病或病症出现或发作之前提供预防性益处,或延迟或最小化与所述疾病或病症的一种或多种症状的出现或发作的量。化合物的“预防有效量”意味着单独或与其他预防疗法组合时,在所述潜在的疾病或病症的出现或发作前提供预防性益处的预防药剂的量。“预防有效量”将随着化合物、待预防的疾病种类、受试者的年龄和相对健康、给药途径和形式、主治医疗或兽医从业人员的判断和其他因素而变。
当在本文中使用时,术语“治疗”包括克服、缓解、减轻、解除或改善损伤、疾病或病症。术语“预防”是指在一定程度上防止潜在的预期损伤、疾病或病症。在某些情况下,术语“治疗”也包括“预防”。
当在本文中使用时,“受试者”包括哺乳动物和非哺乳动物。“哺乳动物”是指哺乳纲的任何成员,包括但不限于人类、非人类灵长动物例如黑猩猩和其他猿类和猴物种;农场动物例如牛、马、绵羊、山羊和猪,家畜例如兔、狗和猫;实验室动物包括啮齿动物例如大鼠、小鼠和豚鼠等。非哺乳动物的实例包括但不限于鸟类等。术语“受试者”不指示特定年龄或性别。本发明所针对的主要受试者是用血液透析治疗或接受血液透析的人类。术语“受试者”在本文中可以与术语“患者”或“个体”互换使用。
本发明的化合物可以以纯物质或与常规药物载体组合经口或经肠胃外施用。可应用的固体载体可包括还可充当调味剂、润滑剂、增溶剂、悬浮剂、填充剂、助流剂、压缩助剂、粘合剂或片剂崩解剂或封装材料的一种或多种物质。在粉末中,载体是与细粉状活性成分混合的细粉状固体。在片剂中,将活性成分与具有必要压缩特性的载体以适当比例混合并压制成所需的形状和尺寸。散剂和片剂优选含有高达99%的活性成分。合适的固体载体包括例如磷酸钙、硬脂酸镁、滑石、糖、乳糖、糊精、淀粉、明胶、纤维素、甲基纤维素、羧甲基纤维素钠、聚乙烯吡咯烷、低熔点蜡和离子交换树脂。
口服制剂是优选的并且本发明相比于相关产品具有在足够水平下容易被哺乳动物吸收以使得本发明化合物作为治疗剂具口服活性的优点。用于口服或注射使用的制剂是基于足够的溶解度以允许治疗剂进入胃中或可注射介质中的溶液。合适的药物制剂包括(但不限于)片剂、丸剂、胶囊剂、小药囊、颗粒剂、散剂、咀嚼胶剂、混悬剂、乳液、栓剂和溶液。用于口服使用的优选实施方式是所有品种的片剂和胶囊剂。用于注射或输液的优选实施方式是不含微生物的溶液。在适当和必要时,制剂可包括稀释剂、粘合剂、分散剂、表面活性剂、润滑剂、包衣材料、调味剂、着色剂、控制释放制剂、甜味剂或任何其它的可药用添加剂,例如明胶、羟乙酸淀粉钠、乳糖、淀粉、滑石、硬脂酸镁、微晶纤维素、聚维酮、氢化或不饱和的油、聚乙二醇、糖浆或其它水溶液。当制剂是片剂或胶囊剂等时,所述制剂可呈现为预测量的单位剂量形式或呈现于多剂量容器中,可从所述容器中提取适当的单位剂量。
当在本文中使用时,“口服剂型”可以包括胶囊(即由外壳和填充物构成的固体口服剂型),其中外壳由单一密封外套或配合在一起并有时用带子密封的两个半外套构成,并且其中胶囊外壳可以由明胶、淀粉或纤维素或其他适合的材料制成,可以是软质或硬质的,并且填充有可以倾倒或挤压的固体或液体成分。口服剂型也可以是胶囊或包衣球粒,其中将药物包封在由适合形式的明胶制成的硬质或软质的可溶性容器或“外壳”内。药物本身可以采取颗粒的形式,所述颗粒已被施加不同量的包衣,或者采取延迟释放包衣胶囊形式,其中药物被包封在由适合形式的明胶制成的硬质或软质的可溶性容器或“外壳”内。此外,可以将胶囊覆盖在指定的包衣中,其以与作为常规剂型存在的一种或多种药物相比,至少允许降低给药频率的方式释放一种或多种药物。
口服剂型还可以是延迟释放胶囊,其中药物被包封在由适合形式的明胶制成的硬质或软质的可溶性容器内,并且其在不是给药后立即的其他时间释放药物(或多种药物),因此肠溶包衣制品是延迟释放剂型。药物被包封在硬质或软质容器或“外壳”内的延迟释放球粒胶囊,也是有用的。在这些情形中,药物本身采取已被施加肠溶包衣的颗粒的形式,因此将药物的释放延迟到它通入到肠中为止。延迟释放胶囊和薄膜包衣延迟释放胶囊,也是有用的。
此外,将胶囊覆盖在指定的薄膜包衣中,其以与作为常规剂型存在的一种或多种药物相比,至少允许降低给药频率的方式释放一种或多种药物。明胶包衣的胶囊(其中药物被包封在由适合形式的明胶制成的硬质或软质的可溶性容器内的固体剂型;通过加带过程,将胶囊用另外的明胶层包衣,以便形成完整密封),液体填充的胶囊(一种固体剂型,其中药物被包封在通过添加多元醇例如山梨糖醇或甘油而增塑,并且因此具有比硬壳胶囊略微更稠的稠度的可溶性明胶外壳内)。
其他形式包括丸剂(旨在用于口服给药的含有药剂的小的圆形固体剂型)、粉剂(可能旨在内服或外用的干燥的细粉药物和/或化学物质的密切混合物)、酏剂(含有溶解的药剂的透亮、香味宜人的增甜的含水酒精液体;它旨在口服使用)、咀嚼胶剂(各种不同形状的增甜和调味的不溶性塑性材料,其在被咀嚼时将药物物质释放到口腔中)、糖浆(含有高浓度蔗糖或其他糖类的口服溶液;该术语也被用于包括在甜味和粘性介质中制备的任何其他液体剂型,包括口服悬液)、片剂(含有药物、带有或不带有适合的稀释剂的固体剂型)、咀嚼片剂(用于咀嚼的含有药物、带有或不带有适合的稀释剂的固体剂型,其在口腔中产生口味怡人的残留物,所述残留物易于吞咽并且不留下苦味或令人不快的余味)、包衣片剂或延迟释放片剂、可分散片剂、泡腾片剂、延迟释放片剂、薄膜包衣片剂或薄膜包衣延迟释放片剂,其中片剂被配制成使得所包含的药物可以在摄入后长时间段内可用。
在其他形式中,可以提供溶液用片剂、悬液用片剂、多层片剂、延迟释放多层片剂,其中片剂被配制成与作为常规剂型存在的药物相比,至少允许降低给药频率。口服崩解片剂、口服崩解延迟释放片剂、可溶性片剂、糖衣片剂、渗透片剂等,也是适合的。
口服剂型组合物可以包含活性药物成分和一种或多种无活性的赋形剂,例如稀释剂、增溶剂、醇类、粘合剂、受控释放聚合物、肠溶聚合物、崩解剂、着色剂、调味剂、甜味剂、抗氧化剂、防腐剂、颜料、添加剂、填充剂、悬浮剂、表面活性剂(例如阴离子型、阳离子型、两性或非离子型)等。各种FDA批准的表面用无活性成分可以在FDA的“无活性成分数据库”(The Inactive Ingredients Database)中找到,该数据库含有制造商旨在用于此目的的无活性成分,其中根据21CFR 210.3(b)(7)中给出的活性成分的定义,无活性成分在某些情况下也可以被当作活性成分。酒精是取决于产品配方、可以被当作有活性或无活性的成分的良好实例。
当在本文中使用时,肠胃外施用的剂型包括但不限于可注射脂质体,其由脂质体构成或形成脂质体(通常由磷脂构成的脂质双层囊泡,其被用于包封活性药物物质)。包含无菌制剂的旨在肠胃外施用的注射液,也是适合的。包括由无菌、无热原制剂构成的乳液,旨在肠胃外给药的注射乳液或脂质复合物注射液,也是适合的。
其他形式包括用于溶液注射的粉剂,其是无菌制剂,旨在重构以形成用于肠胃外使用的溶液;用于悬液注射的粉剂,其是无菌制剂,制造重构以形成用于肠胃外使用的悬液;用于脂质体悬液注射的冷冻干燥的粉剂,其是无菌的冷冻干燥的制剂,旨在重构用于肠胃外使用,其被配制成允许在重构后形成脂质体(通常由磷脂构成的脂质双层囊泡,其被用于将活性药物物质包封在脂质双层内或水性空间中);用于溶液注射的冷冻干燥的粉剂,其是通过冻干(“冷冻干燥”)制备的旨在用于溶液的剂型,所述冻干是涉及在极低压力下,在冷冻状态下从产品除去水的过程。
这旨在用于随后添加液体以产生在所有方面符合注射要求的溶液;用于注射悬液的冻干粉剂,所述注射悬液是旨在肠胃外使用的含有悬浮在适合的流体介质中并在所有方面符合无菌悬液要求的液体制剂;旨在用于悬液的药剂通过冻干(“冷冻干燥”)来制备,所述冻干是涉及在极低压力下,在冷冻状态下从产品除去水的过程;注射溶液,其是含有溶解在适用于注射的适合的溶剂或互溶溶剂的混合物中的一种或多种药物的液体制剂;注射溶液浓缩物,其是用于肠胃外使用的无菌制剂,在添加适合的溶剂后产生在所有方面符合注射要求的溶液。
注射悬液包含适用于注射的液体制剂,其由分散在粒子不溶于其中的整个液相中的固体粒子构成,所述液相也可以由分散在整个水性相中的油相或分散在整个油相中的水性相构成。脂质体注射悬液包含适合于注射的液体制剂,其由分散在整个水性相中的油相构成,以便形成脂质体(通常由磷脂构成的脂质双层囊泡,其被用于将活性药物物质包封在脂质双层内或水性空间中)。超声注射悬液包含适合于注射的液体制剂,其由分散在粒子不溶于其中的整个液相中的固体粒子构成。此外,当将气体鼓泡通过悬液时对产品进行超声,这导致由固体粒子形成微球。
肠胃外载体系统包括一种或多种制药上适合的赋形剂,例如溶剂和共溶剂、增溶剂、润湿剂、悬浮剂、增稠剂、乳化剂、螯合剂、缓冲剂、pH调节剂、抗氧化剂、还原剂、抗微生物防腐剂、增量剂、防护剂、渗涨度调节剂和特殊添加剂。适合于肠胃外给药的配方方便地包含活性成分的无菌油性或水性制剂,其优选地与受体的血液等渗。
液体载体可用于制备包括溶液、混悬液、乳液、糖浆和酏剂的制剂。可以将本发明化合物溶解或悬浮在可药用液体载体例如水、有机溶剂、两者的混合物或者可药用油或脂肪中。液体载体可含有其它合适的药物添加剂,例如增溶剂、乳化剂、缓冲剂、防腐剂、甜味剂、调味剂、悬浮剂、增稠剂、色素、粘度调节剂、稳定剂或渗透调节剂。适于经口和肠胃外施用的液体载体的实例包括水(特别地含有如上文的添加剂,例如纤维素衍生物,优选羧甲基纤维素钠溶液)、醇类(包括一元醇和多元醇例如二醇)和它们的衍生物,以及油类(例如分馏椰子油和花生油)。对于肠胃外施用,载体也可以是油性酯,例如油酸乙酯和肉豆蔻酸异丙酯。无菌液体载体被用于供肠胃外施用的无菌液体形式组合物中。作为无菌溶液或混悬液的液体药物组合物可通过例如肌肉内、腹膜内或皮下注射来施用。
无菌溶液也可以经静脉内施用。口服施用可为液体或固体组合物形式。可注射形式可为可药用液体例如无菌无热原质水或肠胃外可接受的油或液体混合物中的水性或非水性溶液、混悬液或乳液,其可含有抑菌剂、抗氧化剂或其它防腐剂和稳定剂、缓冲剂(优选但不限于6.5-7.7的生理pH范围)、使得溶液与血液等渗的溶质、增稠剂、悬浮剂或其它可药用添加剂。这些形式将呈现为单位剂量形式,例如安瓿或一次性注射装置,或多剂量形式,例如可提取适当剂量的瓶子,或可用于快速制备可注射制剂的固体形式或浓缩物。所有用于注射的制剂优选为无菌和无热原质的。含有所述化合物的栓剂也将含有合适的载体,例如可可脂、聚乙二醇或其它目前发展水平的载体。
优选地,本发明的组合物呈单位剂量形式,例如呈片剂、胶囊剂、散剂、溶液、混悬液、乳液、颗粒剂或栓剂形式。在这种形式中,组合物被细分成含有适量活性成分的单位剂量;所述单位剂型可为包装组合物,例如包装粉末,含有液体的小瓶、安瓿、预填充注射器或小药囊。单位剂型可以是例如胶囊剂或片剂本身,或者它可以是适当数目的呈包装形式的任何这样的组合物。
通常,活性成分可以被溶解或悬浮在液体介质中,可以是颗粒(小粒子或细粒)、球粒(含有或不含赋形剂的由高度纯化的药物构成的小的无菌固体物质,其通过颗粒形成或通过压制和模制来制造)或延迟释放包衣的球粒(一种固体剂型,其中药物本身采取颗粒的形式,所述颗粒已被施加不同量的包衣,并且其以与作为常规剂型存在的一种或多种药物相比,允许降低给药频率的方式释放一种或多种药物)。
实施例
实施例1:红景天苷对慢性间歇性缺氧诱导的C57BL/6J小鼠高血压的影响
40只C57BL/6J小鼠随机分为4组,每组10只,分别为正常对照组、模型组、红景天苷低剂量组(25mg/kg)、红景天苷高剂量组(50mg/kg),其中红景天苷购自南京贝塔生物科技有限公司,货号10189(下同)。除正常对照组动物外,各组动物均置于动物三气培养箱中(Oxycycler Model A42;BioSpherix Instruments,Redfield,NY,USA),通过调节缺氧参数使环境氧浓度达到21%-5%,90秒/循环,10小时/天,以模拟阻塞性睡眠呼吸暂停患者的慢性间歇性缺氧状态,共7周。同时正常组和模型组动物灌胃给予蒸馏水,各给药组分别灌胃给予红景天苷25mg/kg和50mg/kg,每天一次,共7周。利用动物血压记录仪检测小鼠的血压,利用血管张力测定仪(DMT620M,DMT,Denmark)检测内皮依赖舒张功能变化。
结果表明,慢性间歇性缺氧饲养7周的C57小鼠收缩压、舒张压和平均压显著增加,主动脉血管的内皮依赖性舒张功能受损。红景天苷50mg/kg可显著降低由慢性间歇性缺氧诱导升高的C57小鼠收缩压、舒张压和平均压,红景天苷25mg/kg对慢性间歇性缺氧诱导的C57血压升高具有一定程度的改善作用(图2)。红景天苷50mg/kg可显著改善CIH导致的C57小鼠血管内皮依赖性舒张功能损伤(图3)。提示红景天苷明显改善了C57小鼠由阻塞性睡眠呼吸暂停模式的慢性间歇性缺氧引起的高血压和血管功能损伤,具有保护作用。
实施例2:红景天苷对慢性间歇性缺氧诱导的apoE小鼠高血压的影响
40只apoE小鼠随机分为4组,每组10只,分别为正常对照组、模型组、红景天苷低剂量组(25mg/kg)、红景天苷高剂量组(50mg/kg)。除正常对照组动物外,各组动物均置于动物三气培养箱中(Oxycycler Model A42;BioSpherix Instruments,Redfield,NY,USA),通过调节缺氧参数使环境氧浓度达到21%-5%,90秒/循环,10小时/天,以模拟阻塞性睡眠呼吸暂停患者的慢性间歇性缺氧状态,共7周。同时正常组和模型组动物灌胃给予蒸馏水,各给药组分别灌胃给予红景天苷25mg/kg和50mg/kg,每天一次,共7周。另以10只C57BL/6J小鼠作为C57正常对照组。利用动物血压记录仪检测小鼠的血压,利用血管张力测定仪(DMT620M,DMT,Denmark)检测内皮依赖舒张功能变化。
结果表明,慢性间歇性缺氧饲养7周的apoE小鼠收缩压和平均压显著增加,主动脉血管的内皮依赖性舒张功能受损。红景天苷25mg/kg和50mg/kg可显著降低由慢性间歇性缺氧诱导升高的apoE小鼠收缩压和平均压,具有一定的剂量依赖性(图4)。红景天苷50mg/kg可显著改善CIH导致的apoE小鼠血管内皮依赖性舒张功能损伤(图5)。提示红景天苷明显改善了apoE小鼠由阻塞性睡眠呼吸暂停模式的慢性间歇性缺氧引起的高血压和血管功能损伤。
实施例3:红景天苷对慢性间歇性缺氧诱导的人脐静脉内皮细胞(HUVECs)氧化应激的影响
HUVEC细胞以1×104个/孔铺于24孔细胞培养板中,37℃孵箱培养18小时后,吸净培基,加入分别含有终浓度10μM和100μM的红景天苷的培养基预孵育2小时,放入细胞三气培养箱中(Oxycycler Model C42;BioSpherix Instruments,Redfield,NY,USA),通过调节缺氧参数使环境氧浓度达到21%-2%,1小时/循环,持续24小时,然后用ROS试剂盒检测细胞中的活性氧(s0033,碧云天)。方法简述如下:吸净培基,以PBS清洗细胞三次,加入ROS荧光探针(DCFH-DA),37℃孵箱培养30分钟,然后吸净培基,以PBS洗三次,用倒置荧光显微镜在488nm激发光下拍照,图像荧光强度以Image-Pro Plus 6软件定量。
结果表明,慢性间歇性缺氧可诱导HUVECs细胞的氧化应激状态,表现为ROS生成显著增加,红景天苷10μM和100μM可显著降低由慢性间歇性缺氧诱导升高HUVECs细胞的ROS含量,具有一定的剂量依赖性(图6)。提示红景天苷改善了HUVECs细胞由慢性间歇性缺氧引起的氧化应激状态。
应理解,虽然已结合本发明的优选的特定实施方式对本发明进行了描述,但前面的描述和其后的实施例旨在说明而非限制本发明的范围。本领域普通技术人员应理解,在不偏离本发明范围的情况下,可作出各种改变并且可用等效物代替,并且此外应理解,其它方面、优点和修改将是本发明所属领域的普通技术人员所显而易见的。除了本文所述的实施方式之外,本发明涵盖并且要求保护由本文所引用发明的特征和所引用现有技术参考文献的特征(其补充本发明的特征)的组合所产生的那些发明。类似地,应理解,任何所述材料、特征或物品可与任何其它材料、特征或物品组合使用,并且这些组合被视为在本发明的范围内。
参考文献
1、Amin R.Sleep apnea and cardiovascular disease:an American Heart Association/American College of Cardiology Foundation Scientific Statement from the American Hear[J].Journal of the American College of Cardiology,2008,52(8):686-717.
2、Logan A G,Perlikowski S M,Mente A,et al.High prevalence of unrecognized sleep apnoea in drug-resistant hypertension.[J].Journal of Hypertension,2001,19(12):2271-7.
3、Peppard P E,Young T,Palta M,et al.Prospective study of the association between sleep-disordered breathing and hypertension.[J].New England Journal of Medicine,2000,342(19):1378-84.
4、Chobanian A V,Bakris G L,Black H R,et al.The Seventh Report of the Joint National Committee on Prevention,Detection,Evaluation,and Treatment of High Blood Pressure:The JNC 7Report[J].Hypertension,2003,41(6):31–32.
5、Mancia G,Fagard R,Narkiewicz K,et al.2013ESH/ESC Guidelines for the management of arterial hypertension[J].Blood Pressure,2013,25(4):1751-62.
6、Prabhakar N R,Semenza G L.ADAPTIVE AND MALADAPTIVE CARDIORESPIRATORY RESPONSES TO CONTINUOUS AND INTERMITTENT HYPOXIA MEDIATED BY HYPOXIA-INDUCIBLE FACTORS 1AND 2[J].Physiological Reviews,2012,92(3):967-1003.
7、Shafazand S,Patel S R.Effect of CPAP on blood pressure in patients with obstructive sleep apnea and resistant hypertension.[J].Jama the Journal of the American Medical Association,2014,310(10):341-343.
8、Lozano L.Continuous positive airway pressure treatment in sleep apnea patients with resistant hypertension:a randomized,controlled trial[J].Journal of Hypertension,2010,28(10):2161.
9、Ishikawa J,Hoshide S,Eguchi K,et al.Increased low-grade inflammation and plasminogen-activator inhibitor-1 level in nondippers with sleep apnea syndrome.[J].Journal of Hypertension,2008,26(6):1181-7.
10、Silva A Q,Schreihofer A M.Altered sympathetic reflexes and vascular reactivity in rats after exposure to chronic intermittent hypoxia.[J].Journal of Physiology,2011,589(6):1463–1476.
11、Dematteis M,Julien C,Guillermet C,et al.Intermittent hypoxia induces early functional cardiovascular remodeling in mice.[J].American Journal of Respiratory&Critical Care Medicine,2008,177(2):227-35.
12、Nisbet R E,Graves A S,Kleinhenz D J,et al.The Role of NADPH Oxidase in Chronic Intermittent Hypoxia-Induced Pulmonary Hypertension in Mice[J].American Journal of Respiratory Cell&Molecular Biology,2009,40(5):601-609.
13、Castrograttoni A L,Alvarez R,Torres M,et al.Intermittent Hypoxia-Induced Cardiovascular Remodeling is Reversed by Normoxia in A Mouse Model of Sleep Apnea.[J].Chest,2016,149(6):1400.
14、Jun J,Reinke C,Bedja D,et al.Effect of intermittent hypoxia on atherosclerosis in apolipoprotein E-deficient mice.[J].Atherosclerosis,2010,209(2):381.
15、Garvey J F,Taylor C T,Mcnicholas W T.Cardiovascular disease in obstructive sleep apnoea syndrome:the role of intermittent hypoxia and inflammation.[J].European Respiratory Journal,2009,33(5):1195-205.
16、Semenza G L.Oxygen Sensing,Hypoxia-Inducible Factors,and Disease Pathophysiology[J].Annual Review of Pathology Mechanisms of Disease,2014,9(9):47-71.
17、Cicolin A,Mangiardi L,Mutani R,et al.Angiotensin-Converting Enzyme Inhibitors and Obstructive Sleep Apnea[J].Mayo Clinic Proceedings,2006,81(1):53-55.
18、Zillich A J,Garg J,Basu S,et al.Thiazide diuretics,potassium,and the development of diabetes-A quantitative review[J].Hypertension,2006,48:219–224.
19:Parati G,Lombardi C,Hedner J,et al.Recommendations for the management of patients with obstructive sleep apnoea and hypertension[J].European Respiratory Journal,2013,41(3):523-538.
20:Ziegler MG,Milic M,Sun P.Antihypertensive therapy for patients with obstructive sleep apnea[J].Current Opinion in Nephrology and Hypertension,2011;20:50–55.
21、Smith I,Lasserson T J,Wright J.Drug therapy for obstructive sleep apnoea in adults.[J].Cochrane Database of Systematic Reviews,2006,2(2):117-118.
22、Xing S S,Yang X Y,Zheng T,et al.Salidroside improves endothelial function and alleviates atherosclerosis by activating a mitochondria-related AMPK/PI3K/Akt/eNOS pathway[J].Vascular Pharmacology 2015,72:141-152.
23、Chen M,Cai H,Yu C,et al.Salidroside exerts protective effects against chronic hypoxia-induced pulmonary arterial hypertension via AMPKα1-dependent pathways.[J].American Journal of Translational Research,2016,8(1):12-27.
24、Lai M C,Lin J G,Pai P Y,et al.Protective effect of salidroside on cardiac apoptosis in mice with chronic intermittent hypoxia[J].International Journal of Cardiology,2014,174(3):565-73.
- 还没有人留言评论。精彩留言会获得点赞!