艳山姜挥发油的提取方法及制剂与流程
本发明涉及一种艳山姜挥发油的提取方法及制剂,属于制药技术领域。
背景技术:
艳山姜为姜科山姜属植物艳山姜Alpinia zerumbet(Pets.)Burtt.et Smith的干燥成熟果实,具有温中燥湿、行气止痛、截疟等功效,常用于心腹冷痛,胸腹胀满,消化不良,呕吐腹泻等,被收录于2003年版《贵州省中药材、民族药材质量标准》,是贵州少数民族的习用药材之一。目前艳山姜在贵州黔西南地区已有大规模种植,种植面积已超过130hm2,年产量达50吨以上,是贵州西南部喀斯特地区的主要香料发展植物,也是治理石漠化的重要经济植物,成为了贵州“南药”的第一大宗产品,具有广阔的开发应用前景。
艳山姜的化学成分主要包括挥发油、黄酮类和二萜类、有机酸类等,大量研究表明,其挥发油具有抗心肌缺氧、降压、抗炎、镇痛、降血脂、抗动脉粥样硬化等作用,但关于艳山姜挥发油提取工艺的研究尚未见报道。
技术实现要素:
本发明的目的在于,提供一种艳山姜挥发油的提取方法及制剂。本发明显著地提高了艳山姜挥发油的提取率,且本发明重复性好,工艺稳定性、重现性高。
为解决上述技术问题,本发明提供的技术方案如下:一种艳山姜挥发油的提取方法,将艳山姜干燥果实破碎至种子存裂,再加入6-20倍水中浸泡0-2小时,再进行蒸馏提取1-10小时,收集蒸馏冷凝液中的油状物质,得到艳山姜挥发油。
上述的艳山姜挥发油的提取方法中,将艳山姜干燥果实破碎至种子存裂,再加入12倍水中浸泡1小时,再进行蒸馏提取7小时,收集蒸馏冷凝液中的油状物质,得到艳山姜挥发油。
前述的艳山姜挥发油的提取方法中,所述的制剂是片剂、软胶囊剂、微乳剂、脂质体剂、口服液、糖浆剂、颗粒剂、丸剂、微丸剂、散剂、膏剂、丹剂、注射剂、栓剂、霜剂、喷雾剂、滴丸剂、贴剂或缓释制剂。
前述的艳山姜挥发油的制剂中,所述微乳的制备方法是称取适量乳化剂与助乳化剂混匀,形成混合乳化剂;将混合乳化剂与艳山姜挥发油按9-1:1-9的质量比混合,在搅拌下逐渐加水,得到微乳。
前述的艳山姜挥发油的制剂中,所述的混合乳化剂和艳山姜挥发油按6:4的质量比混合。
前述的艳山姜挥发油的制剂中,所述的乳化剂为HS-15。
前述的艳山姜挥发油的制剂中,所述的助乳化剂为无水乙醇。
前述的艳山姜挥发油的制剂中,所述的HS-15和无水乙醇是以1:1的比例进行混合。
前述的艳山姜挥发油的制剂中,艳山姜挥发油包合于环糊精内形成环糊精包合物,艳山姜挥发油与环糊精的质量百分比为10﹪-30﹪。
前述的艳山姜挥发油的制剂中,将含有艳山姜挥发油的环糊精包合物按常规颗粒剂工艺制得。
与现有技术相比,本发明对艳山姜挥发油的提取方法作了研究和深入分析后,改进了提取方法和参数,显著地提高了艳山姜挥发油的提取率,且本发明重复性好,工艺稳定性、重现性高。
申请人对艳山姜挥发油的提取方法作了筛选试验,筛选试验如下:
1、材料:
Agilent GC-MS 6890-5975C联用仪(美国安捷伦公司),BS-223S型分析天平(北京赛多利斯仪器系统有限公司),ZNHW-II型加热套(巩义市予华仪器有限责任公司),无水硫酸钠(重庆江川化工有限公司)。艳山姜购自贵州省黔西南州贞丰县连环乡巧岩村,经鉴定为姜科山姜属植物艳山姜Alpinia zerumbet(Pets.)Burtt.et Smith的干燥成熟果实。
2、方法与结果:
2.1、挥发油提取工艺考察将艳山姜干燥果实破碎至种子破裂,均匀取样,精密称取120g,采用L9(34)正交试验设计表,以挥发油提取率为指标,考察因素为浸泡时间(A)、加水倍量(B)和提取时间(C),按2015年版《中国药典》(四部)通则2204挥发油测定法进行提取,挥发油经无水硫酸钠干燥后称重。因素与水平及正交实验安排见表1,方差分析见表2。挥发油提取率=(挥发油重量/原生药重量)×100%。
表1艳山姜挥发油提取工艺正交试验分析
Table 1 Orthogonal test analysis of extraction process of volatile oil from Alpinia zerumbet
表2艳山姜挥发油提取率方差分析
Table 2 Variance analysis of extracting amount of volatile oil from Alpinia zerumbet
注:F0.05(2,18)=3.55,F0.01(2,18)=6.01
由表2直观分析结果表明,对艳山姜挥发油提取率影响大小的因素为C>A>B。以空白项D因素为误差列进行方差分析,由表2可知因素C对挥发油提取率影响具有显著的统计学意义,考虑到艳山姜药材质地较疏松,因此选用12倍量水进行提取。因此,确定艳山姜挥发油的最佳提取工艺为A2B2C3,即浸泡时间1h,料液比1:12,提取时间7h。
2.2、验证试验:
精密称取艳山姜120g,按优选的提取工艺A2B2C3进行3次重复试验,结果挥发油提取率分别为0.870%、0.871%,0.873%,RSD为2.454%,说明该优选工艺稳定,可行,重现性好。
2.3、GC-MS分析:
2.3.1、样品溶液的制备精密称取艳山姜药材120g,加12倍水浸泡1h,按2015年版《中国药典》(四部)通则2204挥发油测定法提取,经无水硫酸钠干燥后,加适量乙酸乙酯配成1g·L-1样品溶液,经0.22μm微孔滤膜过滤,进行成分分析。
从筛选试验可以看出,艳山姜的粉碎粒度、浸泡时间、料液比、蒸发量与蒸发速度等都会影响挥发油的提取率。试验结果表明,提取时间对艳山姜挥发油提取率的结果更为显著。
通过上述提取方法得到的艳山姜挥发油,可用于各种制剂,如片剂、胶囊剂、微乳剂、口服液、糖浆剂、颗粒剂、丸剂、微丸剂、散剂、膏剂、丹剂、注射剂、栓剂、霜剂、喷雾剂、滴丸剂、贴剂或缓释制剂。其中,微乳制剂作为重要制剂,申请人进一步对艳山姜的微乳制剂的配方作了进一步优选,筛选试验如下:
3.1.1、三元相图的绘制:
称取适量乳化剂与助乳化剂以一定的质量比(km)混匀,形成混合乳化剂(S/A)。以艳山姜挥发油为油相(O),称取适量的混合乳化剂与油分别以9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9的质量比混合(固定体系重量为0.5g),在搅拌下逐滴加水,记录形成微乳临界点时各组分的质量百分数。以油相、水相、乳化剂与助乳化剂混合物为3个顶点,用orgin7.5绘制伪三元相图,以形成微乳区域面积大小为指标,考察不同乳化剂、助乳化剂对自微乳形成的影响。
3.1.2、乳化剂的考察:
选择安全性较高的磷脂、HS-15进行乳化剂种类的考察。
3.1.2.1、考察HS-15对乳剂形成的影响:
HS-15为乳化剂,乙醇为助乳化剂,乳化剂:助乳化剂Km=1∶1,与艳山姜挥发油按9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9比例混合,(油相、乳化剂和组乳化剂总重量为0.5g),进行乳化剂成乳效果考察。通过2.1.1项的方法绘制伪三元相图。以粒径,成乳效果及微乳区域面积大小为考察指标进行考察。
3.1.2.2、考察磷脂对乳剂形成的影响:
乳化剂磷脂、助乳化剂乙醇按Km=1∶1的比例进行配制,再与艳山姜挥发油9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9比例混合,(油相、乳化剂和组乳化剂总重量为0.5g),进行乳化剂成乳效果考察。通过2.1.1项的方法绘制伪三元相图。以粒径,成乳效果及微乳区域面积大小为考察指标进行考察。
3.1.3、复合乳化剂比例的考察:
根据文献报道[6],复合乳剂可显著增大O/W型微乳的成乳区域,故选择磷脂和HS-15为复合乳化剂,二者比例为2∶1、1∶1、1∶2、1∶3、1∶4,分别与艳山姜挥发油按9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9比例混合,进行乳化效果考察,平行3次。绘制伪三元相图,以粒径,成乳效果及微乳区域面积大小为考察指标对复合乳化剂比例进行考察。
3.1.4、助乳化剂的考察:
在考察出最佳乳化剂后,选择无水乙醇、1,2一丙二醇、丙三醇、聚乙二醇-400为助乳化剂。乳化剂与助乳化剂的混合物(Km=1∶1)与艳山姜挥发油按1:9、2:8、3:7、4:6、5:5、6:4、7:3、8:2、9:1比例混合,并绘制伪三元相图,以粒径,成乳效果及微乳区域面积大小为考察指标对不同乳化剂进行考察。
3.1.5、Km值的确定:
根据前期实验结果,分别称取适量油相、乳化剂、助乳化剂,首先按Km=1∶4、2∶3、1∶1、3∶2、4∶1的质量比配制一系列乳化剂与助乳化剂混合物,再将各混合物与艳山姜挥发油分别以9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9的质量比混合(固定体系重量为0.5g),在搅拌下逐滴加水,记录形成微乳临界点时各组分的质量百分数。以油相、水相、乳化剂与助乳化剂混合物为3个顶点,用orgin7.5绘制伪三元相图绘制伪三元相图,确定自微乳区域。以形成微乳区域面积大小为指标,确定Km值。
3.2、最佳处方的确定:
优良的微乳处方,应采用尽可能少的表面活性剂相,载入最多的油相。
3.3艳山姜挥发油自微乳的药剂学性能评价
3.3.1、粒径:
取处方量的磷脂、Kolliphor HS 15、乙醇、艳山姜挥发油适量加热涡旋混匀后即得艳山姜挥发油自微乳,适量稀释数倍,用激光粒度测定仪测定粒径,平行3次。
3.3.2、外观和形态:
艳山姜挥发油自微乳为澄清透明的液体,将其加入100倍量的37℃蒸馏水稀释,取适量用2%磷钨酸负染,于透射电镜下观察自微乳外观形态。
3.3.3、Zeta电位的测定:
取所得艳山姜挥发油自微乳用37℃蒸馏水稀释100倍后,进行Zeta电位测定,平行3次。
3.3.4、自乳化效率:
自乳化速率是评价混合物自发形成粒径均一乳剂的能力的一个重要指标,Gershanik等人通过目测观察来检测,此方法简便易行。本试验通过目测观察自乳化系统在溶液中完全分散所需的时间,即自乳化时间,以及乳剂的外观来评价体系的自乳化速率。
3.3.4.1、分散介质的影响:
精密称取艳山姜挥发油自微乳50mg置西林瓶中,7份,分别加入50mL的蒸馏水、0.1mol·L-1HCl溶液、PBS(pH=6.8)(溶血),于37恒温水浴的条件下搅拌,目测法观察成乳外观,记录自微乳均匀分散成微乳所需要的时间。
3.3.4.2、介质体积的影响:
在37℃条件下,考察艳山姜挥发油自微乳化给药系统(SMEDDS)在不同体积的PBS(pH=6.8)中自微乳化情况。
3.3.4.3、转速的影响:
在37℃条件下,考察转速150、200和250r·min-1对艳山姜挥发油SMEDDS的影响。
3.3.5、稳定性考察:
取适量艳山姜挥发油自微乳于离心管中,以4000r·min-1离心30min,观察有无分层现象。将装有适量艳山姜挥发油自微乳的西林瓶,密封,常温下放置,分别于放置1、2、3、6个月后考察其外观。并测定自微乳粒径,Zeta电位及自乳化能力。
3.6.3、表面张力的测定:
分别取0.5g艳山姜挥发油SMEDDS,放入蒸馏水中加热搅拌均匀,作为待测液。用最大泡压法在25℃测定空白微乳和含药微乳的表面张力。
3.4、急性毒性试验:
3.4.1、急性毒性预试验:
参照药典用量,按照急性毒性试验[8]要求先进行急性毒性预试验,给小鼠尾静脉注射艳山姜挥发油自微乳,找出0%死亡率LD0值和100%死亡率LD100值,并初步摸索r值。根据预实验结果,急性毒性正式实验设置个剂量组,分别为及辅料组、空白对照组。140只小鼠,雌雄各半,随机分为组,每组只。灌胃前禁食不禁水12h,以25m L·kg-1给药,记录药后15min,30min,1h,2h,4h,8h,12h内小鼠毒性反应症状及死亡情况,灌胃后连续观察14天,每天记录存活小鼠体重,观察有无死亡及是否有毒性反应症状。死亡小鼠即刻进行解剖,观察心、肝、脾、肺、肾等重要内脏的大体病理变化。2.2.2艾叶挥发油LD50测定采用与测定艾叶水提组分LD50值相同方法,进行挥发油组分LD50测定实验研究。根据预实验结果,正式试验中也设置7个剂量组,分别为2.25m L·kg-1、2.00m L·kg-1、1.80m L·kg-1、1.45m L·kg-1、1.15m L·kg-1、0.93m L·kg-1(r=0.9)及空白对照组。
3.2.3、根据预试验,取小鼠20只,雌雄各半,禁食不禁水12h,以生药量75.6g·kg-1(最大浓度),40m L·kg-1(最大体积)灌胃并观察记录药后15min,30min,1h,2h,4h,8h,12h内小鼠毒性反应症状及死亡情况,灌胃后连续观察14天,每天记录存活小鼠体重,观察有无死亡及是否有毒性反应症状。死亡动物即刻尸检,肉眼观察其主要脏器变化。
3.5、小动物活体成像
3.6、体内有效性
3.6.1、兔子动脉粥样硬化的诱导
1.6-2.5公斤的雄兔子被单独安置在一个保持19℃且能随时提供食物和水的环境中。兔子随机分为以下两组、正常对照组、模型组。正常对照组常规饮食喂养16周。为了诱导内皮损伤,模型组每隔一天静脉注射100mg/kg牛血清蛋白(BSA),一天三次。模型组给予高脂肪饮食喂养(2%胆固醇,蛋黄粉10%,10%猪油、胆盐钠0.3%,0.2%丙硫氧嘧啶)16周。
3.6.2、血脂的测定
16周后分别从对照组(正常饮食没有管理)、治疗组(高脂肪饮食管理)和阳性对照组(高脂肪饮食没有管理)兔子耳缘静脉取血液(2ml)。通过酶标仪进行血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)的测量。
3.6、细胞吞噬
3.7、溶血实验
根据2015版《中国药典》通则1148相关内容进行。首先进行2%红细胞悬液的制备,取10mL干净玻璃试管,加入样品,编号;另设置阴性对照管和阳性对照管(完全溶血对照),分别加入0.9%氯化钠溶液或蒸馏水;上述试管依次加入2%红细胞悬液,混匀后,立即置(37±0.5)℃的恒温水浴中进行温育,观察并记录各管的溶血情况。开始每隔15分钟观察1次,1小时后,每隔1小时观察1次,一般观察3小时。根据溶血试验结果判断标准进行是否溶血的判断。
3.8、体外的细胞毒性
3.8.1、脐静脉内皮细胞的培养
从超低温冰箱中取出HAECs后立即放入37℃水浴中解冻,转入含ECM(由5%灭活胎牛血清,100U青霉素,100mg·L-1链霉素配制而成)3mL的培养瓶中,于37℃,5%CO2恒温饱和湿度的培养箱中培养,隔天换液1次,用3~6代细胞进行实验。
3.8.2、细胞染毒
给予主动脉内皮细胞不同浓度、不同时间的艳山姜挥发油自微乳刺激,利用MTT检测细胞存活率,反映自微乳的细胞毒性;用光镜、扫描电子显微镜(SEM)和透射电子显微镜(TEM)观察自微乳引起的内皮细胞形态结构改变;待自微乳干预结束后用胰酶替代物消化细胞,重新接种于纤维连接蛋白(fibronectin,FN)包被的培养板中,测量1.2h内的粘附率和粘附过程中细胞铺展的面积以评价内皮细胞粘附能力;利用特异阻断抗体预处理细胞实现整合素(integrin)阻断后,进行粘附实验,观察integrin在其中作用;给予自微乳干预后,利用划痕实验检验乙醇对细胞迁移能力的影。
3.8.3药效研究实验
实验分组及方法:
实验分成三个组:空白组(Control Dose,Contr.)、LPS模型组(Model Dose,LPS)、中剂量本发明(Medium Dose,M.D.)。空白组加无血清DMEM和生理盐水,LPS模型组加无血清DMEM和LPS(15μg/ml),M.D组加艳山姜挥发油软胶囊和LPS(15μg/ml)。除空白对照组外,各组分别给予相应药物干预保护1h后,再给予LPS复制HUVECs炎性损伤模型。
苏木素-伊红染色(HE染色):
将形态完好的细胞接种到3孔板内,长满后上述方法分组给药。各组细胞用PBS浸洗3次,每次5分钟,加4%的多聚甲醛固定15min,弃去多聚甲醛,PBS浸洗3次,每次5分钟,待孔内干燥后,加苏木精染液染色15-20min,PBS浸洗3次,每次5分钟,HCL-乙醇(75%乙醇配制1%HCL)分化30秒,PBS浸洗3次,每次5分钟,95%乙醇润洗5秒,伊红染液染色(5-10)分钟,70%乙醇洗2次。镜检着色满意后观察细胞,拍照。
取生长良好的传代培养的HUVECs,制成细胞悬液,以每孔1×104个接种于96孔培养板(每孔100μl),培养至细胞基本融合,换成无血清的DMEM培养液继续培养24h,使细胞同步化,按上述方法分组给药。再加入MTT(5mg/ml)20μl,继续孵育4h,终止培养。小心吸去孔内培养液,每孔加入150μl二甲基亚砜,低速震荡10min,使结晶物充分溶解。在酶联免疫检测仪490nm波长处测量各孔吸光值,结果以OD值表示。细胞存活率=实验组OD值/对照组OD值×100%。
乳酸脱氢酶(LDH)的测定:
将HUVECs按2.4.1项下方法分组给药处理后,收集24孔板培养液,吸出培养液,-20℃冰箱保存,备测。
(1)分析原理:LDH能够催化乳酸生成丙酮酸,丙酮酸与2,4-二硝基苯肼反应在碱性环境下形成棕红色苯腙化合物,在440nm波长测定,通过比色求出酶的活力。
(2)分析方法:根据试剂盒说明书完成。取样:
混匀,室温放置3分钟,440nm蒸馏水调零1cm光径测各管吸光度,根据公式计算LDH活力。
计算公式:
NO的测定:
将内皮细胞按2.4.1项下方法分组给药处理后,用规格为1.5ml的无菌管收集96孔板培养液,吸出培养液,于-20℃冰箱冷冻保存,备测。
(1)分析原理:NO化学性质活泼,在体内很快代谢成NO2-和NO3-,而NO2-又进一步转化成NO3-,本法利用硝酸还原酶特异性将NO3-还原成NO2,通过显色深浅测定其浓度的高低。
(2)分析方法:根据试剂盒说明书完成。
显色剂的配制:试剂三:试剂四:试剂五=2.5:1:1
前处理:取96孔板内上清液(100μl)+试剂一(200μl)混匀。然后加入试剂二(100μl),漩涡混匀,静置10min。3500-4000r/min,离心15min,取上清液160μl进行以下操作。
取样:
混匀,室温静置10分钟,蒸馏水调零,550nm,1cm光径,测各管吸光值。
计算公式:
4、结果
4.1、乳化剂考察结果
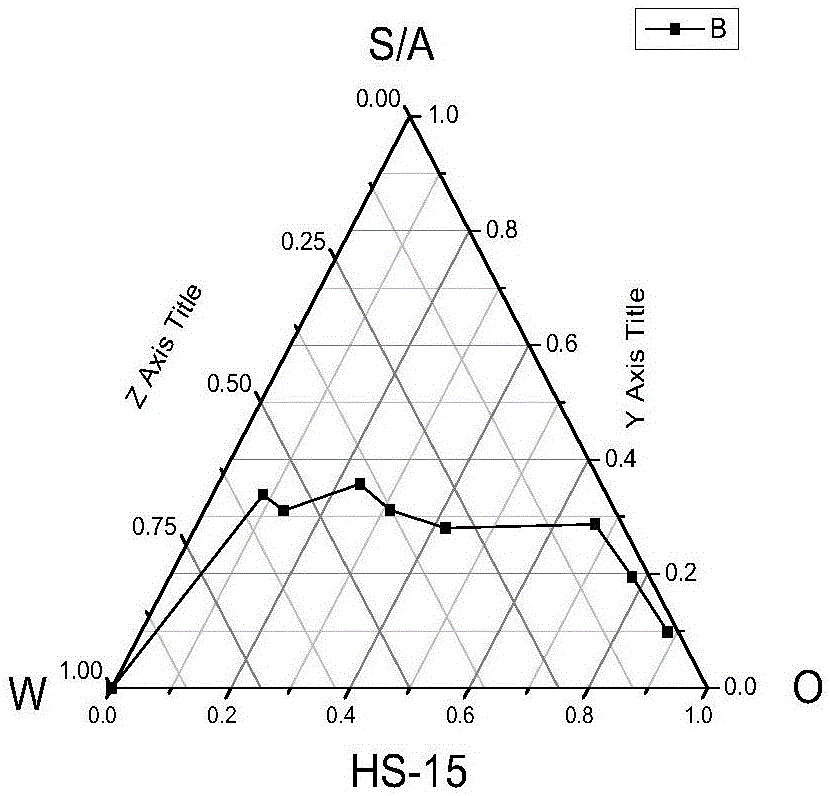
HS-15、磷脂分别与助乳化剂乙醇混合,乳化剂:助乳化剂(Km)=1∶1,再与艳山姜挥发油9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9比例混合,(油相、乳化剂和组乳化剂总重量为0.5g),考察HS-15、磷脂对微乳的影响。结果见表4、表5和图2-3。由结果可知,HS-15的乳化效果优于磷脂,所以选择HS-15为乳化剂。
表4HS-15对微乳粒径、成乳情况的影响
表5磷脂对微乳粒径、成乳情况的影响
4.1.3、复合乳化剂比例考察结果
磷脂和HS-15为复合乳化剂,二者比例为2∶1,1∶1,1∶2,1∶3,1∶4与艳山姜挥发油按9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9比例混合,考察复合乳化剂不同比例对微乳的影响。结果见表6-15和图4-13。由结果可知,随着磷脂和HS-15比例的减小,微乳区域面积变化不明显,但成乳情况有所改善,所以选择单一乳化剂HS-15为乳化剂。
表6磷脂与HS-15按2∶1混合对微乳粒径、成乳情况的影响
表7磷脂与HS-15按1∶1混合对微乳粒径、成乳情况的影响
表8磷脂与HS-15按1∶2混合对微乳粒径、成乳情况的影响
表9磷脂与HS-15按1∶3混合对微乳粒径、成乳情况的影响
表10磷脂与HS-15按1∶4混合对微乳粒径、成乳情况的影响
表11磷脂与HS-15按1∶5混合对微乳粒径、成乳情况的影响
表12磷脂与HS-15按1∶6混合对微乳粒径、成乳情况的影响
表13磷脂与HS-15按1∶7混合对微乳粒径、成乳情况的影响
表14磷脂与HS-15按1∶8混合对微乳粒径、成乳情况的影响
表15磷脂与HS-15按1∶9混合对微乳粒径、成乳情况的影响
4.2助乳化剂考察结果
确定乳化剂为HS-15,选择无水乙醇、1,2一丙二醇、丙三醇、聚乙二醇-400为助乳化剂。乳化剂与助乳化剂混合(Km=1:1)与艳山姜挥发油按1:9、4:6、4:6、4:6、4:6、4:6、4:6、9:1比例混合,并绘制伪三元相图,以粒径,成乳效果及微乳区域面积大小为考察指标对不同乳化剂进行考察。结果见表16-19和图14-17。由结果可知,当以无水乙醇为助乳化剂时,微乳区域面积最大,故选择无水乙醇为助乳化剂。
表16乙醇在混合乳化剂与挥发油不同比例下对微乳粒径、成乳情况的影响
表17 1,2-丙二醇在混合乳化剂与挥发油不同比例下对微乳粒径、成乳情况的影响
表18丙三醇在混合乳化剂与挥发油不同比例下对微乳粒径、成乳情况的影响
表19PEG-400在混合乳化剂与挥发油不同比例下对微乳粒径、成乳情况的影响
4.4、最佳Km的确定:
根据乳化剂、复合乳化剂、助乳化剂考察结果,以HS-15为乳化剂,乙醇为助乳化剂,乳化剂、助乳化剂首先按Km=1∶4、2∶3、1∶1、3∶2、4∶1的质量比配制一系列乳化剂与助乳化剂混合物,再将各混合物与艳山姜挥发油油分别以9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9的质量比混合(固定体系重量为0.5g),用orgin7.5绘制伪三元相图,确定自微乳区域。以形成微乳区域面积大小为指标,确定Km值。结果见图18-23。由图18-23可知,微乳区域随Km值增大而增大,当Km值增大到1时,微乳区域最大,当Km值继续增大,微乳区域逐渐减小。故选择Km=1:1。
4.5、微乳处方的确定:
优良的微乳处方,应采用尽可能少的表面活性剂相,载入最多的油相和水相。通过以上对乳化剂和助乳化剂的考察,选择HS-15为乳化剂,乙醇为助乳化剂。综合考虑微乳的载油量,微乳形成的稳定性,以及粒径要求,确定微乳处方为:乳化剂与助乳化剂比例为1:1,艳山姜挥发油与混合乳化剂比例为6:4,艳山姜挥发油自微乳粒径分布如附图23所示,效果非常显著。
5.1HUVECs的形态学观察
HUVECs传代后,倒置相差显微镜下观察,起初呈圆形或椭圆形,多呈小团存在。2h后细胞开始贴壁,之后很快生长成为多数单层小多角型集落,4h后大部分细胞贴壁。48-72h生长最快,逐渐生长成梭形,有些细胞呈鱼贯状相连,间有漩涡状排列。核清晰,呈圆形或椭圆形,核分裂相多见1-2个核仁,胞浆丰富,内含小颗粒。于2-3d后融合,4-6d胞体呈多角形,相互嵌合为单层呈铺路石状排列。
传代HUVECs约0.5h后部分即开始贴壁生长,1-2d即可长满,2-3d相互融合,生长旺盛,可见多核细胞。传代培养的脐静脉内皮细胞体积增大,胞浆丰满,呈梭形或多角形,细胞排列稍稀疏,随着传代次数的增多,可见多个双核细胞,表明细胞分裂旺盛。结果见图24。
5.2艳山姜挥发油软胶囊对LPS诱导的HUVECs损伤的保护作用:
苏木精-伊红染色(HE染色)
HE染色后,HUVECs胞核染成蓝紫色,胞质染成粉红色。空白组细胞呈明显的铺路石形状,细胞之间排列紧密,形态比较均一;LPS组细胞数量减少,间隙增大,周围模糊,形态异于正常;本发明作用后细胞形态明显较模型组规则,细胞间隙变小,接近于正常形态。结果见图25。
MTT法分析细胞存活率
表4及图26所示,与Contr.组比较,LPS对HUVECs的炎症损伤作用明显,具有极显著性差异(P<0.01);与LPS组比较,Asp.组,H.D(4μg/L),M.D(1μg/L)和L.D(0.25μg/L)都具有极显著性差异(P<0.01),均可提高由LPS诱导损伤的HUVECs的存活率。
下表及图26所示,与Contr.组比较,LPS对HUVECs的炎症损伤作用明显,具有极显著性差异(P<0.01);与LPS组比较,本发明(M.D)组(1μg/L)具有极显著性差异(P<0.01),可明显提高由LPS诱导损伤的HUVECs的存活率。
NO的测定
下表及图27所示:与Contr.组比较,LPS组NO的释放量明显降低,具有一定差异(P<0.05),提示LPS导致HUVECs损伤;与LPS组比较,M.D组NO释放量明显升高,具有显著性差异(P<0.01);证明本发明可使NO的释放增加,减少LPS诱导HUVECs的损伤。
附图说明:
图1是艳山姜挥发油GC-MS总离子流图;
图2是HS-15乳化剂的伪三元相图;
图3是磷脂乳化剂的伪三元相图;
图4是磷脂:HS-15=2:1的伪三元相图;
图5是磷脂:HS-15=1:1的伪三元相图;
图6是磷脂:HS-15=1:2的伪三元相图;
图7是磷脂:HS-15=1:3的伪三元相图;
图8是磷脂:HS-15=1:4的伪三元相图;
图9是磷脂:HS-15=1:5的伪三元相图;
图10是磷脂:HS-15=1:6的伪三元相图;
图11是磷脂:HS-15=1:7的伪三元相图;
图12是磷脂:HS-15=1:8的伪三元相图;
图13是磷脂:HS-15=1:9的伪三元相图;
图14是1,2-丙二醇作为乳化剂的伪三元相图;
图15是丙三醇作为乳化剂的伪三元相图;
图16是PEG-400作为乳化剂的伪三元相图;
图17是无水乙醇作为乳化剂的伪三元相图;
图18是Km=1:4的伪三元相图;
图19是Km=2:3的伪三元相图;
图20是Km=1:1的伪三元相图;
图21是Km=3:2的伪三元相图;
图22是Km=4:1的伪三元相图;
图23是艳山姜挥发油自微乳粒径分布图;
图24是HUVECs倒置显微镜(10×10)观察图;
图25本发明对LPS诱导HUVECs损伤的观察图;
图26是MTT法分析本发明对LPS诱导HUVECs损伤的保护作用;
图27本发明对LPS诱导HUVECs损伤NO释放的影响。
具体实施方式
下面结合实施例对本发明作进一步的说明。
实施例1:艳山姜挥发油的提取方法,将艳山姜干燥果实破碎至种子存裂,再加入10倍水中浸泡1.5小时,再蒸馏提取5小时,收集蒸馏冷凝夜中的油状物质,得到艳山姜挥发油。
通过上述提取方法得到的艳山姜挥发油,可用于制得以下制剂:片剂、胶囊剂、微乳剂、口服液、糖浆剂、颗粒剂、丸剂、微丸剂、散剂、膏剂、丹剂、注射剂、栓剂、霜剂、喷雾剂、滴丸剂、贴剂或缓释制剂。
实施例2:艳山姜挥发油的提取方法,将艳山姜干燥果实破碎至种子存裂,再加入13倍水中浸泡0.5小时,再蒸馏提取8小时,收集蒸馏冷凝夜中的油状物质,得到艳山姜挥发油。
实施例3:艳山姜挥发油的提取方法,将艳山姜干燥果实破碎至种子存裂,再加入12倍水中浸泡1小时,再蒸馏提取7小时,收集蒸馏冷凝夜中的油状物质,得到艳山姜挥发油。
实施例4:通过上述提取方法得到的艳山姜挥发油,可用于制得以下微乳,所述微乳的制备方法是称取适量乳化剂与助乳化剂混匀,形成混合乳化剂;将混合乳化剂与艳山姜挥发油按9-1:1-9的质量比混合,在搅拌下逐渐加水,得到微乳。
实施例5:所述微乳的制备方法是乳化剂与助乳化剂以1:1的比例混匀,形成混合乳化剂,且乳化剂为HS-15,助乳化剂为无水乙醇;将混合乳化剂与艳山姜挥发油按6:4的质量比混合,在搅拌下逐渐加水,得到微乳。
实施例6:含上述艳山姜挥发油的环糊精包合物,是将艳山姜挥发油包合于环糊精内形成环糊精包合物,艳山姜挥发油与环糊精的质量百分比为10﹪-30﹪。再将环糊精包合物按常规颗粒剂工艺制得颗粒剂。
实施例7:通过上述提取方法得到的艳山姜挥发油,可用于制得软胶囊剂,软胶囊剂的制备方法是取明胶、水搅拌至溶解,加入甘油和适量防腐剂,搅拌均匀,抽真空脱气泡后,保温待用;按处方量称取艳山姜提取物,与药用辅料混合,搅拌均匀,制成混悬液,室温静置;将配好的药液倒入药液斗中,用模具压制成软胶囊。服用方法是口服或含服,每天3次,一次1-3粒。
实施例8:一种艳山姜挥发油滴丸的制备方法,取艳山姜果实150g,水蒸气蒸馏法,或超临界萃取法提取,得艳山姜挥发油,备用;取艳山姜挥发油质量的2.38倍的聚乙二醇6000和1.12倍的聚乙二醇4000,混合均匀,至无气泡,完全熔融,然后置49-60℃水浴上保温,然后加入基质4%倍量的吐温80,混合均匀,再加入艳山姜挥发油,使完全溶解,搅拌混合均匀,滴入冷凝液中,制成滴丸,拭去滴丸表面的冷凝液,即得成品。服用方法是口服或含服,每天3次,一次1-3粒。
- 还没有人留言评论。精彩留言会获得点赞!