一种免疫增强组合物、制备方法及其应用与流程
本发明涉及医用生物材料技术领域,具体涉及一种免疫增强组合物,本身无免疫反应,但是可以与抗原配伍,增强人体免疫反应。
背景技术:
疫苗接种是目前最具有性价比的预防疾病的方法,疫苗经过灭活、裂解步骤后,已经不是一个活的抗原物质,不会造成感染。在疫苗使用过程中为了减少抗原的用量,相对地扩大疫苗产量,还需要添加适当的免疫增强剂进行配比。免疫增强剂是非特异性免疫增强剂,当与抗原一起注射或预先注入机体时,可增强机体对抗原的免疫应答或改变免疫应答类型,添加免疫增强剂的疫苗比无免疫增强剂疫苗更能帮助刺激机体产生免疫反应,从而降低疫苗接种时疫苗的使用量。因此在预防疾病的策略下,寻找安全有效的疫苗和免疫增强剂是疫苗开发中的两个热点课题。
理想的免疫增强剂本身不具有免疫原性,但与抗原合并使用能增强抗原免疫性的物质,同时可以广谱使用、生物可降解并安全可靠。目前越来越多的材料被发现具有免疫增强剂活性,常见的有铝盐佐剂、弗氏佐剂、多糖佐剂及脂质体、细胞因子纳米材料等。这些材料虽能较好地强化免疫反应,但是存在不同的缺点,如形成肉芽肿、局部脓肿、持续时间短、易引起发热炎症等。目前被FDA批准用于人体免疫的免疫增强剂只有铝盐佐剂,而该免疫增强剂由于材料的高度异质性,生产过程也难以实现统一标准,皮下注射易引起严重反应(如出现红斑、皮下结节、接触性过敏和肉芽肿性炎症)。因此,免疫增强剂还可以从新材料中寻找更安全、更有效的替代品。
细胞外基质材料是一种潜在的生物型免疫增强剂材料,因为其本身在动物体内可以起到调控细胞微环境的作用,从而促进细胞相互作用、血管化及免疫反应。免疫原去除小肠粘膜下层(SIS)材料是在临床上广泛应用于腹壁、泌尿道、硬脑膜、血心管修复等软组织缺损修复、加固的生物医用材料。本身基质中除了I型胶原蛋白的主要成分,还含有糖胺聚糖、蛋白聚糖、纤维粘连蛋白、碱性纤维生长因子、血管内皮生长因子等生物因子,具有良好的生物相容性,可以促进缺损组织修复、血管化及功能重建。最为关键的是SIS材料与吞噬树突状细胞(DC)具有高度亲和性,而后者为最有效的抗原提呈细胞(APC)。另外SIS材料植入体内所激发的免疫反应主要为Th2通路,实现材料与宿主组织的整合与重建,而抑制Th1通路介导的促炎症反应。因此,SIS有望作为安全、可降解、高效的免疫增强剂,避免植入体内后引起炎症反应。
技术实现要素:
本发明针对现有技术的上述不足,提供一种免疫增强组合物,该免疫增强组合物用于疫苗接种中能强化抗原免疫反应,减少免疫反应中的炎症、肉芽肿、脓肿等副作用。
为了解决上述技术问题,本发明采用的技术方案为:一种免疫增强组合物,其特征在于:该组合物为由包含无免疫原性、可体内降解的胶原蛋白、多糖物质和活性因子的疏松颗粒状构成的组合物。
所述的胶原蛋白为包含I型、III型、IV型和VI型胶原蛋白的组合物。
所述的多糖物质为包含硫酸软骨素和透明质酸的组合物。
所述的活性因子为包含纤维粘连蛋白、层粘连蛋白、整合素及生长因子的组合物。
所述的体内降解时间为1-3个月。
所述的疏松颗粒状为具有孔隙结构的颗粒。
所述的免疫增强组合物形态为颗粒状。
所述的颗粒状的粒径为500μm以下。尺寸为500μm以下的颗粒可以经皮下注射进入人体。
本发明还提供一种上述新型免疫增强组合物的制备方法,其特征在于:采用动物小肠粘膜下层组织作为原料,依次通过组织前置处理、病毒灭活、免疫原消除、冷冻干燥和破碎成型步骤,获得清除动物源病毒风险、细胞成分、DNA成分和α-Gal抗原,同时保留细胞外基质成分的免疫增强组合物。
本发明上述制备方法中步骤(1)的组织前置处理,具体的为:取动物小肠粘膜下层组织材料,清洗并将水滤干。
本发明步骤(2)的病毒灭活,具体的为:采用过氧乙酸-乙醇溶液和氢氧化钠溶液分别浸泡动物小肠粘膜下层组织材料进行病毒灭活。本发明此处采用了两步病毒灭活工艺,氢氧化钠也用于病毒灭活。
本发明步骤(3)的免疫原去除,具体为:免疫原去除液采用包含胰蛋白酶和EDTA的PBS溶液,免疫原去除过程在多频超声波装置中进行,所述多频超声波装置能够产生至少两个不同频率。
本发明步骤(4)的冷冻干燥,具体为:在真空冷冻干燥机中进行。
本发明步骤(5)的破碎成型:将冷冻干燥后的小肠粘膜下层组织材料剪碎,使用液氮冷冻破碎装置研磨破碎,然后通过筛网进行颗粒筛分。
本发明上述方法还包括破碎成型后的灭菌解析步骤。
所述动物为哺乳动物,优选猪或牛。
所述的组织前置处理步骤为采用流动纯水清洗至初始污染菌不高于100cfu/g。
所述的病毒灭活步骤为采用过氧乙酸-乙醇溶液和氢氧化钠二步法进行。病毒灭活滴度可高于6个log。
所述的过氧乙酸-乙醇溶液中过氧乙酸的浓度(体积百分比)为0.1-5%、乙醇的浓度(体积百分比)为5-40%,过氧乙酸-乙醇溶液与动物小肠粘膜下层组织材料的比例(体积比)为(3-20)︰1,作用时间2小时;氢氧化钠溶液采用0.2-2mol/L,的浓度,氢氧化钠的浓度也可以优选为0.8-1.2mol/L,作用时间15-30min,温度采用室温20℃。
所述的免疫原消除步骤为将病毒灭活后的动物小肠粘膜下层组织材料(组织原料)按比例浸于去除液中,采用双频超声处理至动物源DNA残留量为3-20ng/mg,α-Gal抗原清除率不低于99%。
所述的去除液为含有0.01-0.1%(质量百分比浓度)的胰蛋白酶和0.1-1mmol/L浓度的EDTA的pH6-8的PBS溶液,所述的小肠粘膜下层组织材料与去除液的比例(体积比)为1:20-40。
所述的双频超声包含低频和高频两个频率,其中低频频率为20-30KHz,高频频率为60-80KHz,超声功率为3-5kW,其中低频处理1-10min,高频处理1-10min,温度范围为10-40℃;超声功率5000W以上。
所述的破碎成型步骤为先剪碎,然后在液氮冷冻破碎装置中进行破碎,通过筛网筛分出<500μm颗粒。
本发明上述的组合物是动物小肠粘膜下层组织经过一系列上述处理步骤之后的固有组分。
本发明进一步提供上述新型免疫增强组合物的应用,具体为:通过抗原配伍,增强人体免疫反应,激活Th1或Th2应答,产生特异性抗体反应。
所述的配伍比例为抗原、免疫增强组合物、溶剂按1:(10-50):(100-1000)的质量比。
所述的抗体为IgG1型。
与现有技术相比,本发明具有以下显著优点和有益效果:
(1)多频超声免疫原去除工艺:减少了细胞洗脱过程化学试剂使用量与作用时间,保护免疫原去除外基质胶原蛋白纤维完整性与三维多孔结构;
(2)酶法细胞洗脱工艺:采用胰蛋白酶和EDTA复合溶液,脱除细胞过程温和,减少对基质结构的破坏,保留基质中的活性生长因子;
(3)高效破碎技术:低温超高速剪切破碎技术,保护胶原蛋白、生物因子成分不受破坏;
(4)可降解吸收:体内可降解,降解过程可控,作用周期长;
(5)本发明此处采用了采用过氧乙酸-乙醇溶液和氢氧化钠溶液分别浸泡小肠粘膜下层组织材料进行病毒灭活的两步病毒灭活工艺,灭活更加彻底,获得的免疫增强组合物应用于疫苗免疫增强剂,与细菌、病毒等病原微生物疫苗或肿瘤疫苗配合使用,增强机体对抗原的免疫应答,降低引起过敏、感染、炎症、肉芽肿、局部脓肿的风险,可用于皮下注射和肌肉注射。
(6)采用胰蛋白酶和EDTA,使细胞与细胞外基质之间的连接被破坏;采用低频超声对细胞进行破碎,同时使用高频超声作用于破碎的细胞及细胞外基质,进一步使细胞脱离细胞外基质,达到脱细胞目的。采用上述方式,对整个细胞脱离基质过程中的各个步骤进行强化,使细胞被从基质上完全脱离。到达最佳的免疫原去除效果。
附图说明
图1本发明实施例制备的新型免疫增强组合物对抗原提呈细胞细胞表型的影响;
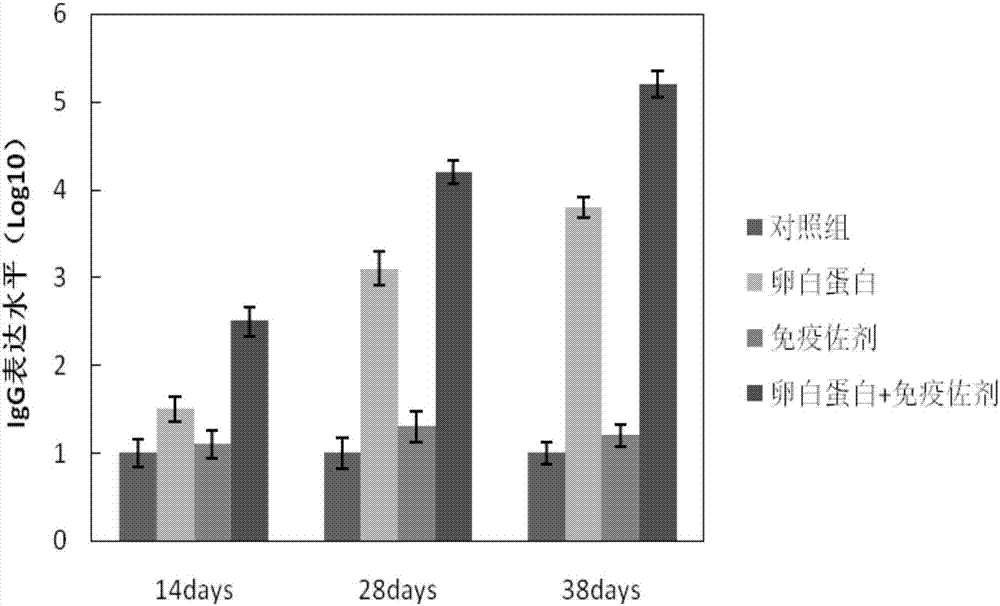
图2本发明实施例制备的新型免疫增强组合物与抗原复合后对动物免疫反应的影响。
具体实施方式
以下结合实施例对本发明作进一步具体描述,但不局限于此。
本发明所述小肠粘膜下层组织材料取自哺乳动物,猪小肠粘膜下层组织材料或牛小肠粘膜下层组织材料均适用于本发明的实施例。
实施例1:
本实施例新型免疫增强组合物,通过以下步骤制备而成:
(1)组织前置处理:
取小肠粘膜下层组织材料分割成宽10cm,长15cm的规定尺寸,剔除淋巴组织,用自来水冲洗3次,再用纯化水冲洗至表面无污渍,将水滤干。
(2)病毒灭活:
采用过氧乙酸-乙醇溶液浸泡小肠粘膜下层组织材料进行病毒灭活,该过程可在不锈钢桶中进行;过氧乙酸-乙醇溶液中过氧乙酸的浓度为1%(体积百分比)、乙醇的浓度为24%(体积百分比),过氧乙酸-乙醇溶液与小肠粘膜下层组织材料的比例(体积比)为9︰1,灭活时间2小时,温度范围为20℃;然后用0.5mol/L的氢氧化钠溶液进行灭活处理,作用时间20min,温度采用室温20℃。完成后在超声波清洗机中先用pH值为7的PBS溶液超声处理多次,PBS溶液与小肠粘膜下层组织材料体积比为20:1,再用纯化水清洗数次至检测清洗后的纯化水电导率为10μS/cm以下终止,纯化水与小肠粘膜下层组织材料体积比为20:1;超声频率3000W。
(3)免疫原去除:
免疫原去除液采用含有质量百分比浓度0.025%胰蛋白酶和浓度为0.6mmol/L的EDTA的pH7的PBS溶液,免疫原去除液与混合比例(体积比)为30︰1,免疫原去除过程在双频超声装置中进行,包含低频和高频两个频率,其中低频频率为20KHz,高频频率为80KHz,超声功率为5KW,其中低频处理5min,高频处理5min,温度范围为30℃。完成后在超声波清洗机中采用pH7中的PBS溶液超声处理,PBS溶液与小肠粘膜下层组织材料体积比为20:1,每次10-30分钟;清洗2-4次;然后采用降温的注射用水清洗,注射用水与小肠粘膜下层组织材料比例为20:1至40:1之间,检测清洗前后注射用水电导率差为1μS/cm以下终止。超声波的频率优选40kHz,功率需要在3000W以上,得到小肠粘膜下层基质材料。
(4)冷冻干燥:
在真空冷冻干燥机中进行,产品的冷冻干燥工艺需要根据不同的设备重新确认,本实施例将去除免疫原的小肠粘膜下层组织材料于真空冷冻干燥机中,关闭冻干室的门,打开循环泵约1min,开启压缩机对冻干箱致冷,预冻至-45℃,保温2h,然后开启真空泵,调节温度至-15℃,保温7h,再调节温度至0℃,保温2h,最后调节温度至25℃,保温4小时,冷冻干燥完成。
(5)破碎成型:
将由步骤(4)得到的经冷冻干燥的小肠粘膜下层基质材料剪碎,置于液氮冷冻破碎装置中进行破碎;所述装置在充入液氮后,剪碎的基质材料被迅速冷冻然后被液氮冷冻破碎装置的旋转刀头连续破碎,该装置的转速优选25000rpm以上,然后通过筛网筛分出<500μm颗粒。
本实施例还可以包括以下步骤:
(6)灭菌解析:
将步骤(5)通过筛网筛分出<500μm颗粒采用双层包装后用环氧乙烷进行灭菌,灭菌条件为:先温度40℃保温4小时,湿度70%,然后通入浓度5000mg/L环氧乙烷,灭菌6小时;解析过程在通风的解析室中进行,温度控制在20℃之间,时间14天。
实施例2:
对实施例1中样品进行性能检测,检测项目与结果如下:
1)胶原蛋白亚型鉴别:采用免疫组化染色法检测I、III、IV型和VI型胶原蛋白,3μm厚连续切片,二甲苯脱蜡,梯度乙醇脱水。将切片移入电饭煲水浴中(内含0.01mol/L,pH6.0的枸橼酸三钠缓冲液),温度保持在95-100℃,煮20min,进行抗原修复,取出后在室温下自然冷却。磷酸盐缓冲液(PBS)洗涤,5min×3次。二步法免疫组化:分别滴加I、III、IV型和VI型胶原蛋白单克隆抗体一抗,浓度1:100,4℃冰箱过夜室温下孵育60min,PBS洗涤3次。滴加Envision反应液,室温下孵育30min。PBS洗涤3次。0.05%的3,3一二氨基联苯胺+0.03%的H2O2显色5-10min。流水洗,苏木精衬染。递增梯度乙醇脱水,二甲苯透明,常规树脂封固。结果表明,显微镜下观察四种染色标本皆可见棕黄染色,为阳性,表明样品中可检测到I、III、IV型和VI型胶原蛋白。
2)多糖物质含量检测:取10个样品,取样,浸提,用Biocolor硫酸软骨素检测试剂盒测试硫酸软骨素含量,样品中硫酸软骨素含量平均值为4895±213μg/g;用透明质酸检测试剂盒测试透明质酸(HA)含量,结果显示,样品的透明质酸(HA)保留量平均值为368±54μg/g。
3)活性因子种类鉴别:将样品浸泡PBS 24h后,固定于4%多聚甲醛5-10min,用0.1mol/LPBS洗3次,每次5min,然后用玻璃细管转至涂有多聚赖氨酸的玻片上,进行免疫组织化学染色。LN抗体、FN抗体和整合素效价均为1∶100,0.5%胰酶消化3-5min暴露抗原,0.1%Triton X100作用10min增加抗体的穿透性。免疫组织化学染色显阳性,表面样品中包含纤维粘连蛋白、层粘连蛋白、整合素及其配体的等物质。
4)DNA残留:依据生物制剂残留DNA检测方法《中国药典》2015年版第四部,采用荧光染色法检测实施例1所提供的样品DNA残留量,结果:实施例1所提供的样品的DNA残留量2.35±0.25ng/mg。
5)半乳糖苷酶(α-Gal)清除率:取动物源性生物材料Gal阳性参考品,Gal抗原阴性参考品各2mg,加裂解液1ml,裂解30-90min,配制成20、10、5、2.5、1.25、0.625μg的Gal标准曲线样品,测试免疫原去除前后的测试品各取50mg,加裂解液2ml,裂解30-90min;取裂解液与M86抗体反应后的上清液,加入96孔板,加二抗,加显色剂,采用ELISA方法450nm检测吸光度值,按标准曲线计算出样品的Gal值,免疫原去除处理前材料的Gal值为20.22±2.15×1014/mg,实施例1中样品的Gal值为0.16±0.02×1014/mg,半乳糖苷酶(α-Gal)清除率在99.20%以上。
6)病毒检测:选择伪狂犬病毒为指示病毒,采用实时定量PCR法检测病毒的DNA拷贝数,检测3批样品。结果:病毒DNA拷贝数为0。
7)细菌内毒:按照GB/T 14233.2-2005《医用输液、输血、注射器具检验方法第2部分:生物学试验方法》进行检测,共3批样品,结果:细菌内毒小于20EU/包装。
8)环氧乙烷残留量:按GB/T14233.1-2008《医用输液、输血、注射器具检验方法第1部分:化学分析法》中9的规定的方法试验,结果:产品环氧乙烷残留量不超过10μg/包装。
9)重金属检查:铅、铬按GB/T 14233.1-2008中5.9.1《医用输液、输血、注射器具检验方法第1部分:化学分析法》规定的方法试验,汞、砷按GB/T 14233.1-2008中5.9.3《医用输液、输血、注射器具检验方法第1部分:化学分析法》规定的方法试验,产品检验液中铅、铬、汞、砷总重金属含量少于1ug/g。
10)生长因子残留量:对实施例1中样品采用ELISA法检测样品中碱性生长因子(bFGF)和血管内皮生长因子(VEGF)含量,并对免疫原去除前动物组织作为对照。结果发现碱性生长因子(bFGF)免疫原去除前后含量分别为2395±210ng/L、1036±112ng/L,保留生长因子40%以上;血管内皮生长因子(VEGF)含量免疫原去除前后含量分别为703±57ng/L、311±21ng/L,保留生长因子40%以上。
实施例3:
对实施例1中样品进行生物相容性实验,检测项目包括:热原、细胞毒性、迟发型超敏反应、皮内反应、急性全身毒性、Ames试验、小鼠淋巴瘤细胞突变试验、染色体畸变、植入、亚慢性毒性
1)热原
按质量比1:5浸提介质的比例,37±1℃,72±2hr制备试验液,浸提介质:生理盐水。按GB/T 14233.2-2005规定的方法进行,产品无热原反应。
2)细胞毒性
按质量比1:5浸提介质的比例,37±1℃,24±2hr制备试验液,浸提介质:含血清的MEM培养基。取试验液按照GB/T16886.5-2003中规定的试验方法进行试验,结果产品的细胞毒性反应不大于1级。
3)迟发型超敏反应
按质量比1:5浸提介质的比例,37±1℃,72±2hr制备试验液,浸提介质:生理盐水和棉籽油。按照GB/T 16886.10-2005第10部分:刺激与迟发型超敏反应试验方法规定进行试验,结果产品无迟发型超敏反应。
4)皮内反应
按质量比1:5浸提介质的比例,37±1℃,72±2hr制备试验液,浸提介质:生理盐水和棉籽油。按照GB/T 16886.10-2005第10部分:刺激与迟发型超敏反应试验试验方法规定进行试验,结果:试验样品与溶剂对照平均记分之差小于1.0。
5)急性全身毒性
按质量比1:5浸提介质的比例,37±1℃,72±2hr制备试验液,浸提介质:生理盐水和棉籽油。取试验液按照GB/T16886.11-2011规定的试验方法进行试验,结果:产品无急性全身毒性反应。
6)Ames试验
按质量比1:5浸提介质的比例,37±1℃,72±2hr制备试验液,浸提介质:生理盐水和DMSO。按GB/T16886.3-2008规定的方法进行,结果:产品的Ames试验为阴性。
7)小鼠淋巴瘤细胞突变试验
按质量比1:5浸提介质的比例,37±1℃,72±2hr制备试验液,浸提介质:生理盐水和DMSO。按GB/T16886.3-2008规定的方法进行,结果:产品的小鼠淋巴瘤细胞突变试验为阴性结果
8)染色体畸变试验
按质量比1:5浸提介质的比例,37±1℃,72±2hr制备试验液,浸提介质:生理盐水和DMSO,按GB/T16886.3-2008规定的方法进行,结果:产品的染色体畸变试验为阴性
9)植入
按GB/T16886.6-1997规定的方法进行,结果:肌肉植入1周:样品周围可见嗜中性粒细胞、淋巴细胞和巨噬细胞浸润,应无囊腔形成;肌肉植入4周:样品周围可见少量巨噬细胞和淋巴细胞,胶原纤维和纤维母细胞增生,有纤维囊腔形成;肌肉植入12周:样品周围可见少量淋巴细胞、胶原纤维、纤维囊腔较致密规整。
10)亚慢性毒性
按GB/T 16886.11规定的方法进行,结果:无亚慢性毒性反应。
实施例4:
对实施例1中样品作体外细胞实验,验证其对抗原提呈细胞(APC)巨噬细胞免疫作用的影响。将健康6-8周龄的小鼠经脱颈法处死,全身75%酒精消毒后,置于超净工作台中,使其腹面朝上。向小鼠腹腔注射无菌PBS后反复按压腹腔多次,用注射器回抽腹腔液,收集到离心管中,离心,去上清,用PBS重悬洗涤细胞,再次离心去上清。加入培养基重悬细胞,调整巨噬细胞浓度至1×106个/ml,培养于24孔,每孔加入细胞悬液2ml,置于37℃二氧化碳培养箱贴壁培养2h,换液去除不贴壁细胞。实验组分别加入不同样品浓度,使样品与溶剂质量比分别为1:50、1:40、1:30、1:20、1:10;阴性对照组只加培养基,每组样品设3个复孔。将细胞培养板置于37℃二氧化碳培养箱分别培养24h,到预定时间后取出培养板进行固定收集细胞,封闭细胞,分别采用Anti-CD80-FITC抗体、Anti-CD86-FITC抗体、Anti-MHCI-FITC抗体、Anti-MHCII-FITC抗体标记细胞,在流式细胞仪中使用488nm激发波长,525nm发射波长检测荧光的强度。结果如附图1所示,加入免疫增强组合物后,巨噬细胞CD80表达明显上升,并与加入浓度呈一定正相关性,CD86表达水平有提高,而MHCI表达无明显变化,MHCII的表达水平显著上升,结果表明实施例1中样品体外刺激,可以激活抗原提呈细胞,刺激抗原提呈细胞分化成熟,进而促进免疫反应。
实施例5:
对实施例1中样品按质量比1:40与卵白蛋白(OVA)复合形成一种含免疫增强组合物的模拟疫苗,选择4-6周的雌性小鼠作为模型动物,采用腿部肌肉注射的方法,将含免疫增强组合物的模拟疫苗注射到小鼠体内。将小鼠分为3组,每组6只,每只注射100μl上述制剂,其中免疫增强组合物的添加量为1mg,卵白蛋白含量为25μg,分两腿注射。第1组为阴性对照,注射无任何添加物的生理盐水;第2组为纯卵白蛋白抗原对照组;第3组免疫增强组合物组;第4组为含免疫增强组合物的卵白蛋白抗原组。动物实验周期为38天,在此期间对小鼠进行3次免疫,免疫时间分别为0、14、28天。初免后14、28、38天后从眼底采血提取小鼠的血清,每只采血量约200μl。取样完成后,将血样置于室温下4h,离心轻吸取上清液,即得到小鼠血清,放在-70℃冰箱中备用。通过ELISA试剂合测定特异性抗体IgG含量。结果如图2所示,加入的免疫增强组合物增强动物免疫反应,利于抗原提呈细胞将识别抗原物质,而强化免疫反应,而免疫增强组合物本身不会引起明显的免疫排斥反应。
由此可见,本发明制备得到的新型免疫增强组合物:
(1)DNA残留能够达到10ng/mg以下,半乳糖苷酶去除率较高,能够达到99%以上;
(2)降低引起过敏、感染、炎症、肉芽肿、局部脓肿的风险;
(3)保留细胞外基质中活性生长因子;
(4)体内可降解,降解过程可控,作用周期长;
(5)在有效剂量内无毒副作用,无致畸、致癌作用,稳定性好,受温度、pH等变化影响较小,可长期储存;
(6)生产过程可实现标准化、产业化;
(7)可用肌肉注射也可以皮下注射。
本发明的上述实施例是对本发明的说明而不能用于限制本发明,与本发明的权利要求书相当的含义和范围内的任何改变,都应认为是包括在权利要求书的范围内。
- 还没有人留言评论。精彩留言会获得点赞!