重组的人源Ang‑2在制备药物中的用途的制作方法
本发明涉及细胞因子的用途技术领域,尤其涉及重组的人源Ang-2在制备保护猪内皮细胞免于人抗体介导的补体依赖型细胞毒性的药物中的用途。
背景技术:
人类器官供体的缺乏是器官移植的最主要的限制之一。猪器官被认为是解决这个问题的最适宜的供体来源。可是,在猪器官移植到灵长类动物中,凝血调节紊乱和炎症反应仍然是一个问题。血管内皮细胞,这类细胞与人类免疫细胞的相互作用在异种移植中具有重要的作用。内皮细胞损伤和功能性失调在炎症与凝血反应的发展中具有重要的影响因素,并且在灵长类动物或者人类受体中,能够影响后来猪异种移植后的存活时间。在血清中,异源抗体,例如,Gal抗体和Neu5Gc抗体,能够诱导由抗体介导的依赖于补体的细胞毒性,进而导致内皮细胞的损伤。在炎症反应中,细胞因子起重要的作用。在以前的报道中发现人源IL-4和IL-13,而不是IL-11,TGF-β2或者IL-10,保护猪内皮细胞防止通过激活的PI3K/AKT信号途径而进行的人类抗体介导的补体依赖型细胞毒性(CDC)。可是,这些细胞因子抑制或者促进内皮细胞毒性,是否是通过人类抗体介导的补体依赖型细胞毒性,人们仍然是不清楚的。在血管发育中血管生成素具有重要的作用并且它们可以稳定其整体性。血管生成素1(Ang-1)是一种对内皮血管特异性受体酪氨酸激酶2的特异配体,这个激酶在血管成熟和血管重塑中具有重要的意义。Ang-1/Tie2途径能够增强血管的整体性和通过激活PI3K/AKT信号途径的从而促进内皮细胞的存活时间。Ang-2与Ang1共用Tie2受体,在与Ang1共通作用下,同样的被认为在血管增长和血管重塑过程具有重要的作用。对于Tie2,Ang-1被认为是一种激动剂,而Ang-2被认为是拮抗剂,起相反的作用。
技术实现要素:
发明人研究发现,Ang-1和Ang-2保护猪内皮细胞防止通过激活的PI3K/AKT信号途径而进行的人类抗体介导的补体依赖型细胞毒性。Ang-1和Ang-2不能改变IgM或者IgG对于PIECs的结合,以及在Ang-1和Ang-2处理下不能上调表达PIECs补体调节因子(CD46、CD55和CD59)。
基于以上发现,本发明提供一种重组的人源Ang-2在制备保护猪内皮细胞免于人抗体介导的补体依赖型细胞毒性的药物中的用途。
进一步地,上述猪内皮细胞是猪髂骨动脉内皮细胞。
进一步地,上述重组的人源Ang-2是通过腺病毒介导表达的人源Ang-2。
进一步地,上述腺病毒介导表达的过程中,通过实时定量PCR和/或半定量PCR检测人源Ang-2的mRNA的表达水平。
进一步地,上述实时定量PCR和/或半定量PCR所使用的用于检测人源Ang-2的引物对是:
5’-agaaccagacggctgtgatg-3’(SEQ ID NO:3)和
5’-gaagttcaagtctcgtggtct-3’(SEQ ID NO:4)。
进一步地,上述实时定量PCR和/或半定量PCR以GAPDH作为内参,用于检测上述内参的引物对是:
5’-acagacagccgtgtgttcc-3’(SEQ ID NO:5)和
5’-accttcaccatcgtgtctca-3’(SEQ ID NO:6)。
进一步地,上述重组的人源Ang-2通过激活PI3K/AKT通路来保护猪内皮细胞免于人抗体介导的补体依赖型细胞毒性。
基于本发明的发现,Ang-1和Ang-2保护PIECs免于人源抗体介导的CDC,因此Ang-1和Ang-2可以作为制备保护猪内皮细胞免于人抗体介导的补体依赖型细胞毒性的药物的重要活性成分。
附图说明
图1显示Ang-1和Ang-2诱导保护PIECs免于人源抗体介导的CDC。(A)PIECs用重组人EGF(100ng/ml)、bFGF(50ng/ml)、VEGF165(100ng/ml)、IL-33(40ng/ml)、IL-17(100ng/ml)、Ang-1(500ng/ml)、IL-4(20ng/ml)或作为阴性对照(NC)的培养基培养48小时,然后暴露于人血清以诱导抗体介导的CDC。(B)PIECs用不同浓度的rhAng-1(50ng/ml、100ng/ml、200ng/ml、500ng/ml)或作为NC的培养基处理48小时,然后暴露于人血清诱导抗体介导的CDC。(C)PIECs用rhAng-1(500ng/ml)或培养基作为NC处理0、24小时、48小时或72小时,然后暴露于人血清以诱导抗体介导的CDC。(D-E)PIECs用rhAng-1(500ng/ml)、rhAng-2(500ng/ml)或作为NC的培养基处理0、24小时、48小时或72小时,然后暴露于人血清诱导抗体介导的CDC。通过CCK8(D)或中性红(E)评价细胞毒性的程度。(F)PIEC用不同浓度的rhAng-2(200ng/ml、500ng/ml、1000ng/ml)或作为NC的培养基处理48小时,然后暴露于人血清诱导抗体介导的CDC。(G)PIECs用rhAng-1(500ng/ml)、rhAng-2(500ng/ml)、rhAng-1加rhAng-2或作为NC的培养基处理48小时,然后暴露于人血清诱导抗体介导的CDC。数据代表至少三个独立实验(平均值±SEM)。通过Student's t检验,*p<0.05,**p<0.01,***p<0.001。
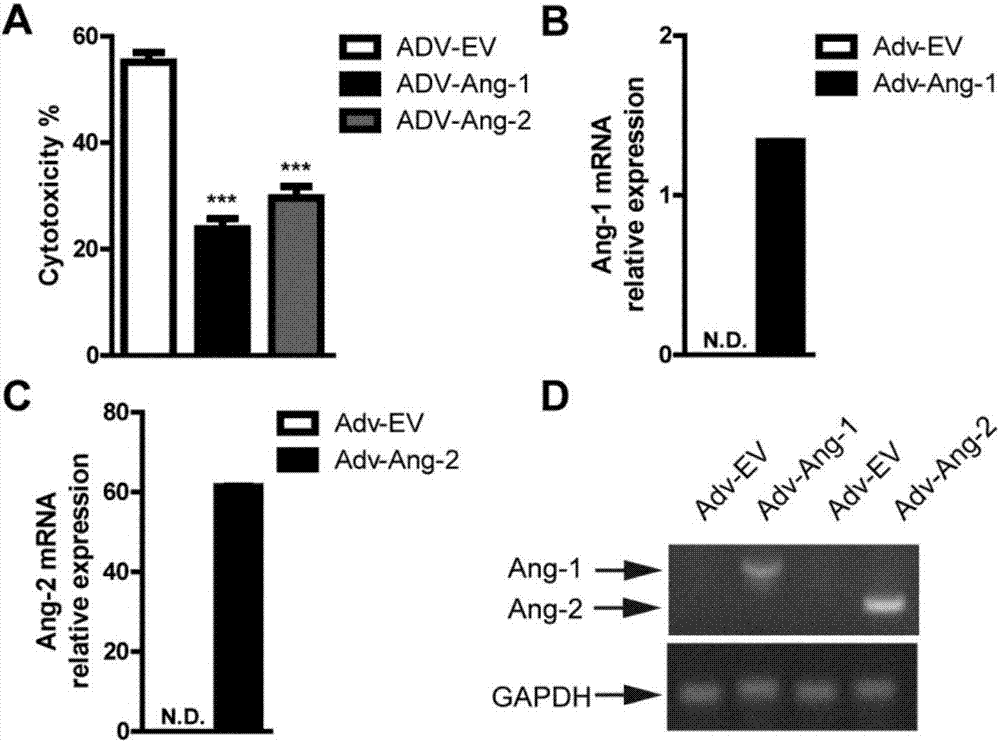
图2显示利用腺病毒系统在PIECs中异位表达Ang-1和Ang-2保护PIECs免于人源抗体介导的CDC。(A)使用腺病毒系统构建人Ang-1或Ang-2基因。包装腺病毒。PIECs用ADV-Ang-1,ADV-Ang-2或ADV-EV(空载体)感染72小时,然后暴露于人血清诱导抗体介导的CDC。(B-C)PIECs用ADV-Ang-1(B),ADV-Ang-2(C)或ADV-EV感染72小时。收集总RNA用于RT-PCR分析。用人Ang-1引物(B)或Ang-2引物(C)评估mRNA水平,并标准化至猪GAPDH。(D)如(B-C)中所述收集RNA,并使用人Ang-1、Ang-2或猪GAPDH引物通过半定量PCR评估mRNA水平(N.D.=未测定)。数据代表至少三个独立实验(平均值±SEM)。通过Student's t检验,***p<0.001。
图3显示在PIEC中,rhAng-1或rhAng-2不上调CD46、CD55或CD59的表达。(A-B)PIECs用rhAng-1(500ng/ml)(A)或rhAng-2(500ng/ml)(B)处理0、2h、6h或12h。通过RT-PCR检测CD46、CD55或CD59的mRNA水平。数据代表至少三个独立实验(平均值±SEM)。
图4显示人IgG或IgM与PIECs的结合程度不受rhAng-1或rhAng-2影响。(A-B)PIECs用rhAng-1(500ng/ml)、rhAng-2(500ng/ml)或作为NC的培养基处理48小时,然后与热灭活的人血清温育30分钟。通过流式细胞术(A)检测人IgM和IgG与PIEC的结合。通过几何平均荧光强度(Gmean)(B)评价人IgM或IgG与PIEC的结合程度。数据代表至少三个独立实验(平均值±SEM)。通过Student's t检验,*p<0.05,**p<0.01,***p<0.001。
图5显示rhAng-1或rhAng-2需要PI3K/AKT途径以诱导保护PIECs免于人源抗体介导的CDC。(A-B)PIECs用rhAng-1(500ng/ml)(A)或rhAng-2(500ng/ml)(B)处理0、15分钟、30分钟或60分钟。使用针对p-AKT和肌动蛋白的抗体通过蛋白质印迹分析裂解物。(C-D)PIECs用渥曼青霉素(wortmannin)(100ng/ml)或DMSO处理3小时,然后暴露于rhAng-1(500ng/ml)(C)或rhAng-2(500ng/ml)(D)0或15分钟。通过用针对p-AKT和肌动蛋白的抗体进行western印迹分析裂解物。(E-F)PIECs用渥曼青霉素(100ng/ml)或DMSO处理3小时,然后暴露于rhAng-1(500ng/ml)(E)、rhAng-2(500ng/ml)(F)或作为NC的培养基48小时,然后暴露于人血清以诱导抗体介导的CDC。数据代表至少三个独立实验(平均值±SEM)。通过Student's t检验,*p<0.05,**p<0.01,***p<0.001。
具体实施方式
下面通过具体实验结合附图对本发明作进一步详细说明。
1实验材料
1.1细胞系
实验中主要培养的细胞系是猪髂骨动脉内皮细胞(PIECs)。
1.2细胞因子
重组人的表皮生长因子(EGF)、成纤维细胞生长因子(bFGF)、VEGF165、IL-33、IL-17、Ang-1、Ang-2和IL-4均购自美国R&D Systems公司。
1.3抗体
肌动蛋白(Actin)和p-AKT购自美国Cell Signaling Technology公司。
1.4实验试剂
渥曼青霉素(Wortmannin)购自美国Selleck公司。其它试剂为常规试剂。
2实验方法
2.1细胞培养
实验中培养的细胞系用含10%胎牛血清、1%P/S,DMEM培养基。温度37℃,5%二氧化碳饱和湿度。
2.2抗体介导的补体依赖的细胞毒性实验
在96孔板中培养PIECs,每孔4×103个细胞,用重组细胞因子刺激0、24h、48h、72h(图1C),所有其他实验延长48h。细胞因子刺激后弃培养基,加入含20%混合的多名健康人的血清(n=20,含ABO血型)孵育2h,以热灭活的人血清作为对照。2h后,用CCK8检测PIECs的活性(图1D),弃培养基并加入含10%CCK8的RPMI-1640孵育2h。采用multiscan GO分光光度计测OD450吸光度。细胞死亡率(细胞毒性)按以下公式计算:
%细胞性=(对照毒组OD-实验组OD)/对照组OD×100
细胞存活性亦采用中性红色染色方法检测(图1E),细胞毒性百分率采用与CCK8同样的计算方法计算。
2.3腺病毒介导的Ang-1和Ang-2在PIECs中的表达
按照文献Song X,H Gao,Y Lin,et al.Alterations in the microbiota drive interleukin-17C production from intestine epithelial cells to promote tumorigenesis[J].Immunity,2014,40(1):140-152构建腺病毒过表达质粒。构建ADV-Ang-1和ADV-Ang-2质粒后,将ADV-Ang-1、ADV-Ang-2及空载体ADV-EV转染293T细胞进行包装腺病毒。对重组腺病毒进行扩增、纯化、滴度检测及稀释,终浓度为1010至1011/mlPBS。ADV-Ang-1、ADV-Ang-2、ADV-EV感染PIECs72h,然后暴露于人血清诱导抗体介导CDC。
2.4实时定量PCR和半定量PCR检测人Ang-1和Ang-2的mRNA水平
采用提取总RNA,用Transcript First-Strand cDNA Synthesis SuperMix试剂盒(中国北京TransGene Biotech公司)合成cDNA。采用SYBRPremix Ex Taq试剂盒(中国大连Takara公司)检测人的Ang-1和Ang-2基因水平。这两种基因的表达以均以GAPDH作为内参,以2-ΔΔct方法计算。在ViiA7实时定量PCR仪(美国Applied Biosystems)上进cDNA的扩增,对于半定量PCR,使用人Ang-1、Ang-2或猪GAPDH引物通过PCR扩增cDNA,PCR产物用2%琼脂糖凝胶电泳
核苷酸引物的序列如下:
人的Ang-1:5’-aaacatgaagtcggagatgg-3’(SEQ ID NO:1)和
5’-ttctccagcagctgtatctc-3’(SEQ ID NO:2)。
人的Ang-2:5’-agaaccagacggctgtgatg-3’(SEQ ID NO:3)和
5’-gaagttcaagtctcgtggtct-3’(SEQ ID NO:4)。
猪的GAPDH:5’-acagacagccgtgtgttcc-3’(SEQ ID NO:5)和
5’-accttcaccatcgtgtctca-3’(SEQ ID NO:6)。
2.5流式细胞术检测IgG、IgM的结合
混合多名健康人的血清在56℃中加热灭活30min。取1×106个PIECs细胞,用20%灭活的人血清在37℃孵育30min。PBS洗一次后,加入10%山羊血清避免非特异性结合,再加入FITC标记的山羊抗人IgM和IgG抗体,避光4℃条件下孵育30min,以不加人血清的细胞作为对照组。清洗之后用流式细胞仪进行检测,IgG、IgM与PIECs的结合程度以几何平均荧光强度表示。
3实验结果
3.1Ang-1和Ang-2保护PIECs免于人源抗体介导的CDC
重组的人源Ang-1(rhAng-1)保护PIECs免于人抗体介导的CDC,杀伤效率从65%下降到25%(图1A)。rhAng-1的保护效果优于rhIL-4(图1A)。然而,在这个模型中,人源EGF、bFGF、VEGF165、IL-33和IL-17对于PIECs并没有显示出保护效应(图1A)。剂量依赖的实验表明rhAng-1保护PIECs免于人抗体介导的CDC是剂量依赖的(图1B)。rhAng-1预处理PIECs48h或者72h比24h的保护效果更好(图1C)。因此,在后续的实验中,我们利用500ng/ml的rh-Ang-1处理PIECs48h。
Ang-2是血管生成素家族的另一个成员,传统观点认为其与Ang-1存在拮抗效应。我们利用这个模型探究Ang-2的作用。令人惊奇的是,我们发现Ang-2与Ang-1的效应相似(图1D-E)。我们利用中性红和CCK-8两种试剂评估杀伤效率得出相似的结果(图1D-E)。500ng/ml的rhAng-2预处理PIECs的保护效果更好(图1F)。rhAng-1和rhAng-2共同处理PIECs所显现的保护效果与Ang-1、Ang-2单独处理效果相似(图1G)。因此Ang-2并没有抑制Ang-1介导的PIECs的保护效应,这两个细胞因子对于PIECs的保护也没显示出协同效应。
3.2在PIECs中,腺病毒介导的Ang-1、Ang-2过表达保护PIECs免于人源抗体介导的CDC
我们利用腺病毒系统在PIECs中异位表达Ang-1和Ang-2。ADV-Ang-1或者ADV-Ang-2感染过的PIECs显著的保护PIECs免于人源抗体介导的CDC(图2A)。ADV-Ang-1或ADV-Ang-2的保护效果与rhAng-1或rhAng-2的保护效果很接近。实时定量PCR和半定量PCR的结果表明感染ADV-Ang-1或ADV-Ang-2的PIECs中Ang-1或Ang-2的表达水平很高。
3.3Ang-1或Ang-2并没有影响补体调节因子的表达以及人源抗体结合PIECs的水平
接下来,我们去探究其中的机制,我们首先想到Ang-1或Ang-2是否增加了补体调节蛋白的表达或者减少了结合到PIECs的人源IgM或IgG。我们发现,Ang-1或Ang-2并没有上调CD46和CD55、CD59的mRNA水平反而有一定的下调,虽然这下调并不显著(图3A-B)。
我们通过流式细胞术分析IgG或IgM结合PIECs的水平,发现Ang-1、Ang-2处理组和对照组并没有明显差别(图4A;统计学数据显示在4B)。
Ang-1还具有下调一些连接蛋白的表达水平,例如Zo-1、Occludin和VE-cadherin,进而达到抗渗的作用。先前有报道显示连接蛋白Claudin 5上调可以保护猪的内皮细胞免于人源抗体介导的CDC,所以我们利用Ang-1处理PIECs并检测了Claudin-5、Zo-1和Occludin的表达,发现这些基因并没有上调(数据没显示)。
3.4PI3K/AKT通路对于Ang-1或Ang-2介导的PIECs免于人源抗体介导的CDC的保护效应是必需的
先前的报道表明IL-4通过激活PI3K/AKT通路保护猪的内皮细胞免于人源抗体介导的CDC。Ang-1或Ang-2能够激活PI3K/AKT通路促进ECs的存活。我们探究Ang-1或Ang-2是否通过激活PI3K/AKT通路保护PIECs免于人源抗体介导的CDC。
我们发现,在PIECs中,rhAng-1或rhAng-2激活了p-AKT(图5A-B)。我们利用PI3K的特异性抑制剂-wortmannin处理PIECs,发现wortmannin抑制了Ang-1或者Ang-2诱导了p-AKT的激活(图5C-D)。Wortmannin抑制了Ang-1或Ang-2介导的PIECs的保护效应(图5E-F)。我们也检测了下游促凋亡和抑凋亡基因是否受到调控,发现在在Ang-1或Ang-2处理的PIECs中抑凋亡基因Bcl-2,Bcl-xl和促凋亡基因Bad的水平并没有明显变化(数据没显示)。这些数据表明PI3K/AKT通路对于Ang-1或Ang-2介导的PIECs免于人源抗体介导的CDC是必需的,下游调控的基因仍然有待于进一步研究。
4讨论
在免疫调控中,细胞因子扮演着重要的角色,但是在异种移植中它们的功能是不清楚的。在我们的研究中发现,Ang-1和Ang-2保护猪内皮细胞防止通过激活的PI3K/AKT信号途径而进行的人源抗体介导的补体依赖型细胞毒性。在PIECs中,重组细胞因子和重组腺病毒过量表达Ang-1或者Ang-2人源抗体介导的补体依赖型细胞毒性具有保护作用。另外,我们发现人源Ang-1和Ang-2不能上调表达PIECs补体调节因子(CD46、CD55和CD59)。并且在Ang-1和Ang-2处理下,人类IgM或者IgG对PIECs结合时没有改变的。这些结果说明Ang-1和Ang-2在保护PIECs防止人源抗体介导的补体依赖型细胞毒性的功能上具有相似性。在猪-非人类灵长类动物异种移植的模型中,Ang-1和Ang-2促进了异种移植的存活时间。由于腺病毒过来表达Ang-1或者Ang-2模拟转基因猪种所达到的表达量,我们推测在异种移植中,Ang-1转基因猪能够保护器官的存活。由于在胚胎期,Ang-2转基因小鼠中显示出干扰血管形成,所以Ang-2转基因猪仔血管生成的过程中有一定的缺陷。
血管生成素,结合Tie2受体的一类糖蛋白,包括Ang-1、Ang-2和Ang-3/Ang-4。Ang-1是一个通过它对Tie2包外的高亲和性结合第一个被鉴定出来的。通过同源性比对,Ang-2氨基酸相似性达到60%。Ang-1在血管生成和血管重塑上具有重要作用,它对内皮细胞有抗炎反应,增加存活时间和抗渗透作用。Ang-1通过影响交界基因的表达,例如Zo-1、Occludin和VE-cadherin,来抑制渗透作用。此前的报道显示,连接蛋白Claudin-5的上调表达防止人类抗体介导的补体依赖型细胞毒性来保护猪内皮细胞。可是,我们发现Ang-1不能增加Claudin-5、Zo-1和Occludin的mRNA水平,这就说明在PIECs中,Claudin-5不是主要因素对于Ang-1调节保护。当PIECs暴露在人血清CDC中,在PI3K抑制剂,wortmannin,能够抑制Ang-1/Ang-2调节的防护作用。这些数据表明PI3K/AKT介导的内皮细胞的存活是Ang-1/Ang-2介导对PIECs防护作用的主要因素。但是在Ang-1/Ang-2处理PIECs后,抗凋亡下游基因的表达,Bcl-2和Bcl-xl没有增加,促凋亡基因Bad也没有下降。这些结果说明,由Ang-1/Ang-2调节的PI3K/AKT调控其他保护PIECs的基因来抑制人类抗体介导的补体依赖型细胞毒性。
综上所述,我们的研究发现Ang-1和Ang-2,通过相似的机制,防止人类抗体介导的补体依赖型细胞毒性来保护猪内皮细胞,以及通过激活PI3K/AKT途径促进PIECs的存活。Ang-1和Ang-2是异种移植潜在的研究目标。Ang-1和Ang-2对于灵长类的调控可能对异种移植具有防护作用,以免受到补体的损伤和提升起存活时间。Ang-1转基因猪对异种移植有重要的使用价值。
以上内容是结合具体的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
SEQUENCE LISTING
<110> 深圳市第二人民医院
<120> 重组的人源Ang-2在制备药物中的用途
<130> 17I23951
<160> 6
<170> PatentIn version 3.3
<210> 1
<211> 20
<212> DNA
<213> 人工序列
<400> 1
aaacatgaag tcggagatgg 20
<210> 2
<211> 20
<212> DNA
<213> 人工序列
<400> 2
ttctccagca gctgtatctc 20
<210> 3
<211> 20
<212> DNA
<213> 人工序列
<400> 3
agaaccagac ggctgtgatg 20
<210> 4
<211> 21
<212> DNA
<213> 人工序列
<400> 4
gaagttcaag tctcgtggtc t 21
<210> 5
<211> 19
<212> DNA
<213> 人工序列
<400> 5
acagacagcc gtgtgttcc 19
<210> 6
<211> 20
<212> DNA
<213> 人工序列
<400> 6
accttcacca tcgtgtctca 20
- 还没有人留言评论。精彩留言会获得点赞!