重组的人源IL‑6在制备药物中的用途的制作方法
本发明涉及细胞因子的用途技术领域,尤其涉及重组的人源IL-6在制备药物中的用途。
背景技术:
器官移植是治疗器官功能衰竭的一种有效治疗方案,但是人类器官供体的缺少是其主要限制。由于病理学、解剖学、经济学和伦理学方面的因素,猪被认为是解决器官缺乏的一个最适宜的供体来源。但是,免疫排斥反应是异种移植的主要障碍。促炎细胞因子在细胞免疫反应中起重要的作用,所以我们推测一些促炎细胞因子在异种移植中有重要的病理学作用。然而,这些细胞因子在异种移植中的作用仍然不清楚。
在炎症反应、凝血反应和细胞存活或者死亡中,内皮细胞具有重要调节作用。内皮细胞功能性紊乱与多种疾病有关,例如,肿瘤转移、动脉硬化和持久的慢性炎症。由于内皮细胞是被免疫细胞最先识别的,所以它们是最重要的一道防御线。在异种移植中,它们在炎症反应和凝血反应中具有重要作用的细胞。同时它们在同种和异种移植损伤中具有关键性的作用,作为异种移植研究领域中的相关研究的主要靶细胞。
在异种移植的反应过程中,会产生许多促炎细胞因子。在猪-人的器官移植过程中,人源细胞因子是否能够刺激来自猪供体的细胞或者器官是一个需要弄清楚的问题。在各种异种移植的模型中,包括猪-狒狒的模型中,其他一些重要的细胞因子,例如白细胞介素-6(IL-6)、白细胞介素(IL-17)和白细胞介素-1β(IL-1β)的表达量也有所增加。这些细胞因子的生物学功能和它们的促炎反应在各种生理学中作用也都已经报到了。可是这些促炎细胞因子在异种移植中的效果仍然不清楚。
技术实现要素:
为了弄清上述促炎细胞因子在异种移植中的效果,我们用这些细胞因子去刺激猪主动脉内皮细胞(PAEC)。我们检测了一些信号通路的激活情况和下游基因的表达,例如粘附分子(内皮细胞选择素(E-selectin)、血管细胞粘附分子-1(VCAM-1)和细胞间黏附分子-1(ICAM-1)),趋化因子(白细胞介素-8(IL-8)和单核细胞趋化蛋白-1(MCP-1)),促炎因子(IL-6)和促凝血反应有关的基因(组织因子)。并且对猪白细胞抗原I(SLA-I)和猪白细胞抗原II(SLA-II DR)也进行检测。
发明人发现人源的细胞因子IL-6、IL-17、IL-1β和TNFα以不同的通路激活猪内皮细胞。在猪主动脉内皮细胞,人源的细胞因子IL-6、IL-17、IL-1β和TNFα与来源于猪的细胞因子IL-6、IL-17、IL-1β和TNFα作用效果一致。人源的细胞因子rhIL-17、rhIL-1β和rhTNFα可以诱导粘附分子(E-selectin、VCAM-1和ICAM-1)、趋化因子(IL-8和MCP-1)、促炎因子(IL-6)和促凝血反应有关的基因(组织因子)的表达,而人源的细胞因子rhIL-6可以增加趋化因子MCP-1和促凝血因子(组织因子)的表达。人源的细胞因子rhIL-1β和rhTNFα可以上调表达猪白细胞抗原I(SLA-I)而人源的细胞因子rhIL-17或rhIL-6都不能。虽然人源的细胞因子rhIL-17不能使E-selectin、VCAM-1、ICAM-1、IL-8、MCP-1、IL-6和组织因子的表达量增加很多,但是它与人源的细胞因子rhTNFα的协同作用下,显著增加E-selectin、IL-6和IL-8的表达量。另外,在猪主动脉内皮细胞中,托珠单抗(tocilizumab)不能阻止由人源的IL-6激活的STAT3信号通路。发明人认为人源的细胞因子IL-6、IL-17、IL-1β和TNFα在异种移植中具有重要的病理学作用,能够成为潜在的治疗靶点。并且人源的细胞因子IL-6、IL-17、IL-1β和TNFα可以作为激活相关信号通路、诱导或上调相关基因表达的活性分子。进而,这些人源的细胞因子可以作为制备相关药物的活性成分。相关药物可以是包括人源的细胞因子IL-6、IL-17、IL-1β或TNFα作为活性成分,以及任选地药物载体——例如水等溶剂的药物组合物。
基于以上发现,本发明提供一种重组的人源IL-6在制备药物中的用途。
根据本发明的第一方面,本发明提供一种重组的人源IL-6在制备激活猪内皮细胞中信号传导与转录激活因子(Signal Transducer and Activator of Transcription,STAT)STAT3信号通路的药物中的用途。
根据本发明的第二方面,本发明提供一种重组的人源IL-6在制备诱导猪内皮细胞中趋化因子表达的药物中的用途。
进一步地,上述趋化因子是白细胞介素-8(IL-8)。
进一步地,上述趋化因子是单核细胞趋化蛋白-1(MCP-1)。
根据本发明的第三方面,本发明提供一种重组的人源IL-6在制备上调猪内皮细胞中组织因子表达的药物中的用途。
进一步地,在本发明的第一方面至第三方面中,上述猪内皮细胞是猪主动脉内皮细胞。
本发明发现重组的人源IL-6能够激活猪内皮细胞中STAT3信号通路、诱导猪内皮细胞中趋化因子表达以及上调猪内皮细胞中组织因子表达,因此重组的人源IL-6可以作为实现这些功能的药物的活性成分。
附图说明
图1显示在PAEC中,IL-17、IL-1β和TNFα激活NF-κB和MAPK,而IL-6激活STAT3。(A)将PAEC暴露于rpIL-6(20ng/ml)或rhIL-6(20ng/ml)(指定的时间),并将HUVEC暴露于rhIL-6(20ng/ml)(指定的时间)。裂解物通过针对p-STAT3、STAT3、p-AKT和肌动蛋白的抗体进行免疫印迹分析。p-STAT3和p-AKT的定量分析显示在右侧。(B)将PAEC暴露于rpIFNγ(40ng/ml)或rhIFNγ(40ng/ml),将HUVEC暴露于rhIFNγ(40ng/ml)。裂解物通过针对p-STAT1、STAT1和肌动蛋白的抗体进行免疫印迹分析。p-STAT1的定量分析显示在右侧。(C-E)将PAEC暴露于rpIL-17(100ng/ml),rhIL-17(100ng/ml)(C),rpIL-1β(20ng/ml),rhIL-1β(20ng/ml)(D),rpTNFα(100ng/ml)或rhTNFα(20ng/ml)(E),HUVEC暴露于rhIL-17(100ng/ml)(C),rhIL-1β(20ng/ml)(D)或rhTNFα(20ng/ml)(E)。通过用所示抗体免疫印迹分析裂解物。p-P65、p-IκBα、p-P38和p-JNK的定量分析显示在右侧。数据代表至少三个独立实验(平均值±SEM)。通过Student's t检验,*p<0.05,**p<0.01,***p<0.001。
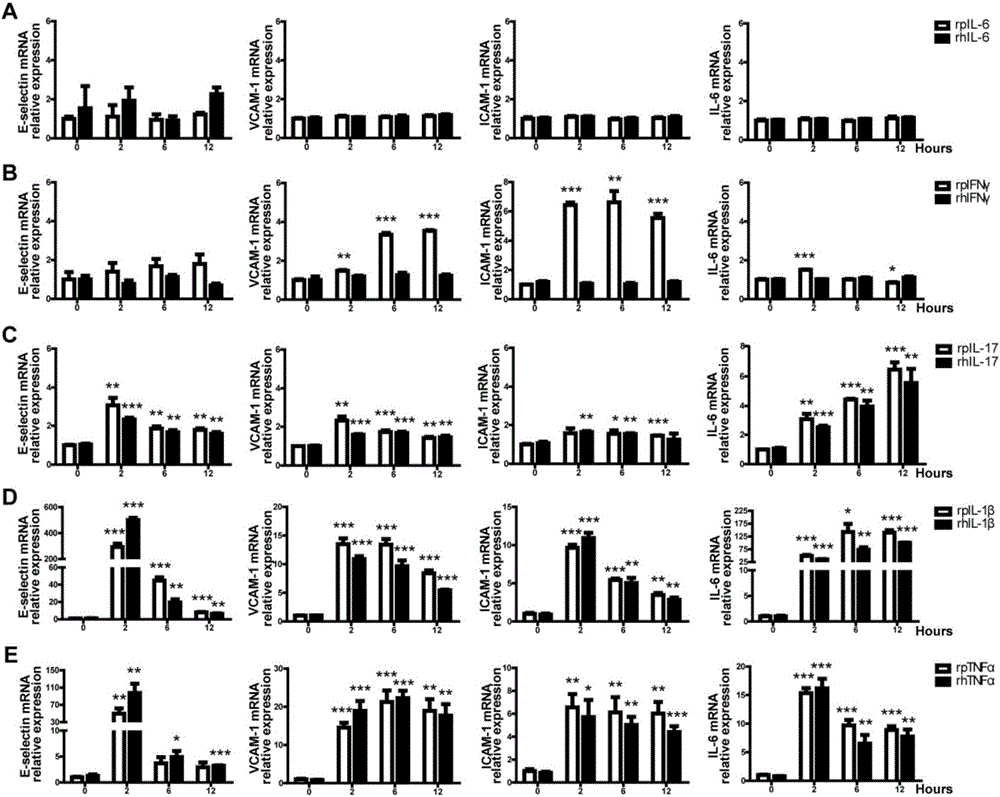
图2显示在PAEC中,IL-17、IL-1β和TNFα增加粘附分子和促炎细胞因子IL-6的表达。PAEC不作处理或者使用rpIL-6(20ng/ml)或rhIL-6(20ng/ml)(A),rpIFNγ(40ng/ml),rhIFNγ(40ng/ml)(B),rpIL-17(100ng/ml),rhIL-17(100ng/ml)(C),rpIL-1β(20ng/ml),rhIL-1β(20ng/ml)(D),rpTNFα(20ng/ml)或rhTNFα(20ng/ml)(E)处理2、6或12小时。通过实时PCR检测E-selectin、VCAM-1、ICAM-1和IL-6的mRNA水平。数据代表至少三个独立实验(平均值±SEM)。通过Student's t检验,*p<0.05,**p<0.01,***p<0.001。
图3显示在HUVEC中粘附分子(E-selectin、VCAM-1和ICAM-1)和IL-6被人IL-6、IFNγ、IL-1β和TNFα诱导。HUVEC不作处理或者使用rhIL-6(20ng/ml)(A),rhIFNγ(40ng/ml)(B),rhIL-17(100ng/ml)(C),rhIL-1β(20ng/ml)(D)或rhTNFα(20ng/ml)(E)处理2、6或12小时。通过RT-PCR分析E-selectin、VCAM-1、ICAM-1和IL-6的mRNA水平。数据代表至少三个独立实验(平均值±SEM)。通过Student's t检验,*p<0.05,**p<0.01,***p<0.001。
图4显示在PAEC中,IL-6、IL-17、IL-1β和TNFα诱导IL-8和MCP-1的表达。(A-B)PAEC不作处理或者使用rpIL-6(20ng/ml),rhIL-6(20ng/ml),rpIFNγ(40ng/ml),rhIFNγ(40ng/ml),rpIL-17(100ng/ml),rhIL-17(100ng/ml),rpIL-1β(20ng/ml),rhIL-1β(20ng/ml),rpTNFα(20ng/ml)或rhTNFα(20ng/ml)处理2、6或12小时。通过实时PCR检测IL-8(A)或MCP-1(B)的mRNA水平。(C-D)PAEC不作处理或者使用rpIL-6(20ng/ml),rhIL-6(20ng/ml),rpIFNγ(40ng/ml),rhIFNγ(40ng/ml),rpIL-17(100ng/ml),rhIL-17(100ng/ml),rpIL-1β(20ng/ml),rhIL-1β(20ng/ml),rpTNFα(20ng/ml)或rhTNFα(20ng/ml)处理24小时,其中直方柱从左到右依次对应右侧的分子。通过ELISA测量上清液中猪IL-8(C)或MCP-1(D)的蛋白水平。数据代表至少三个独立实验(平均值±SEM)。通过Student's t检验,*p<0.05,**p<0.01,***p<0.001。
图5显示在HUVEC中,人IL-6、IFNγ、IL-17、IL-1β和TNFα调节IL-8和MCP-1的mRNA水平。(A-B)HUVEC不作处理或者使用rhIL-6(20ng/ml),rhIFNγ(40ng/ml),rhIL-17(100ng/ml),rhIL-1β(20ng/ml)或rhTNFα(20ng/ml)处理2、6或12小时。通过RT-PCR分析IL-8(A)和MCP-1(B)的mRNA水平。数据代表至少三个独立实验(平均值±SEM)。通过Student's t检验,*p<0.05,**p<0.01,***p<0.001。
图6显示在PAEC中,组织因子的mRNA水平由IL-6、IL-17、IL-1β和TNFα诱导。PAEC未经处理或用rpIL-6(20ng/ml),rhIL-6(20ng/ml),rpIFNγ(40ng/ml),rhIFNγ(40ng/ml),rpIL-17(100ng/ml),rhIL-17(100ng/ml),rpIL-1β(20ng/ml),rhIL-1β(20ng/ml),rpTNFα(20ng/ml)或rhTNFα(20ng/ml)处理2、6或12小时。通过实时PCR检测组织因子的mRNA水平。数据代表至少三个独立实验(平均值±SEM)。通过Student's t检验,*p<0.05,**p<0.01,***p<0.001。
图7显示人IL-6、IL-1β和TNFα诱导HUVEC中组织因子的表达。HUVEC未经处理或用rhIL-6(20ng/ml),rhIFNγ(40ng/ml),rhIL-17(100ng/ml),rhIL-1β(20ng/ml)或rhTNFα(20ng/ml)处理2、6或12小时。通过RT-PCR分析组织因子的mRNA水平。数据代表至少三个独立实验(平均值±SEM)。通过Student's t检验,**p<0.01,***p<0.001。
图8显示在用IL-1β和TNFα处理的PAEC中,SLA-1,而不是SLA-II DR增加。(A-B)PAEC未经处理或用rpIL-6(20ng/ml),rhIL-6(20ng/ml),rpIFNγ(40ng/ml),rhIFNγ(40ng/ml),rpIL-17(100ng/ml),rhIL-17(100ng/ml),rpIL-1β(20ng/ml),rhIL-1β(20ng/ml),rpTNFα(20ng/ml)或rhTNFα(20ng/ml)处理24小时,其中直方柱从左到右依次对应右侧的分子。通过流式细胞仪检测SLA-I(A)或SLA-II DR(B)的表达。通过几何平均荧光强度(Gmean)评价SLA-1或SLA-II DR与PAEC结合的程度。数据代表至少三个独立实验(平均值±SEM)。通过Student's t检验,***p<0.001。
图9显示在PAEC中IL-17和TNFα协同诱导E-selectin、IL-6和IL-8表达。PAEC用rhIL-17(100ng/ml),rhTNFα(2ng/ml)或rhIL-17+rhTNFα处理0、2或6小时的PAEC。通过实时PCR检测E-selectin、VCAM-1、ICAM-1、IL-6、IL-8、MCP-1或组织因子mRNA的诱导。数据代表至少三个独立实验(平均值±SEM)。其中直方柱从左到右依次对应右侧的分子。通过Student's t检验,*p<0.05,**p<0.01,***p<0.001。
图10显示在PAEC中,托珠单抗不抑制IL-6诱导的STAT3活化。(A-B)PAEC或HUVEC用低浓度(100ng/ml)(A)或高浓度(500ng/ml)(B)托珠单抗预处理30分钟或不处理,然后PAEC用rpIL-6(20ng/ml)或rhIL-6(20ng/ml)处理0、15或30分钟,HUVEC用rhIL-6(20ng/ml)处理0、15或30分钟。裂解物使用针对p-STAT3和STAT3的抗体通过蛋白质印迹分析。p-STAT3的定量分析显示在图像下。数据代表至少三个独立实验(平均值±SEM)。通过Student's t检验,*p<0.05,**p<0.01,***p<0.001。
具体实施方式
下面通过具体实验结合附图对本发明作进一步详细说明。
1.实验材料
1.1 实验仪器
37℃CO2细胞培养箱(Heraus)
超净工作台(苏净集团安森公司)
细胞/颗粒计数仪(BECKMAN COULTER)
荧光显微镜(Carl ZEISS)
蛋白电泳仪(BIO-RAD)
流式细胞仪(BD)
常温和冷冻离心机(Eppendorf)
纯水装置(Millipore)
超低温冰箱(Haier)
摇床(Thermo Fisher)
实时定量PCR仪(ABI 7900)
自动冲片机(Danaford ML 400)
真空泵(上海精宏)
1.2 原代细胞和细胞系
实验中主要用到两种细胞原代猪主动脉内皮细胞(PAECs)和人脐静脉内皮细胞(HUVECs),其中PAECs由中国野生型五指山小型猪主动脉分离而得。
1.3 细胞因子和抗体
重组人的IL-17、重组人和猪的IL-6、IFNγ、IL-1β及TNFα均购自美国R&D Systems公司。重组猪的IL-17购自美国Kingfisher Biotech Inc公司。pP65、P65、p-IκBα、IκBα、p-JNK、JNK、P38、p-P38、p-STAT1、STAT1、p-STAT3、STAT3和β-Actin抗体均购自美国Cell Signaling Technology公司。FITC-标记的SLA class I(SLA-I)和SLA class II DR(SLA-II DR)抗体均购自美国Bio-rad公司。猪的IL-8 ELISA试剂盒购自美国Abcam公司(Cambridge,MA,USA)。猪的MCP-1 ELISA试剂盒购自RayBiotech Inc(Norcross,GA,USA)。
本发明中,相关细胞因子或蛋白的英文缩写前面的符号的含义说明如下:r一般是指重组,例如rhIL-17表示重组的人源IL-17;h一般是指人源,例如rhIL-17表示重组的IL-17是人源的;p一般是指猪源,例如rpIL-17表示重组的猪源IL-17。英文缩写IFN表示干扰素,例如IFNγ表示γ干扰素;TNF表示肿瘤坏死因子,例如TNFα表示肿瘤坏死因子α。
1.4 其它试剂
Tocilizumab购自美国Genentech公司。内皮细胞培养基(ECM)、胎牛血清(FBS,Cat.No.0025)、青霉素/链霉素溶液(P/S,Cat.No.0503)以及内皮细胞生长添加剂(ECGS,Cat.No.1052)均购自美国Sciencell公司。蛋白酶抑制剂Cocktail购自Roche公司。TEMED、丙烯酰胺、甲叉丙烯酰胺和过硫酸氨均购自Sigma-Aldrich公司。100×青霉素-链霉素浓缩液和非必需氨基酸购自Gibco公司。胎牛血清(FBS)购自Gibco公司。RPMI-1640、DMEM培养基购自Gibco公司。TRIzol RNA提取试剂购自Invitrogen公司。0.45um硝酸纤维素膜(PVDF)购买自Millipore公司。胰酶Trypsin(EDTA)购自Gibco公司。Lipofectamine 2000购自Invitrogen公司。磷酸缓冲液(phosphate bufferd saline,PBS)购自Hyclone公司。ECL反应试剂盒购自Millipore公司。异丙醇、甲醇、三氯甲烷购自国药集团化学试剂有限公司。苯甲基磺酰氟(Phenylmethanesulfonyl fluoride,PMSF)购自Sigma公司。DEPC购自上海生工公司。
2.实验方法
2.1 细胞培养
实验中培养的细胞系用含10%胎牛血清、1%P/S和1%ECGS的ECM培养基。温度37℃及5%二氧化碳饱和湿度。
2.2 蛋白免疫印迹
采用冷的PBS(磷酸盐缓冲液,phosphate-buffered saline)清洗PAECs和HUVECs细胞后收集细胞,用含10mM NaF,1mM Na3VO4,1mM苯甲基磺酰氟和蛋白酶抑制剂的RIPA裂解液冰上裂解细胞30min,采用10%SDS-PAGE凝胶分离蛋白。分离蛋白后进行转膜,将蛋白转至PVDF膜(美国Millipore公司),然后用含5%脱脂牛奶及0.1%Tween 20的TBST(20mM Tris-HCl,150mM NaCl,pH7.6)溶液室温下封闭1h。封闭后清洗PDVF膜,加入一抗在4℃孵育过夜,TBST清洗后加入二抗,在室温下孵育1h,用增强的化学发光(ECL)检测试剂(美国Millipore公司)显影。采用ImageJ软件计算总蛋白和actin条带灰度,磷酸化蛋白的表达水平以相对灰度值表示。
2.3 荧光实时定量PCR
采用(美国Invitrogen)试剂提取PAECs和HUVECs的总RNA,用500ngRNA和Transcript First-Strand cDNA Synthesis SuperMix合成cDNA样品。采用SYBR Premix Ex Taq试剂盒(中国大连Takara公司)。检测E-selectin,VCAM-1,ICAM-1,IL-6,IL-8,MCP-1及tissue factor的水平。这些基因的表达以均以GAPDH作为内参,以2-ΔΔCt方法计算。在ViiA 7 Real-Time PCR仪(美国Applied Biosystems公司)上进行cDNA的扩增,核苷酸引物的序列如表1所示。PCR条件为:95℃,1min;95℃,10s,60℃,34s 40个循环;95℃15s,60℃15s,95℃15s。
表1
2.4酶联免疫吸附实验(ELISA)
分别采用rpIL-6(20ng/ml)、rhIL-6(20ng/ml)、rpIFNγ(40ng/ml)、rhIFNγ(40ng/ml)、rpIL-17(100ng/ml)、rhIL-17(100ng/ml)、rpIL-1β(20ng/ml)、rhIL-1β(20ng/ml)、rpTNFα(20ng/ml)及rhTNFα(20ng/ml)刺激PAEC 24h后,收集细胞上清液,用pIL-8、pMCP-1ELISA试剂盒检测细胞上清液中猪的IL-8(pIL-8)和MCP-1(pMCP-1)蛋白浓度。
2.5 流式细胞术
收集PAECs并用PBS清洗一次,取1×106个细胞用100μl含1%BSA的PBS溶液重悬,用FITC标记的SLA-I及SLA-II DR抗体进行染色,同种型匹配(Isotype-matched)抗体作为阴性对照,在4℃避光条件下孵育30min。用PBS清洗一次,用100μl含1%BSA的PBS溶液重悬细胞后,用BD流式细胞仪进行检测,SLA-I、SLA-II与PAECs的结合程度以几何平均荧光强度表示。
2.6 统计学分析
展示的数据是平均值(Mean),误差范围是标准差(SEM)。不同组间的差异用双尾Student’s t test进行分析。P值小于0.05的视为统计学显著差异。
3.实验结果
3.1.在PAECs中,IL-6、IL-17、IL-1β和TNFα激活了不同的信号通路
人源IL-17、IL-1β和TNFα主要激活NF-κB和MAPKs信号通路,人源IL-6和IFNγ则分别激活STAT3和STAT1通路。然而,这些人源的细胞因子在PAECs中能激活哪些信号通路仍然不清楚。
利用重组的人源和猪源细胞因子刺激PAECs或HUVECs细胞。我们发现在PAECs或者HUVECs中,rhIL-6能够显著的激活pSTAT3;在PAECs中,rpIFNγ能够激活pSTAT1,然而rhIFNγ不能激活(图1A-B)。在PAECs中,rhIL-17、rhIL-1β和rhTNFα上调了p-P65,pIκBα、p-P38和p-JNK(图1C-E)。在PAECs中,rhIL-6和rpIL-6激活的p-STAT3水平几乎一致(图1A)。rhIL-17激活的p-P65和pIκBα水平比rpIL-17略高(图1C);rhIL-1β激活的p-JNK水平略低于rpIL-1β(图1D);然而这些差异都没有显著性。
这些结果表明,在PAECs中,人源的IL-17、IL-1β和TNFα能够显著的激活NF-κB和MAPKs信号通路,人源的IL-6能够激活STAT3通路,然而人源的IFNγ并不能激活STAT1信号通路,这个结论与先前的报道一致。另外,在PAECs中,人源的IL-6、IL-17、IL-1β和TNFα激活的信号通路水平与猪源的细胞因子基本一致,表明猪源和人源的IL-6、IL-17、IL-1β和TNFα具有很高的同源性并且功能保守。
3.2.在PAECs中,IL-17、IL-1β和TNFα上调了粘附分子和IL-6的表达
接下来在PAECs中,我们想研究粘附分子(内皮细胞选择素(E-selectin)、VCAM-1和ICAM-1)及促炎分子IL-6的表达是否受这些细胞因子的调控。令人意外的是我们发现rpIFNγ上调了VCAM-1和ICAM-1的表达,然而rpIL-6、rhIL-6和rhIFNγ并不能上调这些基因的表达(图2A-B)。rhIL-17、rhIL-1β和rhTNFα能够显著上调E-selectin、VCAM-1、ICAM-1和IL-6的表达(图2C-E)。在PAECs中,rhIL-1β或rhTNFα处理两小时,E-selectin的mRNA水平上调超过100倍(图2D-E)。在HUVECs中,rhIL-6提高了ICAM-1和IL-6的表达但没有上调E-selectin和VCAM-1(图3A)。在rhIFNγ处理的HUVECs中,VCAM-1、ICAM-1和IL-6的mRNA水平明显上调,但E-selectin的水平没变(图3B)。在HUVECs中,rhIL-1β和rhTNFα同样上调了E-selectin、VCAM-1、ICAM-1和IL-6的表达,然而IL-17并没有上调任何基因,这个结果与之前的信号结果一致(图3C-E,图1C)。
3.3.在PAECs中,IL-6、IL-17、IL-1β和TNFα诱导了趋化因子的表达
另外,在PAECs中,我们还检测了这些细胞因子是否影响趋化因子(IL-8和MCP-1)的表达。rhIL-6上调了MCP-1的mRNA表达但是没有上调IL-8(图4A-B)。rpIFNγ上调了MCP-1的表达而且还微弱下调IL-8的表达,rhIFNγ并没有调控MCP-1和IL-8的表达水平(图4A-B)。在PAECs中,rhIL-17、rhIL-1β和rhTNFα诱导MCP-1的mRNA表达水平大约2-6倍,rhIL-1β和rhTNFα则大大的上调了IL-8的表达水平(图4A-B)。
我们利用ELISA的方法检测上清中的IL-8和MCP-1的蛋白水平,结果与mRNA水平保持一致(图4C-D)。在HUVECs中,rhIL-6和rhIFNγ上调了MCP-1的表达但是下调了IL-8的表达(图5A-B)。rhIL-1β和rhTNFα极大的增加了IL-8和MCP-1的mRNA表达水平(图5A-B)。
3.4.在PAECs中,IL-6、IL-17、IL-1β和TNFα上调了组织因子的表达
凝血失调是导致异种器官移植失败的一个重要原因。组织因子通过一系列的分子级联反应使得凝血酶原转化为凝血酶进而促进凝血反应的发生。在PAECs中,IL-6、IL-1β和TNFα使组织因子的mRNA表达水平提高了2-3倍,然而IL-17诱导的水平非常低(图6)。rpIFNγ或者rhIFNγ并不能诱导组织因子的表达(图6)。在HUVECs中,rhIL-6、rhIL-1β和rhTNFα提高了组织因子的mRNA表达水平,然而rhIL-17和rhIFNγ不能上调组织因子的表达(图7)。
3.5.在PAECs中,IL-1β和TNFα诱导了SLA-I的表达
利用人源或者猪源的细胞因子处理PAECs 24小时,利用流式细胞术分析SLA-I和SLA-II的表达水平。人源和鼠源的IL-1β、TNFα以及rpIFNγ提高了SLA-I的表达,然而IL-6、IL-17或rhIFNγ不能诱导SLA-I的表达。然而除了rpIFNγ外,其它细胞因子都不能诱导SLA-I的表达(图8)。
3.6.在PAECs中,IL-17和TNFα通过协同效应上调E-selectin、IL-8和IL-6的表达
据我们所知,在鼠源或人源系统中,IL-17和TNFα协同诱导的基因表达水平比它们各自单独诱导的基因水平之和要高。在猪源系统中,rhIL-17和rhTNFα是否具有协同效应仍不可知。我们发现,在PAECs中,rhIL-17和rhTNFα诱导的E-selectin、IL-8和IL-6的表达水平明显高于rhIL-17和rhTNFα单独诱导的水平之和(图9)。虽然IL-17单独诱导的基因表达水平不高,然而通过与TNFα的协同作用可显著提高基因的表达水平。
3.7.在PAECs中,tocilizumab不能阻断IL-6激活的STAT3通路
Tocilizumab是人源IL-6受体的人源化单克隆抗体,在人源系统中,它可以阻断IL-6介导的下游信号通路的激活进而抑制其炎症效应。在HUVECs中,tocilizumab(100ng/ml)抑制了rhIL-6介导的STAT3的激活,在一个高浓度(500ng/ml)的情况下基本完全阻断了IL-6介导的STAT3的激活(图10A-B)。令人吃惊的是,在PAECs中,tocilizumab(100ng/ml或500ng/ml)处理组或非处理组,rhIL-6或rpIL-6激活的STAT3水平没有明显差异(图10A-B)。造成这种结果的原因可能是人源和鼠源IL-6受体的结构差异,特别是tocilizumab与受体结合位点处的结构差异。基于这些结果,我们预测tocilizumab在异种移植中抑制免疫排斥的效果不如病人中的效果好。
4.讨论
虽然这些促炎细胞因子在各种疾病和同种移植中具有重要的病理学作用,但是在异种移植中它的病理学作用仍然不清楚。在猪主动脉内皮细胞,我们发现人源的细胞因子IL-17、IL-1β和TNFα可以激活NF-κB和MAPKs信号通路,而人源的细胞因子IL-6可以激活STAT3信号通路。人源的细胞因子IL-17、IL-1β和TNFα不仅能够诱导粘附分子(E-selectin、VCAM-1和ICAM-1)、促炎因子(IL-6)和趋化因子(IL-8和MCP-1),而且也能诱导组织因子。在人源细胞因子IL-1β或TNFα猪白细胞抗原I(SLA-I)的表达量也有所增加,但是在人源细胞因子IL-17中不能。在猪主动脉内皮细胞中,人源细胞因子IL-6只能增加MCP-1和组织因子mRNA的水平。可是,人源细胞因子IFNγ对猪主动脉内皮细胞没有作用。基于我们的试验,我们认为人源的细胞因子IL-6、IL-17、IL-1β和TNFα在异种移植中对炎症反应和促凝血反应有重要的作用。
Batten等人认为人源细胞因子IL-1β对猪主动脉内皮细胞没有作用,然而我们发现它能够刺激猪主动脉内皮细胞产生某些变化。他们发现在500U/ml人源细胞因子rhIL-1β处理1天、2天、3天或者6天后,在猪主动脉内皮细胞中,E-selectin和VCAM-1的蛋白质水平没有增加,而在我们的试验中发现,用20ng/ml人源细胞因子rhIL-1β处理猪主动脉内皮细胞2h后,E-selectin和VCAM-1的mRNA水平可以增加10-400倍。另外我们发现,人源细胞因子rhIL-1β可以显著激活NF-κB和MAPKs信号通路,以及其他的炎症相关基因,趋化因子,组织因子和SLA-I。但是猪白细胞抗原II(SLA-II DR)是没有变化的,这个结论与Batten等人报道的结论是一致的。我们认为导致这样两种不同结果原因可能与不同的处理时间或者人源细胞因子IL-1β的不同浓度有关。
IL-17是由Th17细胞产生的一种特异性的细胞因子,与自身免疫疾病,癌症和各种炎症紊乱反应有关。在之前的研究中,人源细胞因子IL-17能够激活PAECs下游信号通路,例如NF-κB、JNK和P38或上调表达下游粘附因子,促炎基因,趋化因子和组织因子。虽然有些基因的表达在人源细胞因子IL-17刺激下表达并不是很大,但是当它与人源细胞因子rhTNFα共同作用下,能够明显扩大其影响效果。人源细胞因子IL-17通过加强mRNA的稳定性。在牛皮癣疾病中,Andrea Chiricozzi等人鉴定了160个基因,例如CCL20,CXCL1,IL-17C,IL-8等都能通过协同作用上调表达。利用基因芯片分析和RT-PCR在另外196个基因表达中这两个细胞因子具有协同作用。在之前研究中,我们发现在人源细胞因子IL-17和rhTNFα的协同作用下,可以诱导E-selectin、IL-6和IL-8的表达。我们预测除了这三个基因外,在猪主动脉内皮细胞中,会有更多的基因受到这种协同作用的影响。基因芯片技术是一种比较好的方法去研究这些问题。在异种移植中,人源细胞因子rhIL-17和rhTNFα能够扩大促炎反应。抗IL-17和抗TNFα药物联合使用会对异种移植临床治疗具有一定的治疗效果。
IL-6是一种在炎症反应、癌症、免疫调控和造血过程中具有广泛的生物学功能的多效细胞因子。它主要激活JAK/STAT3的信号通路。在我们的研究中,人源化细胞因子IL-6能够激活STAT3信号通路和诱导MCP-1和组织因子的表达。同样,IL-6在急性和慢性炎症反应中具有重要的作用。它也能促进多形核中性白血球(PMN)向单核粒细胞/巨噬细胞的转移。并且我们发现人源细胞因子IL-6能够诱导内皮细胞产生MCP-1。这种现象可能支持多形核中性白血球(PMN)向单核粒细胞的转化。IL-6也是一种能够平衡调节性T细胞和产生IL-17的Th17细胞。另外,IL-6在T细胞具有抗凋亡作用。我们认为在异种移植中,通过招募单核粒细胞,平衡调节性T细胞和Th17细胞以及促进T细胞的存活,人源细胞因子IL-6可以诱导炎症反应。更加有趣的是,托珠单抗(tocilizumab),一种抗IL-6受体的特异性抗体,不能阻断由人源细胞因子IL-6激活的STAT3信号通路。并且建议在体外模型或者猪-狒狒的异种移植模型中,使用其他药品,例如单抗药物sarilumab和siltuximab是否能够阻断IL-6信号。
另外,我们发现人源细胞因子rhTNFα能够显著激活NF-κB和MAPKs信号通路,然后调节下游基因的表达。猪源rpIFNγ明显能够激活下游基因和STAT1,而人源细胞因子rhIFNγ不能。
在PAECs中,趋化因子MCP-1和IL-8能够与一些粘附分子E-selectin、ICAM-1和VCAM-1一起,与特异性的内细胞相互作用并且招募它们到炎症反应位点。IL-6也被认为是促炎反应中的最重要的细胞因子与促炎反应相关基因的表达是一个放大免疫反应最重要的途径。在我们的研究中,发现人源细胞因子rhIL-17、rhIL-1β和rhTNFα能够诱导这些基因的表达,以及人源rhIL-6能够增加MCP-1的表达。这些结果显示人源细胞因子IL-6、IL-17、IL-1β和TNFα在异种移植中能够促进炎症反应,它们可以被联合药物所抑制。
T细胞反应在异种移植的细胞免疫反应中有重要的作用。主要组织相容性复合体(MHC)对T细胞的激活是十分重要的。猪白细胞抗原II(SLA-II)主要负责CD4+T细胞的激活,而SLA-I主要对CD8+T细胞和NK细胞的活性。显性负Ⅱ类反式激活(Dominant negative class II transactivator)转基因猪能够降低这类T细胞的反应,而在猪白细胞抗原I(SLA-I)缺陷性猪的外周血中CD4-CD8+T细胞的数量有所减少。
在我们的研究中发现,人源细胞因子TNFα和IL-1β能够诱导猪白细胞抗原I(SLA-I),但是人源细胞因子IL-17和IL-6不能。猪白细胞抗原II(SLA-II)只能被猪源rpIFNγ激活,而其他的细胞因子则不能。这些发现显示,人源细胞因子TNFα和IL-1β处理的PAECs更容易被CD8+T细胞和NK细胞识别。在猪-狒狒异种移植的模式中,会经常发生凝血紊乱,成为移植成功的一个重要壁垒。凝血反应是一个非常紧密的调控过程。组织因子引起的凝血酶原向凝血酶转变的一个分子联机反应,它能够启动外源性凝血级联反应。Ahrens等人认为,与野生型的猪相比,下调组织因子的猪能够减少凝血酶的形成和增加凝血的时间。在我们的研究中发现,人源细胞因子IL-6、IL-1β或者TNFα能够诱导组织因子的表达,而人源细胞因子rhIL-17可以微弱的上调表达组织因子。这些研究结果发现,在猪-狒狒异种移植的模式中,人源细胞因子IL-6、IL-1β、TNFα和IL-17能够促凝血反应。因此,在异种移植中,阻断这些细胞因子可以缓解凝血紊乱反应。
综上所述,在我们的研究中我们发现:(1)人源细胞因子IL-6、IL-17、TNFα和IL-1β能够以不同的方式激活PAECs;(2)激活的PAECs在不同程度上调控粘附因子、趋化因子、促炎基因IL-6、SLA-I和凝血因子,这些基因在异种移植中能够影响炎症和凝血反应。
以上内容是结合具体的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
SEQUENCE LISTING
<110> 深圳市第二人民医院
<120> 重组的人源IL-6在制备药物中的用途
<130> 17I23971
<160> 32
<170> PatentIn version 3.3
<210> 1
<211> 20
<212> DNA
<213> 人工序列
<400> 1
ctgagcacct gcaatgtacc 20
<210> 2
<211> 21
<212> DNA
<213> 人工序列
<400> 2
gctttacacg ttggcttctt g 21
<210> 3
<211> 19
<212> DNA
<213> 人工序列
<400> 3
cattccatgg tgtcccaga 19
<210> 4
<211> 21
<212> DNA
<213> 人工序列
<400> 4
tccaaactct tcgtttcctt g 21
<210> 5
<211> 20
<212> DNA
<213> 人工序列
<400> 5
gaggagctgt tcaggcagtc 20
<210> 6
<211> 19
<212> DNA
<213> 人工序列
<400> 6
catccggaac gtgacattg 19
<210> 7
<211> 25
<212> DNA
<213> 人工序列
<400> 7
gctgcttctg gtgatggcta ctgcc 25
<210> 8
<211> 25
<212> DNA
<213> 人工序列
<400> 8
tgaaactcca caagaccggt ggtga 25
<210> 9
<211> 22
<212> DNA
<213> 人工序列
<400> 9
agcccgtgtc aacatgactt cc 22
<210> 10
<211> 21
<212> DNA
<213> 人工序列
<400> 10
ttgtgttggc atctttactg a 21
<210> 11
<211> 20
<212> DNA
<213> 人工序列
<400> 11
ctcccacacc gaagcttgaa 20
<210> 12
<211> 20
<212> DNA
<213> 人工序列
<400> 12
taattgcatc tggctgggca 20
<210> 13
<211> 21
<212> DNA
<213> 人工序列
<400> 13
tttaccaact cgcccccctt c 21
<210> 14
<211> 23
<212> DNA
<213> 人工序列
<400> 14
aatgtgccgt tcaccctgac taa 23
<210> 15
<211> 19
<212> DNA
<213> 人工序列
<400> 15
acagacagcc gtgtgttcc 19
<210> 16
<211> 20
<212> DNA
<213> 人工序列
<400> 16
accttcacca tcgtgtctca 20
<210> 17
<211> 21
<212> DNA
<213> 人工序列
<400> 17
agagtggagc ctggtcttac a 21
<210> 18
<211> 23
<212> DNA
<213> 人工序列
<400> 18
cctttgctga caataagcac tgg 23
<210> 19
<211> 21
<212> DNA
<213> 人工序列
<400> 19
gggaagatgg tcgtgatcct t 21
<210> 20
<211> 21
<212> DNA
<213> 人工序列
<400> 20
tctggggtgg tctcgatttt a 21
<210> 21
<211> 20
<212> DNA
<213> 人工序列
<400> 21
atgcccagac atctgtgtcc 20
<210> 22
<211> 20
<212> DNA
<213> 人工序列
<400> 22
ggggtctcta tgcccaacaa 20
<210> 23
<211> 23
<212> DNA
<213> 人工序列
<400> 23
actcacctct tcagaacgaa ttg 23
<210> 24
<211> 23
<212> DNA
<213> 人工序列
<400> 24
ccatctttgg aaggttcagg ttg 23
<210> 25
<211> 23
<212> DNA
<213> 人工序列
<400> 25
actgagagtg attgagagtg gac 23
<210> 26
<211> 21
<212> DNA
<213> 人工序列
<400> 26
aaccctctgc acccagtttt c 21
<210> 27
<211> 19
<212> DNA
<213> 人工序列
<400> 27
ttctgtgcct gctgctcat 19
<210> 28
<211> 18
<212> DNA
<213> 人工序列
<400> 28
ggggcattga ttgcatct 18
<210> 29
<211> 19
<212> DNA
<213> 人工序列
<400> 29
ggcgcttcag gcactacaa 19
<210> 30
<211> 21
<212> DNA
<213> 人工序列
<400> 30
ttgattgacg ggtttgggtt c 21
<210> 31
<211> 20
<212> DNA
<213> 人工序列
<400> 31
gagtcaacgg atttggtcgt 20
<210> 32
<211> 20
<212> DNA
<213> 人工序列
<400> 32
tggaagatgg tgatgggatt 20
- 还没有人留言评论。精彩留言会获得点赞!