一种甘丙肽在制备抑制胶质瘤细胞增殖的试剂中的应用的制作方法
本发明属于医疗技术领域,具体来说,涉及一种甘丙肽及其受体在抑制胶质瘤细胞的增殖中的用途。
背景技术:
甘丙肽(galanin):是由29个氨基酸组成的神经肽,广泛分布于中枢和外周神经系统中;胶质瘤(glioma):常见的恶性中枢神经系统肿瘤之一,胶质瘤细胞则是由人体胶质瘤病理组织体外培养的细胞系,用于基础科研研究使用;细胞增殖(cell proliferation):细胞以分裂的方式进行增殖并产生新的细胞,是生命体的重要生命特征。而肿瘤细胞的增殖则是指细胞在致癌因素的作用下,基因发生改变,从而导致异常持续的分裂增殖。
甘丙肽是由29~30个氨基酸组成的神经肽,能广泛分布于中枢和外周神经系统,并且更有研究提示甘丙肽也存在于神经内分泌的组织中(Giaid et al.,1991)。在后续对甘丙肽的研究中发现,其参与了多种重要的生理、行为以及认知过程当中。除此之外,更有研究提示甘丙肽与多种疾病有密切的关系,例如癫痫、抑郁症、阿尔茨海默病和癌症。其中,甘丙肽与肿瘤发生、增殖以及凋亡的关系越来越引起关注。早期研究就已经发现,甘丙肽和其三种受体亚型广泛表达于多种人类肿瘤细胞系,包括神经母细胞瘤、肺癌细胞系以及大肠癌等。在深入研究后发现,越来越多的数据显示甘丙肽在多种神经内分泌相关肿瘤的病理过程中起到了负调节的作用,这也提示甘丙肽及其受体可能具有抑癌的功能。
甘丙肽通过其三种G蛋白偶联受体亚型广泛参与和调控多种类型的生理过程中,分别被克隆和命名为甘丙肽1型受体(GalR1),甘丙肽2型受体(GalR2)和甘丙肽3型受体(GalR3)。每种甘丙肽受体亚型均展现出了不同的生理药理特性,并且三种受体亚型分别介导多种不同的下游信号通路。GalR1和GalR3主要与Gi/o蛋白受体亚型偶联,通过激活腺苷酸环化酶引起细胞膜上电流的超极化和膜上钾离子通道的开放。与GalR1和GalR3受体亚型不同的是,GalR2下游信号通路的激活主要是通过与Gq/11蛋白受体亚型偶联后,使细胞内的三磷酸腺苷聚集,细胞内钙离子的释放以及下游信号通路的开放。
胶质瘤作为人类最为常见的恶性中枢神经系统肿瘤之一,其较高的致死率一直排在颅脑疾病的前列。由于脑胶质瘤具有较强的增殖、侵袭以及对药物耐受的能力,而且预后效果一直极其不佳,临床上一直没有较为有效的治疗方法。因此,研究探索一种新的抑癌药物对于人脑胶质瘤在临床上的治疗尤为紧要。
技术实现要素:
本发明所要解决的技术问题是提供一种甘丙肽在制备抑制胶质瘤细胞增殖的试剂中的应用,由此解决现有临床无甘丙肽是否能调节胶质瘤的增殖研究的空白。
本发明解决上述技术问题所采取的技术方案如下:
一种甘丙肽在制备抑制胶质瘤细胞增殖的试剂中的应用,所述试剂中具有甘丙肽作为有效成分,该试剂通过甘丙肽与甘丙肽受体结合对胶质瘤细胞进行作用,并对细胞系的增殖进行抑制。
进一步地,优选的是,所述胶质瘤细胞选择人源U251或者T98G瘤细胞。
进一步地,优选的是,将甘丙肽和生理盐水混合并制成试剂。
进一步地,优选的是,所述试剂中,所述甘丙肽的浓度为100nM-1000nM。
进一步地,优选的是,所述试剂被制备成静脉注射针剂。
进一步地,优选的是,所述试剂中,所述甘丙肽的浓度为100nM。
进一步地,优选的是,所述甘丙肽通过甘丙肽1型受体(GalR1)来介导,并对胶质瘤细胞进行作用。
进一步地,优选的是,将甘丙肽和培养基混合并制成试剂。
一种制备抑制胶质瘤细胞增殖的试剂,所述试剂中具有甘丙肽作为有效成分,该试剂通过甘丙肽与甘丙肽受体结合对胶质瘤细胞进行作用,并对细胞系的增殖进行抑制。
本发明采取了上述方案以后,从临床上提供了甘丙肽作为试剂抑制胶质瘤细胞增殖的支持,同时,该试剂可进一步制备成静脉注射针剂,一方面易于临床上的操作和使用,另一方面也能方便于患者术后自行注射和进行辅助康复治疗。
本发明的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本发明而了解。本发明的目的和其他优点可通过在所写的说明书、权利要求书、以及附图中所特别指出的结构来实现和获得。
附图说明
下面结合附图对本发明进行详细的描述,以使得本发明的上述优点更加明确。其中,
图1a是甘丙肽及其三个受体在人源U251胶质瘤细胞中的mRNA表达水平示意图;
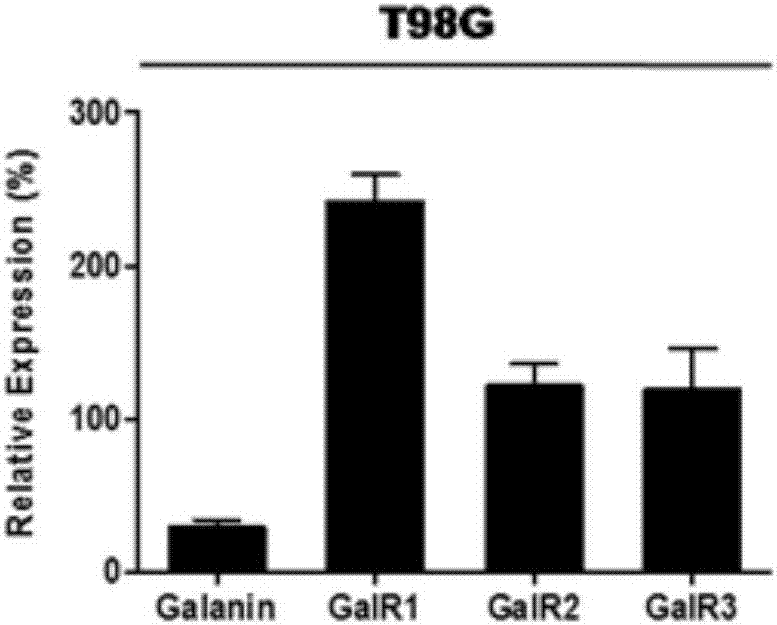
图1b是甘丙肽及其三个受体在人源T98G胶质瘤细胞中的mRNA表达水平示意图;
图2a-图2f是实验中甘丙肽对人源U251和T98G胶质瘤细胞系的增殖起抑制作用的实验测试示意图;
图3a-图3d是实验中甘丙肽抑制人源U251和T98G胶质瘤细胞的克隆形成的测试示意图;
图4a-图4b是实验中甘丙肽对细胞周期发挥有效的阻滞作用示意图;
图5a-图5h是甘丙肽在裸鼠的肿瘤种植模型实验中显著抑制肿瘤的增殖示意图。
具体实施方式
以下将结合附图及实施例来详细说明本发明的实施方式,借此对本发明如何应用技术手段来解决技术问题,并达成技术效果的实现过程能充分理解并据以实施。需要说明的是,只要不构成冲突,本发明中的各个实施例以及各实施例中的各个特征可以相互结合,所形成的技术方案均在本发明的保护范围之内。
具体来说,随着甘丙肽的研究,人民逐渐发现细胞生长因子,并且发现其对胶质瘤具有显著的抑癌作用。并且,更有研究提示神经肽也能作用到胶质瘤并具有抑制其增殖的功能。由于调节胶质瘤的增殖对临床上抑制肿瘤生长起到了至关重要的作用,因此,研究甘丙肽是否能调节胶质瘤的增殖具有重要的临床意义。
值得关注的是,早期就有研究提示甘丙肽及其三种受体亚型均有表达于人脑胶质瘤病理组织当中,但是其是否在人源胶质瘤细胞系中表达和发挥调节作用一直很少关注。近几年研究发现甘丙肽通过GalR1在口腔鳞状细胞癌中发挥了抑制其肿瘤增殖的作用,更有研究深入探究了甘丙肽及其受体亚型的抑癌功能主要是通过介导MAPK信号通路而作用的。因此,基于上述的研究基础,对于探究甘丙肽及其受体对肿瘤的增殖是否起抑制作用具有重要的基础和临床意义。并且,由于甘丙肽对人源胶质瘤细胞系的增殖和凋亡是否也有一定的调节作用一直少有关注和研究。因此,研究其对胶质瘤细胞系是否也能发挥抑癌作用显得尤为重要。
为此,提供了一种甘丙肽在制备抑制胶质瘤细胞增殖的试剂中的应用,所述试剂中具有甘丙肽作为有效成分,该试剂通过甘丙肽或者甘丙肽受体对胶质瘤细胞进行作用,并对细胞系的增殖进行抑制。
进一步地,优选的是,所述胶质瘤细胞选择人源U251或者T98G瘤细胞。
进一步地,优选的是,将甘丙肽和生理盐水混合并制成试剂。
进一步地,优选的是,所述试剂中,所述甘丙肽的浓度为100nM-1000nM。
进一步地,优选的是,所述试剂被制备成静脉注射针剂。
进一步地,优选的是,所述试剂中,所述甘丙肽的浓度为100nM。
进一步地,优选的是,所述甘丙肽通过甘丙肽1型受体(GalR1)来介导,并对胶质瘤细胞进行作用。
进一步地,优选的是,将甘丙肽和培养基混合并制成试剂。
本发明采取了上述方案以后,从临床上提供了甘丙肽作为试剂抑制胶质瘤细胞增殖的支持,同时,该试剂可进一步制备成静脉注射针剂,一方面易于临床上的操作和使用,另一方面也能方便于患者术后自行注射和进行辅助康复治疗。
具体来说,在本专利中,通过实时定量PCR检测到甘丙肽及其三个受体亚型均表达于人源U251和T98G胶质瘤细胞系中。采用体外细胞实验分别检测两种胶质瘤细胞系在甘丙肽处理后增殖活性和细胞周期的变化,同时建立人源U251和T98G胶质瘤细胞株裸鼠皮下接种模型裸鼠模型。研究结果表面,甘丙肽能明显抑制肿瘤的细胞增殖和周期,并对裸鼠皮下移植模型也起到抑瘤作用。
其中,针对发明中的附图,简单说明如下:图1a-图1b是通过使用实时定量PCR(RT-PCR)技术来检测细胞中甘丙肽及其三个受体的mRNA表达水平(Relative Expression)变化,目的基因的mRNA表达水平以管家基因GAPDH为内参,其中,图1a是甘丙肽及其三个受体在人源U251胶质瘤细胞中的mRNA表达水平;图1b是甘丙肽及其三个受体在人源T98G胶质瘤细胞中的mRNA表达水平。
图2a-图2f是采用CCK-8体外细胞活性检测试剂盒研究甘丙肽和AR-M1896对两种细胞系的增殖是否发挥作用,加药处理组的细胞增殖活性均以正常对照组为内参来分析细胞相对增殖率(Relative Cell Proliferation)。
其中,图2a和图2b是通过酶标仪检测各细胞系在不同细胞种植数下的吸光值(Absorbance 450nm),分别研究两种细胞的生长曲线,从而确定最佳细胞种植密度(Cell Number);
图2c和图2d是各种细胞在不同浓度的甘丙肽和AR-M1896处理48小时后,甘丙肽对细胞增殖的抑制作用呈正相关;
图2e和图2是经100nM甘丙肽和AR-M1896处理后,甘丙肽处理组在48小时对两种细胞系均呈现明显的抑制生长活性的作用;
其中,图3a和图3b中,细胞克隆形成实验提示,100nM甘丙肽处理组可以显著降低细胞的克隆形成数,提示甘丙肽均对两种细胞系发挥抑制增殖的作用;
图3c和图3d中,通过软琼脂克隆实验进一步证实,与对照组相比甘丙肽处理组显著降低了两种细胞的克隆形成数(Colonies Number)。
其中,图4a-图4b是细胞经24小时的不同药物处理后,通过使用流式细胞术来检测甘丙肽和AR-M1896对细胞的周期分布(Distribution of Cell Cycle)是否产生影响。2mM秋水仙碱(Colchicine)实验组作为阳性实验对照组,处理时间和方法与实验组一致。
其中,图4a中,人源U251胶质瘤细胞系在100nM甘丙肽处理后,细胞周期明显放生阻滞;
图4b中,人源T98G胶质瘤细胞系的细胞周期同样在100nM甘丙肽处理后发生阻滞;
其中,图5a-图5b的图像是从模型动物处死后剥离的肿瘤组成;
图5c和图5d中,经甘丙肽和AR-M1896药物组处理后,肿瘤体积大小的变化。结果提示甘丙肽可以显著抑制胶质瘤细胞的肿瘤体积大小(Tumor Volume);
图5e和图5f中,肿瘤剥离后经称重,来分析药物组对肿瘤的生长是否有抑制作用。如图所示,甘丙肽药物组肿瘤的重量(Tumor Weight)与正常对照组相比显著减轻;
图5g和图5h是实验模型动物每隔三天的体重变化(Body Weight)。
解决技术问题的具体实验步骤:
1实时定量RT-PCR检测甘丙肽及其受体在胶质瘤细胞中的表达情况:
1.1细胞总RNA提取
(1)4℃离心收集细胞放于EP管中。按照试剂盒提RNA(QIAGEN RNeasy Lipid Tissue Mini Kit)的操作步骤,提取细胞中的RNA;
(2)在各EP管中加0.5ml QIAZOL;
(3)反复吹打直至QIAZOL澄清,室温放置5分钟;
(4)加200μl chloroform试剂,剧烈震荡15秒,室温放置2-3分钟;
(5)12000rpm,4℃离心15分钟;
(6)可见液体明显分层,取上清至一新管,并加入等体积70%乙醇溶液;
(7)将液体转移至2ml RNeasy column tube,≥8000rpm离心15秒,弃滤液;
(8)加入700μl buffer RW1,≥8000rpm,15s,弃滤液;
(9)加入500μl RPE,≥8000rpm离心15秒,弃滤液;
(10)加入500μl RPE,≥8000rpm离心2分钟,弃滤液;
(11)更换1.5ml EP管,加入30-50ul无RNA酶水,≥8000rpm离心1分钟。
1.2RNA的定性与定量鉴定
取1ulRNA进行1%琼脂糖凝胶电泳,可见清晰的28s rRNA、18s rRNA和5s rRNA三条带,28s rRNA的宽度和亮度约为18sRNA的1.5~2.0倍,且5srRNA带亮度不如18S带和28S带清晰,表明提取过程中RNA未被降解。
取1ulRNA,用DEPC水稀释至100ul,用紫外分光光度计测量样品在260nm和280nm处的光密度(optic density,OD)值。RNA浓度的计算公式为:RNA浓度(ug/ml)=[OD260×40×100]。OD260/OD280在1.8-2.0之间,表明无蛋白质污染且RNA纯度比较好。
1.3逆转录
(1)将反转录试剂从冰箱取出置于冰上溶解,然后混匀、离心;
(2)配制cDNA合成混合体系,成分及用量如下:
10×RT Buffer 2μl
25mM MgCl2 4μl
0.1M DTT 2μl
RNase OUT 1μl
SuperScriptⅢRT 1μl
Total 10μl
(3)取1ug新鲜提取的RNA,配制用于反转录的混合体系b并加入到cDNA合成体系中,成分及用量如下:
Total RNA总量 1ug
Primer[oligo(dT)] 1ul
10mM dNTP mix 1ul
DEPC-free H2O 5ul
(4)将含有反转录体系的PCR管放入65℃水浴锅10分钟,然后迅速转移至冰上最少放置1分钟;
(5)然后将PCR放置于PCR仪中,设置程序:50℃50分钟,85℃5分钟,4℃降温;
(6)完成上述的反应体系后加入1ul RNase H,然后至于37℃,20分钟;
(7)将cDNA合成反应物置于-20℃度保存。
1.4引物设计及合成
根据Genbank已发表的人源Galanin,受体GalR1,GalR2,GalR3序列,用primer 5.0软件辅助设计特异引物,并由上海英骏公司合成。
Gal-F AGGAAAAACGAGGCTGGAC
Gal-R TGGTTTCATGTCATCTTCGGG
GalR1-F CATTCGCAAAGATTCACACCTGAG
GalR1-R GTTTGTTTCTGTGTCTGGTCCACT
GalR2-F ACAGGTATCTGGCCATCCGCTAC
GalR2-R ACTGGCGGTAGTAGCTCAGGTAGG
GalR3-F TACACGCTGGATGCCTGGCTCTTT
GalR3-R GTACCTGTCCACGGAGACAGCAG
Gadph-F TGGGTGTGAACCATGAGAAG
Gadph-R GAGTCCTTCCACGATACCAAAG
1.5RT-PCR检测基因的表达
(1)将反转录后的细胞cDNA样品按RT-PCR反应体系加入,反应体系和反应条件如下:
SYBR GREEN PCR Master Mix 10.0μl
上游引物(10μM) 0.5μl
下游引物(10μM) 0.5μl
cDNA模板 1.0μl
无菌ddH2O补充至 20.0μl
(2)每一模板扩增目的片段三个复孔,扩增GAPDH三个复孔,并设阴性对照;
50℃预热2min
95℃变性10min
96℃预变性3min;
94℃变性15s,59℃退火20s,72℃延伸30s,40个循环;
(3)应用相对定量分析软件对结果进行分析,显示扩增曲线,比较各组目的基因表达量。实时定量PCR的过程是在7300实时PCR反应系统(Applied Biosystems)完成,荧光信号用7300系统SDS软件进行分析。
2细胞生长标准曲线
在对细胞的活力进行检测之前,需要确定细胞生长的最佳种植密度,从而确定药物对细胞作用时的每孔最佳细胞数。因此,根据每孔细胞种植数与对应OD值的相互关系,绘制细胞的体外生长标准曲线。
(1)吸弃培养基中的细胞培养上清,在PBS洗涤之后加入胰酶消化5分钟;
(2)加入含有10%FBS的DMEM高糖培养基终止胰酶消化,并且重悬细胞进行细胞计数;
(3)按照每100ul细胞悬液中分别含有1000~10000个细胞依次进行浓度稀释,然后分别将按比例稀释后的细胞接种于96孔培养板中,每组样品重复9个副孔;
(4)将细胞置于37℃,5%CO2培养箱内培养24小时,然后于每孔中加入20ul的CCK-8细胞增殖检测溶液,在培养箱孵育2小时;
(5)用酶标仪检测450nm波长处的吸光度值,统计数据并分别绘制每种细胞系的标准生长曲线。
3CCK-8方法检测细胞活力
(1)将细胞按1×105个/孔的密度用100μl培养基接种于96孔板,每种细胞重复8个复孔;
(2)细胞接种后继续培养24小时,然后向各孔中加入CCK-8溶液10μl,置于37℃,5%CO2培养箱继续培养1~2小时;
(3)将96孔板置于酶标仪中,读取450nm波长处的吸光度值,并统计作图。
4细胞克隆形成实验
细胞克隆形成率即细胞接种存活率,表示细胞在接种后贴壁细胞成活并形成克隆的数量。细胞贴壁后不一定都能增殖和形成克隆,但是形成克隆的细胞必须是有贴壁和增殖活力的细胞。因此,细胞克隆形成率可以反映出细胞群体依赖性和增殖能力两个重要性状。
基本步骤:
1)取对数生长期的各组单层培养细胞,分别用0.25%Trypsin-EDTA消化并吹打成单个细胞;
2)使用台盼蓝染色进行活细胞计数,并把细胞悬浮在含有10%胎牛血清的DMEM培养液中备用;
3)每组细胞分别以1000个/孔种植于含2mL 37℃预温DMEM培养基的六孔板中,并轻轻转动培养板,使细胞尽量均匀分散的分布;
4)待细胞贴壁后(约12h),分别给予10-7M甘丙肽以及10-7M甘丙肽二型受体激动剂AR-M1896,并同时设control空白对照组。然后置于37℃5%CO2及饱和湿度的细胞培养箱中培养1~2周;
5)每3天更换培养基并观察克隆形成情况,待培养板中出现肉眼可见的克隆时,终止培养;
6)弃去培养基,用PBS小心浸洗细胞2次后,加入1mL/孔甲醇固定5分钟;
7)弃去固定液并以流水缓慢冲洗干净,每孔加入1mL结晶紫染色液染色10分钟,然后用流水缓慢洗去染色液,置于通风橱中干燥;
8)将培养皿倒置,用肉眼直接计数克隆,或在显微镜下计数直径大于50m(或含50个细胞以上)的细胞克隆数。每种药物处理的细胞样本接种3个复孔,并独立重复3次实验;
9)按以下公式计算细胞克隆形成率,并计算细胞克隆形成率并保存图像:
细胞克隆形成率(%)=药物处理后的克隆形成数/接种的总细胞数×100%
5细胞双层软琼脂实验。
(1)用蒸馏水分别制备出1.2%和0.65%两个浓度的低溶点琼脂糖液体,高压灭菌后,维持在50℃中,使之保持溶解状态;
(2)在无菌条件下制备2×DMEM(含2×抗生素和20%小牛血清),保存在37℃中待用;
(3)按1:1比例混合1.2%的琼脂糖和2×DMEM(含2×抗生素和20%小牛血清)后,取3ml混合液加入六孔培养板中并确保没有气泡,待底层冷却凝固后,置入培养箱中备用;
(4)取对数生长期的细胞,用0.25%胰蛋白酶消化并轻轻吹打至细胞悬液,进行活细胞计数。用含20%胎牛血清的DMEM培养液调整细胞密度至1×105个每毫升,然后根据实验要求作梯度倍数稀释;
(5)按1:1比例让0.65%的琼脂糖和2×DMEM(含2×抗生素和20%小牛血清)培养基在无菌试管中相混以后,再向管中加入0.1mL的细胞悬液并充分混匀,轻轻加入到铺有1.2%琼脂糖底层平皿中,逐形成双琼脂层。待上层琼脂凝固后,置入37℃5%CO2温箱中培养10~14天;
(6)观察细胞克隆形成情况,每三天补加细胞培养基,待2~3周后将培养皿放置在倒置显微镜下,观察细胞克隆数并统计克隆形成率;
(7)在倒置显微镜下(100×),在镜下随机选择10个视野,计数视野中大于50个克隆数(﹥0.05mm的克隆)和所有克隆数:
克隆形成率=(大于50个克隆数/所有克隆数)×100%
(8)用显微镜拍照后可将上层培养基吸干后,每孔中加入0.1%结晶紫染色液染色15~30分钟后用数码相机拍照统计,并作图分析。
6细胞周期分析
碘化丙啶是一种双链DNA的荧光染料。碘化丙啶和双链DNA结合后可以产生荧光,并且荧光强度和双链DNA的含量呈正比。细胞内的DNA被碘化丙啶染色后,可以用流式细胞仪对细胞进行DNA含量测定,然后根据DNA含量的分布情况进行细胞周期分析。
(1)收集细胞培养基到离心管备用。用胰酶消化细胞,至细胞可以被轻轻用枪头吹打下来时,加入前面收集的细胞培养基,吹打下所有的贴壁细胞;
(2)将细胞悬液收集到离心管内,1000g左右离心5分钟,沉淀细胞;
(3)小心弃去上清,剩余约50ul左右的培养基以避免流失细胞;
(4)加入约1ml预冷的PBS,重悬细胞并转移到1.5ml的离心管中;
(5)再次离心沉淀细胞,并且小心洗除上清,预留约50ul左右的PBS;
(6)轻轻弹击离心管底使得细胞分散,避免细胞成团;
(7)加入1ml冰浴预冷70%乙醇,并且轻轻吹打均匀,4℃固定过夜;
(8)细胞固定后1000g左右离心5分钟,沉淀细胞;
(9)小心弃去上清并加入1ml冰浴预冷的PBS,重悬细胞;
(10)再次离心沉淀细胞并洗除上清,轻轻弹击离心管底部以适当分散细胞;
(11)每管细胞样品中加入0.5ml含有RNase A的碘化丙啶染色液,轻轻充分重悬细胞沉淀,37℃避光温浴30分钟;
(12)用流式细胞仪在激发波长488nm波长处检测红色荧光,并采用分析软件进行细胞DNA的含量分析。
6裸鼠皮下移植瘤模型
6.1实验动物及来源
SPF清洁级BALB/c裸鼠共计36只,4~6周龄,体重约18g~20g,雄性,均由首都医科大学动物实验中心提供,并饲养于首都医科大学动物实验中心的SPF清洁级实验环境。
6.2动物模型的建立
在含有10%FBS的DMEM高糖培养基中大量培养扩增人源U251和T98G胶质瘤细胞,当细胞生长达到所需数量后,将处于对数生长期的细胞收集,用胰酶消化后离心处理,并弃去上清。用提前冰浴的生理盐水重悬细胞,并调整成1×107个/mL的细胞悬液。在无菌环境下,抽取100ul细胞悬液接种于裸鼠前肢右侧腋下皮下,每天观察肿瘤的生长情况。若在种植细胞5天后,在接种部位的皮下可见移植瘤包块,并且测量其体积约为100mm3,则判定为建立成功的胶质瘤模型。
造模后,每隔两天称量裸鼠体重,并分别测量肿瘤最长径(mm)、垂直径(mm)和宽度(mm)。按照文献公式计算肿瘤体积V:V=(平均直径)3×π/6。分别计算每次测量肿瘤的体积,并绘制肿瘤生长曲线(El-Salhy et al.,2004)。
6.3动物的分组给药
分别给18只裸鼠种植U251和T98G胶质瘤细胞,并根据不同的细胞系随机将造模成功的18只裸鼠分为3组,每组6只。分别为空白对照组、甘丙肽剂量组、AR-M1896剂量组。每天腹腔注射溶解于100ul生理盐水的甘丙肽和AR-M1896(40ug/kg),给药1次,共计25天。在最后一次给药后的次日处死裸鼠,剥离肿瘤称重,并进行相关分析检测。
7数据处理和统计学检验
采用Prism 5.0版统计软件,对实验结果用平均值±标准误(Mean±SEM)表示。两组间的比较采用非配对t检验,多组间的比较采用单因素方差分析(One-way ANOVA),若比较两组及两组以上并且有不同时间点则采用双因素方差分析(Two-way ANOVA),检验显著性取α=0.05,p<0.05作为有显著性差异。
技术研究结果:
1甘丙肽及其受体亚型均在人源U251和T98G胶质瘤细胞中表达
早期研究提示甘丙肽及其三个受体均在人体的脑胶质瘤组织中表达(Berger et al.,2003)。但是在细胞水平层面,甘丙肽及其三个受体是否在人脑U251和T98G胶质瘤细胞中表达一直未知。
通过实时定量PCR技术来检测甘丙肽及其三个受体在人源U251和T98G胶质瘤细胞上面的mRNA水平表达情况。实验结果提示,甘丙肽的三种受体亚型均表达于人源U251和T98G胶质瘤细胞系中(图1a和图1b)。但是相比于其三个受体的表达水平,甘丙肽的mRNA水平在细胞中表达较低。
2甘丙肽可以显著抑制肿瘤细胞的增殖和活性
通过实时定量PCR技术提示,甘丙肽的三个受体亚型在mRNA水平上均表达与人脑胶质瘤细胞系中,这些结果提示了甘丙肽很有可能在细胞功能水平参与了胶质瘤细胞的调控。因此,采用体外细胞增殖实验来进一步研究甘丙肽是否对人源胶质瘤细胞的生长与活性发挥作用。
2.1人源U251和T98G胶质瘤细胞生长曲线的制备
在人源U251和T98G胶质瘤细胞经甘丙肽和甘丙肽2型及3型受体特异性激动剂(AR-M1896)处理之前,需要先确定各胶质瘤细胞系的最佳生长细胞数,然后在其基础上进一步检测药物对细胞增殖的作用。由于每一种细胞系都有着不同的生长速率和密度,因此,为了更加客观的研究甘丙肽和AR-M1896是否对胶质瘤细胞的增殖产生影响,需要先制备人源U251和T98G胶质瘤细胞系的细胞生长曲线。
如图所示(图2a),通过酶标仪检测人U251胶质瘤细胞的吸光值可以明显看出,当细胞数处在4,000~6,000个/mL之间时,细胞处于对数生长期。当细胞生长至9,000个/mL时,细胞处于生长平台期。因此,结果提示当人U251胶质瘤细胞在5,000个/mL时,细胞生长旺盛,是后续细胞增殖实验的理想细胞种植密度。同样,人T98G胶质瘤细胞的吸光值显示,在细胞密度处于6,000个/mL时,是该细胞系的最佳种植密度(图2b)。
2.2甘丙肽对细胞的增殖起抑制作用
人源U251和T98G胶质瘤细胞分别经不同浓度的甘丙肽和AR-M1896处理48小时后,两种细胞系的增殖均呈现抑制现象。并且,甘丙肽抑制细胞活性的程度与其浓度梯度呈正比。当甘丙肽的浓度达到100nM时,均能显著抑制胶质瘤细胞的增殖能力,差异具有统计学意义(P<0.05)。但是,甘丙肽2型和3型受体激动剂AR-M1896无论在何种浓度下都无法降低细胞的生长活性(图2c和图2d)。
在确认甘丙肽在100nM时能有效对人源U251和T98G胶质瘤细胞的增殖发挥抑制作用后,进一步检测甘丙肽和AR-M1896对两种细胞系的增殖抑制是否与时间相关。实验结果提示,在两种细胞系经100nM甘丙肽处理48小时后,其细胞的增殖均明显发生抑制,其差异均具有统计学意义(P<0.05),但AR-M1896对细胞的增殖仍无显著抑制作用(图2e和图2f)。
3甘丙肽抑制细胞的克隆形成
为了在细胞水平上进一步验证甘丙肽对细胞增殖的抑制作用,采用细胞克隆形成实验来反映人源U251和T98G胶质瘤细胞的克隆存活率是否也受到甘丙肽或者AR-M1896的影响。结果显示,两种细胞系经100nM甘丙肽处理后,与对照组相比,其细胞的克隆形成情况均受到明显的抑制(P<0.05)。但是,AR-M1896处理组与对照组相比,仍然没有显著性差异(图3a和图3b)。
除此之外,还通过软琼脂克隆形成实验将人源U251和T98G胶质瘤细胞分别培养于立体软琼脂培养基当中,通过单克隆细胞生长聚集形成的克隆数量来反映甘丙肽和AR-M1896对两种细胞系的生长活性是否也起抑制作用。如图所示(图3c和图3d),将两种细胞系分别培养于含有100nM甘丙肽的软琼脂培养基中,与无药物处理的对照组相比,100nM甘丙肽能显著减少细胞的克隆形成数(P<0.05),而100nM的AR-M1896处理组与对照组相比并无显著性差异。因此,采用软琼脂克隆形成实验同样也体现出甘丙肽对两种细胞系增殖的抑制作用。
4甘丙肽对细胞的周期产生明显阻滞作用
通过上述结果得出,两种胶质瘤细胞系经甘丙肽处理后,细胞的增殖均发生明显的抑制,而AR-M1896并不能起到相同的抑制细胞活性的作用。因此,为了进一步研究甘丙肽和AR-M1896抑制细胞增殖的现象是否通过影响其细胞的有丝分裂前期过程,通过使用流式细胞术来检测甘丙肽是否有影响到两种细胞系的细胞周期。
与无处理的正常对照组相比,两种细胞系在经过100nM甘丙肽处理24小时后通过流式细胞术可以得出,其细胞周期G1期显著减少,均大量滞留在S/G2期,且其差异具有统计学意义(P<0.05)。其甘丙肽处理组的实验结基本与阳性实验对照组,即细胞经过2mM秋水仙碱处理24小时后相同。相反,AR-M1896处理组与正常对照组结果较为一致,几乎没有对细胞周期产生任何的显著作用。因此,实验结果也提示甘丙肽是通过阻滞细胞周期来影响细胞的增殖能力的。
以上细胞水平的实验结果均显示,甘丙肽可以在一定的浓度和时间作用下对人源U251和T98G胶质瘤细胞系的细胞增殖发挥显著的抑制作用。但是,甘丙肽2型和3型受体激动剂AR-M1896无论在不同浓度和时间的作用下,均不能对细胞的生长活性起到抑制作用。这也进一步提示,甘丙肽抑制细胞的增殖能力有可能是通过甘丙肽1型受体(GalR1)来介导的。
5甘丙肽在体内裸鼠模型中能有效抑制肿瘤的生长
在上述体外细胞水平的实验结果基础之上,进一步在动物体内水平上来验证甘丙肽和AR-M1896对人源U251和T98G胶质瘤细胞的抑癌作用。因此,分别建立人源U251和T98G胶质瘤细胞株裸鼠皮下接种模型裸鼠模型,研究甘丙肽和AR-M1896是否可以抑制裸鼠胶质瘤细胞皮下移植模型中的肿瘤生长。
参照实验方法中的裸鼠皮下接种方法,将人源U251和T98G胶质瘤细胞分别接种于裸鼠皮下,并于25天之后将动物处死并剥离肿瘤(图5a和图5b)。随着肿瘤细胞皮下移植天数的增加,空白正常对照组和AR-M1896药物处理组的肿瘤呈正比例增长,而甘丙肽药物处理组的肿瘤细胞增长明显受到抑制(图5c和图5d)。在测量与分析了肿瘤生长的体积大小之后,将肿瘤剥离并且称量其重量。与甘丙肽抑制肿瘤体积大小的结果一致,甘丙肽实验组的肿瘤重量显著减轻(P<0.05),但是AR-M1896实验组的肿瘤重量与正常对照组无显著差异(图5e和图5f)。
综上体外和体内水平实验的结果可以得出,甘丙肽对人源U251和T98G胶质瘤细胞有显著的抑癌作用,因此预示甘丙肽有可能对临床上的人脑胶质瘤也起到抑制作用。但是,由于AR-M1896无论是在细胞水平还是裸鼠模型上,都无法显著抑制肿瘤细胞的增殖。这也提示了甘丙肽对胶质瘤细胞增殖的抑制作用主要是通过甘丙肽1型受体(GalR1)所介导的。
其中,本发明采取了上述方案以后,由于甘丙肽易于提取和合成,试剂配制方法操作简单,具有经济适用的临床价值。
需要说明的是,对于上述方法实施例而言,为了简单描述,故将其都表述为一系列的动作组合,但是本领域技术人员应该知悉,本申请并不受所描述的动作顺序的限制,因为依据本申请,某些步骤可以采用其他顺序或者同时进行。其次,本领域技术人员也应该知悉,说明书中所描述的实施例均属于优选实施例,所涉及的动作和模块并不一定是本申请所必须的。
本领域内的技术人员应明白,本申请的实施例可提供为方法、系统、或计算机程序产品。因此,本申请可采用完全硬件实施例、完全软件实施例、或结合软件和硬件方面的实施例的形式。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!