去细胞皮瓣及其制备方法和应用与流程
本发明涉及临床医学、生物医学与再生医学
技术领域:
,尤其是涉及一种去细胞皮瓣及其制备方法和应用。
背景技术:
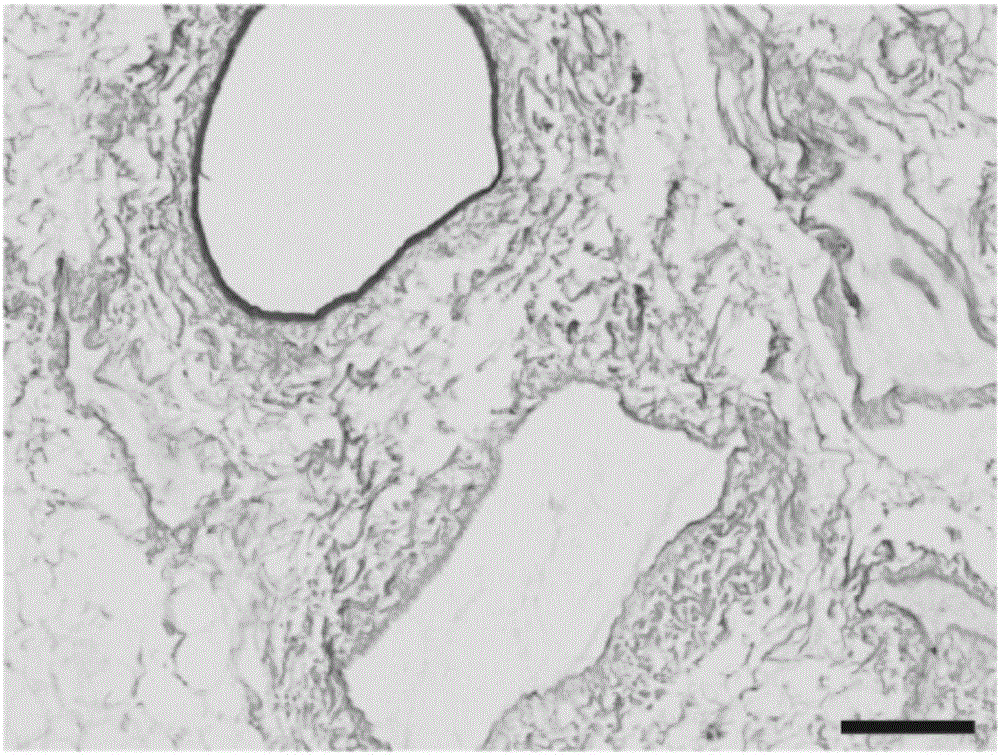
:烧伤、外伤、手术、慢性溃疡等导致皮肤缺损,而大面积的缺损机体无法自行修复其外观及功能。缺损创面需要利用皮肤移植物进行覆盖,目前临床常用的是自体皮瓣移植。取患者身体其他区域健康的皮肤(供区),对缺损创面(受区)进行修补。这种方式能有效的覆盖皮肤缺损创面,但常常造成供区受损。随着组织工程的发展,大量人工皮肤替代物涌现。现有的皮肤替代物主要分4类:一种是去细胞真皮:通过去细胞方法去除细胞成分,保留完整的细胞外基质的异体、异种真皮。但是,此种方法具有如下缺点,如异体皮来源有限;有传染疾病的危险且受到伦理学的制约;其中异种去细胞真皮修补创面后创面挛缩明显,创面愈合质量差;结构单薄,无法修复全厚皮肤的缺损;力学性能难于复合操作的要求等。一种是人工合成真皮:由各种生物、化学材料构建的真皮类似物。但是,此种方法具有如下缺点,如水分易丢失;移植后还要再进行二次表皮移植;结构单薄,无法修复全厚皮肤的缺损等。另一种是复合皮替代物:自体刃厚表皮或自体角质形成细胞膜片与真皮替代物在体内体外组合的接近正常皮肤结构的一种皮肤替代物。但是,此种方法具有如下缺点,如Apligraft因含有异体人表皮细胞,存在一定程度的免疫排斥反应;现阶段的研究停留在免疫缺陷的裸鼠模型中;缺少皮下组织的结构,无法修复深层皮肤缺损等。还有一种是去细胞皮瓣:去细胞皮瓣的研究始于2010年,其主要制备方法是血管灌注法。目前现有的去细胞皮瓣的制备方法大致分为以下三种,第1种方法最先报道,具体方法不详,其制备过程中涉及叠氮钠有毒;第2种方法于2015年报道,以灌注法为主,同时辅以振荡法,耗时比较长;第3种方法于2016年报道,灌注NaCl、胰酶、TritonX-100、超纯水等,步骤繁琐,耗时较长。因此,开发一种能够实现全厚皮肤及皮下组织缺损的修复,无免疫排斥反应,不涉及剧毒有害化学物质,操作步骤简单,灌注耗时短,且具有良好的细胞相容性及组织相容性的去细胞皮瓣尤为重要。有鉴于此,特提出本发明。技术实现要素:本发明的第一个目的在于提供一种去细胞皮瓣的制备方法,以缓解现有技术中存在的操作步骤繁琐,耗时长的技术问题。本发明的第二个目的在于提供一种去细胞皮瓣,以缓解现有技术中存在的包含有毒害化学物质,使受体产生免疫排斥反应,且细胞相容性及组织相容性较差的技术问题。本发明的第三个目的在于提供一种去细胞皮瓣在修补缺损创面及科学研究中的应用,以缓解现有技术中不能实现全厚皮肤及皮下组织缺损的修复的技术问题。本发明提供的去细胞皮瓣的制备方法,包括如下步骤:取动脉的穿支皮瓣,依次灌注肝素溶液,TritonX-100溶液和SDS溶液;将灌注后的所述穿支皮瓣进行干燥处理、灭菌处理和无菌保存。进一步地,所述动脉为腹壁浅动脉。进一步地,所述灌注的速度为20-40mL/h。进一步地,所述肝素溶液为肝素PBS溶液,所述肝素PBS溶液的浓度为10-20U/mL,所述TritonX-100溶液的浓度为0.3%-2%W/V,所述SDS溶液的浓度为0.1%-1%W/V。进一步地,所述肝素PBS溶液的灌注时间为4-8h,所述TritonX-100溶液的灌注时间为10-14h,所述SDS溶液的灌注时间为10-14h。进一步地,所述干燥处理为将灌注后的所述穿支皮瓣置于真空冷冻干燥机内,所述干燥处理的时间为4-8h。进一步地,所述灭菌处理为将干燥后的所述穿支皮瓣照射60Co-γ射线进行灭菌,所述60Co-γ射线的照射剂量为20-30KGy,所述灭菌处理的时间为1-3h。进一步地,所述无菌保存的温度为-80℃。本发明还提供了一种去细胞皮瓣,应用上述的制备方法制备得到。另外,本发明还提供了上述的去细胞皮瓣在修补缺损创面及科学研究中的应用。本发明提供的去细胞皮瓣的制备方法,操作步骤简单,制备耗时短;本发明提供的去细胞皮瓣,无免疫排斥反应,不涉及剧毒有害化学物质,且具有良好的细胞相容性及组织相容性;本发明提供的去细胞皮瓣在修补缺损创面及科学研究中的应用,能够实现全厚皮肤及皮下组织缺损的修复,愈合质量好。附图说明图1为本发明提供的去细胞皮瓣的外观图;图2A为本发明提供的去细胞皮瓣的皮下组织侧HE染色结果图;图2B为本发明提供的去细胞皮瓣的表皮真皮侧HE染色结果图;图3为本发明提供的去细胞皮瓣的酶联免疫吸附实验结果图;图4为本发明提供的去细胞皮瓣的扫描电镜结果图;图5A为正常皮瓣经血管造影术后X射线结果图;图5B为本发明提供的去细胞皮瓣经血管造影术后X射线结果图;图6A为本发明提供的去细胞皮瓣体外接种内皮细胞后24小时的免疫荧光染色结果图;图6B为本发明提供的去细胞皮瓣体外接种内皮细胞后7天的免疫荧光染色结果图;图7A为本发明提供的去细胞皮瓣体内皮下包埋后7天HE染色结果图;图7B为本发明提供的去细胞皮瓣体内皮下包埋后28天HE染色结果图。具体实施方式为了更清楚地说明本发明,下面结合优选实施例对本发明做进一步的说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。本发明提供的一种去细胞皮瓣的制备方法,包括如下步骤:取动脉的穿支皮瓣,依次灌注肝素溶液,TritonX-100溶液和SDS溶液;将灌注后的所述穿支皮瓣进行干燥处理、灭菌处理和无菌保存。在本发明中,动脉为腹壁浅动脉。腹壁浅动脉穿支皮瓣不带腹直肌及其前鞘,只含有皮肤、皮下脂肪和血管蒂,具有传统皮瓣的优点,又避免了并发症的发生。由于去细胞皮瓣是将正常皮瓣去除其内的细胞成分,故而保留全厚皮肤及皮下组织的细胞外基质结构,可以用于修补全厚皮肤及皮下组织缺损的创面。肝素溶液是为了去除组织内的血液,TritonX-100溶液及SDS溶液为去细胞试剂,无毒害作用。其中,灌注的速度为20-40mL/h,例如可以为,但不限于20mL/h,25mL/h,30mL/h,35mL/h或40mL/h。在一个优选的实施方式中,灌注的速度为30mL/h。在本发明中,肝素溶液为肝素PBS溶液。在本发明中,肝素PBS溶液的浓度为10-20U/mL,例如可以为,但不限于10U/mL,11U/mL,12U/mL,13U/mL,14U/mL,15U/mL,16U/mL,17U/mL,18U/mL,19U/mL或20U/mL。TritonX-100溶液的浓度为0.3%-2%W/V,例如可以为,但不限于0.3%W/V,0.5%W/V,0.8%W/V,1%W/V,1.2%W/V,1.5%W/V,1.8%W/V或2%W/V。SDS溶液的浓度为0.1%-1%W/V,例如可以为,但不限于0.1%W/V,0.2%W/V,0.3%W/V,0.4%W/V,0.5%W/V,0.6%W/V,0.7%W/V,0.8%W/V,0.9%W/V或1%W/V。在一个优选的实施方式中,肝素PBS溶液的浓度为15U/mL,TritonX-100溶液的浓度为1%W/V,SDS溶液的浓度为0.5%W/V。在本发明中,肝素PBS溶液的灌注时间为4-8h,例如可以为,但不限于4h,5h,6h,7h或8h;TritonX-100溶液的灌注时间为10-14h,例如可以为,但不限于10h,11h,12h,13h或14h;SDS溶液的灌注时间为10-14h,例如可以为,但不限于10h,11h,12h,13h或14h。在一个优选的实施方式中,肝素PBS溶液的灌注时间为6h,TritonX-100溶液的灌注时间为12h,SDS溶液的灌注时间为12h。在本发明中,干燥处理为将灌注后的穿支皮瓣置于真空冷冻干燥机内,去细胞皮瓣经真空冷冻干燥处理,易于保存;其中,干燥处理的时间为4-8h,例如可以为,但不限于4h,6h或8h。在本发明中,灭菌处理为将干燥后的穿支皮瓣照射60Co-γ射线进行灭菌,利用辐照灭菌,避免穿支皮瓣上有化学灭菌剂残留,而产生毒性;其中,60Co-γ射线的照射剂量为20-30KGy,例如可以为,但不限于20KGy,25KGy或30KGy;灭菌处理的时间为1-3h,例如可以为,但不限于1h,2h或3h。在本发明中,无菌保存的温度为-80℃。本发明还提供了一种去细胞皮瓣,应用上述的制备方法制备得到。另外,本发明还提供了上述的去细胞皮瓣在修补缺损创面及科学研究中的应用。本发明提供的去细胞皮瓣的制备方法,操作步骤简单,制备耗时短;本发明提供的去细胞皮瓣,无免疫排斥反应,不涉及剧毒有害化学物质,且具有良好的细胞相容性及组织相容性;本发明提供的去细胞皮瓣在修补缺损创面及科学研究中的应用,能够实现全厚皮肤及皮下组织缺损的修复,愈合质量好。本发明的方法可以在传统的市售设备或装置中进行,本领域普通技术人员可以根据本发明方法的条件自行设计所用的设备或装置。所用试剂均为市售,也可以自制。下面将结合实施例和对比例对本发明的技术方案进行进一步地说明。实施例:(一)本发明所用的实验试剂与仪器:健康SpragueDawley大鼠由温州医科大学实验动物中心提供;主要仪器均由温州医科大学生物支架移植与免疫研究所提供:超纯水制备系统(UPWS-I-20T,杭州永洁达净化科技有限公司);电热恒温鼓风干燥箱(GZX-GF-101-2-BS-II,上海贺德实验设备有限公司);酶标仪(DENLEYDRAGONWellscanMK3,Thermo);离心机(TGL-16B型,上海安亭科学仪器厂);蠕动泵(BT100-2J型,保定兰格恒流泵有限公司);倒置荧光显微镜(BX53型,Olympus,Japan);手术显微镜(XTS-4A型,镇江中天光学仪器公司);真空冷冻干燥机(YB-FD-18型,上海亿倍实业有限公司);超低温冰箱(DW-86L828J,青岛海尔);主要试剂:水合氯醛(碧云天生物技术研究所);青链霉素混合液(北京索莱宝科技有限公司);SDS(上海博蕴生物有限公司);TritonX-100(上海博蕴生物有限公司);肝素(上海博蕴生物有限公司);无水乙醇(无锡市民丰试剂厂);PBS(碧云天生物有限公司);BSA(碧云天生物医学公司);抗CD31一抗(英国Abcam公司);抗FN一抗(英国Abcam公司);Dylight488二抗(美国Chemicon公司);Dylight594二抗(美国Chemicon公司);DAPI(碧云天生物有限公司);VEGFElisa试剂盒(美国R&D公司);bFGFElisa试剂盒(美国R&D公司);EGFElisa试剂盒(美国R&D公司);TGF-βElisa试剂盒(美国R&D公司);PDGFElisa试剂盒(美国R&D公司)。(二)实验取动脉的穿支皮瓣,本实施例动脉的穿支皮瓣可以以大鼠腹壁浅动脉为原料,采用去细胞化方法处理得到,比如,可以按照如下方法制备:选取体重250-300g的SpragueDawley大鼠,雌雄不限。5%水合氯醛麻醉后,腹部及双下肢去毛,备皮。切开股部皮肤,找到股动脉并与周围组织分离,找到股动脉的分支---腹壁浅动脉,保留股动脉主干3cm,结扎股动脉其余分支。以腹壁浅动脉为血管蒂,切取腹壁浅动脉穿支皮瓣,大小约5x4cm2。24G留置针置于股动脉内,并固定,离断股动脉远端。将游离的腹壁浅动脉穿支皮瓣置于培养皿内,留置针远端连接灌流装置。实施例1肝素PBS溶液浓度实施例1-1向实验所得穿支皮瓣内灌注:浓度为15U/mL的肝素PBS溶液。实施例1-2向实验所得穿支皮瓣内灌注:浓度为10U/mL的肝素PBS溶液。实施例1-3向实验所得穿支皮瓣内灌注:浓度为20U/mL的肝素PBS溶液。对比例1-1向实验所得穿支皮瓣内灌注:浓度为5U/mL的肝素PBS溶液。对比例1-2向实验所得穿支皮瓣内灌注:浓度为30U/mL的肝素PBS溶液。上述实施例1-1至1-3及对比例1-1和1-2中,肝素PBS溶液的灌注时间均为6h,之后,依次灌注1%W/VTritonX-100溶液,灌注时间为12h;0.5%W/VSDS溶液,灌注时间为12h;灌流速度均为30mL/h。灌流结束后,将去细胞皮瓣置于真空冷冻干燥机内干燥处理6小时;干燥后进行60Co-γ射线灭菌,照射剂量为25KGy,照射时间为2h。为了检验灌注不同浓度的肝素PBS溶液对穿支皮瓣的影响,对实施例1-1至1-3及对比例1-1和1-2的穿支皮瓣进行细胞外基质结构完整性及血小板粘附情况的测定。细胞外基质结构完整性测定的具体方法为:HE染色后,光学显微镜下观察结构,红色部分为细胞外基质部分;血小板粘附情况测定的具体方法为:冰冻切片机进行组织块切面,进行血小板粘附试验。实施例1-1至1-3及对比例1-1和1-2的实验结果见表1。表1肝素PBS溶液浓度细胞外基质结构完整性血小板粘附情况(%)实施例1-1完整1实施例1-2完整13实施例1-3较完整0对比例1-1完整76对比例1-2不完整0由表1的结果可以看出,实施例1-1、实施例1-2和实施例1-3的穿支皮瓣均满足去细胞皮瓣的标准。当肝素PBS溶液浓度为15U/mL时,细胞外基质结构完整,且血小板粘附量低于5%,为优选浓度。实施例2肝素PBS溶液灌注时间向实验所得穿支皮瓣内灌注:浓度为15U/mL的肝素PBS溶液。实施例2-1实施例2提供的穿支皮瓣,灌注肝素PBS溶液的时间为6h。实施例2-2实施例2提供的穿支皮瓣,灌注肝素PBS溶液的时间为4h。实施例2-3实施例2提供的穿支皮瓣,灌注肝素PBS溶液的时间为8h。对比例2-1实施例2提供的穿支皮瓣,灌注肝素PBS溶液的时间为2h。对比例2-2实施例2提供的穿支皮瓣,灌注肝素PBS溶液的时间为10h。上述实施例2-1至2-3及对比例2-1和2-2中,依次灌注1%W/VTritonX-100溶液,灌注时间为12h;0.5%W/VSDS溶液,灌注时间为12h;灌流速度均为30mL/h。灌流结束后,将去细胞皮瓣置于真空冷冻干燥机内干燥处理6小时;干燥后进行60Co-γ射线灭菌,照射剂量为25KGy,照射时间为2h。为了检验肝素PBS溶液灌注时间不同对穿支皮瓣的影响,应用实施例1提供的检测方法对实施例2-1至2-3及对比例2-1和2-2的穿支皮瓣进行细胞外基质结构完整性及血小板粘附情况的测定。实施例2-1至2-3及对比例2-1和2-2的实验结果见表2。表2肝素PBS溶液灌注时间细胞外基质结构完整性血小板粘附情况(%)实施例2-1完整1实施例2-2完整15实施例2-3较完整0对比例2-1完整69对比例2-2不完整0由表2的结果可以看出,实施例2-1、实施例2-2和实施例2-3的穿支皮瓣均满足去细胞皮瓣的标准。当肝素PBS溶液灌注时间为6h时,细胞外基质结构完整,且血小板粘附量低于5%,为优选灌注时间。实施例3TritonX-100溶液浓度向实验所得穿支皮瓣内灌注:浓度为15U/mL的肝素PBS溶液,灌注时间为6h。实施例3-1向实施例3提供的穿支皮瓣内灌注:浓度为1%W/V的TritonX-100溶液。实施例3-2向实施例3提供的穿支皮瓣内灌注:浓度为0.3%W/V的TritonX-100溶液。实施例3-3向实施例3提供的穿支皮瓣内灌注:浓度为2%W/V的TritonX-100溶液。对比例3-1向实施例3提供的穿支皮瓣内灌注:浓度为0.1%W/V的TritonX-100溶液。对比例3-2向实施例3提供的穿支皮瓣内灌注:浓度为5%W/V的TritonX-100溶液。上述实施例3-1至3-3及对比例3-1和3-2中,灌注TritonX-100溶液的时间均为12h,之后继续灌注0.5%W/VSDS溶液,灌注时间为12h;灌流速度均为30mL/h。灌流结束后,将去细胞皮瓣置于真空冷冻干燥机内干燥处理6小时;干燥后进行60Co-γ射线灭菌,照射剂量为25KGy,照射时间为2h。为了检验TritonX-100溶液不同浓度对穿支皮瓣的影响,对实施例3-1至3-3及对比例3-1和3-2的穿支皮瓣进行细胞外基质结构完整性及内部细胞与核酸含量的测定,具体方法为:HE染色后,光学显微镜下观察结构,红色部分为细胞外基质部分,蓝色颗粒为细胞核结构。实施例3-1至3-3及对比例3-1和3-2的实验结果见表3。表3TritonX-100溶液浓度细胞外基质结构完整性细胞与核酸含量(%)实施例3-1完整3实施例3-2完整17实施例3-3较完整2对比例3-1完整71对比例3-2不完整1由表3的结果可以看出,实施例3-1、实施例3-2和实施例3-3的穿支皮瓣均满足去细胞皮瓣的标准。当TritonX-100溶液的浓度为1%W/V时,细胞外基质结构完整,且内部细胞与核酸含量低于5%,为优选灌注浓度。实施例4TritonX-100溶液灌注时间向实验所得穿支皮瓣内依次灌注:浓度为15U/mL的肝素PBS溶液,灌注时间为6h;浓度为1%W/V的TritonX-100溶液。实施例4-1实施例4提供的穿支皮瓣,灌注TritonX-100溶液的时间为12h。实施例4-2实施例4提供的穿支皮瓣,灌注TritonX-100溶液的时间为10h。实施例4-3实施例4提供的穿支皮瓣,灌注TritonX-100溶液的时间为14h。对比例4-1实施例4提供的穿支皮瓣,灌注TritonX-100溶液的时间为8h。对比例4-2实施例4提供的穿支皮瓣,灌注TritonX-100溶液的时间为16h。上述实施例4-1至4-3及对比例4-1和4-2中,继续灌注0.5%W/VSDS溶液,灌注时间为12h;灌流速度均为30mL/h。灌流结束后,将去细胞皮瓣置于真空冷冻干燥机内干燥处理6小时;干燥后进行60Co-γ射线灭菌,照射剂量为25KGy,照射时间为2h。为了检验TritonX-100溶液不同灌注时间对穿支皮瓣的影响,应用实施例3提供的检测方法,对实施例4-1至4-3及对比例4-1和4-2的穿支皮瓣进行细胞外基质结构完整性及内部细胞与核酸含量的测定。实施例4-1至4-3及对比例4-1和4-2的实验结果见表4。表4TritonX-100溶液灌注时间细胞外基质结构完整性细胞与核酸含量(%)实施例4-1完整3实施例4-2完整18实施例4-3较完整2对比例4-1完整65对比例4-2不完整1由表4的结果可以看出,实施例4-1、实施例4-2和实施例4-3的穿支皮瓣均满足去细胞皮瓣的标准。当TritonX-100溶液的灌注时间为12h时,细胞外基质结构完整,且内部细胞与核酸含量低于5%,为优选灌注时间。实施例5SDS溶液浓度向实验所得穿支皮瓣内依次灌注:浓度为15U/mL的肝素PBS溶液,灌注时间为6h;浓度为1%W/V的TritonX-100溶液,灌注时间为12h。实施例5-1向实施例5提供的穿支皮瓣内灌注:浓度为0.5%W/V的SDS溶液。实施例5-2向实施例5提供的穿支皮瓣内灌注:浓度为0.1%W/V的SDS溶液。实施例5-3向实施例5提供的穿支皮瓣内灌注:浓度为1%W/V的SDS溶液。对比例5-1向实施例5提供的穿支皮瓣内灌注:浓度为0.02%W/V的SDS溶液。对比例5-2向实施例5提供的穿支皮瓣内灌注:浓度为1.5%W/V的SDS溶液。上述实施例5-1至5-3及对比例5-1和5-2中,灌注时间为12h;灌流速度均为30mL/h。灌流结束后,将去细胞皮瓣置于真空冷冻干燥机内干燥处理6小时;干燥后进行60Co-γ射线灭菌,照射剂量为25KGy,照射时间为2h。为了检验SDS溶液不同浓度对穿支皮瓣的影响,应用实施例3提供的检测方法,对实施例5-1至5-3及对比例5-1和5-2的穿支皮瓣进行细胞外基质结构完整性及内部细胞与核酸含量的测定。实施例5-1至5-3及对比例5-1和5-2的实验结果见表5。表5SDS溶液浓度细胞外基质结构完整性细胞与核酸含量(%)实施例5-1完整3实施例5-2完整18实施例5-3较完整3对比例5-1完整85对比例5-2不完整2由表5的结果可以看出,实施例5-1、实施例5-2和实施例5-3的穿支皮瓣均满足去细胞皮瓣的标准。当SDS溶液的浓度为0.5%W/V时,细胞外基质结构完整,且内部细胞与核酸含量低于5%,为优选灌注浓度。实施例6SDS溶液灌注时间向实验所得穿支皮瓣内依次灌注:浓度为15U/mL的肝素PBS溶液,灌注时间为6h;浓度为1%W/V的TritonX-100溶液,灌注时间为12h;浓度为0.5%W/V的SDS溶液。实施例6-1实施例6提供的穿支皮瓣,灌注SDS溶液的时间为12h。实施例6-2实施例6提供的穿支皮瓣,灌注SDS溶液的时间为10h。实施例6-3实施例6提供的穿支皮瓣,灌注SDS溶液的时间为14h。对比例6-1实施例6提供的穿支皮瓣,灌注SDS溶液的时间为8h。对比例6-2实施例6提供的穿支皮瓣,灌注SDS溶液的时间为16h。上述实施例6-1至6-3及对比例6-1和6-2中,灌流速度均为30mL/h。灌流结束后,将去细胞皮瓣置于真空冷冻干燥机内干燥处理6小时;干燥后进行60Co-γ射线灭菌,照射剂量为25KGy,照射时间为2h。为了检验SDS溶液不同灌注时间对穿支皮瓣的影响,应用实施例3提供的检测方法,对实施例6-1至6-3及对比例6-1和6-2的穿支皮瓣进行细胞外基质结构完整性及内部细胞与核酸含量的测定。实施例6-1至6-3及对比例6-1和6-2的实验结果见表6。表6SDS溶液灌注时间细胞外基质结构完整性细胞与核酸含量(%)实施例6-1完整3实施例6-2完整16实施例6-3较完整2对比例6-1完整73对比例6-2不完整1由表6的结果可以看出,实施例6-1、实施例6-2和实施例6-3的穿支皮瓣均满足去细胞皮瓣的标准。当SDS溶液的灌注时间为12h时,细胞外基质结构完整,且内部细胞与核酸含量低于5%,为优选灌注时间。实施例7灌注速度向实验所得穿支皮瓣内依次灌注:浓度为15U/mL的肝素PBS溶液,灌注时间为6h;浓度为1%W/V的TritonX-100溶液,灌注时间为12h;浓度为0.5%W/V的SDS溶液,灌注时间为12h。实施例7-1实施例7提供的各溶液的灌注速度均为30mL/h。实施例7-2实施例7提供的各溶液的灌注速度均为20mL/h。实施例7-3实施例7提供的各溶液的灌注速度均为40mL/h。对比例7-1实施例7提供的各溶液的灌注速度均为10mL/h。对比例7-2实施例7提供的各溶液的灌注速度均为50mL/h。上述实施例7-1至7-3及对比例7-1和7-2中,灌流结束后,将去细胞皮瓣置于真空冷冻干燥机内干燥处理6小时;干燥后进行60Co-γ射线灭菌,照射剂量为25KGy,照射时间为2h。为了检验各溶液不同灌注速度对穿支皮瓣的影响,应用实施例3提供的检测方法,对实施例7-1至7-3及对比例7-1和7-2的穿支皮瓣进行细胞外基质结构完整性及内部细胞与核酸含量的测定。实施例7-1至7-3及对比例7-1和7-2的实验结果见表7。表7灌注速度细胞外基质结构完整性细胞与核酸含量(%)实施例7-1完整3实施例7-2完整20实施例7-3较完整1对比例7-1完整81对比例7-2不完整1由表7的结果可以看出,实施例7-1、实施例7-2和实施例7-3的穿支皮瓣均满足去细胞皮瓣的标准。当灌注速度均为30mL/h时,细胞外基质结构完整,且内部细胞与核酸含量低于5%,为优选灌注速度。实施例8干燥处理时间向实验所得穿支皮瓣内依次灌注:浓度为15U/mL的肝素PBS溶液,灌注时间为6h;浓度为1%W/V的TritonX-100溶液,灌注时间为12h;浓度为0.5%W/V的SDS溶液,灌注时间为12h;各溶液灌注速度均为30mL/h。实施例8-1将实施例8提供的去细胞皮瓣置于真空冷冻干燥机内干燥处理6h。实施例8-2将实施例8提供的去细胞皮瓣置于真空冷冻干燥机内干燥处理4h。实施例8-3将实施例8提供的去细胞皮瓣置于真空冷冻干燥机内干燥处理8h。对比例8-1将实施例8提供的去细胞皮瓣置于真空冷冻干燥机内干燥处理2h。对比例8-2将实施例8提供的去细胞皮瓣置于真空冷冻干燥机内干燥处理10h。上述实施例8-1至8-3及对比例8-1和8-2中,干燥后进行60Co-γ射线灭菌,照射剂量为25KGy,照射时间为2h。不同干燥时间对去细胞皮瓣的影响见表8。表8干燥处理时间干燥程度(%)结构完整性保存时间实施例8-1100%完整长实施例8-280%完整较长实施例8-3100%完整长对比例8-150%完整较短对比例8-2100%完整长由表8的结果可以看出,实施例8-1、实施例8-2、实施例8-3和对比例8-2的穿支皮瓣均满足去细胞皮瓣的标准,但实施例8-3和对比例8-2中,干燥处理时间长,对能源造成不必要的浪费。当干燥处理时间为6h时,去细胞皮瓣的干燥程度完全,结构完整,保存时间长,为优选干燥处理时间。实施例9灭菌处理照射剂量向实验所得穿支皮瓣内依次灌注:浓度为15U/mL的肝素PBS溶液,灌注时间为6h;浓度为1%W/V的TritonX-100溶液,灌注时间为12h;浓度为0.5%W/V的SDS溶液,灌注时间为12h;各溶液灌注速度均为30mL/h。干燥后进行60Co-γ射线灭菌。实施例9-1实施例9提供的去细胞皮瓣,60Co-γ射线的照射剂量为25KGy。实施例9-2实施例9提供的去细胞皮瓣,60Co-γ射线的照射剂量为20KGy。实施例9-3实施例9提供的去细胞皮瓣,60Co-γ射线的照射剂量为30KGy。对比例9-1实施例9提供的去细胞皮瓣,60Co-γ射线的照射剂量为15KGy。对比例9-2实施例9提供的去细胞皮瓣,60Co-γ射线的照射剂量为35KGy。上述实施例9-1至9-3及对比例9-1和9-2中,照射时间为2h。不同灭菌处理照射剂量对去细胞皮瓣的影响见表9。表9灭菌处理照射剂量由表9的结果可以看出,实施例9-1、实施例9-2、实施例9-3和对比例9-2的穿支皮瓣均满足去细胞皮瓣的标准,但实施例9-3和对比例9-2中,照射剂量大,对能源造成不必要的浪费。当灭菌处理照射剂量为25KGy时,去细胞皮瓣灭菌完全,体内接种无炎症反应且血管生成明显,体外接种能促进细胞增殖且保持培养基澄清,为优选灭菌处理照射剂量。实施例10灭菌处理时间向实验所得穿支皮瓣内依次灌注:浓度为15U/mL的肝素PBS溶液,灌注时间为6h;浓度为1%W/V的TritonX-100溶液,灌注时间为12h;浓度为0.5%W/V的SDS溶液,灌注时间为12h;各溶液灌注速度均为30mL/h。干燥后进行60Co-γ射线灭菌,照射剂量为25KGy。实施例10-1实施例10提供的去细胞皮瓣,灭菌处理的时间为2h。实施例10-2实施例10提供的去细胞皮瓣,灭菌处理的时间为1h。实施例10-3实施例10提供的去细胞皮瓣,灭菌处理的时间为3h。对比例10-1实施例10提供的去细胞皮瓣,灭菌处理的时间为0.5h。对比例10-2实施例10提供的去细胞皮瓣,灭菌处理的时间为4h。不同灭菌处理时间对去细胞皮瓣的影响见表10。表10灭菌处理时间由表10的结果可以看出,实施例10-1、实施例10-2、实施例10-3和对比例10-2的穿支皮瓣均满足去细胞皮瓣的标准,但实施例10-3和对比例10-2中,照射时间长,对能源造成不必要的浪费。当灭菌处理时间为2h时,去细胞皮瓣灭菌完全,体内接种无炎症反应且血管生成明显,体外接种能促进细胞增殖且保持培养基澄清,为优选灭菌处理时间。为了进一步说明本发明的有益效果,结合上述优选条件,即用实施例1-1、2-1、3-1、4-1、5-1、6-1、7-1、8-1、9-1和10-1提供的各条件制备去细胞皮瓣,制备得到的去细胞皮瓣外观通透,如图1所示。并通过以下实验检测制备得到的去细胞皮瓣的各项指标。HE染色去细胞皮瓣制备好后,行苏木精-伊红(HE)染色:经福尔马林溶液固定-梯度酒精脱水硬化-二甲苯透明-石蜡浸透等过程,制成石蜡切片,使用切片机制成5微米厚的组织切片。取干燥的切片,置于二甲苯缸内脱蜡10min,梯度酒精复水,蒸馏水洗去酒精,苏木素染液15min,盐酸分色30s,伊红溶液染色3min,二甲苯透明,中性树脂封片。光学显微镜下观察结构,片中红色部分为细胞外基质部分,蓝色颗粒为细胞核结构。结果如图2A和2B所示,其中2A是去细胞皮瓣的皮下组织侧,2B是去细胞皮瓣的表皮真皮侧。通过图2A和2B的HE染色结果观察到,去细胞皮瓣内细胞已被去除,且结构蛋白未断裂。酶联免疫吸附实验使用酶联免疫吸附测定的相关试剂盒检测,去细胞皮瓣内残存的各种细胞因子含量:将正常皮瓣与去细胞皮瓣在组织匀浆机中匀浆,离心收集上清。测总蛋白浓度后,按照试剂盒说明进行操作。最后通过酶标仪于450nm波长处读取OD数值,结果制成柱形图,见图3。通过图3可以得出,去细胞皮瓣内多种细胞因子的含量有一定程度的保留。扫描电镜利用扫描电镜观察去细胞皮瓣的超微结构:在皮瓣的多处切取大小约1x1x1mm3的组织,于戊二醛中固定,四氯化锇后固定,醋酸铀染色,丙酮包埋液穿透,经超薄切片机切成80nm厚的切片,经醋酸铀、柠檬酸铅染色后,电镜70kV条件下观察结果,结果如图4所示。通过图4可以看出,去细胞皮瓣内的微细结构较完整。血管造影术血管造影术观察皮瓣去细胞前后血管结构的完整性:自股动脉留置针处注入明胶-氧化铅造影剂,待皮瓣周边显现出点状、斑片状灌注液颜色时,即停止灌注,标本冷藏后,行X线拍摄片,结果见图5A和图5B,其中,图5A为正常皮瓣,图5B为去细胞皮瓣。皮瓣最重要的结构是血管,向正常皮瓣及去细胞皮瓣内灌注明胶氧化铅,通过X线机射片,观察到去细胞皮瓣内的血管结构保存完整。体外相容性实验将去细胞皮瓣置于冷冻机内(-20℃),切成10μm厚的组织片,贴于圆形爬片。将爬片放置入细胞培养6孔板内,青/链霉素(青霉素浓度1000U/ml,链霉素浓度1mg/mL)过夜灭菌。次日,无菌PBS溶液清洗3次。巴氏吸管吸取内皮细胞(细胞密度为2×104个/mL)悬液2mL,滴入放有去细胞皮瓣组织片的6孔板内,细胞培养箱内37℃培养7天。7天后,取出爬片,行免疫荧光染色,CD31标记内皮细胞,fibronectin标记去细胞皮瓣组织片。实验结果见图6A和图6B,其中图6A为内皮细胞接种24小时后免疫荧光染色结果,图6B为内皮细胞接种7天后免疫荧光染色结果。通过体外细胞接种实验,观察到接种的内皮细胞能够粘附到皮瓣基质上,并且该去细胞皮瓣能够促进细胞的增殖。体内相容性实验取250g实验用SD大鼠,麻醉后,腹部消毒备皮。剪开腹部皮肤,暴露腹直肌,将去细胞皮瓣置于腹直肌表面,并用手术缝线固定于腹直肌表面,关腹。术后28天,取出皮下包埋的去细胞皮瓣,进行常规HE染色,光学显微镜下进行观察。结果如图7A和图7B所示,其中,图7A为去细胞皮瓣皮下包埋7天后苏木精-伊红染色结果,图7B为去细胞皮瓣皮下包埋28天后苏木精-伊红染色结果。图7A和图7B是将去细胞皮瓣包埋于实验动物的皮下,病理切片提示动物体内没有产生免疫排斥反应,并且包埋28天后形成明显的血管。以上各实验说明应用各优选条件制备的去细胞皮瓣,结构完整,无免疫原性。方法学上,用到的肝素PBS溶液是为了去除组织内的血液,TritonX-100及SDS是去细胞试剂,无毒害作用,且所用的时间较现有技术中所报道的明显缩短。同时也说明,该去细胞皮瓣无免疫原性,具有良好的细胞相容性及组织相容性。可以应用于体内、外各项皮肤生理病理相关性的研究。最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1