高穿透性肿瘤靶向脂质插件的构建及其促进细胞及细胞膜制剂向肿瘤聚集的作用的制作方法
本发明属于生物与新医药技术领域,特别涉及高穿透性肿瘤靶向生物膜载药体系、主动靶向性高穿透性细胞的制备及其在抗肿瘤中的应用。
背景技术:
本发明之前,包括传统化疗药物、抗肿瘤药物纳米制剂在内的多种抗肿瘤药物多缺乏主动的肿瘤靶向性,治疗效果差强人意。这些药物进入人体后的分布多无组织特异性,且由于复杂的肿瘤微环境,药物无法渗透至肿瘤病灶深部,影响其抗肿瘤效果。至目前,经过研究者们的不断努力,也有不同类型的主动肿瘤靶向纳米载体被研发出来,但这些技术大多限于实验研究。近十年来,肿瘤纳米靶向药物载体领域发展迅速,制备载体的材料经历了一个由天然高分子材料到人工合成智能化材料再到天然材料的转变过程。然而这些fda批准的材料仍然是异体物质,我们迫切地想寻找到一种以人体自身物质为材料构建的纳米药物载体。
在越来越引起人们重视的免疫细胞治疗领域,尽管存在类似于嵌合抗原受体t细胞疗法等可以实现肿瘤的靶向性,但却在实体瘤的治疗中进展缓慢。免疫细胞难以有效进入肿瘤组织是其中一个重要的原因。因此,改善免疫细胞的主动靶向性与穿透性是进一步提高抗肿瘤治疗效果的关键。
技术实现要素:
本发明是在考虑到目前研究进展、临床迫切需求等信息后设计、实施的,其优势恰巧在于可以一定程度上克服上述局限。
本发明利用含有穿透肽irgd成分的物质作为实现肿瘤主动靶向性、高穿透性的分子,将其修饰一段脂质分子,形成一个能够明确增强肿瘤靶向性的多用肿瘤靶向插件。成功构建后经反复实验验证,本发明具有明确肿瘤靶向性,能够切实地增强免疫细胞、细胞膜制剂的肿瘤局部聚集,提高抗肿瘤治疗效果。
本发明提供的技术方案是:
实现主动肿瘤靶向、高穿透的含有穿透肽irgd成分的脂质插件,该插件由含有高穿透肽irgd的成分以及dspe-peg-mal构成,可嵌插在多种载药体系、免疫细胞上,实现其主动肿瘤靶向性。
所述含有高穿透肽irgd的成分为irgd、含有irgd成分的多肽或融合蛋白如anti-egfr-irgd等以及含有irgd成分的其他物质。
所述的主动肿瘤靶向、高穿透的含有穿透肽irgd成分的脂质插件的制备方法为:通过加成方法(如迈克尔加成法)将含有穿透肽irgd的成分进行dspe-peg-mal修饰,再进行细胞或者细胞膜插入,具体包括以下步骤:
(1)含有穿透肽irgd成分的脂质插件的制备方法:
将含有穿透肽irgd成分的多肽或蛋白与dspe-peg-mal以一定比例在缓冲液(如hepes缓冲液)中进行加成反应(如迈克尔加成反应),在一定温度下置于摇床上孵育一段时间,反应后溶液进行多次透析,透析后液体制备成冻干粉备用,得到含有irgd成分的多肽/蛋白-peg-dspe;
(2)插件修饰:
插件修饰细胞:将含有irgd成分的多肽/蛋白-peg-dspe与细胞37℃孵育一定时间(如30分钟),离心弃上清,用培养基重悬备用;
或者插件修饰生物膜类制剂:将含有irgd成分的多肽/蛋白-peg-dspe与生物膜类制剂37℃孵育一定时间(如30分钟),孵育后离心(参数举例:14000rpm,15分钟),弃上清,沉淀加入适量生理盐水重悬,探头超声一定时间(参数举例:30s)进行重悬。
本发明还提供上述的主动肿瘤靶向、高穿透的含有穿透肽irgd成分的脂质插件用于免疫治疗及其他抗肿瘤治疗,含有穿透肽irgd成分的脂质插件作为肿瘤靶向分子在免疫治疗和生物膜载体中用于肿瘤的治疗。
含有穿透肽irgd成分的脂质插件嵌插至各种细胞(如免疫细胞),作为提高细胞靶向性应用。细胞不受限于细胞类型及分子表型。
所述肿瘤不限于肿瘤类型。
含有穿透肽irgd成分的脂质插件的液体制剂、粉剂,适于经直肠、鼻内、肺部、阴道内、外部、口服或肠胃外,包括皮下、植入、静脉内、腹腔和肌内给药。
有益效果:
1、本发明所制备的含有irgd成分的多肽/蛋白-peg-dspe制备过程简单、不涉及有毒有机溶剂、可重复性好。
2、高穿透性irgd成分使修饰的细胞积聚于肿瘤局部,同时使细胞在肿瘤局部获得良好的穿透性,使其更多地进入肿瘤组织而发挥作用。
3、高穿透性irgd成分使修饰的细胞膜制剂积聚于肿瘤局部,并在肿瘤局部获得良好的穿透性,使其更多地进入肿瘤组织而发挥抗肿瘤作用。
4、可选用生物膜为载体包载药物(如紫杉醇等模式药物),将其用本发明所制备的含有irgd成分的多肽/蛋白-peg-dspe修饰后,具有更好的肿瘤靶向性、穿透性及抗肿瘤作用,具体表现参见附图。
附图说明
图1——irgd-peg-dspe连接t细胞。
irgd嵌插上t细胞后,在流式细胞仪上可以检测到穿透肽irgd的荧光峰向右偏移,证明irgd已连接至t细胞。
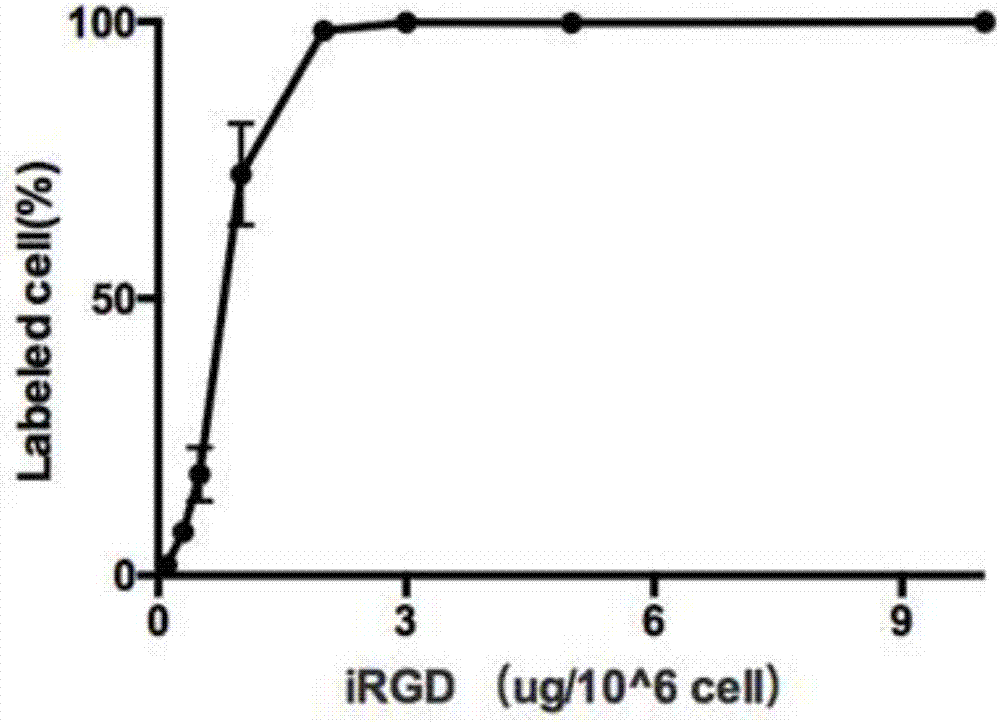
图2——irgd-peg-dspe连接10^6个t细胞饱和量。
irgd-peg-dspe连接10^6个t细胞饱和量在3ug左右。
图3——irgd、irgd-peg-dspe对t细胞活力的影响。
irgd-peg-dspe对t细胞活力的影响与irgd组相比无明显差异。
图4——irgd、irgd-peg-dspe对t细胞增殖能力的影响。
游离irgd+t细胞组、irgd嵌插t细胞组与单独t细胞组相比,增殖能力未见明显改变。
图5——irgd、irgd-peg-dspe对t细胞体外杀伤能力的影响(靶细胞snu719)。
游离irgd+t细胞组、irgd嵌插t细胞组与单独t细胞组相比,对肿瘤细胞snu719的杀伤能力类似。
图6——t细胞三维球穿透实验。
irgd嵌插t细胞组中,t细胞对肿瘤三维球的渗透明显强于单独t细胞组及游离irgd+t细胞组。
图7——t细胞肿瘤组织靶向浸润实验(共聚焦结果图)。
本实验中,绿色荧光代表的t细胞,irgd嵌插t细胞组的肿瘤组织中的绿色荧光明显强于游离irgd+t细胞组及单独t细胞组。
图8——t细胞肿瘤组织靶向浸润实验(近红外结果图)。
本实验中,irgd嵌插t细胞组肿瘤组织处的信号明显强于游离irgd+t细胞组及单独t细胞组。
图9——t细胞抑瘤实验。
相比于对照组、单独t细胞组及游离irgd+t细胞组,irgd嵌插t细胞组的肿瘤体积平均值最小,提示该组具有更好的抗肿瘤作用。
图10——anti-egfr-irgd脂链修饰。
图中泳道1系标准蛋白分子量,泳道2是表达纯化后的anti-egfr-irgd融合蛋白,泳道3是anti-egfr-irgd脂链修饰后产物,泳道4是空白脂链,1、2、4泳道分别作为标准参照、阳性参照、内部参照。
图11——验证纳米抗体融合蛋白嵌插入生物膜。
图11系流式细胞仪检测结果,从左至右,第一幅图是空白细胞本底,第2幅图系anti-egfr-irgd脂链修饰后,分别验证了红细胞、白细胞、肿瘤细胞(由上至下)等多种不同细胞。
图12——纳米抗体融合蛋白与参照药物共定位验证。
图12中蓝色为肿瘤细胞核,绿色为包载的模式药物,红色为纳米抗体融合蛋白。由图可见,三者定位关系良好。
图13——纳米抗体融合蛋白修饰对于所包载药物抗肿瘤作用的影响。
从图13中可以看出,纳米抗体融合蛋白的嵌插修饰并未降低模式药物体外对肿瘤细胞株的抗肿瘤作用。
图14——体内肿瘤靶向性。
近红外结果显示,与单纯模式药物相比,纳米抗体融合蛋白修饰后的荷瘤动物皮下瘤具有较强的荧光信号。这提示嵌插修饰的模式下,载体能更多地靶向至肿瘤区域,同时载体内的药物也更多地聚集至肿瘤部位。
图15——药物的渗透。
冰冻切片结果显示,经纳米抗体融合蛋白修饰后的模式药物,与模式药物裸药相比,能够更多地进入肿瘤组织,且渗透到肿瘤组织的深部。
图16——体内抗肿瘤作用。
由图16可见,相比于对照组、红细胞膜载紫杉醇(ptx)单独给药组、融合蛋白与红细胞膜载ptx系统共同给药组,融合蛋白嵌插的红细胞膜载ptx具有更好的抗肿瘤作用。
图17——各组动物体重比较。
实验动物对各组药物的耐受性良好,各组无明显体重差异。
图18——各给药组重要器官的毒性。
与对照组、单纯模式药物组相比,给予融合蛋白修饰后的模式药物,各组小鼠的心、肝、脾、肺、肾等重要器官无明显毒性。
具体实施方式
以下结合附图和具体实施方式详细说明,但不限制本发明。
实施例1
以irgd-peg-dspe修饰t细胞为例进行含有穿透肽irgd成分的脂质插件修饰细胞。
本发明技术思路是:将脂链修饰的irgd嵌插至各种方式活化的免疫细胞表面,促进细胞在肿瘤中的靶向聚集,提高免疫细胞治疗疗效。本发明以eb病毒抗原肽刺激的细胞毒t淋巴细胞(ctl)细胞为例,但不受限于这种免疫细胞。
图1-图9是以irgd-peg-dspe修饰t细胞为例进行含有穿透肽irgd成分的脂质插件修饰细胞的介绍。但本发明不受限于细胞的类型及分子表型。
具有主动肿瘤靶向能力的穿透肽插件的制备及其功能验证如下:
1、irgd与脂链连接:
合成的irgd与dspe-peg3400-mal以一定的比例(如:摩尔比1:1)在缓冲液(如:hepes缓冲液ph=6.5)中进行反应(如:迈克尔加成反应),室温摇床孵育24-48h,反应后溶液置于3000分子量透析袋中透析3次,每次至少8h,透析后液体制备成冻干粉备用。
2、外周血pbmc的获取:
抽取健康人外周血于抗凝管;
用等体积生理盐水稀释;
在50ml离心管内加入相同体积的人淋巴细胞分离液;
将生理盐水稀释后的细胞液用巴氏吸管沿管壁缓慢叠加于人淋巴细胞分离液上;
水平离心800g,20分钟;
离心后管内分为三层,中层界面处有一以单个核细胞为主的白膜层,即为外周血单个核细胞层;
用吸管吸到白膜层,吸取单个核细胞,置入另一个50ml离心管,补加生理盐水,水平离心1000rpm,5分钟;
弃上清,用aim-v培养液稀释,细胞计数。
3、ebv-ctl培养:
将获得的pbmc置于6孔板,aim-v培养液培养;
37℃,5%co2培养箱中孵育2h,使单核细胞贴壁;
2h后吸取悬浮细胞,调整浓度至1-2×10^6/ml,加入okt-3(50ng/ml),il-2(300u/ml)进行t细胞活化扩增,每2-3天补加相应浓度培养基及细胞因子;贴壁细胞加入2mlaim-v培养基,补充gm-csf(500u/ml),il-4(500u/ml),37℃,5%co2培养箱中培养,诱导单核细胞向dc分化;
第六天加dc促成熟因子lps(100ng/ml)诱导dc成熟;
第七天获得成熟dc,加入ebv抗原肽孵育5h后,将负载抗原肽的dc加入t细胞,补加il-7(10ng/ml)、il-15(10ng/ml)诱导ebv反应性t细胞。
4、irgd修饰ctl:
irgd-peg-dspe与活化t细胞37℃孵育30分钟,离心弃上清,用aim-v培养基重悬备用。
5、体外评估irgd、irgd-peg-dspe对t细胞增殖的影响:
将新分离的pbmc标记cfse,okt-3(50ng/ml),il-2(300u/ml)活化,均分三组,分别为单独t细胞组,游离irgd+t细胞组,irgd嵌插t细胞组;37℃孵箱培养4天,流式检测细胞增殖水平。
6、体外评估irgd、irgd-peg-dspe对t细胞活力的影响:
将体外培养的ebv-ctl与不同浓度irgd、irgd-peg-cfse37℃孵育30分钟,pi染色,流式检测t细胞活力。
7、体外评估irgd、irgd-peg-dspe对t细胞杀伤能力的影响:
将体外培养的ebv-ctl分三组:单独t细胞组,游离irgd+t细胞组,irgd嵌插t细胞组;分别按5:1、10:1、20:1的效靶比与cfse标记的snu719共孵育6-8小时,pi染色,流式检测杀伤比例。
8、体外评估irgd、irgd-peg-cfse对活化t细胞三维球穿透能力的影响:
将hcg27按2000细胞/孔的数量接种于96孔超低吸附培养板,3天后形成直径约500nm的三维细胞球,将cfse标记的t细胞分为单独t细胞组、游离irgd+t细胞组、irgd嵌插t细胞组,按5:1比例分别加入各三维球培养孔中,37℃孵育24h,荧光显微镜观察t细胞对三维球穿透水平。
9、体内评估irgd-t细胞的肿瘤靶向性:
利用snu719细胞建立裸鼠皮下瘤模型。待裸鼠皮下瘤体积增至约100mm3时,随机分为3组,即:单独t细胞组、游离irgd+t细胞组、irgd嵌插t细胞组,每组至少3只,分别尾静脉注射活化t细胞,irgd+t细胞,irgd嵌插的t细胞,每只鼠尾静脉注射药物100ul,给药后2h、6h、24h、72h分别使用maestrotmautomatedinvivoimagingsystem(cri)进行检测。按同样的方法将t细胞用cfse标记后按不同分组进行尾静脉注射,24h后断颈处死小鼠,取肿瘤组织,中性甲醛固定4h后用30%蔗糖脱水,24h后制备冰冻切片,anti-cd31抗体标记血管,dapi标记细胞核,共聚焦显微镜下观察t细胞在肿瘤组织中浸润水平。
10、体内实验评估irgd-t细胞的抗肿瘤作用:
选用24只生长良好的裸鼠,于每只鼠的腋下注射人snu719细胞悬液100ul,内含肿瘤细胞约10^7个。待裸鼠皮下瘤体积增长至约100mm3时,随机分为7组,即:对照组、单独ctl组、ctl+irgd组、ctl-irgd组,每组6只,依次分别给予ns、ebv-ctl、ebv-ctl与irgd联合给药、ebv-ctl-irgd。每3-4天给药一次,连续给药三次。期间每两天测量皮下瘤大小(v=1/2长径*短径*短径)、称量裸鼠体重,同时观察各组小鼠日常饮食、活动,给药后第十五天处死小鼠,取出皮下瘤、心、肝、脾、肺、肾等组织备检。
实施例2
以anti-egfr-irgd-peg-dspe修饰红细胞膜载药粒子为例进行含有穿透肽irgd成分的脂质插件修饰细胞膜制剂。
本发明技术思路是:通过基因重组技术获得anti-egfr-irgd基因编码片段,将其转入原核表达载体中,活化表达,表达后进行提取、纯化,并进行鉴定。随后,对制备的纳米抗体融合蛋白进行脂质修饰,嵌插至多种细胞膜载体等,实现载体的肿瘤靶向。
图10-图18是以anti-egfr-irgd-peg-dspe修饰红细胞膜载药粒子为例进行含有穿透肽irgd成分的脂质插件修饰细胞膜制剂的介绍。但本发明不受限于anti-egfr-irgd融合蛋白、细胞膜的种类及包载药物。
具有主动肿瘤靶向能力的纳米抗体融合蛋白插件的制备及其功能验证如下:
1、肿瘤靶向分子anti-egfr-irgd的表达纯化:
通过基因重组技术获得anti-egfr-irgd基因编码片段,pcr扩增,构建pet28a-anti-egfr–irgd蛋白表达载体,转化至表达菌株bl21de3,摇菌,提取、纯化并鉴定蛋白。
2、anti-egfr-irgd与脂链连接:
纯化的anti-egfr-irgd与dspe-peg3400-mal以一定的比例(如:摩尔比1:1)在缓冲液(如:hepes缓冲液,ph=6.5)中进行反应(如:迈克尔加成反应),室温摇床孵育24-48h,反应后溶液置于7000分子量透析袋中透析3次,每次至少8h,透析后液体制备成冻干粉备用。
3、载药红细胞膜纳米粒子制备:
a)采集外周血,分离红细胞,洗涤后低渗破膜,提取红细胞膜;
b)得到红细胞膜后,加生理盐水重悬至2ml,置于冰水浴中超声10min(80%,37khz),至溶液透明;
c)向其中缓慢滴入200ul无水乙醇溶解的ptx1mg,磁力搅拌5min,随后用探头超声1min;
d)超好后4℃14000rpm离心15min,弃上清,沉淀即载药纳米粒子,加入适量生理盐水重悬,探头超声30s重悬。
4、融合蛋白脂质插件修饰载药红细胞膜纳米粒子:
dspe-peg-anti-egfr-irgd与载药红细胞膜纳米粒子37℃孵育30min,孵育后14000rpm离心15min,弃上清,沉淀加入适量生理盐水重悬,探头超声30s重悬,备用。
5、体外评估验证纳米抗体融合蛋白修饰与否对于载药红细胞膜纳米粒子抗肿瘤作用的影响:
以胃癌mkn45细胞株为研究对象,以8000个细胞/孔密度接种96孔板,37℃孵育过夜,按0.05、0.2、1、5、20、100ng/ml浓度梯度分别加入rbc-ptx,anti-egfr-irgd-rbc-ptx,anti-egfr-irgd与rbc-ptx联合给药,空白细胞作为对照组。继续培养24h后,吸出培养液,向每孔加入mtt溶液100ul,继续培养4h,随后弃去溶液每孔加入dmso溶解结晶150ul,酶标仪490nm检测。
6、活体内肿瘤靶向性评估:
利用mkn45细胞建立裸鼠皮下瘤模型。待裸鼠皮下瘤体积增至约100mm3时,随机分为3组,即:单纯rbc-ptx组、rbc-ptx与anti-egfr-irgd联合给药组、anti-egfr-irgd-rbc-ptx组,每组至少3只,依次分别给予rbc-dir、rbc-dir与anti-egfr-irgd联合给药、anti-egfr-irgd-rbc-dir,每只鼠尾静脉注射药物100ul,给药后2h、24h、48h分别使用maestrotmautomatedinvivoimagingsystem(cri)进行检测。
7、体内实验评估融合蛋白脂质修饰的载ptx红细胞纳米粒子肿瘤靶向性及抗肿瘤作用:
选用40只生长良好的裸鼠,于每只鼠的腋下注射人mkn45细胞悬液100ul,内含肿瘤细胞约5x10^5个。待裸鼠皮下瘤体积增至约100mm3时,随机分为4组,即:对照组、单纯rbc-ptx组、rbc-ptx与anti-egfr-irgd联合给药组、anti-egfr-irgd-rbc-ptx组,每组10只,依次分别给予生理盐水ns、rbc-ptx、rbc-ptx与anti-egfr-irgd联合给药、anti-egfr-irgd-rbc-ptx。荷瘤裸鼠的给药量以ptx10mg/kg计,经尾静脉注射100ul,每周给药2次,连续给药2周。期间每两天测量皮下瘤大小(v=1/2长径*短径*短径)、裸鼠体重,同时观察各组小鼠日常饮食、活动,第十五天处死小鼠,取出皮下瘤、心、肝、脾、肺、肾等组织备检。
以上所述,仅是本发明的较佳实施例,并非对本发明作任何形式上的限制,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,依据本发明的技术实质,对以上实施例所作的任何简单的修改、等同替换与改进等,均仍属于本发明技术方案的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!