miR‑1288在诊断或治疗骨关节炎疾病中的应用的制作方法
本发明属于生物医药领域,具体地涉及mir-1288在诊断或治疗骨关节炎疾病中的应用。
背景技术:
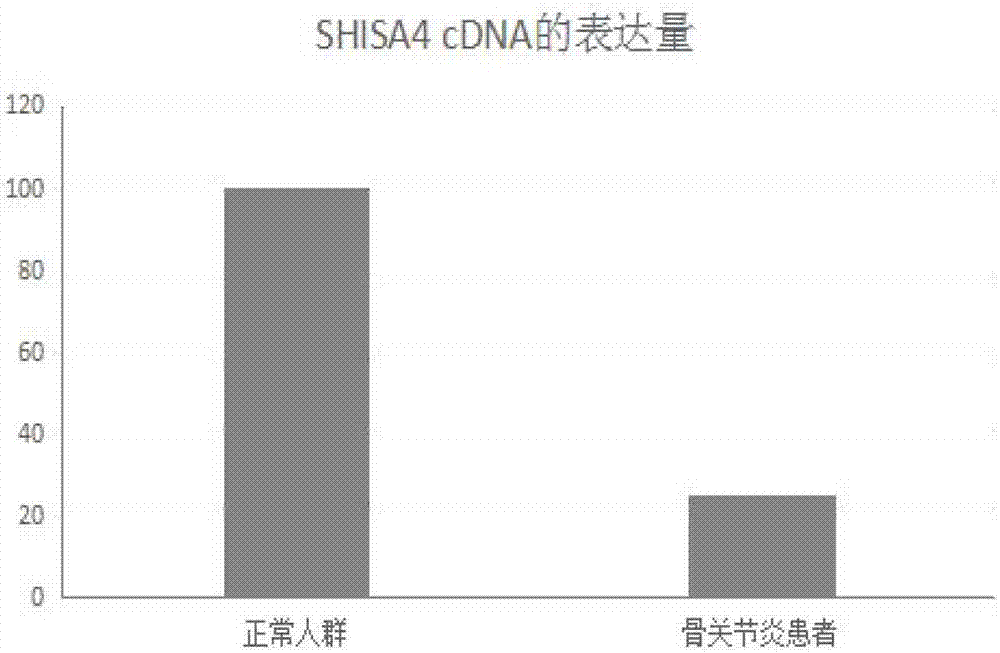
:骨关节炎(osteoarthritis,oa)是一种以关节软骨退变、破坏、消失和关节周围骨质增生为主要病变特征的慢性进行性疾病,随着年龄增加,患病率显著升高。其主要的临床表现为:受累关节的疼痛、肿胀、畸形、活动受限,x线片的主要表现为受累关节的关节间隙变窄、软骨下骨硬化、周围骨赘形成。目前oa的发病机制尚不清楚,比较统一的解释是,机械力学和生物学因素导致软骨细胞、细胞外基质和软骨下骨的退化。关节软骨主要由软骨细胞、ii型胶原、蛋白聚糖和水组成。关节软骨没有血或神经分布,软骨细胞是该组织中仅有的细胞类型。软骨细胞负责制造软骨基质的ii型胶原和蛋白聚糖。其后该基质又具有允许用水使基质饱和的物理化学特性。这种结构-功能关系的净效应是关节软骨具有特殊的耐磨特征,并且关节软骨面之间发生几乎无摩擦的移动。在未患骨关节炎时,关节软骨经常在甚至高需求的身体条件下提供终生的无痛承重和无限制的关节移动。现有的骨关节炎治疗方法包括运动、药物、休息和关节保健、手术、疼痛缓解技术、替代治疗和体重控制。由于软骨组织病变的不可逆性,目前临床上还未出现一种有效的治疗方法。此外,由于骨关节炎隐匿式发生并且发展缓慢,因此骨关节炎经常在疾病发展的晚期才得到鉴定,而不是潜在治疗可能更有效的疾病发展早期。micrornas(mirnas)是一类长约19-23个核苷酸的内源性非编码单链rna分子,大量的研究表明microrna是一类重要的调控因子,通过与靶基因序列特异性相互作用在转录水平调节基因表达,参与多种生物学过程,进化过程保守。越来越多的研究表明,mirna的表达具有时序特异性和组织特异性。每种mirna针对的数个甚至上百个潜在靶基因,mirna与risc的复合体通过碱基配对可与靶基因mrna5’-utr或者3’-utr中的互补序列相结合,抑制蛋白质翻译,或是引发mrna降解,从而负调控靶基因的表达。目前普遍认为mirna的功能是参与生命的一些基本过程如生长发育、器官形成、造血、细胞增殖与凋亡、应激反应和肿瘤生成等。因此寻找mirnas作为早期诊断骨关节炎退行性疾病的标志物,对骨关节炎疾病的诊断和治疗具有重要意义。技术实现要素:为了实现骨关节炎的早期发现,早期干预,本发明的目的之一在于提供mir-1288在制备治疗shisa4基因相关疾病的药物中的应用。本发明的目的之二在于提供一种治疗骨关节炎的药物。本发明的目的之三在于提供一种诊断早期骨关节炎的试剂盒。为实现上述目的,本发明首先提供了mir-1288在制备治疗shisa4基因相关疾病的药物中的应用,所述mir-1288包括前体mirna和成熟mirna;所述前体mirna的核苷酸序列如seqidno.1所示;所述成熟的mirna为mir-1288-5p和mir-1288-3p序列分别如seqidno.2和seqidno.3所示。优选地,所述shisa4基因相关疾病是由于shisa4基因表达下调引起的,所述疾病为骨关节炎,所述mir-1288的靶基因为shisa4。优选地,所述mir-1288的核苷酸序列在骨关节炎组织中表达上调。进一步地,本发明提供了一种治疗骨关节炎的药物,所述的药物包含mir-1288抑制剂。优选地,所述mir-1288抑制剂能够抑制mir-1288的功能,进而促进shisa4基因的表达。优选地,所述mir-1288抑制剂是mir-1288的反义寡核苷酸或拮抗剂,所述的mir-1288的反义寡核苷酸序列如seqidno.4所示。优选地,所述的药物能够促进软骨细胞的增殖和抑制软骨细胞的凋亡。本发明的药物可根据需要制备成各种剂型。包括但不限于,经皮、粘膜、口颊、舌下或经口使用的片剂、溶液剂、颗粒剂、贴剂、膏剂、胶囊剂、气雾剂或栓剂。本发明的药物的施用途径不受限制,只要它能发挥期望的治疗效果或预防效果即可,包括但不限于口服、静脉注射、肌肉注射、皮下注射、舌下含化、直肠灌注、鼻腔喷雾、口腔喷雾、皮肤局部或全身经皮用药。本发明的药物的剂量不受限制,只要获得期望的治疗效果或者预防效果即可,可以依据症状、性别、年龄等来恰当的确定。本发明的治疗药物或预防药物的剂量可以使用对疾病的治疗效果或者预防效果作为指标来确定。进一步地,本发明提供了一种诊断早期骨关节炎的试剂盒,所述试剂盒包括用于检测mir-1288的表达水平的试剂。优选地,所述的试剂包括特异性扩增mir-1288引物或探针。优选地,所述的引物序列包括正向引物序列和反向通用引物,其中正向引物序列如seqidno.5所示。本发明的有益效果如下:本发明公开了一种与骨关节炎相关的mir-1288,并进一步证实mir-1288在骨关节炎组织中表达上调。利用mir-1288检测骨关节炎不仅能够快速有效的做到早期检测,而且为基因治疗、药物治疗等临床应用提供了治疗靶点和重要依据。附图说明图1rt-pcr验证骨性关节炎患者和对照组mir-1288的表达情况;图2rt-pcr验证骨性关节炎患者和对照组shisa4的表达情况;图3mir-1288抑制剂对oa软骨细胞中shisa4蛋白表达的影响;图4mir-1288抑制剂对oa软骨细胞增殖能力的影响。图5mir-1288抑制剂对oa软骨细胞凋亡的影响。具体实施方式以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。实施例中未注明具体条件的实验方法,通常为本领域常规方法,如按照常规条件如sambrook等人,分子克隆,实验手册(第三版)(科学出版社,2002)中的所述条件,或按照试剂制造厂家所建议的条件。本发明的发明人对10例骨性关节炎样本及4例对照样本进行高通量测序,结合生物信息学方法进行差异性表达mirna和mrna的筛选,再进行mirna和mrna关联分析,共得到109个mirna-靶基因关系对,挑选了差异表达上调最明显的mir-1288,其靶标基因为shisa4。现有研究中并没有mir-1288和骨性关节炎相关的报道,进一步,发明人进行了分子生物学方法验证,证实了mir-1288在骨性关节炎组织中表达上调,其相关制剂可用于治疗骨性关节炎。本发明的shisa4基因是在本发明之前的已知基因,其基本信息如下:genbank登录号:ncbigeneid:149345,来源于人类基因组。本发明还采用rt-pcr方法检测上述mir-1288和shisa4在骨关节炎患者和正常人群中的表达,并验证了该mirna在骨关节炎表达上调,其靶基因shisa4在骨关节炎表达下调。实施例1高通量测序1、取样取2012年10月到2015年12月期间在北京协和医院骨科就诊骨性关节炎患者,病例组共收集10例,对照来源于同时期骨科住院的其他疾病患者,共收集4例。获取所有研究对象的滑液样本,编号后置-80℃低温冰箱保存。病例组均符合膝关节oa诊断标准,进行膝关节人工关节置换术患者;对照组为半月板损伤及交叉韧带损伤进行关节镜手术治疗的患者。根据1995年美国风湿协会骨性关节炎的诊断标准,诊断为重度骨性关节炎,有膝关节置换指征的患者病例。其中,临床诊断标准依据1995年美国风湿病协会所制定的标准:(1)1个月内大多数时间有膝痛;(2)关节活动时响声;(3)晨僵不大于30分钟;(4)年龄不小于40岁;(5)膝关节骨性肿胀伴弹响;(6)膝关节骨性肿胀不伴有弹响。最少存在((1)、(2)、(3)、(4)或(1)、(2)、(3)、(5)或(1)、(6)即可诊断oa。2、对滑液进行总rna提取采用reagent(invitrogen,货号15596-018)进行样本rna提取,实验操作按产品说明书进行,具体操作如下:收集样本后冻存于液氮,取出后把滑液放入已预冷的研钵中进行研磨,待组织样本成粉末状后:①加入trizol,室温保存5分钟;②加氯仿0.2ml,用力振荡离心管,充分混匀,室温下放置5分钟-10分钟;③12000rpm高速离心15分钟后吸取上层水相(吸70%)到另一新离心管管中,注意不要吸到两层水相之间的蛋白物质。移入新管,加入等体积的-20℃预冷异丙醇,充分颠倒混匀,置于冰上10分钟;④12000rpm高速离15分钟后小心弃掉上清液,按1ml/mltrizol的比例加入75%depc乙醇洗漆沉淀(4℃保存),洗漆沉淀物,振荡混合,4℃下12000rpm高速离心5分钟;⑤弃去乙醇液体,室温下放置5分钟以充分晾干沉淀,加入depc处理过的水溶解沉淀;⑥用nanodrop2000紫外分光光度计测量rna纯度及浓度,冻存于-80℃。rna质量判定标准:rna样本的od260/od280值为1.7-2.2之间;总rna电泳图谱有清晰的28s、18s条带;70℃水浴保温1小时后的电泳图谱与水浴保温前的图谱无明显差异。3、rna样品的质量分析rna提取后琼脂糖凝胶电泳,从电泳结果可以初步判定提取的rna样品质量合格与否,是否可以用于进一步的转录组分析。进而通过nanodrop1000分光光度计检测rna样品的提取情况,rna-seq测序的样品要求:od260/od280为1.8-2.2。4、高通量测序测序平台为illumina公司的hiseq2500高通量测序平台,进行高通量转录组深度测序,测序后我们运用fast-qc(http://www.bioinformatics.babraham.ac.uk/projects/fastqc/)软件对测序数据的质量进行整体评估,包括碱基的质量值分布,质量值的位置分布,gc含量,pcrduplication含量,kmer的frequency等。在差异mirna及mrna表达分析时,根据得到的fpkm值,采用国际公认算法ebseq进行差异筛选。其中,筛选时,log2fc>1或<-1,fdr<0.05,共筛选出15个差异表达的mirna,其中表达水平上调的mirna6个,表达水平下调的mirna9个。分析过程中log2fc>1或<-1,fdr<0.05,共筛选出435个差异表达的mrna,其中表达水平上调的基因265个,表达水平下调的基因170个。利用包括rna22,miranda,mirdb,mirwalk,pictar2及targetscan这些算法预测差异表达mirna的靶基因,选取≥4个算法预测出来的靶基因,并在mirwalk数据库查找已验证的差异表达的mirna的靶基因,然后将所有靶基因与mrna测序结果中与mirna表达负相关的基因进行整合分析,我们共得到109个mirna-靶基因关系对,结合文献我们筛选了差异表达上调最明显的mir-1288,通过预测得到mir-1288-靶基因关系对,其靶标基因为shisa4。实施例2rt-pcr验证骨性关节炎患者mir-1288和shisa4的表达情况1、材料选取36例骨性关节炎患者滑液及10例对照滑液,对其进行分组及编号。病例组均符合膝关节oa诊断标准,进行膝关节人工关节置换术患者;对照组为半月板损伤及交叉韧带损伤进行关节镜手术治疗的患者。2、方法2.1对滑液进行总rna提取,同实施例1的提取方法。2.2逆转录(1)mrna逆转录采用iiireversetranscriptase(invitrogen,货号18080-044)进行cdna反转录,实验操作按产品说明书进行,具体操作如下:使用逆转录试剂盒,用逆转录缓冲液对lμg总rna进行逆反录合成cdna。采用25μl反应体系,每个样品取1μg总rna作为模板rna。获得的cdna保存放-20℃冰箱备用。(2)mirna逆转录使用onestepprimescriptmirnacdnasynthesiskit(takara,codeno.d350a)进行逆转录,实验操作按产品说明书进行,具体操作如下:采用20μl反应体系,每个样品取1μg总rna作为模板。获得的cdna保存放-20℃冰箱备用。2.3real-timepcr用abi7500型荧光定量pcr仪,采用2-δδct法进行数据的相对定量分析。(1)mrna的rt-pcr使用powergreenpcrmastermix(invitrogen,货号4367659)进行扩增,实验操作按产品说明书进行。反应体系如表1所示。表1mrna的rt-pcr反应体系mrnas的表达检测每次设置3个平行管反应。扩增shisa4(nm_198149.2)正向引物序列如seqidno.5所示,反向引物序列如seqidno.6所示。以gapdh作为内参基因,其上游引物如seqidno.7所示,下游引物如seqidno.8所示。扩增程序为:95℃10min,45x(95℃15s,60℃60s)。(2)mirna的rt-pcr使用sybrprimesciptmirnart-pcrkit(takara,codeno.rr716)进行扩增,实验操作按产品说明书进行。表2mirna的rt-pcr反应体系组分加入量sybrpremixextaqii(2×)10μlpcrforwardprimer(10μm)0.5μluni-mirqpcrprimer(10μm)0.5μlroxreferencedyeii(50×)2μl模板(cdna溶液)2μldh2o至20μlmirnas的表达检测每次设置3个平行管反应。扩增mir-1288正向引物序列如seqidno.9所示,以snrnau6作为内参,其上游引物如seqidno.10所示,下游引物如seqidno.11所示。扩增程序:95℃30s;40x(95℃5s,60℃34s)。3统计学分析实时定量pcr扩增曲线拐点清楚,扩增曲线整体平行性好,表明各反应管的扩增效率相近,极限平而无上扬现在,曲线指数期斜率较大,说明扩增效率较高;样本扩增产物溶解曲线都是单峰,说明扩增产物只有一条,为特异性扩增;根据qrt-pcr的相对定量公式:2-δδct×100%,比较mir-1288和shisa4基因在骨关节炎组织和对照组织中的表达水平。结果显示:qrt-pcr扩增结果稳定,其中mir-1288在骨关节炎组织表达水平明显高于对照组,约是对照的3.5倍,具体见图1,而shisa4在骨关节炎组织中的表达水平明显低于正常对照,约为对照的25%,具体见图2,以上结果验证了高通量转录组表达数据的整合分析的结果。实施例3mir-1288与shisa4靶基因关系验证1、设计合成针对mir-1288的反义寡核苷酸(anti-mir-1288)根据mir-1288的序列信息由大连宝生物生物技术有限公司设计合成mir-1288的反义寡核苷酸序列和随机对照序列,mir-1288的反义寡核苷酸序列如seqidno.4所示。2、细胞培养用含青霉素(100u/ml)、链霉素(100μg/ml)的磷酸盐缓冲液(petalbovineserum,pbs)冲洗从关节置换取下的无菌膝关节软骨组织置于无菌培养皿数次后,将软骨修剪至1mm×1mm×1mm大小;加入3倍体积的0.25%胰蛋白酶于37℃消化30-50分钟,然后轻轻吹打弃去上清液,d-hanks(百浩生物)液冲洗3-5次;加入3倍体积的0.15%的ii型胶原酶(invitrogen),37℃下摇荡消化6小时,每3个小时收一次细胞;200目筛网过滤消化后的细胞悬液,低温离心5分钟(约2800转/分)后再次弃去上清液,dmem/f12(invitrogen)培养液冲洗3次,加入含10%胎牛血清的dmem/f12培养基,用吸管轻轻吹打,使细胞悬液分布均匀,从而得到含有软骨细胞的细胞悬液;将细胞以1×108个/l接种于25cm2培养瓶内(5ml/瓶),置于37℃恒温,5%co2饱和湿度培养箱内培养。培养中使用倒置相差显微镜观察细胞贴壁生长情况和形态,待细胞贴壁后再第一次换液,以后每2天换液一次。原代培养细胞的覆盖超过瓶子底部面积的80%时传代。3、转染采用阳离子脂质体法进行瞬时转染,操作按照lipofectaminetm2000transfectionreagent试剂说明书进行。转染前24h将生长状态良好的细胞接种到6孔板中,细胞计数约5×104,常规培养至转染当天,细胞融合度为50-60%时进行试验。将80nmanti-mir-1288加入到100uldmem培养基中,轻柔混匀;另用100uldmem培养基稀释2ullipofectamintm2000脂质体,轻柔混匀,室温孵育5min;混合dmem-脂质体与dmem-mirnas,室温孵育20min,以形成转染复合物;然后将上述混合物加到细胞培养基中,轻轻混匀,使他们充分混合。其中,非特异性序列作为阴性对照(anti-nc),同期设有空白对照组。培养48h后提取细胞总rna进行下一步实验。4、anti-mir-1288对于oa软骨细胞mir-1288表达的作用:细胞总rna提取和pcr步骤同实施例2。real-timepcr结果显示,阴性对照组对软骨细胞中mir-1288表达无明显抑制作用,和空白对照组无统计学差异,转染的anti-mir1288组对软骨细胞中mir-1288表达起到一定抑制作用抑制率为59%。5、anti-mir-1288对oa软骨细胞中shisa4基因表达的影响取对数期生长细胞,以4×105/孔的密度接种于6孔培养板中,按照所述各组进行转染。并重复3次。48h后收集细胞,裂解细胞并提取细胞总蛋白质,将蛋白加入到10%sds-page进行电泳,再将蛋白转至pvdf膜上,经5%脱脂奶粉封闭后,加入相应的一抗于4℃孵育过夜,anti-shisa4antibody(1∶1000稀释,abcam,ab167046)。二抗(goatanti-rabbitigg,hrpconjugated(cw0103))室温孵育1h后,利用ecl液显影,扫描仪中成像。以β-actin作为内参进行数据标准化,与对照组相比,观察anti-mir-1288组中shisa4蛋白的相对表达水平情况,采用imagej分析软件对蛋白电泳条带灰度值进行定量,最后得到的数据进行配对样本t检验统计分析。结果如图3显示,将anti-mir-1288转染至oa软骨细胞中,48h后提取细胞蛋白质,空白对照为未转染mirna的软骨细胞,转染非特异性序列作为阴性对照。用wb方法检测靶基因shisa4的蛋白表达水平变化,结果显示,与空白对照组相比,转染非特异性序列没有明显变化,转染anti-mir-1288组中shisa4蛋白表达明显上调(p<0.01),表明shisa4是anti-mir-1288的靶基因。实施例4mir-1288的抑制剂对oa软骨细胞增殖能力的影响实验分组:空白对照组,阴性对照组,转染anti-mir-1288实验组。取对数增殖期细胞配置成1×104/ml单细胞悬液接种于96孔板,每孔100μl,每组设6个复孔。待细胞贴壁后,加入cck-8试剂,2h后用酶标仪测定其450nm波长吸光度值作为零点。以后连续5d每过24h,每孔加入cck-8试剂10μl温育2h后,酶标仪测定细胞吸光度值,并绘制细胞增殖曲线。结果如图4显示,与对照组相比较,阴性对照组细胞增殖无显著差异,而经anti-mir-1288转染后软骨细胞,其细胞增殖能力显著上升(p<0.05)。实施例5mir-1288抑制剂对oa软骨细胞凋亡的影响按照实施例3的方法对软骨细胞进行anti-mir-1288和anti-nc的转染。细胞转染48h后,将细胞用不含edta的胰酶消化收集(注:胰酶消化时间不易过长,否则容易引起假阳性);用pbs洗涤细胞二次(2000rpm离心5min)收集1~5×105细胞;按照annexinv-fitc/pi双染试剂盒(购自invitrogen公司)的操作说明进行细胞处理。加入500μl的bindingbuffer(凯基,南京)悬浮细胞;加入5μlannexinv-fitc(凯基,南京)混匀后,加入5μlpropidiumiodide(凯基,南京),混匀;室温、避光、反应5-15min后进行流式细胞仪的检测。统计细胞凋亡率,实验都是按照重复3次来完成的,结果数据都是以平均值±标准差的方式来表示,采用spss19.0统计软件来进行统计分析的,两者之间的差异采用t检验,认为当p<0.05时具有统计学意义。结果如图5所示,与转染anti-nc细胞组相比,转染anti-mir-1288的细胞凋亡率降低,差异具有统计学意义(p<0.05)。虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。序列表<110>中国医学科学院北京协和医院<120>mir-1288在诊断或治疗骨关节炎疾病中的应用<130>16zjp115<160>11<170>patentinversion3.5<210>1<211>75<212>rna<213>rna序列<400>1gaggguguugaucagcagaucaggacuguaacucaccauagugguggacugcccugaucu60ggagaccacugccuu75<210>2<211>23<212>rna<213>rna序列<400>2gcagaucaggacuguaacucacc23<210>3<211>21<212>rna<213>rna序列<400>3uggacugcccugaucuggaga21<210>4<211>21<212>rna<213>人工序列<400>4accugacgggacuagaccucu21<210>5<211>20<212>dna<213>人工序列<400>5tcagtcgcatcattggaccc20<210>6<211>22<212>dna<213>人工序列<400>6tgtagtgcaaacgagcatctct22<210>7<211>21<212>dna<213>人工序列<400>7ggagcgagatccctccaaaat21<210>8<211>23<212>dna<213>人工序列<400>8ggctgttgtcatacttctcatgg23<210>9<211>21<212>dna<213>人工序列<400>9tggactgccctgatctggaga21<210>10<211>23<212>dna<213>人工序列<400>10gtgctcgcttcggcagcacatat23<210>11<211>22<212>dna<213>人工序列<400>11aaaatatggaacgcttcacgaa22当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1