甘草素‑环糊精或环糊精衍生物包合物及组合物及制备方法及新用途与流程
本发明属于甘草素深加工的应用技术领域,尤其涉及一种甘草素-环糊精或环糊精衍生物包合物及组合物及制备方法及新用途。
背景技术:
运动性疲劳是运动医学和运动生理学研究的永恒主题。关于运动性疲劳的形成机制,人们提出了各种假说,如能源物质耗竭学说、自由基伤害学说、神经递质学说、乳酸堆积学说及ca2+稳态异常学说等。
能源物质耗竭学说提出,能源物质包括各种糖原、atp、磷酸肌酸等,机体在短时间高强度运动时,会大量的动用糖原等能源物质分解,以提供能量,如果其中的一些含量下降,又得不到及时的补充,从而会引发运动性疲劳。
甘草素(liquiritigenin)化学名:7,4’-二羟基二氢黄酮,是从甘草中提炼制成的黄酮类成分,其化学结构通式为:
甘草中的黄酮类成分可分为水溶性黄酮和脂溶性黄酮,具有抗炎、抗病毒、抗氧化、抗衰老、抗溃疡、抗肿瘤、保护胃黏膜作用。近年来又发现甘草黄酮能够抑制癌细胞的增殖。
甘草素具有消除自由基,抗氧化的药理活性,但是在水中的溶解性较差,服用是吸收较差,所以需要解决甘草素溶解性差、人体吸收较差的问题。
关于甘草素-环糊精或环糊精衍生物包合物的制备技术,及其包合物及组合物用于抗运动性疲劳的研究,尚未见报道。
技术实现要素:
本发明提出了甘草素-环糊精或环糊精衍生物包合物。
本发明还提出了甘草素-环糊精或环糊精衍生物包合物的制备方法。
本发明还提出了甘草素-环糊精或环糊精衍生物包合物药物组合物。
本发明还提出了甘草素-环糊精或环糊精衍生物包合物的新用途。
一种甘草素-环糊精或环糊精衍生物包合物,含有甘草素和环糊精或环糊精衍生物,所述甘草素与环糊精或环糊精衍生物的分子摩尔比为1:1~1:100,所述环糊精衍生物选自β-环糊精、羟乙基-β-环糊精、羟丙基-β-环糊精、甲基-β-环糊精、麦芽糖-β-环糊精、羧甲基-β-环糊精、磺乙基-β-环糊精、磺丙基-β-环糊精、磺丁基-β-环糊精的一种。
一种甘草素-环糊精或环糊精衍生物包合物的制备方法,取环糊精或环糊精衍生物,加水溶解,在室温下边搅拌边加入甘草素,加入的甘草素摩尔数与环糊精或环糊精衍生物的摩尔数的比例为1:1~1:100,继续搅拌,使所述环糊精或环糊精衍生物和甘草素完全反应,待反应完成后,得到溶液,将上述溶液用微孔滤膜过滤,滤液在-80℃冰箱预冷冻4h,再用冷冻干燥机在-80℃干燥过夜得固体甘草素-环糊精或环糊精衍生物包合物;
所述环糊精衍生物选自β-环糊精、羟乙基-β-环糊精、羟丙基-β-环糊精、甲基-β-环糊精、麦芽糖-β-环糊精、羧甲基-β-环糊精、磺乙基-β-环糊精、磺丙基-β-环糊精、磺丁基-β-环糊精的一种。
一种药物组合物,包含一种甘草素-环糊精或环糊精衍生物包合物和制药学上可接受的辅料,所述药物组合物是以甘草素-环糊精或环糊精衍生物包合物为活性成分,所述辅料为药剂上任意可以接受的赋形剂,所述甘草素-环糊精或环糊精衍生物包合物和辅料的重量比为10:90~90:10;
所述甘草素-环糊精或环糊精衍生物包合物含有甘草素和环糊精或环糊精衍生物,所述甘草素与环糊精或环糊精衍生物的分子摩尔比为1:1~1:100;
所述环糊精衍生物选自β-环糊精、羟乙基-β-环糊精、羟丙基-β-环糊精、甲基-β-环糊精、麦芽糖-β-环糊精、羧甲基-β-环糊精、磺乙基-β-环糊精、磺丙基-β-环糊精、磺丁基-β-环糊精的一种,所述环糊精选自β-环糊精。
甘草素-环糊精或环糊精衍生物包合物在制备治疗和/或预防抗运动性疲劳药物中的应用。
本发明通过环糊精或环糊精衍生物的包合行为,提高甘草素的水溶性,进而提高人体对甘草素的吸收能力;
甘草素-环糊精或环糊精衍生物包合物的制备方法还可以采用超声法和研磨法:
超声法:精密称取甘草素和环糊精或环糊精衍生物加入水溶解,在环糊精或环糊精衍生物水溶液中加入甘草素后,立即超声至溶解透明,加入的甘草素摩尔数与环糊精或环糊精衍生物的摩尔数的比例为1:1~1:100,超声完成后,将上述溶液过微孔滤膜过滤,滤液在-80℃冰箱预冷冻4h,再用冷冻干燥机在-80℃干燥过夜得固体甘草素-环糊精或环糊精衍生物包合物。
研磨法:精密称取精密称取环糊精或环糊精衍生物,加入适量蒸馏水将环糊精研匀,在研磨条件下,缓慢分次加入甘草素,充分研磨,将获得的糊状物在-80℃冰箱预冷冻4h,再用冷冻干燥机在-80℃干燥过夜得固体甘草素-环糊精或环糊精衍生物包合物,加入的甘草素摩尔数与环糊精或环糊精衍生物的摩尔数的比例为1:1~1:100。
包含一种甘草素-环糊精或环糊精衍生物包合物和制药学上可接受的辅料的药物组合物,是以甘草素-环糊精或环糊精衍生物包合物为活性成分,所述辅料为药剂上任意可以接受的赋形剂,赋形剂可以为蔗糖、乳糖、葡萄糖的一种或几种任意组合而成的稳定剂。在具体实施例中,所述甘草素-环糊精或环糊精衍生物包合物和辅料的重量比可以为10:90、20:80、25:85、30:70、35:65、40:60、45:55、50:50、60:60、70:30、75:25、80:20、85:15、90:10。
上述甘草素-环糊精或环糊精衍生物包合物作为制备改善或治疗抗运动性疲劳药物中的应用及药物组合物是发明人在研究甘草素-环糊精或环糊精衍生物包合物的过程中,经过建立动物模型,检测试验小鼠样本中的肝糖原、血乳酸、尿素氮的变化水平,证实了甘草素具有抗运动性疲劳的作用,并制备出了抗运动性疲劳药物组合物。
附图说明
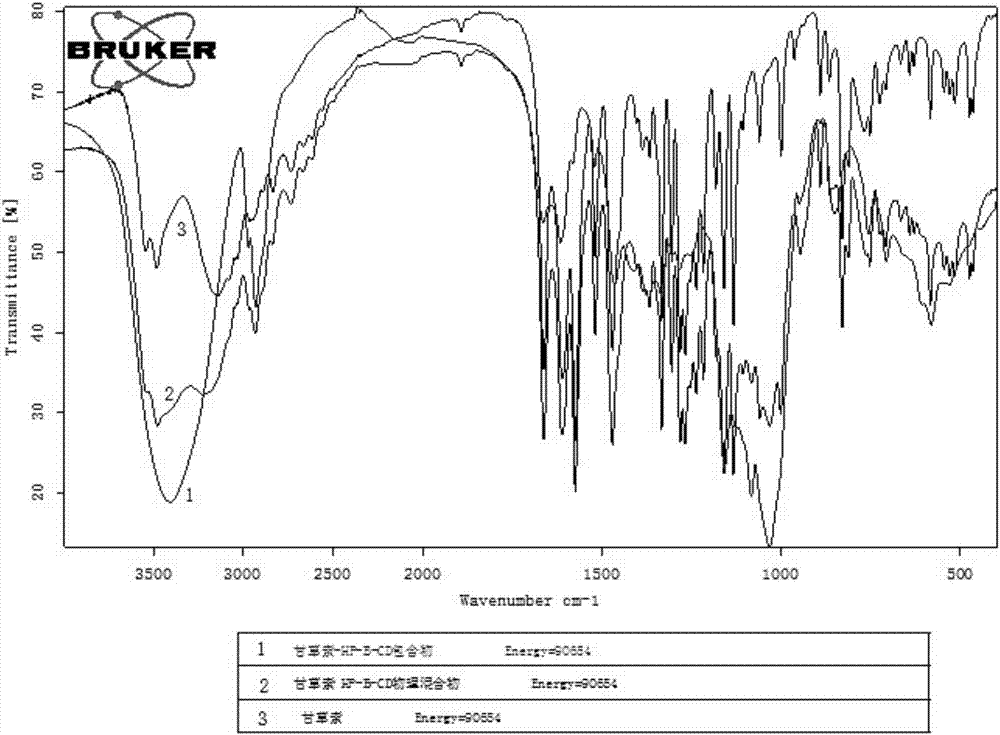
图1为甘草素、甘草素-β-环糊精包合物以及甘草素和β-环糊精混合物的红外图谱。
图2为甘草素、甘草素-羟丙基-β-环糊精包合物以及甘草素和羟丙基-β-环糊精包合物的红外图谱。
具体实施方式
以下为甘草素-环糊精或环糊精衍生物包合物的制备方法实施例
实施例一:甘草素-β-环糊精包合物的制备方法
取1mmolβ-环糊精,加60g水溶解,在室温下边搅拌边加入1mmol甘草素,继续搅拌,使所述β-环糊精和甘草素完全反应,待反应完成后,得到溶液,将上述溶液用微孔滤膜过滤,滤液在-80℃冰箱预冷冻4h,再用冷冻干燥机在-80℃干燥过夜得固体甘草素-β-环糊精包合物。
实施例二:甘草素-β-环糊精包合物的制备方法
取10mmolβ-环糊精,加600g水溶解,在室温下边搅拌边加入1mmol甘草素,继续搅拌,使所述β-环糊精和甘草素完全反应,待反应完成后,得到溶液,将上述溶液用微孔滤膜过滤,滤液在-80℃冰箱预冷冻4h,再用冷冻干燥机在-80℃干燥过夜得固体甘草素-β-环糊精包合物。
实施例三:甘草素-羟丙基-β-环糊精包合物的制备方法
取1mmol羟丙基-β-环糊精,加10g水溶解,在室温下边搅拌边加入1mmol甘草素,继续搅拌,使所述羟丙基-β-环糊精和甘草素完全反应,待反应完成后,得到溶液,将上述溶液用微孔滤膜过滤,滤液在-80℃冰箱预冷冻4h,再用冷冻干燥机在-80℃干燥过夜得固体甘草素-羟丙基-β-环糊精包合物。
实施例四:甘草素-羟丙基-β-环糊精包合物的制备方法
取10mmol羟丙基-β-环糊精,加100g水溶解,在室温下边搅拌边加入1mmol甘草素,继续搅拌,使所述羟丙基-β-环糊精和甘草素完全反应,待反应完成后,得到溶液,将上述溶液用微孔滤膜过滤,滤液在-80℃冰箱预冷冻4h,再用冷冻干燥机在-80℃干燥过夜得固体甘草素-羟丙基-β-环糊精包合物。
实施例五:甘草素-羟丙基-β-环糊精包合物的制备方法
取100mmol羟丙基-β-环糊精,加500g水溶解,在室温下边搅拌边加入1mmol甘草素,继续搅拌,使所述羟丙基-β-环糊精和甘草素完全反应,待反应完成后,得到溶液,将上述溶液用微孔滤膜过滤,滤液在-80℃冰箱预冷冻4h,再用冷冻干燥机在-80℃干燥过夜得固体甘草素-羟丙基-β-环糊精包合物。
实施例六:甘草素-羧甲基-β-环糊精包合物的制备方法
取1mmol羧甲基-β-环糊精,加10g水溶解,在室温下边搅拌边加入1mmol甘草素,继续搅拌,使所述羧甲基-β-环糊精和甘草素完全反应,待反应完成后,得到溶液,将上述溶液用微孔滤膜过滤,滤液在-80℃冰箱预冷冻4h,再用冷冻干燥机在-80℃干燥过夜得固体甘草素-羧甲基-β-环糊精包合物。
对上述实施例一、实施例三制得的甘草素-β-环糊精包合物、甘草素-羟丙基-β-环糊精包合物进行红外光谱测定,进而验证是否生成包合物。
红外测定方法为:各取微量甘草素、甘草素-β-环糊精包合物、甘草素和β-环糊精混合物、甘草素-hp-β-环糊精包合物以及甘草素和hp-β-环糊精混合物,加入适量固体kbr,充分研磨均匀并压片,分辨率为2cm-1,3500~500cm-1全谱扫描。对甘草素、甘草素-β-环糊精包合物、甘草素和β-环糊精混合物、甘草素-hp-β-环糊精包合物以及甘草素和hp-β-环糊精混合物分别进行红外测定,结果如图1、图2所示。
由图1可见,甘草素与β-环糊精各有自身的红外特征吸收峰。混合物的光谱图具有加和性,表现为两组分的叠加;包合物则表现不同,包合物有部分峰发生紫移,部分峰发生红移,部分峰消失。包合物与环糊精的图谱比较,包合物以环糊精的图谱为主,而甘草素的光谱特征部分消失。这可以说明实验结果和理论预期几乎一致,环糊精空腔孔径与客体分子相匹配,甘草素分子包埋于β-环糊精的空腔内,其分子振动受到限制而不能完全显现其原有的红外特性。甘草素与β-环糊精之间形成了超分子包合物。
由图2可见,甘草素与hp-β-环糊精各有自身的红外特征吸收峰。混合物的光谱图具有加和性,表现为两组分的叠加;包合物则表现不同,包合物有部分峰发生紫移,部分峰发生红移,部分峰消失。包合物与环糊精的图谱比较,包合物以环糊精的图谱为主,而甘草素的光谱特征部分消失。这可以说明实验结果和理论预期几乎一致,环糊精空腔孔径与客体分子相匹配,甘草素分子包埋于hp-β-环糊精的空腔内,其分子振动受到限制而不能完全显现其原有的红外特性。甘草素与hp-β-环糊精之间形成了超分子包合物。
以下为甘草素-β-环糊精包合物及甘草素-羟丙基-β-环糊精包合物的药理实验:
本发明中,发明人经过建立动物模型,检测试验小鼠样本中的肝糖原、血乳酸、尿素氮的变化水平,证实了甘草素-β-环糊精包合物,及甘草素-羟丙基-β-环糊精包合物具有抗运动性疲劳的作用,并制备出了抗运动性疲劳药物组合物。
一、实验动物:实验小鼠购自宁夏医科大学实验动物中心,雄性、四周龄、体重(22±2g)、spf级,动物生产许可证号:syxk(宁)。喂养条件包括标准饲料,自来水,室温保持在(24士2)℃,湿度50-60%,每日光照与黑暗时间各12h。实验准备前,将动物置于实验环境适应3天。
二、实验药品及仪器
药品:采用上述方法制备得到的甘草素-β-环糊精包合物,甘草素-羟丙基β-环糊精包合物,三氯醋酸(ar,麦克林试剂公司),葡萄糖(ar,阿拉丁试剂公司),羧甲基纤维素钠(ar,麦克林试剂公司),蒽酮(ar,阿拉丁试剂公司),硫脲(ar,阿拉丁试剂公司),氟化钠(ar,阿拉丁试剂公司),钨酸钠(ar,麦克林试剂公司),三氯乙酸(ar,麦克林试剂公司),硫酸铜(ar,阿拉丁试剂公司),对羟基联苯(ar,阿拉丁试剂公司),乳酸钙(ar,阿拉丁试剂公司),浓硫酸(宁夏美信生物试剂公司),乙醇(宁夏美信生物试剂公司),naoh(宁夏美信生物试剂公司)。
仪器:sps202f型分析天平(中州电子衡器有限公司),model1510型超声波清洗器(沃珑仪器设备),l-530型低温离心机(塞维亚科技发展公司),uv-2901型紫外可见分光光度计(hitachi公司),bs-220型迈瑞全自动生化分析仪(武汉盛世达设备)。
三、实验方法
1.试验用药的配制:甘草素-β-环糊精包合物溶液、甘草素-羟丙基-β-环糊精包合物溶液。
每隔三天按照试验小鼠的实际重量按10mg·kg-1的药量分别配制甘草素-β-环糊精包合物溶液和甘草素-羟丙基-β-环糊精包合物溶液储存于4℃的冰箱中备用;
所述甘草素-β-环糊精包合物溶液配制的操作为:每1ml0.5%羧甲基纤维素钠中加入含1mg甘草素的甘草素-β-环糊精包合物,用于对以下c组实验小鼠灌胃使用;
所述甘草素-羟丙基-β-环糊精包合物溶液配制的操作为:每1ml0.5%羧甲基纤维素钠中加入含1mg甘草素的甘草素-羟丙基-β-环糊精包合物,用于对以下d组实验小鼠灌胃使用。
2.实验分组
实验小鼠80只、雄性、四周龄、体重(22±2g)、spf级、正常饲养以及每天适应性游泳20分钟,三天后,按体重随机分为四组:
a(安静对照组)、b(耐力训练组)、c(耐力训练+甘草素-β-环糊精包合物组)、d(耐力训练+甘草素-羟丙基-β-环糊精包合物组)每组20只。
每组实验小鼠每日下午1:00给药,给药的量为为按照小鼠的体重每千克灌10mg·kg-1,10mg·kg-1为小鼠每公斤体重灌的甘草素-β-环糊精包合物溶液中甘草素的量为10mg,10mg·kg-1为小鼠每千克体重灌的甘草素-羟丙基-β-环糊精包合物溶液中甘草素的量为10mg,a组和b组小鼠用等体积0.5%羧甲基纤维素钠溶液灌胃,连续6周,室温为25±2℃。每日更换清洁垫料,每日更换清洁饮水瓶.每天称小鼠体重一次并记录。
3.小鼠耐力训练
a组只灌胃不进行游泳训练,b、c、d组小鼠在实验动物游泳池中分别进行每日递进式游泳锻炼,水深为40~50cm,水温为25士2℃。每周进行5天训练,每天上午和下午各1次,上午9:00am开始训练,下午3:00pm开始训练,训练量如下表1:
表1耐力训练时间表
4.小鼠力竭游泳运动
按上述时刻表每天对各b、c、d组小鼠进行两次游泳训练,在训练第六周后进行力竭游泳运动并记录小鼠力竭游泳的时间,如下表2:
表2为试验小鼠力竭游泳时间
注:δ组与b组比较p<0.01。
由表2中可得出,c组、d组试验小鼠的力竭游泳时间比其他组都长,可见,甘草素-β-环糊精包合物溶液、及甘草素-羟丙基-β-环糊精包合物能够明显延长小鼠力竭游泳的时间,而游泳时间的长短可以直接反映小鼠疲劳的程度,因此,说明甘草素能够改善耐力训练小鼠的疲劳症状,提高小鼠的运动能力,延缓运动性疲劳的发生,具有抗运动性疲劳的效果。
5.小鼠取材
宰杀小鼠前对使用器械进行消毒灭菌。每组小鼠随机取出10只小鼠不进行游泳,直接取眼球血,立即预留80μl全血,剩余离血清。
再将小鼠处死,即刻用75%酒精为小鼠皮肤消毒,取肝脏,用4℃的生理盐水清洗血液,用滤纸吸干生理盐水,再称重,将其迅速放于液氮中速冻。
每组小鼠中剩下10只小鼠进行游泳训练100min,训练后取眼球血,每一只小鼠取血以后,预留80μl的全血,剩下的全血必须立即在3000rpm/min条件下,用低温离心机(4℃),离心15min,小心吸取血清保存于-80℃的冰箱。
6.检测指标
本实施例主要检测甘草素-环糊精包合物对耐力训练小鼠的抗运动性疲劳的有关指标。其中检测指标主要包括:肝糖原、血乳酸(bla)、尿素氮(bun)。
(1)酮一硫酸法测定小鼠肝糖原
试剂配制:
配制葡萄糖标准溶液:称取0.01g的葡萄糖,溶解于10ml蒸馏水中。
配制5%三氯醋酸(tca):准确称取5.0g三氯醋酸,溶解于100ml蒸馏水中。
配制蒽酮试剂:先配制72%的浓硫酸溶液,72%的浓硫酸溶液配制时,先在烧杯中加入140ml蒸馏水,边搅边缓缓加入比重为1.84的浓硫酸360ml,等到h2so4的温度降到80-90℃时加入0.25g的蒽酮和5g的硫脲,摇匀,待冷却后储存于冰箱。
检测步骤:以c组为例
对c组试验小鼠的肝糖原的提取计算:精确称取c组的不游泳的10只小鼠的肝脏组织各100mg,分别加入8mltca,然后匀浆1min,以3000转/min的速度离心15min,转移上清液至另一支试管内;取上清液1ml于10ml的离心管中,每管加入4ml95%乙醇,充分混匀,盖紧离心管,保持竖立,常温下过夜,以3000转/min的速度离心15min;小心弃去上清液,倒立离心管10min至管内无液滴存在;加入2ml蒸馏水,确保洗下管壁糖原,振荡离心管使糖原完全溶解;向各管加入10ml蒽酮试剂,充分混合,待温度降至凉水温度后,再浸于沸水中加热15min,转移到冷水浴冷却,在620nm波长下,测定吸光度,得到第一组吸光度值。
为了数据更加精确,做三组平行实验,即,第二组平行试验为:继续精确称取c组的不游泳的10只小鼠的剩余肝脏组织各100mg,重复上述步骤,测定吸光度,得到第二组吸光度值;第三组平行试验为:再次精确称取c组的不游泳的10只小鼠的剩余肝脏组织各100mg,重复上述步骤,测定吸光度,得到第三组吸光度值;
将上述三组平行试验的三组吸光度值分别代入肝糖原公式计算,得到c组的三组肝糖原数,再将三组肝糖原数求均值得到c组的肝糖原数。
作为对比试验方案,也可以分别配制空白管、标准管:
空白管:取2ml蒸馏水于干净的试管中。
标准管:取葡糖糖标准液0.5ml和蒸馏水1.5ml于标准管中,混匀。
然后在空白管和标准管中分别加入10ml蒽酮试剂,充分混合,待温度降至凉水温度后,再浸于沸水中加热15min,转移到冷水浴冷却,在620nm波长下,分别测定空白管吸光度和标准管吸光度。
同理,对a组、b组的试验小鼠的肝糖原的提取计算方法同于c组的方法,也对不游泳的10只小鼠的肝脏组织采用同于c组的方法提取计算肝糖原。如下表4。
肝糖原公式为:
每100克肝(肌)组织中糖原的毫克数=du/ds×0.5×提取液体积/肝组织克数×100×0.9,式中,
ds:标准管吸光度;
du:样品管吸光度;
提取液体积为8ml;
肝组织克数为0.1g;
0.9为将葡萄糖换算成糖原的系数;
0.5为0.5ml葡萄糖标准液中葡萄糖的含量。
(2)用自配试剂方法测定小鼠血乳酸含量
试剂配制:
10%钨酸钠:称取10g钨酸钠溶解于100ml蒸馏水中。
1/3mol/l硫酸:量取浓硫酸0.8ml于50ml容量瓶,用蒸馏水定容。
1%naf溶液:准确称取1.125gnaf溶解于100ml蒸馏水中。
10%的三氯醋酸:准确量取三氯醋酸9.9ml,溶解于100ml蒸馏水中。
cuso4溶液:准确称取0.42gcuso4,溶于10ml蒸馏水中。
蛋白沉淀剂:将1/3mol/l的硫酸、10%的钨酸钠、蒸馏水按照体积比为1:1:1的比例混合。
蛋白沉淀剂-naf混合液:按体积分别取10ml1%naf和30ml蛋白沉淀剂混合。
1.5%对羟基联苯溶液:称取对羟基联苯1.5g溶解于100ml热的0.5%的naoh中。
乳酸标准储备液(1g/l):称取0.171g乳酸钙,加入10%三氯醋酸中定容至100ml。
乳酸标准应用液(0.01g/l):吸取1.0ml乳酸标准储备液,溶解于100ml容量瓶,用蒸馏水定容。
对c组试验小鼠的血乳酸的检测步骤:
吸取0.48ml1%naf溶液于5ml离心管中,加入c组游泳的小鼠的全血20μl。混匀后,加入1.5ml蛋白沉淀剂,用力振荡混匀,在3000转/min条件下,离心10min,取上清液,30℃水浴中加热30min,再置于沸水浴中90s,待冷却后,在560nm波长下,测定吸光度值,即c组的吸光度值a样品管,然后依据血乳酸含量计算公式计算得到c组血乳酸含量。
作为对比试验方案,也可以分别配制空白管、标准管,如下表3
表3血乳酸测定试验方案配制
将标准管至于30℃水浴中加热30min,再置于沸水浴中90s,待冷却后,在560nm波长下,测定吸光度值,即c组的吸光度值a标准管,用于计算每一组的血乳酸含量。
同理,对a、b组试验小鼠的血乳酸的检测步骤同于c组的检测步骤,测定a、b组吸光度值,即a组的a样品管、b组的a样品管,计算得到a、b组血乳酸含量。如下表4。
血乳酸含量计算公式为:
血乳酸(mg/l)=a样品管/a标准管×100×10
(3)生化指标测定
本实验中,用全自动生化分析仪分别对a、b、c组、d组中游泳的试验小鼠的血清进行分析测定,进而对各组试验小鼠的尿素氮(bun)的含量进行测定。如表4。
7.试验结果
表4肝糖原、尿素氮和血乳酸
注:#与b组肝糖原比较p<0.01;▼与b组尿素氮比较p<0.01;■与b组血乳酸比较p<0.01。
由表4可知,c组和d组的肝糖原含量高于a组、b组的肝糖原含量,可见,从能量代谢的角度可推断甘草素-羟丙基-β-环糊精包合物、甘草素-β-环糊精包合物能减小肝糖原的分解,或者能促进肝糖原的合成,进而提高运动耐力,有良好的抗运动疲劳效果。
c组、d组的血乳酸含量低于b组的血乳酸含量,可见,从乳酸堆积学说角度来推断,甘草素-羟丙基-β-环糊精包合物、甘草素-β-环糊精包合物能抑制或降低血乳酸的产生,或能够分解血乳酸,进而提高运动耐力,有良好的抗运动疲劳效果。
c组、d组的尿素氮含量低于b组的尿素氮含量,可见,从数据可推断,甘草素-羟丙基-β-环糊精包合物、甘草素-β-环糊精包合物能抑制或降低尿素氮的产生,或能够分解尿素氮,进而提高运动耐力,有良好的抗运动疲劳效果。
以上所揭露的仅为本发明较佳实施例而已,当然不能以此来限定本发明之权利范围,本领域普通技术人员可以理解实现上述实施例的全部或部分流程,并依本发明权利要求所作的等同变化,仍属于发明所涵盖的范围。
- 还没有人留言评论。精彩留言会获得点赞!